药物性肝损伤临床分型特点及其与肝组织学改变的关系
徐曾丽, 高 敏, 郭春霞, 邢敏丹, 李 嘉
(1 天津医科大学研究生院, 天津 300070; 2 天津市第二人民医院, 天津 300192;3 天津市肝病医学研究所, 天津 300192)
药物性肝损伤临床分型特点及其与肝组织学改变的关系
徐曾丽1, 高 敏2,3, 郭春霞1, 邢敏丹1, 李 嘉2,3
(1 天津医科大学研究生院, 天津 300070; 2 天津市第二人民医院, 天津 300192;3 天津市肝病医学研究所, 天津 300192)
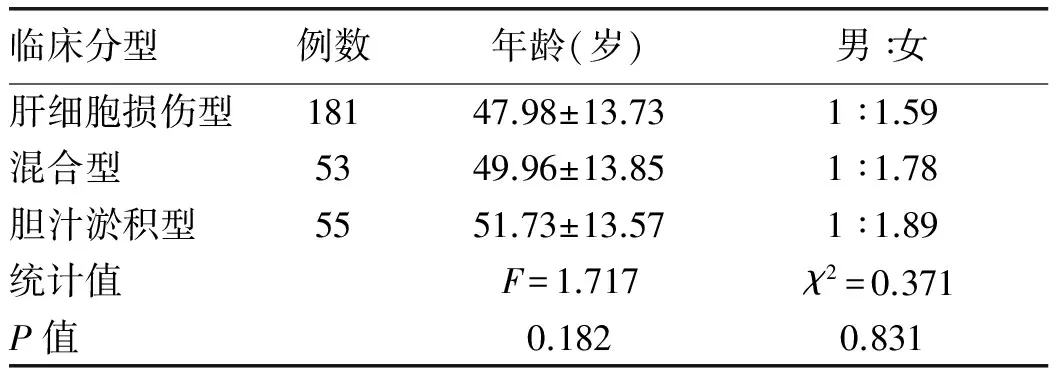
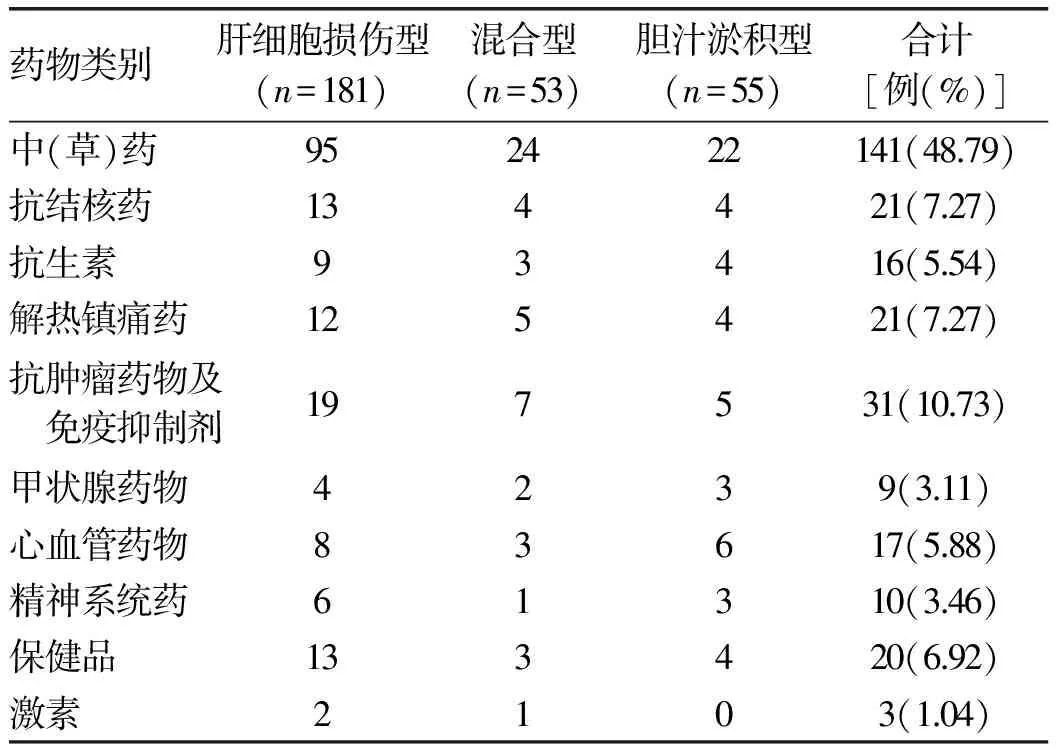
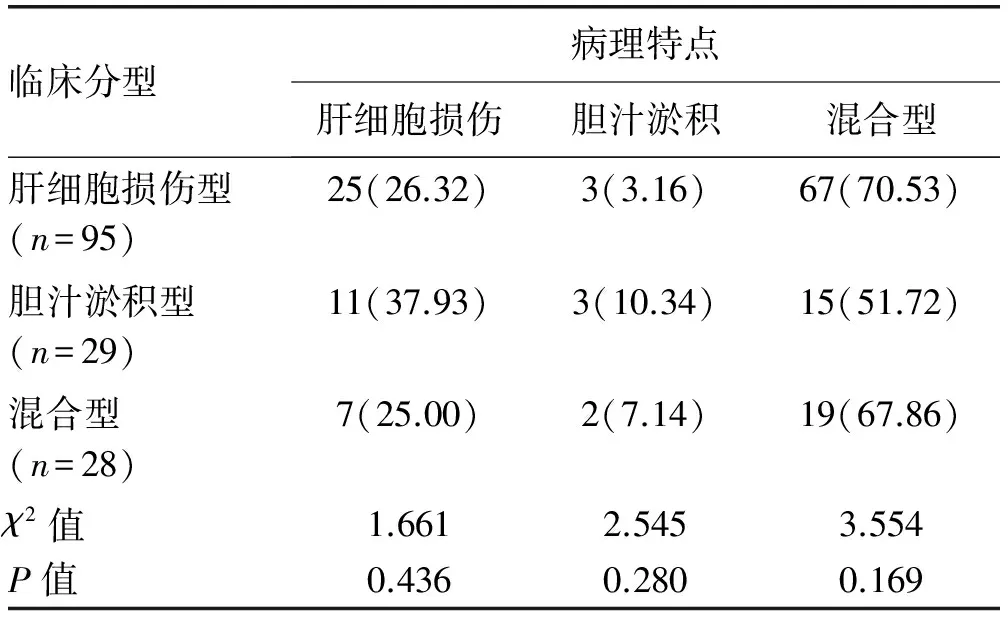
目的 分析不同临床分型药物性肝损伤(DILI)患者的临床特征,并比较临床分型与病理损伤分型的关系。方法 收集2014年1月-2016年1月天津市第二人民医院收治的289例DILI患者,依据生化指标计算“R值”将DILI临床分型分为:肝细胞损伤型、胆汁淤积型和混合型,分别统计其用药情况、生化指标,并对行肝脏病理检查患者的肝组织学改变进行分析,比较其病理损伤类型与临床分型的一致性。非正态分布的计量资料多组间比较采用非参数Kruskal-WallisH检验;正态分布的计量资料多组间比较采用单因素方差分析。计数资料组间比较采用χ2检验。结果 依据R值将289例DILI患者分为:肝细胞损伤型181例(62.63%)、胆汁淤积型55例(19.03%)以及混合型53例(18.34%)。其中致肝损伤的药物以中(草)药所占比例最大(48.79%)。共152例患者行肝脏病理检查,依据组织学改变情况分为:肝细胞损伤型43例(28.29%),胆汁淤积型8例(5.26%),混合型101例(66.45%);该152例患者依据R值的临床分型为:肝细胞损伤型95例(62.50%),胆汁淤积型29例(19.08%),混合型28例(18.42%)。二者比较的一致性较差(κ=0.229,P<0.05)。结论 中(草)药是诱发DILI的主要原因,DILI的临床分型与病理损伤分型一致性较差,病理损伤以混合型居多,故临床分型标准有待进一步改进。
药物性肝损伤; 病理学, 临床; 组织学
药物性肝损伤(DILI)的临床分型现多按照国际医学组织理事会(CIOMS)制订的分型标准进行划分,即通过生化指标计算“R值”将DILI分为3种分型:肝细胞损伤型、胆汁淤积型和混合型[1]。此分型方法被广泛应用于临床,但根据生化指标进行的临床分型与肝脏病理损伤情况是否相符,现阶段并没有太多研究。本文分析了3种分型患者的临床特征及病理特点,并对比临床分型与病理损伤分型的关系,以期为临床实践提供参考和指导。
1 资料与方法
1.1 研究对象 收集2014年1月-2016年1月天津市第二人民医院收治的DILI患者,诊断标准参照发病前(时)详细的用药情况及DILI因果关系评价(RUCAM)量表评分[2],RUCAM评分≥6分的纳入研究。同时排除:(1)合并巨细胞病毒、EB病毒、柯萨奇病毒感染者;(2)病毒性肝炎患者;(3)自身免疫性肝病患者;(4)酒精性肝病患者;(5)遗传性肝病患者;(6)胆道梗阻性疾病患者。
1.2 检查方法
1.2.1 生化学检查 所有患者在入院后24 h内均抽取晨起空腹外周肘静脉血。检测指标:ALT、AST、ALP、GGT、TBil,均用全自动生化分析仪(日立-7180)测定。试剂购自日本和光与中生北控。
1.2.2 肝脏病理学检查 穿刺吸取肝活组织经4%甲醛液固定,石蜡包埋,连续5 μm组织切片,所有肝组织常规行HE、Masson染色,显微镜下观察炎症、纤维化程度及病变特点;普鲁士蓝染色及红氨酸染色观察肝细胞内铁及铜沉积情况。链霉亲和素-生物素复合物法检测肝组织原位HBsAg、HBcAg表达情况;免疫组化染色(SP法)检测CK19表达。病理诊断除由1位天津市第二人民医院病理科资深专家诊断外,均送外院病理会诊。
1.3 分型标准
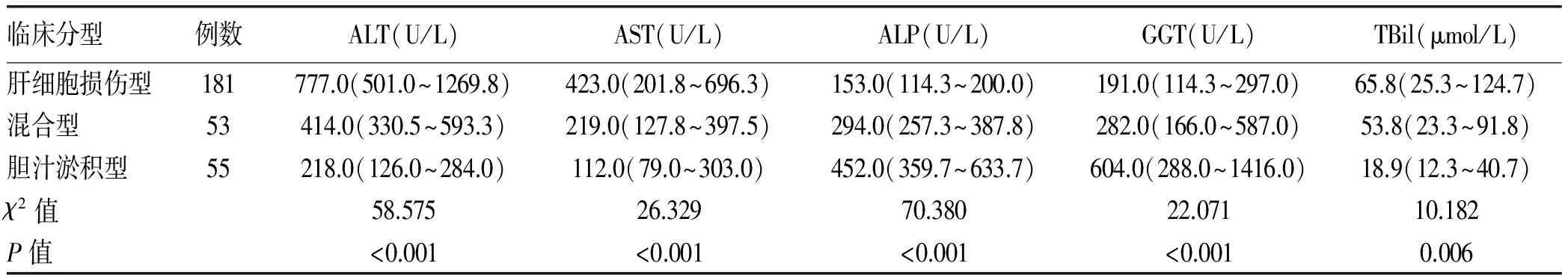
1.3.1 临床分型 按照CIOMS制订的DILI临床分型标准[1]:(1)肝细胞损伤型:ALT≥3倍正常值上限(ULN),且R≥5;(2)胆汁淤积型:ALP≥2×ULN,且R≤2;(3)混合型:ALT≥3×ULN,ALP≥2×ULN,且2 1.3.2 肝脏病理损伤分型标准 肝内胆汁淤积的特征性病理表现包括:肝细胞内胆汁淤积,肝细胞呈羽毛状变性,伴毛细胆管扩张,胆栓形成;严重时以扩张含胆栓的毛细胆管为中心,肝细胞呈腺泡样排列,形成胆汁花环,门管区小叶间胆管胆汁淤积伴胆栓形成[3-5]。肝细胞损伤的病理变化包括:肝细胞变性、坏死和细胞凋亡,界面性肝炎,小叶炎症,嗜酸性粒细胞和中性粒细胞浸润,点灶状坏死甚至桥接坏死,肝细胞玫瑰花结形成,小叶紊乱等[5-6]。肝组织学改变仅有肝细胞损伤表现的为肝细胞损伤型,仅有胆汁淤积表现的为胆汁淤积型,二者均有的为混合型。 2.1 一般资料 共纳入DILI患者289例,其中男108例(37.37%),女181例(62.63%),男∶女=1∶1.68;年龄10~88岁,平均(49.06±13.76)岁。依据入院时生化指标计算的R值将纳入患者分为:肝细胞损伤型181例(62.63%)、胆汁淤积型55 例(19.03%)和混合型53 例(18.34%),3种分型患者在年龄、性别比方面差异均无统计学意义(P值均>0.05)(表1),具有可比性。 表1 3种临床分型患者一般资料比较 2.2 临床症状 DILI患者发病时间多为用药后的1~12周,其临床表现并无特异性,主要症状为乏力(52.40%)、黄疸(61.06%)、恶心(8.65%)、纳差(40.38%)、腹胀(9.62%),部分存在发热(3.46%)、皮疹(0.48%)和瘙痒(1.45%)。 2.3 药物应用情况 289例患者中可疑药物种类排列前几位的分别是中(草)药(48.79%)、抗肿瘤药物(10.73%)、抗结核药物(7.27%)和非甾体抗炎药(7.27%),其次是保健品(6.92%)、心血管药物(5.89%)、抗生素(5.53%)、精神系统药物(3.46%)。其中中药成分以何首乌、雷公藤等多见,主要用于治疗脱发、皮肤病、骨关节病等。3种分型患者中可疑药物的分布比例差别不大(表2)。 表2 3种临床分型患者的DILI药物应用情况 2.4 生化学指标的比较 肝细胞损伤型患者的ALT、AST、TBil水平明显高于其他2组(P值均<0.05);而胆汁淤积型患者的ALP、GGT水平显著高于其他2组 (P值均<0.05)(表3)。 2.5 肝脏病理检查 共有152例患者行肝脏病理检查,病理改变主要为肝细胞变性和细胞凋亡,界面性肝炎,小叶炎症,点灶状坏死甚至桥接坏死,凋亡小体形成,嗜酸性粒细胞和中性粒细胞浸润,肝细胞玫瑰花结形成,肝细胞和(或)毛细胆管淤胆,胆管增生,胆栓形成,纤维组织增生等。该152例患者依据计算R值的临床分型情况:肝细胞损伤型95例(62.50%),胆汁淤积型29例(19.08%),混合型28例(18.42%);而按照肝脏病理损伤特点:肝细胞损伤43例(28.29%),胆汁淤积8例(5.26%),混合型101例(66.45%);二者比较的κ值为0.229(P<0.05),因其<0.40,故认为二者分型的一致性较差。3种临床分型的肝脏病理学特点差异均无统计学意义(P值均>0.05),3种临床分型的病理特点均为既有肝细胞损伤又有胆汁淤积的混合型所占比例最大(表4)。 表4 3种临床分型DILI的病理学特点[例(%)] DILI发病的潜伏期差异很大,多为用药后的1~12周。本组DILI病例女性多于男性,其可能机制为女性细胞色素P450 3A活性和底物清除率较男性高,此代谢过程影响药物代谢及其代谢产物生成,同时女性的高免疫反应性可能将这些代谢产物识别为新抗原[7]。与其他肝病相比,DILI的临床表现并无特异性。 按照R值进行临床分型后,肝细胞损伤型、胆汁淤积型及混合型在可疑药物的种类和比例上差别不大,均为中(草)药所致DILI所占比例最高。近年来,中草药及保健品引起的DILI呈逐年升高趋势,可能由于其没有药物开发与监管的程序,且缺乏对某些中草药制剂潜在肝毒性的认识。因此建立中药的不良反应监测系统,加强对中草药使用的安全意识,迫在眉睫。 临床上,DILI的分型普遍按照入院时生化指标计算R值进行分型,按此标准,在本研究中,肝细胞损伤型所占比例最高,这与大多数文献[8-10]报道一致。肝细胞损伤型患者TBil水平高于胆汁淤积型及混合型患者,可能由于胆汁淤积早期,仅有胆汁淤积相关酶学(ALP和GGT)升高,可不出现黄疸[3,11]。 DILI至今尚无很好的确诊方法和可靠的诊断标准,肝脏病理虽然不是诊断的金标准,但对DILI的诊治十分重要,可提供潜在的发病机制、预后信息和指导治疗的线索等。本文行肝脏病理检查的152例DILI患者,依据病理损伤特点,混合型(有肝细胞损伤同时合并胆汁淤积)所占比例最大(66.45%),与依据生化指标的临床分型并不一致。在DILI的组织学改变上,肝细胞变性和坏死较为普遍,淤胆、胆栓形成和胆管损伤也并不少见,因此混合型比例较高。国内外均有文献[5,12]曾报道发病时临床分型与病理损伤模型的相关性有限, 其可能的原因有:(1)生化指标可能对判断胆管损伤的敏感性不够,不能及时反映患者肝组织病变的情况;(2)目前通用的临床分型标准仅与ALT和 ALP 2个指标有关,而与临床症状,TBil、AST及 GGT是否异常,DBil占TBil的比例等无关,从而存在着一定的局限性;(3)临床分型依据R值,即ALT升高倍数与ALP升高倍数的比值,病情进展中血清ALT升高较快而ALP相对缓慢,故疾病早期按此计算混合型所占比例较少。依据生化指标的临床分型标准并不能真实反映肝损伤的类型,临床实践中混合型(有肝细胞损伤同时合并胆汁淤积)所占比例并不低,肝脏病理可提供相对准确损伤类型,对疾病的诊治及预后有重要的参考和指导价值。 表3 3种临床分型DILI患者生化指标的比较[M(P25~P75)] 综上所述,DILI患者临床分型情况与肝脏病理损伤分型相关性不高,依据计算R值的临床分型并不能够完全体现肝损伤的类型,应引起广大临床医师的注意。希望以后能进一步扩大样本量,以DILI的病理学特征为基础,对其他相关指标等进行多因素回归分析,寻找并制订出更精确的临床分型标准,为临床诊治提供帮助。 [1] HAYASHI PH, FONTANA RJ. Clinical features, diagnosis, and natural history of drug-induced liver injury[J]. Semin Liver Dis, 2014, 34(2): 134-144. [2] DANAN G, BENICHOU C. Causality assessment of adverse reactions to drugs-I. A novel method based on the conclusions of international consensus meetings: application to drug induced liver injuries[J]. J Clin Epidemiol, 1993, 46(11): 1323-1330. [3] Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Gastroenterology, Chinese Medical Association; Chinese Society of Infectious Diseases, Chinese Medical Association. Consensus on diagnosis and treatment of cholestasis liver disease(2015)[J]. J Clin Hepatol, 2015, 31(12): 1989-1999. (in Chinese) 中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会感染病学分会. 胆汁淤积性肝病诊断和治疗共识(2015)[J]. 临床肝胆病杂志, 2015, 31(12): 1989-1999. [4] RAMACHANDRAN R, KAKAR S. Histological patterns in drug-induced liver disease[J]. J Clin Pathol, 2009, 62(6): 481-492.[5] KLEINER DE, CHALASANI NP, LEE WM, et al. Hepatic histological findings in suspected drug-induced liver injury: systematic evaluation and clinical associations[J]. Hepatology, 2014, 59(2): 661-670. [6] SCHIFF ER, MADDREY WC, SOREEL MF. SCHIFF′s diseases of the liver[M]. 11th ed. America: John Wiley & Sons Press, 2012: 148-170. [7] CHALASANI N, BJÖRNSSON E. Risk factors for idiosyncratic drug-induced liver injury[J]. Gastroenterology, 2010, 138(7): 2246-2259. [8] CHALASANI N, BONKOVSKY HL, FONTANA R, et al. Features and outcomes of 899 patients with drug-induced liver injury: the DILIN prospective study[J]. Gastroenterology, 2015, 148(7): 1340-1352. [9] KAPLOWITZ N. Idiosyncratic drug hepatotoxicity[J]. Nat Rev Drug Discov, 2005, 4(6): 489-499.[10] ROBLES-DIAZ M, LUCENA MI, KAPLOWITZ N, et al. Use of Hy′s law and a new composite algorithm to predict acute liver failure in patients with drug-induced liver injury[J]. Gastroenterology, 2014, 147(1): 109-118. [11] Drug-induced Liver Disease Study Group, Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the management of drug-induced liver injury[J]. J Clin Hepatol, 2015, 31(11): 1752-1769. (in Chinese) 中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 临床肝胆病杂志, 2015, 31(11): 1752-1769. [12] HE WP, XU B, WANG HF, et al. Correlation between clinical classification and histopathology in drug-induced liver injury[J]. Chin Hepatol, 2010, 15(4): 241-243. (in Chinese) 何卫平, 许彪, 王慧芬, 等. 药物性肝病临床分型和病理相关性分析[J]. 肝脏, 2010, 15(4): 241-243. 引证本文:XU ZL, GAO M, GUO CX, et al. Clinical features of different types of drug-induced liver injury and their association with liver histological changes[J]. J Clin Hepatol, 2017, 33(5): 924-927. (in Chinese) 徐曾丽, 高敏, 郭春霞, 等. 药物性肝损伤临床分型特点及其与肝组织学改变的关系[J]. 临床肝胆病杂志, 2017, 33(5): 924-927. (本文编辑:葛 俊) Clinical features of different types of drug-induced liver injury and their association with liver histological changes XUZengli,GAOMin,GUOChunxia,etal. (GraduateSchoolofTianjinMedicalUniversity,Tianjin300070,China) Objective To investigate the clinical features of patients with different clinical types of drug-induced liver injury (DILI), as well as the association between clinical type and pathological type. Methods A total of 289 patients with DILI who were admitted to Tianjin Second People's Hospital from January 2014 to January 2016 were enrolled, and according to the “R value” calculated based on biochemical parameters, they were divided into hepatocellular injury type group, cholestasis type group, and mixed type group. Medications and biochemical parameters were summarized and the liver histological changes in patients undergoing biopsy were observed to investigate the consistency between pathological type and clinical type. The non-parametric Kruskal-WallisHtest was used for comparison of non-normally distributed continuous data between multiple groups, and a one-way analysis of variance was used for comparison of normally distributed continuous data between multiple groups. The chi-square test was used for comparison of categorical data between groups. Results According to the calculated “R value”, of all patients, 181 (62.63%) had hepatocellular injury type, 55 (19.03%) had cholestasis type, and 53 (18.34%) had mixed type. Most of the drugs that caused liver injury were traditional Chinese medicine (48.79%). A total of 152 patients underwent biopsy, and according to the histological changes, 43 (28.29%) had hepatocellular injury type, 8 (5.26%) had cholestasis type, and 101 (66.45%) had mixed type; among these patients, the calculation of the “R value” showed that 95 (62.50%) had hepatocellular injury type, 29 (19.08%) had cholestasis type, and 28 (18.42%) had mixed type. There was a poor consistency between pathological type and clinical type (κ=0.229,P<0.05). Conclusion Traditional Chinese medicine is the main cause of DILI. There is a poor consistency between clinical type and pathological type of DILI, and the most common pathological type is mixed type. Therefore, the criteria for clinical typing await further improvement. drug-induced liver injury; pathology, clinical; histology 10.3969/j.issn.1001-5256.2017.05.027 2016-12-19; 2016-12-30。 天津市卫生计生委科技基金项目(2015KZ011) 徐曾丽(1990-),女,主要从事肝病研究。 李嘉,电子信箱:18622663700@163.com。 R575 A 1001-5256(2017)05-0924-04
2 结果
3 讨论
——以咸阳市屯庄水库为例

