小麦蛋白对TGase酶交联改性大豆蛋白凝胶特性的影响及机制
秦新生,姜绍通,赵妍嫣,郑 志
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽合肥 230009)
小麦蛋白对TGase酶交联改性大豆蛋白凝胶特性的影响及机制
秦新生,姜绍通,赵妍嫣,郑 志*
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽合肥 230009)
为探讨TGase酶对大豆与小麦混合蛋白凝胶性质的影响,本文研究了小麦蛋白的加入前后混合蛋白凝胶功能性质的变化规律。通过研究TGase酶添加量、反应温度、反应pH对混合蛋白凝胶特性的影响可知:蛋白浓度为11%(11 g/100 mL)保持不变,TGase酶添加量为30 U/g,反应温度为40 ℃,反应pH为7.0时,TGase酶对混合蛋白凝胶特性改善效果最强。对比小麦蛋白加入前后蛋白凝胶的性质,发现小麦蛋白的添加使得蛋白结构的β-折叠含量升高,游离巯基含量减少,凝胶弹性模量(G′)增强,形成了更为多空且紧密有序的三维网络结构,使得混合蛋白的凝胶性能显著增强(p<0.05)。
大豆分离蛋白,小麦蛋白,TGase酶,凝胶性
大豆分离蛋白(SPI)蛋白质含量在90%以上,具有丰富的营养价值,其氨基酸种类齐全,富含人体必需的赖氨酸,它的主要成分是7S和11S球蛋白。凝胶特性是大豆蛋白产品的一个重要功能性质,可直接应用在豆制品、乳制品、肉制品等制作中[1-2]。小麦蛋白(谷朊粉,WG)是小麦淀粉加工的副产物,其蛋白质质量分数达75%左右,主要成分是麦谷蛋白和麦醇溶蛋白,是营养丰富的纯天然植物蛋白源,但其第一限制性氨基酸是赖氨酸。由于小麦蛋白的组成以疏水性氨基酸为主,分子内疏水作用区域较大,在水中分散性较差,溶解度较低,导致其凝胶性较弱且不稳定,限制了其在食品中的大规模应用[3]。
蛋白质的凝胶特性是蛋白产品的重要评价指标。谷氨酰胺转氨酶(TGase酶)通过催化蛋白质或多肽中谷氨酰胺残基的γ-羟胺基团与赖氨酸上的ε-氨基之间形成ε-(γ-glutamyl)lys共价键,发生交联反应形成凝胶[4],从而改善了蛋白质的各种性质,如粘弹性、保水性等。董建云等[5]研究发现通过TGase酶改性小麦蛋白可明显提高其凝胶特性。Sun等[6]研究了TGase酶作用于豌豆分离蛋白和肌纤维蛋白,结果表明TGase酶对混合蛋白的溶解性、乳化性、凝胶强度等功能特性有所改善,并提高了其应用范围。由于大豆蛋白富含赖氨酸,而小麦蛋白含有丰富的谷氨酰胺,赖氨酸和谷氨酰胺作为TGase酶的作用底物,若将大豆蛋白和小麦蛋白混合进行TGase酶改性,不仅有助于形成凝胶,还可以平衡人体必需氨基酸结构,提高蛋白质营养价值[7-8]。
本文采用TGase酶交联改性制备大豆分离蛋白和小麦混合蛋白凝胶,分析TGase酶添加量、反应温度、pH等因素对蛋白凝胶性质的凝胶强度、持水性、溶解性的影响,并探讨小麦蛋白的添加对混合蛋白凝胶的功能性质(流变性、游离巯基含量、蛋白质二级结构、微观结构)变化的影响,为开发大豆和小麦复合蛋白的加工和利用提供参考。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白(蛋白质含量>90%) 河南省鲲华生物技术有限公司;小麦蛋白(蛋白质含量>75%) 安徽瑞福祥食品有限公司;谷氨酰胺转氨酶(酶活力为1000 U/g) 泰州市一鸣生物制品有限公司;其他试剂 均为分析纯。
722E型可见分光光度计 上海光谱仪器有限公司;himac CR22GⅡ高速冷冻离心机 日本HITACHI公司;TA-XT plus物性测定仪 英国Stable Mciro System公司;JSM-6490LV型扫描电子显微镜 日本电子公司;Nicolet 6700型傅里叶变换红外光谱仪 美国Thermo Nicolet公司;DHR-3型旋转流变仪 美国TA公司。
1.2 TGase酶催化大豆与小麦蛋白混合凝胶的制备
将蛋白乳状液(11%,w/v,SPI∶WG=10∶1)用磁力搅拌器搅拌2 h后,边搅拌边加入TGase酶,分散均匀,用缓冲液调节pH,停止搅拌。将样品放入振荡的恒温水浴锅中,于一定温度的水溶液中保温2 h,再放于90 ℃恒温水浴锅高温灭酶10 min,然后立即冰浴,样品于4 ℃冰箱保存24 h。
1.3 各因素对混合蛋白凝胶特性的影响
1.3.1 TGase酶添加量对混合蛋白凝胶特性的影响 在TGase酶促大豆与小麦混合蛋白凝胶反应体系中,控制蛋白浓度为11%(11 g/100 mL),反应温度40 ℃,反应pH7.0,研究不同TGase酶添加量(0、10、20、30、40和50 U/g)对蛋白凝胶特性的影响。
1.3.2 反应温度对混合蛋白凝胶特性的影响 在TGase酶促大豆与小麦混合蛋白凝胶反应体系中,控制蛋白浓度为11%(11 g/100 mL),TGase酶添加量为30 U/g,反应pH7.0,研究不同反应温度(30、40、45、50、55和60 ℃)对蛋白凝胶特性的影响。
1.3.3 pH对混合蛋白凝胶特性的影响 在TGase酶促大豆与小麦混合蛋白凝胶反应体系中,控制蛋白浓度为11%(11 g/100 mL),TGase酶添加量为30 U/g,反应温度40 ℃,研究不同反应pH(6.0、6.5、7.0、7.5、8.0和8.5)对蛋白凝胶特性的影响。
1.4 冻干小麦蛋白的制备
制备10% SPI,11% SPI和10% SPI+1% WG三种蛋白浓度的悬浊液,加入TGase酶形成凝胶。取凝胶样品置于培养皿中于-20 ℃冰箱中冷冻,等冻结成块放于冷冻干燥机中,取出磨成粉放置干燥器中备用。冻干的蛋白粉用来测定流变性、游离巯基含量、蛋白质二级结构、微观结构等性质。
1.5 性质的测定
1.5.1 凝胶强度的测定 依据Campbell等[9]测定方法,略有改动。采用TA-XT plus物性测定仪进行大豆与小麦混合凝胶的强度测定。测定方法是将制好的凝胶置于物性测定仪的载物台上,然后使装有P/0.5的平头柱对准烧杯中心压缩两次,即得到蛋白凝胶强度图。测定参数:探头直径:P/0.5;探头测量前速度:5.0 mm/s;探头测量时速度:5.0 mm/s;返回速度:5.0 mm/s;目标深度:10 mm。第一次对凝胶按压变形时所产生的最大破坏力作为凝胶强度。
1.5.2 凝胶持水性测定 依据Tang等[10]测定方法,略有改动。取5 g凝胶样品置于离心管中,8000 r/min离心20 min,用滤纸小心吸除离心出来的水分,再次称重。持水性(WHC)计算公式如下:
WHC(%)=[(Wt-Wr)/Wt]×100
式中,Wt为凝胶样品中所含水分的总质量(g);Wr为离心后凝胶溢出水分的质量(g)。
1.5.3 凝胶溶解性的测定 依据Sun等[11]的测定方法,略有改动。将凝胶样品配成浓度为10 mg/mL的水溶液,用磁力搅拌器搅拌均匀,8000 r/min离心20 min,上清液中可溶性蛋白质含量采用考马斯亮蓝法测定,以牛血清蛋白为标准品绘制标准曲线,在595 nm吸光值下测定样品吸光度。
1.5.4 凝胶流变性的测定 依据Sun等[6]测定方法,略有改动。将制备的凝胶进行振荡温度扫描分析,利用旋转流变仪进行温度扫描,测定参数:将样品放在测试平台上,上板直径为40 mm,狭缝为1 mm,温度扫描设定参数为:频率为0.1 Hz,应变为0.01%,从25 ℃升温至95 ℃,升温速率为2 ℃/min,使用凡士林封口防止水分蒸发。记录下弹性模量G′。
1.5.5 傅里叶变换红外光谱分析 将冷冻干燥后的蛋白粉与适量溴化钾混合均匀,干燥压片,放在测试平台上,用傅里叶变换红外光谱仪扫描,测定波段为4000~400 cm-1,扫描次数为64次。用PeakFit v4.12软件对酰胺I带1600~1700 cm-1波段的图谱进行分析。先校正基线,然后用Gaussian去卷积,再由俄二阶导数拟合,多次拟合使残差最小。根据峰面积计算各二级结构的比率。各吸收峰与二级结构对应关系:1610~1640 cm-1和1670~1690 cm-1为β-折叠;1640~1650 cm-1为无规则卷曲;1650~1660 cm-1为α-螺旋;1660~1670 cm-1和1690~1700 cm-1为β-转角[8]。
1.5.6 凝胶游离巯基的测定 依据Hu等[12]测定方法,略有改动。配制pH=8.0的Tris-Gly缓冲液(0.086 mol/L Tris,0.09 mol/L Glycine和4 mmol/L Na2EDTA)和4 mg/mL DTNB溶液(Ellman试剂)。取样品溶解在Tris-Gly缓冲液中配成0.5%的浓度,在25 ℃恒温水浴锅中反应30 min,8000 r/min离心15 min,取3 mL上清液中加入0.03 mL DTNB溶液混合均匀,反应15 min后在412 nm处测定吸光度,同时测定空白样(以缓冲液代替样品)。按如下公式计算:
SH(μmol/g)={[106/(1.36×104)]×A412×D}/C
式中,1.36×104是Ellman试剂的摩尔消光系数;A412是412 nm处的吸光值;D为稀释系数;C为样品最终浓度(mg/mL)。
1.5.7 扫描电镜分析 依据Zhang等[13]测定方法,略有改动。取冷冻干燥后的样品薄片,临界点干燥,离子溅射,给样品进行喷金处理。将样品移至扫描电子显微镜台面上,加速电压20 kV,用扫描电镜观测并拍摄冻干样品的微观形态结构。
1.6 数据统计分析
所有实验进行3次重复平行,结果用平均值表示,采用Origin 9.0软件对实验数据进行拟合处理。
2 结果与分析
2.1 各因素对TGase酶促蛋白凝胶的影响
2.1.1 TGase酶添加量对混合蛋白凝胶特性的影响 由图1可知,随着TGase酶添加量的增加,蛋白凝胶性能先增加后减小。当TGase酶添加量为30 U/g蛋白时,凝胶强度达到最大值90.67 g,随后凝胶强度开始下降。但持水性和溶解度在40 U/g蛋白时达到最大值,分别为78.26%和7.79 mg/mL。适量的酶添加量不仅可以缩短酶促反应时间,提高反应速度,而且可以避免由于加酶量过多造成浪费和成本的增加。所以选择TGase酶添加量为30 U/g蛋白时,可得到较好性质的蛋白凝胶。实验表明,在确定的蛋白浓度下,TGase酶能提高大豆与小麦混合蛋白凝胶的凝胶强度和持水性。Zhang等[13]和Yang等[14]研究表明:TGase酶通过催化大豆和小麦蛋白中谷氨酰胺残基的γ-羟胺基团与赖氨酸上的ε-氨基之间形成ε-(γ-glutamyl)lys共价键,这种共价键的连接力比氢键和二硫键更强,是它们的20倍,同时蛋白分子质量增大,更加有利于发生交联反应形成凝胶。

图1 TGase酶添加量对混合蛋白凝胶特性的影响Fig.1 Effect of TGase addition amount on gel properties of TGase-induced protein gels
2.1.2 反应温度对混合蛋白凝胶特性的影响 由图2可知,随着反应温度的增加,蛋白凝胶性能先增加后减小。当反应温度为40 ℃时,凝胶强度达到最大值87.67 g,随后凝胶强度开始下降。持水性和溶解度也在40 ℃时达到最大值,分别为81.01%和7.83 mg/mL。有实验表明,温度对蛋白凝胶性质的影响主要还是对其酶促反应的影响,使TGase酶在最适温度下发生交联反应,进而引起蛋白凝胶性质的变化[15]。郭秀瑾等[15]研究表明:微生物TGase酶的酶促反应最佳温度是40 ℃,最佳pH7.0。在最佳温度下,酶促交联反应速度较快,使得蛋白质表面的作用位点很快被交联,又增加了蛋白质分子间交联的几率,促进蛋白分子间形成空间网状结构,导致凝胶强度增加。所以选择反应温度为40 ℃时,可得到较好性质的蛋白凝胶。
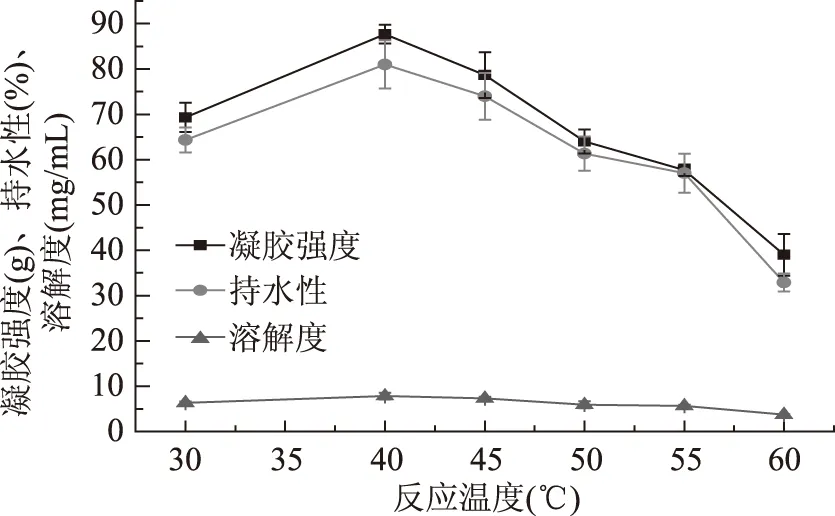
图2 反应温度对混合蛋白凝胶特性的影响Fig.2 Effect of reaction temperature on gel properties of TGase-induced protein gels
2.1.3 pH对混合蛋白凝胶特性的影响 由图3可知,随着反应pH的增加,蛋白凝胶性能先增加后减小。当反应pH为7时,凝胶强度达到最大值80.33 g,随后凝胶强度开始下降。持水性和溶解度在pH为7时也达到最大值,分别为76.47%和7.46 mg/mL。实验表明,反应体系中pH的变化会影响蛋白质分子的静电荷量和离子化作用,影响蛋白质相互作用体系中的疏水作用和静电作用之间的平衡,进而影响凝胶的性质和网状性质[5]。大豆蛋白和小麦蛋白的等电点分别为4.6和5左右,当溶液为酸性状态时,蛋白易结块,分散性溶解度较低,不能与TGase酶接触均匀,阻碍了蛋白分子间的交联反应,导致蛋白凝胶不能形成较好的凝胶网络结构,从而降低了凝胶特性[16]。当pH在中性状态下,蛋白凝胶强度较大。当pH大于8时,由于TGase酶发生空间构象变化而部分失活,导致交联反应减少,蛋白凝胶强度下降。所以选择pH为7时,可得到较好的蛋白凝胶。

图3 pH对混合蛋白凝胶特性的影响Fig.3 Effect of pH on gel properties of TGase-induced protein gels

表1 小麦蛋白加入前后蛋白凝胶二级结构及游离巯基的比较分析Table 1 Experimental analysis and results of WG addition amount on secondary structure and free sulfhydryl contents of TGase-induced protein gels
2.2 小麦蛋白的加入前后混合蛋白凝胶功能性质的比较分析
小麦蛋白的加入前后混合蛋白凝胶的二级结构、游离巯基含量、流变性、微观结构等功能性质的变化规律如表1、图4~图6所示。

图4 小麦蛋白加入前后蛋白凝胶的红外光谱图Fig.4 Effect of WG addition amount on FTIR spectra of TGase-induced protein gels

图5 小麦蛋白加入前后蛋白凝胶流变性的比较分析(升温温度扫描)Fig.5 Effect of WG addition amount on rheological properties of TGase-induced protein gels(Heating phase)

图6 小麦蛋白加入前后蛋白凝胶微观结构的比较分析Fig.6 Effect of WG addition amount on microstructure images of TGase-induced protein gels注:A、10% SPI;B、11% SPI;C、10% SPI+1% WG。
由表1、图4~图6可知,小麦蛋白的加入后,蛋白凝胶的二级结构、游离巯基含量、流变性、微观结构等功能性质均有显著改善。由表1得到,蛋白的α-螺旋和β-转角结构减少且伴随着β-折叠和无规则卷曲结构的增加,原因是小麦蛋白加入后,使反应体系中谷氨酰胺键含量上升,为TGase酶交联作用提供更多作用位点,蛋白质交联聚集形成紧密有序的网络结构,使得β-折叠含量升高,另外,TGase酶改性过程中,蛋白结构展开导致氢键断裂,使得α-螺旋含量降低。TGase酶的交联改性使蛋白结构更加紧密,阻止了多肽链的反转,从而降低了β-转角结构的减少[17]。与相同含量的未加小麦蛋白的凝胶对比,游离巯基含量明显降低。原因在于TGase酶的交联改性形成的聚集体使暴露在蛋白表面的游离巯基被包埋到分子内部,另外,在改性过程中多肽链中含硫氨基酸通过氧化作用形成二硫键也会导致游离巯基含量的减少[18]。
弹性模量G′表示流体样品的弹性,反应出样品的凝胶强度,由图5得到,蛋白凝胶形成经过两次热变性阶段,在第一个峰值出现的阶段,说明松散的凝胶结构已初步形成,随着温度的进一步升高,导致半凝胶的流动性增加,导致刚形成的网络结构被破坏,凝胶强度降低,随后G′随着温度的升高而升高,蛋白聚集体相互交联,形成不可逆的凝胶。结果显示,小麦蛋白加入后,蛋白凝胶的凝胶强度(G′)显著增强[17]。由图6得到,随着小麦蛋白的添加,蛋白凝胶微观结构越来越致密和规则,主要是由于小麦蛋白的加入促进了TGase酶的交联改性,使得蛋白舒展生成大量多聚体,从而形成更加稳定的三维网状凝胶结构[19-20]。
3 结论
本文研究了TGase酶对大豆与小麦混合蛋白凝胶性质的影响。通过TGase酶添加量、反应温度、反应pH3个因素对混合蛋白凝胶特性的影响研究可知:蛋白浓度为11%(11 g/100 mL)保持不变,TGase酶添加量为30 U/g,反应温度为40 ℃,反应pH为7.0时,TGase酶对混合蛋白凝胶特性改善效果最强。小麦蛋白的加入前后混合蛋白凝胶功能性质的比较分析结果显示:小麦蛋白加入后,使反应体系中谷氨酰胺键含量增加,为TGase酶交联作用提供更多有效的作用位点,促进了蛋白质交联聚集反应。导致蛋白结构的β-折叠含量升高,游离巯基含量减少,凝胶弹性模量(G′)增强,形成了更为多空且紧密有序的三维网络结构,使得混合蛋白的凝胶性能显著增强。本研究为拓宽大豆蛋白和小麦蛋白的综合利用具有重要意义。
[1]Nishinari K,Fang Y,Guo S,et al. Soy proteins:A review on composition,aggregation and emulsification[J]. Food Hydrocolloids,2014,39(2):301-318.
[2]赵妍嫣,秦新生,朱圣伟,等. 大豆凝集素的超声波辅助提取工艺优化及其性质[J]. 食品科学,2016,37(10):34-39.
[3]Wang P,Jin Z,Xu X. Physicochemical alterations of wheat gluten proteins upon dough formation and frozen storage-A review from gluten,glutenin and gliadin perspectives[J]. Trends in Food Science & Technology,2015,46(2),189-198.
[4]Gaspar A L,de Goes-Favoni S P. Action of microbial transglutaminase(MTGase)in the modification of food proteins:A review[J]. Food Chemistry,2015,171:315-322.
[5]董建云,钟昔阳,罗水忠,等. 谷氨酰胺转氨酶对小麦蛋白凝胶性的影响研究[J]. 中国粮油学报,2014,29(12):5-11.
[6]Sun X D,Arntfield S D. Gelation properties of myofibrillar/pea protein mixtures induced by transglutaminase crosslinking[J]. Food Hydrocolloids,2012,27(2):394-400.
[7]Qin X S,Luo S Z,Cai J,et al. Effects of microwave pretreatment and transglutaminase crosslinking on the gelation properties of soybean protein isolate and wheat gluten mixtures[J]. Journal of the Science of Food and Agriculture,2016,96(10):3559-3566.
[8]Qin X S,Luo S Z,Cai J,et al. Transglutaminase-induced gelation properties of soy protein isolate and wheat gluten mixtures with high intensity ultrasonic pretreatment[J]. Ultrasonics Sonochemistry,2016,31:590-597.
[9]Campbell L J,Gu X,Dewar S J,et al. Effects of heat treatment and glucono-δ-lactone-induced acidification on characteristics of soy protein isolate[J]. Food Hydrocolloid,2009,23(2):344-351.
[10]Tang C H,Chen L,Foegeding E A. Mechanical and water-holding properties and microstructures of soy protein isolate emulsion gels induced by CaCl2,glucono-δ-lactone(GDL),and transglutaminase:influence of thermal treatments before and/or after emulsification[J]. Journal of Agricultural and Food Chemistry,2011,59(8):4071-4077.
[11]Sun Y,Hayakawa S,Izumori K. Modification of ovalbumin with a rare ketohexose through the Maillard reaction:effect on protein structure and gel properties[J]. Journal of Agricultural and Food Chemistry,2004,52(5):1293-1299.
[12]Hu H,Li-Chan E C Y,Wan L,et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloid,2013,32(2):303-311.[13]Zhang P,Hu T,Feng S,et al. Effect of high intensity ultrasound on transglutaminase-catalyzed soy protein isolate cold set gel[J]. Ultrasonics Sonochemistry,2016,29:380-387.
[14]Yang M,Liu F,Tang C H. Properties and microstructure of transglutaminase-set soy protein-stabilized emulsion gels[J]. Food Research International,2013,52(1):409-418.
[15]郭秀瑾,胡杨,尤娟,等. 微生物转谷氨酰胺酶诱导下鲢鱼糜凝胶的结构演化规律[J]. 食品科学,2016,37(5):6-11.
[16]Zhong Q,Wan W,Hu Z,et al. Sequential preheating and transglutaminase pretreatments improve stability of whey protein isolate at pH7.0 during thermal sterilization[J]. Food Hydrocolloids,2013,31(2):306-316.
[17]潘丽华,冯美琴,孙健,等. 不同温度下亚麻籽胶对肌原纤维蛋白凝胶特性的影响及机制[J]. 食品科学,2016,37(9):1-6.
[18]史可夫,肖雄,吴双双,等. 超高压对肌球蛋白-海藻酸钠-氯化钙混合凝胶特性的影响[J]. 食品科学,2015,36(23):33-37.
[19]涂宗财,包中宇,王辉,等. 超声波对大豆分离蛋白结构及其形成谷氨酰胺转氨酶改性凝胶性质的影响[J]. 食品科学,2015,36(15):15-19.
[20]Arzeni C,Martínez K,Zema P,et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering,2012,108(3):463-472.
Effect of wheat gluten on gelation properties of soy protein isolate induced by transglutaminase crosslinking
QIN Xin-sheng,JIANG Shao-tong,ZHAO Yan-yan,ZHENG Zhi*
(School of Food Science and Engineering,Hefei University of Technology,Key Laboratory for Agriculture Products Processing of Anhui Province,Hefei 230009,China)
To study the effect of transglutaminase(TGase)on gel properties of soy protein isolate(SPI)and wheat gluten(WG)mixtures,the change of functional properties of mixed protein gels were measured,and compared with basic SPI gels. The effects of TGase enzyme concentration,temperature,and pH on colloidal characteristics had been investigated. The optimum parameters were determined as follows:protein concentration 11 g/100 mL,TGase enzyme concentration 30 U/g,temperature 40 ℃ and pH7.0. Under these conditions,TGase had the highest improving effect on colloidal properties of mixed protein gels. Compared with TGase induced SPI gels,an increase in theβ-sheet content and gel strength(G′),and a reduction in free sulfhydryl content and resulted in denser and more homogeneous networks of the mixed protein gels.
soy protein isolate;wheat gluten;transglutaminase;gelation
2016-09-02
秦新生(1992-),男,硕士研究生,研究方向:食品资源综合利用,E-mail:qinxinsheng@mail.hfut.edu.cn。
*通讯作者:郑志(1971-),男,博士,教授,研究方向:农产品加工及贮藏工程,E-mail:zhengzhi@hfut.edu.cn。
国家高技术研究发展计划(863计划)课题(2013AA102201);安徽省科技重大专项项目(16030701082);安徽省科技攻关项目(1301031031、15czz03096)。
TS201.7
A
1002-0306(2017)08-0214-05
10.13386/j.issn1002-0306.2017.08.033

