腹膜透析和血液透析对终末期肾脏疾病患者钙磷代谢及炎症因子的影响
徐庆东 郭焕开 陈小荷 姜松青 石晓峰
·论著·
腹膜透析和血液透析对终末期肾脏疾病患者钙磷代谢及炎症因子的影响
徐庆东 郭焕开 陈小荷 姜松青 石晓峰
目的 探讨不同透析方式对终末期肾脏疾病患者钙磷代谢及炎症因子水平的影响。方法 选取2015年1月至2015年12月在江门市中心医院接受血液净化治疗的250例终末期肾脏疾病患者为研究对象,根据透析方式的不同分为2组,腹膜透析(peritoneal dialysis,PD)组115例,血液透析(hemodialysis,HD)组135例。对所有患者均进行至少6个月的随访调查,比较2组透析后炎症因子水平(C反应蛋白、白细胞介素6、肿瘤坏死因子α)、钙磷代谢水平(血钙、血磷)、生化指标水平(总胆固醇、三酰甘油、总蛋白、血红蛋白、白蛋白、血肌酐、尿素氮)、生存质量状况及并发症发生率。结果 PD组C反应蛋白水平较HD组低,差异有统计学意义(P<0.05);2组白细胞介素6、肿瘤坏死因子α、血钙及血磷比较差异无统计学意义(P>0.05)。PD组总蛋白、白蛋白水平较HD组低,差异有统计学意义(P<0.05);其余生化指标无统计学差异(P<0.05)。2组生存质量评估无统计学差异(P>0.05)。PD组感染、低蛋白血症发生率比HD组高,差异有统计学意义(P<0.05);PD组高血压、心律失常及充血性心力衰竭发生率较HD组低,差异有统计学意义(P<0.05)。结论 行PD或HD的终末期肾脏疾病患者体内均存在炎症反应,且HD患者炎症反应更为严重;两种透析方式对钙磷代谢的影响未见明显差异,临床应根据患者具体情况,选择合理的透析方式。
腹膜透析;血液透析;终末期肾脏疾病;钙磷代谢;炎症因子
终末期肾脏疾病(end stage renal disease,ESRD)是指各种慢性肾脏疾病的终末阶段,严重危害人类健康。在ESRD早期,患者可无明显症状,随着疾病的进展,体内毒素不断聚积,患者肾功能不断下降,导致消化道出血、皮肤瘙痒、恶心呕吐、水肿、胃纳差及口氨臭味等临床症状的发生,严重影响患者生存质量[1]。相关研究表明,ESRD患者体内存在微炎症反应,而这种微炎症反应是促使ESRD患者病死率上升的重要因素之一[2]。因此,降低微炎症反应对于提高ESRD患者生存率具有重要意义。血液净化是治疗ESRD的主要方式之一,主要包括血液透析(hemodialysis,HD)、腹膜透析(peritoneal dialysis,PD)两种,可延长患者生存期、提高患者生存质量。不同的透析方式具有不同的疗效[3-4],因此本研究探讨不同透析方式对ESRD患者钙磷代谢及炎症因子水平的影响,为临床选择合理的透析方式治疗ESRD提供依据。
资料与方法
一、研究资料
1.一般资料 选取2015年1月至2015年12月在江门市中心医院接受治疗的250例ESRD患者为研究对象,其中男142例,女108例,年龄36~77岁,平均年龄(56.4±6.5)岁,透析时间13~32个月,平均透析时间(18.25±2.54)个月。
2.纳入标准 年龄范围在35~80岁之间;临床资料完整;肾小球滤过率<15 ml/min;规律透析时间>12个月;无严重心力衰竭、营养不良等并发症;依从性好,配合本次研究;随访时间超过6个月;预计生存期>6个月。
3.排除标准 近期内接受腹部手术;既往有肾移植手术史;妊娠及哺乳期妇女;急性心脑血管疾病病史;患有严重精神疾病;严重传染性疾病患者;近期内合并肺结核、肝硬化及肿瘤者;近期内应用免疫抑制剂、激素等药物治疗者。
4.分组 根据透析方式的不同将患者分为PD组和HD组。PD组男62例,女53例,年龄36~75岁,平均年龄(56.0±7.8)岁,透析时间14~32个月,平均透析时间(18.29±1.77)个月;原发病分别为慢性肾小球肾炎35例,高血压肾病16例,梗阻性肾病23例,慢性间质性肾炎22例,多囊肾病15例,其他4例。PD组男80例,女55例,年龄38~77岁,平均年龄(56.1±7.7)岁,透析时间13~30个月,平均透析时间(18.30±1.81)个月;原发病分别为慢性肾小球肾炎40例,高血压肾病19例,梗阻性肾病27例,慢性间质性肾炎26例,多囊肾病17例,其他6例。2组患者性别、平均年龄、透析时间及原发病类型等一般资料相比,差异无统计学意义(P>0.05),具有可比性。
二、治疗方法
PD组患者接受PD治疗,2 000 ml/次,3~4次/d,采用聚砜膜。HD组患者接受HD治疗,应用碳酸氢盐透析液,血流量为200~250 ml/min,3次/周,4 h/次,采用聚砜膜。所有患者均控制血压、血糖,纠正贫血,常规补充活性维生素D、促红细胞生成素、铁剂、钙剂及叶酸等。
三、观察指标
所有患者均随访6个月,观察2组患者炎症因子水平[C反应蛋白(C-reactive protein,CRP)、白细胞介素6(interleukin-1,IL-6)、肿瘤坏死因子α(tumor necrosis factors-α,TNF-α)]、钙磷代谢水平(血钙、血磷)、生化指标水平[三酰甘油 (triglyceride,TG),总胆固醇 (total cholesterol,TC),总蛋白(total protein,TP),血红蛋白(hemoglobin,Hb),白蛋白(Albumin,Alb),血肌酐(SCr)及尿素氮(BUN)]、生存质量状况及并发症发生率。
参考SF-36生活质量评估量表,应用本院自拟生存质量调查问卷对患者生存质量状况进行评价,包括躯体活动、情感职能、心理健康、社会关系、生理健康及活力6个方面,每方面总分0~0分,评分越高表示生存质量状况越好[5]。并发症包括感染、高血压、心律失常、低蛋白血症、充血性心力衰竭。
四、统计学处理
采用SPSS 18.0软件进行统计学处理,计量资料符合正态分布采用均数±标准差表示,计数资料采用百分率表示;2组治疗后6个月实验室检测指标及生存质量评分的比较采用t检验,两组并发症发生率采用χ2检验,设置双侧检验水准α=0.05,P<0.05表示差异具有统计学意义。
结 果
一、治疗后实验室指标比较
PD组CRP水平较HD组低,差异有统计学意义(P<0.05);PD组IL-6、TNF-α水平与HD组相比,差异无统计学意义(P>0.05)。PD组血钙(2.18±0.76) mmol/L、血磷(1.97±0.74) mmol/L, HD组血钙(2.16±0.75) mmol/L、血磷(1.94±0.77) mmol/L,2组比较差异无统计学意义(P>0.05)。(表1)
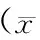
表1 炎症因子水平比较±s)
PD组TG、TC、Hb、SCr、BUN水平与HD组相比,差异无统计学意义(P>0.05);PD组TP、Alb水平较HD组低,差异有统计学意义(P<0.05)。(表2)
二、生存质量状况及并发症比较
PD组躯体活动、情感职能、心理健康、社会关系、生理健康及活力评分与HD组相比,差异无统计学意义(P>0.05)。PD组感染、低蛋白血症发生率较HD组明显更高,差异有统计学意义(P<0.05);PD组高血压、心律失常及充血性心力衰竭发生率较HD组低,差异有统计学意义(P<0.05)。(表3~4)
讨 论
各种慢性肾脏疾病最终进展为ESRD,肾脏移植、PD及HD是目前临床治疗ESRD的三种主要方式。肾脏移植效果最佳,但由于受脏器来源缺乏、临床匹配困难及费用昂贵等因素影响,导致目前临床主要以PD及HD等肾替代疗法对ESRD患者进行治疗,不同的透析方式具有不同的效果及特点[6-8]。对ESRD患者采用透析治疗,可延长患者生存时间,但由于感染及并发症,患者预后一直不理想。随着医疗技术的不断进步,对ESRD的发病机制的研究不断深入,越来越多的学者及专家重视患者体内存在的微炎症状态。相关研究表明,ESRD及PD、HD患者体内均存在微炎症状态,其诱发因素可能与肾脏清除炎症因子能力降低、免疫功能障碍等有关[9]。这种微炎症状态会加重ESRD患者营养不良、感染及心血管疾病,不利于患者预后,增加了患者的病死率。微炎症反应是由单核巨噬细胞被激活所导致,释放大量IL-6、TNF-α等炎症因子。IL-6由巨噬细胞、T细胞及B细胞产生,可调节免疫应答及细胞生长分化,在维持机体生理平衡中具有重要作用[10]。ESRD患者体内IL-6的表达失调,在疾病处于活动期时,IL-6的含量可上升。TNF-α主要由单核细胞、巨噬细胞产生,参与多种免疫反应及炎症反应,在恶性肿瘤及慢性肾衰竭等疾病的病理状态下大量产生。
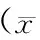
表2 生化指标水平比较±s)
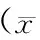
表3 生存质量评分比较±s)

表4 并发症发生率比较[例(%)]
CRP是一种环状五聚体蛋白,在机体受到组织损伤及感染时,其含量会急剧上升,浓度随着炎症变化而改变[11]。本研究中,PD组CRP水平较HD组低,提示可能在HD治疗过程中,其体外循环模式下,血液与透析管路、透析膜等接触,因透析膜具有生物不相容性,导致炎症因子的释放,且在动静脉内瘘穿刺点或中心静脉导管管口存在病菌侵入,并在体内激活单核巨噬细胞,进一步导致炎症因子的大量释放,从而加重这种微炎症反应[12-13]。但PD可能会因为操作或胃肠道感染等因素也增加腹膜炎等感染的几率[14]。与HD相比PD,可更好对中分子物质进行清除,充分清除尿毒症毒素,可能会减少对炎症因子激活,同时保护残余肾功能更佳,因此虽然PD发生感染几率高于HD,但PD可更好清除炎症因子,降低CRP水平。
慢性肾脏疾病患者,尤其是维持性血液透析患者,普遍存在钙磷代谢紊乱的问题,增加骨折、骨痛等发生率,影响治疗效果。本研究结果显示,PD组血钙、血磷水平与HD组相比未见明显差异,说明两种透析方式对钙磷代谢的影响较为接近,其原因可能为Ca2+、P3+属于小分子物质,而两种透析方式对Ca2+、P3+清除无明显差异。另外,本研究还发现,PD组高血压、心律失常及充血性心力衰竭发生率较血液透析组少,提示PD在持续维持患者体内水钠平衡方面较有优势。本研究中,PD组低蛋白血症发生率较HD组高,原因可能与PD患者营养状况和透析时TP、Alb丢失有关[15]。
综上所述,行PD及HD的ESRD患者体内均存在微炎症反应,且行HD患者较为严重;两种透析方式对钙磷代谢的影响未见明显差异,临床应根据患者具体情况,选择合理的透析方式。
[1] Krishnan M, Weinhandl ED, Jackson S, et al. Comorbidity ascertainment from the ESRD Medical Evidence Report and Medicare claims around dialysis initiation: a comparison using US Renal Data System data[J]. Am J Kidney Dis, 2015, 66(5): 802-812.
[2] 马坤岭, 刘晶, 高民, 等. 炎症诱导低密度脂蛋白受体表达失调在终末期肾脏病患者桡动脉泡沫细胞形成中的作用[J]. 中华内科杂志, 2013, 52(6): 464-468.
[3] Leung S, McCormick B, Wagner J, et al. Meal phosphate variability does not support fixed dose phosphate binder schedules for patients treated with peritoneal dialysis: a prospective cohort study[J]. BMC Nephrol, 2015, 16(1): 205.
[4] Yang CW, Tzeng NS, Yin YJ, et al. Angiotensin Receptor Blockers Decrease the Risk of Major Adverse Cardiovascular Events in Patients with End-Stage Renal Disease on Maintenance Dialysis: A Nationwide Matched-Cohort Study[J]. PloS one, 2015, 10(10): e0140633.
[5] 张英, 乔淑芳, 赵颖, 等. 居家有氧运动对维持性血液透析患者生存质量的影响[J]. 中华现代护理杂志, 2013, 19(z19): 2299-2301.
[6] 邢同海, 彭志海, 钟林, 等. 慢加急性肝功能衰竭伴肾功能不全选择肝移植或肝肾联合移植治疗的经验[J]. 中华器官移植杂志, 2014, 35(10): 599-602.
[7] 葛益飞, 任海滨, 刘佳, 等. 甲状旁腺全切除加前臂移植术治疗尿毒症继发性甲状旁腺功能亢进症[J]. 中华肾脏病杂志, 2013, 29(1): 16-20.
[8] Bernardo AP, Oliveira JC, Santos O, et al. Insulin Resistance in Nondiabetic Peritoneal Dialysis Patients: Associations with Body Composition, Peritoneal Transport, and Peritoneal Glucose Absorption[J]. Clin J Am Soc Nephrol, 2015, 10(12): 2205-2212.
[9] 刘晓斌, 王凉, 刘斌, 等. 高通量血液透析对老年糖尿病肾病患者胰岛素抵抗及微炎症状态的影响[J]. 中华老年医学杂志, 2014, 23(2): 159-162.
[10]Xu G, Yan Y, Liu Y. The cardiovascular disease risks of nonthyroidal illness syndrome and inflammatory responses on patients with chronic kidney disease: from the association to clinical prognosis[J]. Cardiovasc Ther, 2014, 32(6): 257-263.
[11]Sharma R, Agrawal S, Saxena A, et al. Association of IL-6, IL-10, and TNF-α gene polymorphism with malnutrition inflammation syndrome and survival among end stage renal disease patients[J]. J Interferon Cytokine Res, 2013, 33(7): 384-391.
[12]Casimiro de Almeida J, Lou-Meda R, Olbert M, et al. The Growth Attainment, Hematological, Iron Status and Inflammatory Profile of Guatemalan Juvenile End-Stage Renal Disease Patients[J]. PloS one, 2015, 10(10): e0140062.
[13]Carlsson AC, Carrero JJ, Stenvinkel P, et al. Endostatin, Cathepsin S, and Cathepsin L, and Their Association with Inflammatory Markers and Mortality in Patients Undergoing Hemodialysis[J]. Blood Purif, 2015, 39(4): 259-265.
[14]Lee YC, Hung SY, Wang HH, et al. Different Risk of Common Gastrointestinal Disease Between Groups Undergoing Hemodialysis or Peritoneal Dialysis or With Non-End Stage Renal Disease: A Nationwide Population-Based Cohort Study[J]. Medicine, 2015, 94(36): e1482.
[15]肖静, 黄忠, 卢珊, 等. 终末期肾脏病伴晚期肝硬化患者血液透析和腹膜透析临床分析[J]. 中华肾脏病杂志, 2013, 29(3): 227-228.
Objective To investigate the effects of different kinds of dialysis on calcium-phosphorus metabolism and inflammatory factors in patients with end-stage renal disease (ESRD).Methods 250 ESRD patients treated in our hospital from January 2015 to December 2015 were divided into two groups given different dialysis procedures: 115 cases given peritoneal dialysis (PD), and the rest 135 cases hemodialysis (HD). All the patients were given a 6-month follow-up investigation. The inflammatory factors (CRP, IL-6, TNF-α) levels, calcium-phosphorus metabolism levels (Ca, P), biochemical index levels [total cholesterol (TC), triglyceride (TG), total protein (TP), hemoglobin (Hb), albumin (Alb), serum creatinine (SCr), and blood urea nitrogen (BUN)], living quality and incidence of complications between two groups after treatment were compared.Results The C-reactive protein level in PD group was lower than that in HD group (P<0.05). There was no significant difference in IL-6, TNF-α, Ca and P levels between two groups (P>0.05). There was no significant difference in TC, TG, Hb, SCr and BUN between two groups (P>0.05). The TP and Alb in PD group were significantly lower than those in HD group (P<0.05). There was no significant difference in living quality between two groups (P>0.05). The incidence of infection and hypoproteinemia in PD group was significantly higher than that in HD group (P<0.05). The incidence of hypertension, arrhythmia and congestive heart failure in PD group was significantly lower than that in HD group (P<0.05).Conclusions ESRD patients with PD or HD have inflammatory response and patients with HD have more severe response. The effects of two kinds of dialysis on calcium-phosphorus metabolism have no significant difference. The suitable dialysis procedure should be selected in terms of patients' clinical specific conditions.
Peritoneal dialysis; Hemodialysis; End-stage renal disease; Calcium-phosphorus metabolism; Inflammatory factors
10.3969/j.issn.1671-2390.2017.04.007
江门市科技计划(No.20150020002792)
529000 江门,江门市中心医院肾内科
2016-06-11
2016-10-05)
Effects of different kinds of dialysis on calcium-phosphorus metabolism and inflammatory factors in patients with end-stage renal diseaseXUQing-dong,GUOHuan-kai,CHENXiao-he,JIANGSong-qing,SHIXiao-feng.DepartmentofRenalMedicine,JiangmenCentralHospital,Jiangmen529000,China

