紫叶白桦组培苗叶片花青素含量影响因素分析
杨玲,刘虹男,张冬严,沈海龙
(东北林业大学 林学院,林木遗传育种国家重点实验室,哈尔滨,150040)
紫叶白桦组培苗叶片花青素含量影响因素分析
杨玲,刘虹男,张冬严,沈海龙*
(东北林业大学 林学院,林木遗传育种国家重点实验室,哈尔滨,150040)
以紫叶白桦为试材,测定离体快繁过程中组培苗叶片花青素含量及其与叶绿素、类黄酮、类胡萝卜素和总酚等物质含量的比例关系,分析环境因素对组培苗叶片颜色和花青素含量的影响。结果表明:增殖阶段的WPM培养基有利于花青素的合成。随着培养基中激素浓度增加,花青素合成被抑制,这种抑制作用没有激素种类差异。培养基中缺乏蔗糖会减少花青素积累。较低pH值和温度以及延长光照时间对花青素积累有促进作用。强光照可增加组培微枝和再生植株叶片中花青素含量,但降低了叶绿素的含量和比例。随着花青素比例减小,类黄酮和总酚含量减小,叶绿素比例增加,类胡萝卜素比例增加。研究结果为培育紫叶白桦优质观赏苗木提供了理论指导和参考依据。
紫叶白桦;离体快繁;花青素;叶绿素
0 引言
紫叶白桦(Betulapopulifolia‘Whitespire’×B.‘Crimson Frost’)是欧洲白桦和亚洲白桦经过反复杂交并根据叶色特征长期选育出来的新品种,是适合一年四季观赏的优良树种。紫叶白桦具有抗虫性强,喜光照,耐潮湿,适应性广,易种植的特点。由于紫叶白桦常表现为花无育性、不产生种子或产生的种子不能形成具有稳定遗传性状的小植株,所以一直以嫩枝扦插或嫁接的方式进行繁殖。国外对紫叶白桦的繁殖研究较早,已经建立了通过组织培养手段的紫叶白桦离体快繁技术,可以实现紫叶白桦的快速、高效繁殖及大规模推广种植(个人通讯)。国内关于紫叶白桦的研究起步较晚,但目前已经建立了通过组织培养手段的紫叶白桦离体快繁技术方法[1],并对紫叶白桦扦插和嫁接技术进行了初步研究[2]。与扦插和嫁接方法相比较,通过组织培养手段的离体快繁方法是目前国内比较成熟的紫叶白桦繁殖技术,具有繁殖系数大、繁殖速度快、苗木性状稳定的优点。但在紫叶白桦离体快繁过程中,我们发现紫叶白桦组培苗叶片颜色的稳定性较差,叶色受环境条件的影响容易发生明显的改变。已知彩叶植物的叶色形成是由遗传因素和外部环境共同作用的结果,通过改变植物叶片中色素的种类、含量及分布形成了多彩的叶色[3]。利用环境因子调控花青素等色素物质含量将会极大地提高植物的观赏价值[3]。本研究以紫叶白桦离体快繁过程中的试管苗和再生植株为研究对象,测定了试管苗和再生植株叶片花青素含量以及叶绿素含量、类黄酮含量、类胡萝卜素含量和总酚含量的变化,分析了6种环境因素对花青素等物质含量及其比例的影响。研究结果为了解紫叶白桦组培苗叶色变化影响因素奠定基础,为培育紫叶白桦优质观赏苗木提供理论指导和参考依据。
1 材料与方法
1.1 材料来源
研究材料来自美国威斯康星州Evergreen苗圃获得的试管内紫叶白桦无菌茎芽。将试管内无菌茎芽的叶片去除,将茎剪切成2.0 cm长度、带顶芽或腋芽的茎段作为外植体,平行或垂直接种到培养基上。每个培养瓶(500 mL容量)内装50 mL培养基,每培养瓶内接种10个茎段。
1.2 试验方法
1.2.1 茎芽增殖培养方法
分别采用MS、1/2MS和WPM作为基本培养基,培养基中分别含有不同浓度的6-BA(0.0、0.2、0.4、0.8 μM)和NAA(0、0.05、0.1 μM)组合。各培养基中分别添加15、20、25、30 g/L蔗糖,培养基的pH值在121℃高压灭菌20 min前分别调节为5.0、5.4、5.8、6.2、6.6。所有培养基内均添加6.0 g/L琼脂作为固化剂。每种培养基重复10瓶。培养条件:30℃下每天光照16 h或20 h,光照强度75 μmol/(m2·s)。接种后培养30 d时测定叶片花青素等物质含量。
1.2.2 茎芽增壮培养方法
将增殖获得的茎芽单独剪切下来,垂直接种到增壮培养基上。每培养瓶内接种10个茎芽。采用WPM作为基本培养基,培养基中添加20 g/L蔗糖,培养基的pH值在121℃高压灭菌20 min前调节为6.2。培养基内添加6.0 g/L琼脂作为固化剂。重复10瓶。光周期条件实验:25℃下每天光照20 h,光照强度分别为55、65、75和85 μmol/(m2·s)。接种后培养30 d时测定叶片花青素等物质含量。
1.2.3 茎芽生根培养方法
将经过增壮培养的茎芽(微枝)进行试管外生根培养。在生根基质(草炭土、蛭石和珍珠岩以5∶2∶3体积比混合)中培养30 d,培养条件为30℃下每天光照20 h,光照强度75 μmol/(m2·s)。然后分别转移到光照强度为28 μmol/(m2·s)和110 μmol/(m2·s)的条件下培养30 d。取各处理的再生植株顶部第1~3片叶进行测量花青素等物质含量。
1.2.4 花青素等物质含量的测定
花青素含量测定参考王庆菊等(2008)的方法[4]:称取0.2 g叶片,将叶片剪切成0.2 cm×0.2 cm大小的方块,用1.5 mmol/L HCl / 95%乙醇=15/85(v/v)的混合溶液在黑暗中浸提24 h以提取叶片中的花青素,然后在OD535 nm下检测吸光值。花青素含量以单位体积单位质量下的吸光值(U/(g·mL))表示;类黄酮含量和总酚含量的测定:提取方法同花青素提取方法一样,分别在OD325 nm和OD280 nm下检测吸光值[5],以单位体积单位质量下的吸光值(U/(g·mL))表示类黄酮含量或总酚含量;叶绿素含量和类胡萝卜素含量采用丙酮法测定[5]。全部测定均重复3次。
1.2.5 数据处理与统计分析
表格和图中数据均为各处理的“平均数±标准差”。采用的数据用于方差分析,平均数在P=0.05或P=0.01水平上进行了邓肯多重比较。
2 结果与分析
2.1 茎芽增殖阶段的花
2.1.1 培养基种类对花青素等含量的影响
培养基种类对叶片花青素含量的影响及多重比较如图1所示。方差分析结果表明,各种培养基对花青素含量的影响差异极显著(P<0.01)。各种培养基中,WPM培养基的花青素含量最高,达到1.28 U/(g·mL),与MS、1/2MS培养基差异极显著(P<0.01)。MS与1/2 MS的差异也达到了显著水平(P<0.05),其花青素含量分别为0.27 U/(g·mL)(MS)和0.24 U/(g·mL)(1/2MS)。因此,相对于MS和1/2MS,WPM培养基有利于紫叶白桦茎芽增殖培养中叶片花青素的合成。
不同培养基上,叶片中花青素与叶绿素、类黄酮、类胡萝卜素和总酚等物质含量的比例关系如图2所示。3种培养基中,WPM上的花青素比例最高(5.70%),叶片表现为紫红色;其次是MS(1.45%),叶片为深绿色,边缘紫红色;最后是1/2MS(1.06%),叶片为深绿色。随着花青素比例增加,叶片中叶绿素(叶绿素a和b)的比例减小,类黄酮比例增加,类胡萝卜素比例减小,总酚含量变化不明显。
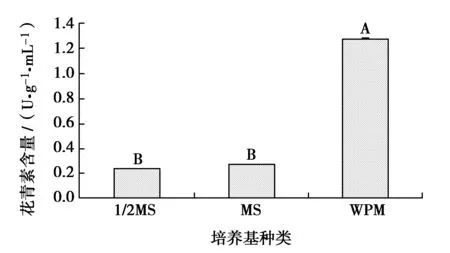
图1 培养基种类对叶片花青素含量影响Fig.1 Effects of culture medium types on content of anthocyaninin Royal Frost Betula leaves
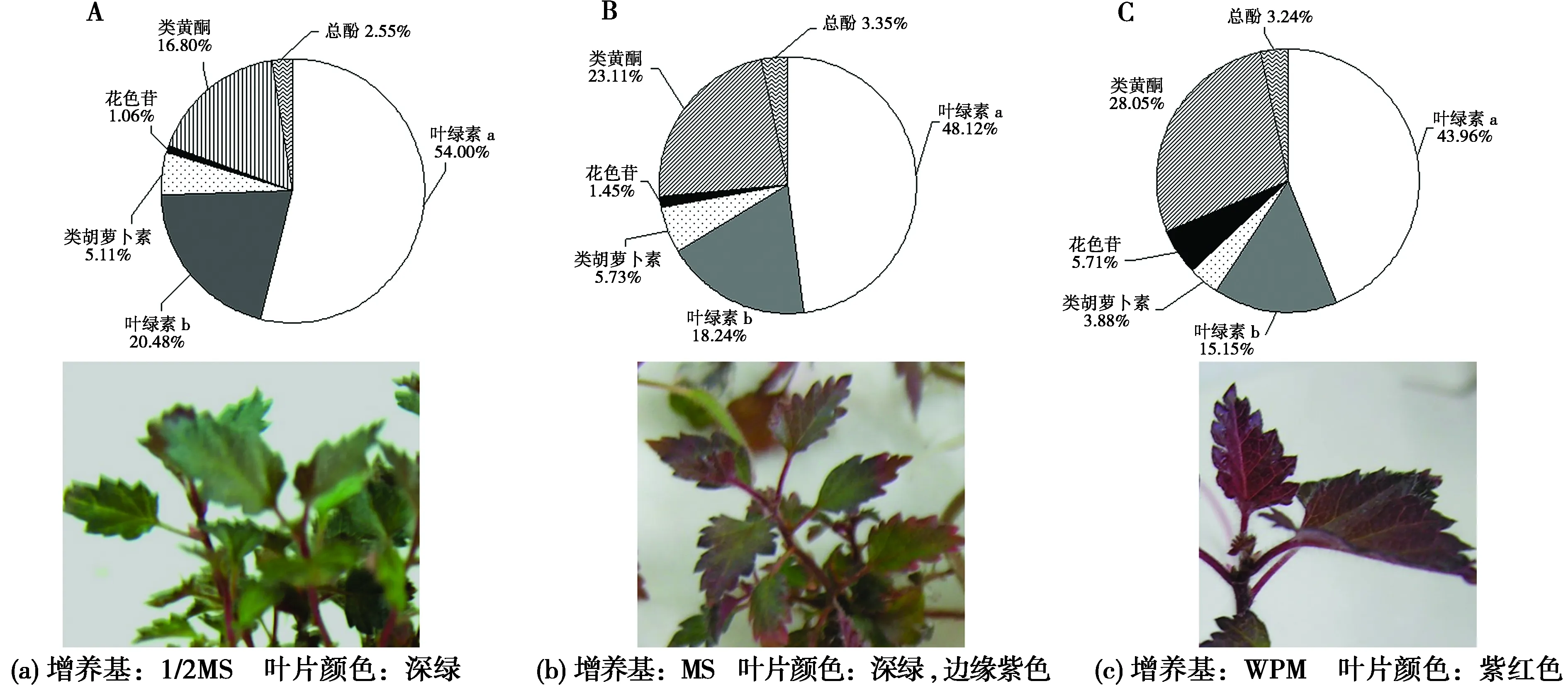
图2 不同培养基上紫叶白桦叶片颜色变化和色素组成的影响Fig.2 Effects of different culture mediums on color change and pigment composition of Royal Frost Betula leavesA:叶片深绿色 B:叶片边缘紫红色 C:叶片紫红色
2.1.2 生长调节剂组合对花青素等含量的影响
培养基中生长调节剂组合对叶片花青素含量的影响及多重比较如图3所示。方差分析结果表明,各种生长调节剂组合对花青素含量的影响差异极显著(P﹤0.01)。各种组合中,无生长调节剂的处理中花青素含量最高,达到2.45 U/(g·mL),与其他处理差异极显著(P﹤0.01)。随后是只添加0.2 μM BA、0.05 μM NAA、0.1 μM NAA的处理的花青素含量分别居于第2位、第3位和第4位。当培养基中NAA浓度一定时,随着BA浓度的增加,花青素含量下降;当培养基中BA浓度一定时,随着NAA浓度的增加,花青素含量下降;花青素含量最低的处理是0.1 μM NAA+0.8 μM BA(0.96 U/(g·mL))。说明增殖培养中培养基中添加生长调节剂不利于茎芽花青素的合成,随着生长调节剂浓度的增加,对花青素合成的抑制作用增强,并且这种抑制作用没有生长调节剂种类的差异。
生长调节剂处理对叶片中花青素与叶绿素、类黄酮、类胡萝卜素和总酚等物质含量比例关系的影响(图4)。如图3和4所示,无生长调节剂处理的叶片花青素含量虽然最高,其花青素比例占3.57%,但叶片表现为深绿色(边缘紫红色);0.1 μM NAA+0.8 μM BA处理的叶片花青素含量虽然最低,但其花青素比例占5.57%,叶片表现为紫红色。随着叶片中花青素比例增加,类黄酮比例增加,总酚比例略有增加,叶绿素(叶绿素a和b)比例减小,类胡萝卜素比例略有减小。说明影响叶片颜色变化的不是叶片中花青素的含量,而是其与叶绿素等色素含量的比例。

图3 不同PGR组合对叶片花青素含量的影响Fig.3 Effects of different combinations of plant growth regulatorson the contents of anthocyanin in Royal Frost Betula leaves

图4 植物生长调节剂对紫叶白桦叶片颜色变化和色素组成的影响Fig.4 Effects of different combinations of plant growth regulators on color change and pigment composition of Royal Frost Betula leaves
2.1.3 蔗糖浓度对花青素等含量的影响
蔗糖浓度对叶片花青素含量的影响及多重比较结果如图5所示。方差分析结果表明,各种蔗糖浓度对花青素含量的影响差异极显著(P﹤0.01)。各种蔗糖浓度中,20 g/L蔗糖处理的花青素含量最高,达到1.28 U/(g·mL),与其他处理相比差异极显著(P﹤0.01)。其他浓度的花青素含量分别为1.09 U/(g·mL)(15 g/L)、0.64 U/(g·mL)(25 g/L)、0.34 U/(g·mL)(30 g/L)。因此,培养基中添加20 g/L蔗糖有利于增殖培养中叶片花青素的合成。其次是15、25 g/L,最低的是30 g/L蔗糖的处理。即较低浓度的蔗糖有利于花青素合成和积累。
不同蔗糖浓度对叶片中花青素与叶绿素、类黄酮、类胡萝卜素和总酚等物质含量比例关系的影响如图6所示。不同浓度蔗糖处理中,20 g/L蔗糖处理的花青素比例最高(5.65%,叶片紫红色),15和25 g/L的处理居中(5.54%和 5.58%,叶片紫红色),最低的是30 g/L蔗糖处理(1.47%,叶片深绿色)。当蔗糖浓度大于20 g/L时,随着蔗糖浓度增加,花青素比例减小,类黄酮比例减小,总酚比例减小,类胡萝卜素和叶绿素(a和b)比例增加。
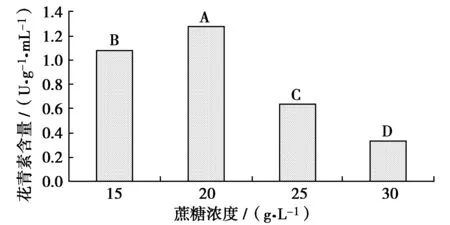
图5 蔗糖浓度对叶片中花青素含量的影响Fig.5 Effects of sucrose concentration on content of anthocyanin in l Royal Frost Betula leaves

图6 蔗糖浓度对紫叶白桦叶片色素组成的影响Fig.6 Effects of sucrose concentrations on color change and pigment composition of Royal Frost Betula leaves
2.1.4 培养基酸碱度对花青素等含量的影响
培养基酸碱度对叶片花青素含量的影响和多重比较结果如图7所示。方差分析结果表明,不同处理中,除pH5.0对花青素含量的影响差异显著(P﹤0.05)外,其余酸碱度对花青素含量的影响差异极显著(P﹤0.01)。各种处理中,pH6.2的处理中花青素含量最高,达到1.35 U/(g·mL),与其他处理差异极显著(P﹤0.01)。随后是pH5.8、pH5.4和pH5.0处理的花青素含量分别居于第2、3和4位,最后是pH6.6处理的花青素含量最低。
不同培养基pH值对叶片中花青素与叶绿素、类黄酮、类胡萝卜素和总酚等物质含量比例关系的影响如图8所示。不同培养基pH值处理中,pH5.4处理的花青素比例最高(8.35%,叶片紫红色),其次是pH6.2的处理(7.54%,叶片紫红色),然后是pH5.0(7.38%,叶片紫红色)和pH5.8(5.65%,叶片紫红色),最低的是pH6.6处理(1.35%,叶片深绿色)。随着花青素比例减小,叶绿素比例增加,类黄酮和总酚比例减小,类胡萝卜素比例变化不大。说明微酸性环境有利于茎芽增殖培养中叶片花青素的合成,碱度过大不利于花青素合成。
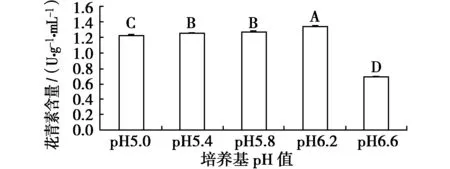
图7 培养基酸碱度对叶片花青素含量的影响Fig.7 Effects of PH values on contents of anthocyanin in leaves of Royal Frost Betula
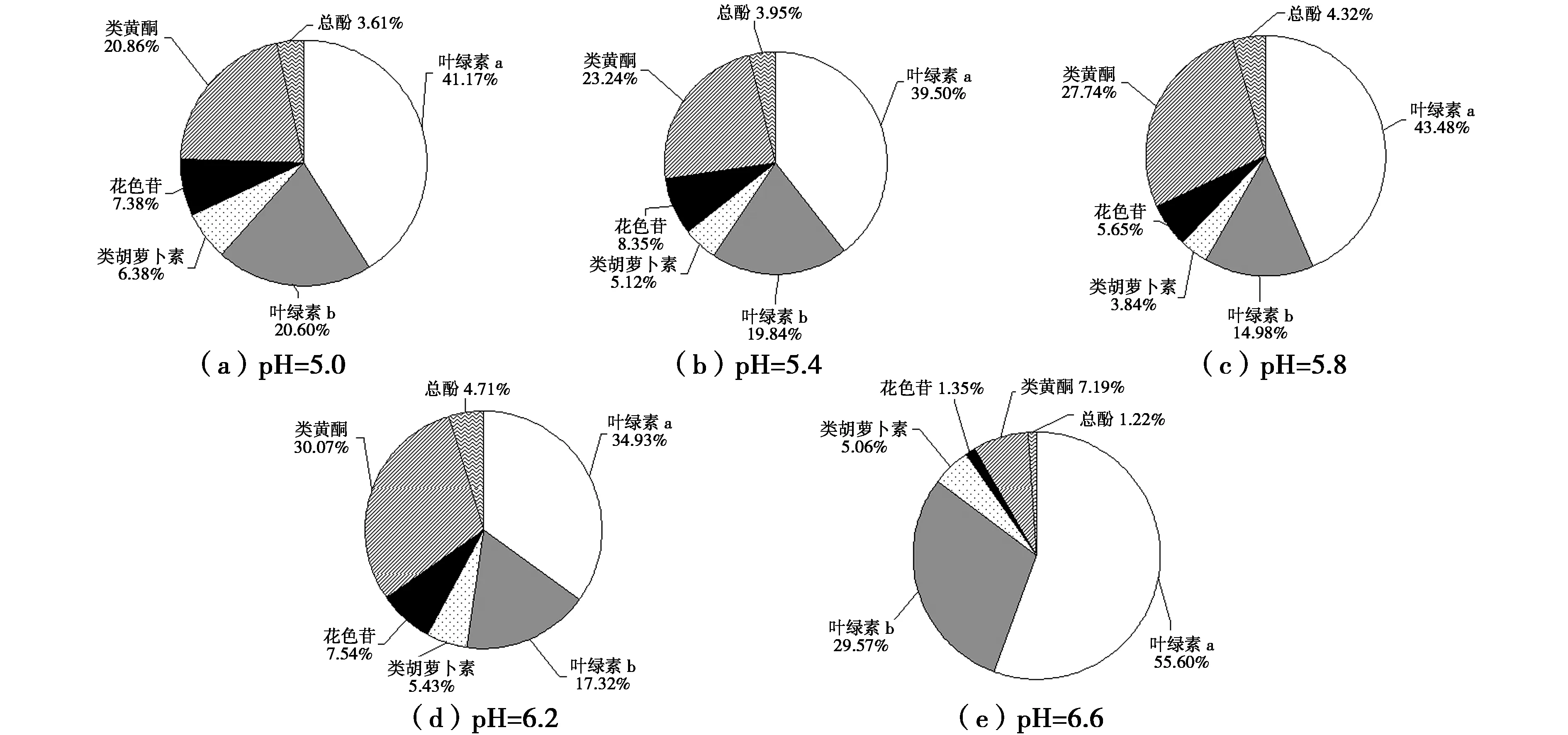
图8 培养基pH值对紫叶白桦叶片色素组成的影响Fig.8 Effects of pH values on color change and pigment composition of Royal Frost Betula leaves
2.1.5 温度和光周期对花青素等含量的影响
不同培养温度和光周期组合对叶片花青素含量的影响和多重比较结果如图9所示。方差分析结果表明,3种培养条件对花青素含量的影响差异极显著(P﹤0.01)。各种组合中,25℃、光照20 h处理的花青素含量最高,达到1.28 U/(g·mL),与其他处理差异极显著(P﹤0.01)。相同温度(30℃)下,光照16 h处理的花青素含量比光照20 h处理的含量高,而在相同光照时间(20 h)下,25℃比30℃处理的花青素含量高。
不同温度和光周期对叶片中花青素与叶绿素、类黄酮、类胡萝卜素和总酚等物质含量比例关系的影响如图10所示。不同处理中,25℃、光照20 h处理的花青素比例最高(5.65%,叶片紫红色),其次是30℃、光照20 h处理(3.47%,叶片紫红色),
然后是30℃、光照16 h处理(2.08%,叶片紫红色)。随着花青素比例减小,类黄酮和总酚含量减小,叶绿素比例增加,类胡萝卜素比例增加。因此认为降低培养温度会促进花青素的积累,延长光照时间可以促进叶片中花青素比例增加。

图9 培养温度和光周期对叶片花青素含量的影响Fig.9 Effects of culture temperature and photoperiod on the contents of anthocyanin in leaves of Royal Frost Betula
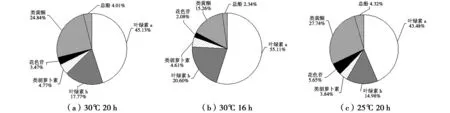
图10 温度和光周期对紫叶白桦叶片色素组成的影响Fig.10 Effects of temperature and photoperiod on color change and pigment composition of Royal Frost Betula leaves
2.2 茎芽增壮阶段的花青素等物质含量
光照强度对微枝叶片花青素含量的影响和多重比较结果如图11所示。方差分析结果表明,4种光照条件对叶片中花青素含量的影响达到极显著水平(P﹤0.01)。高强度的光照可以增加叶片中的花青素含量。各处理中,85 μmol/(m2·s)处理的微枝叶片中花青素含量最高(1.39 U/(g·mL));其次是75 μmol/(m2·s)处理的(1.33 U/(g·mL))。
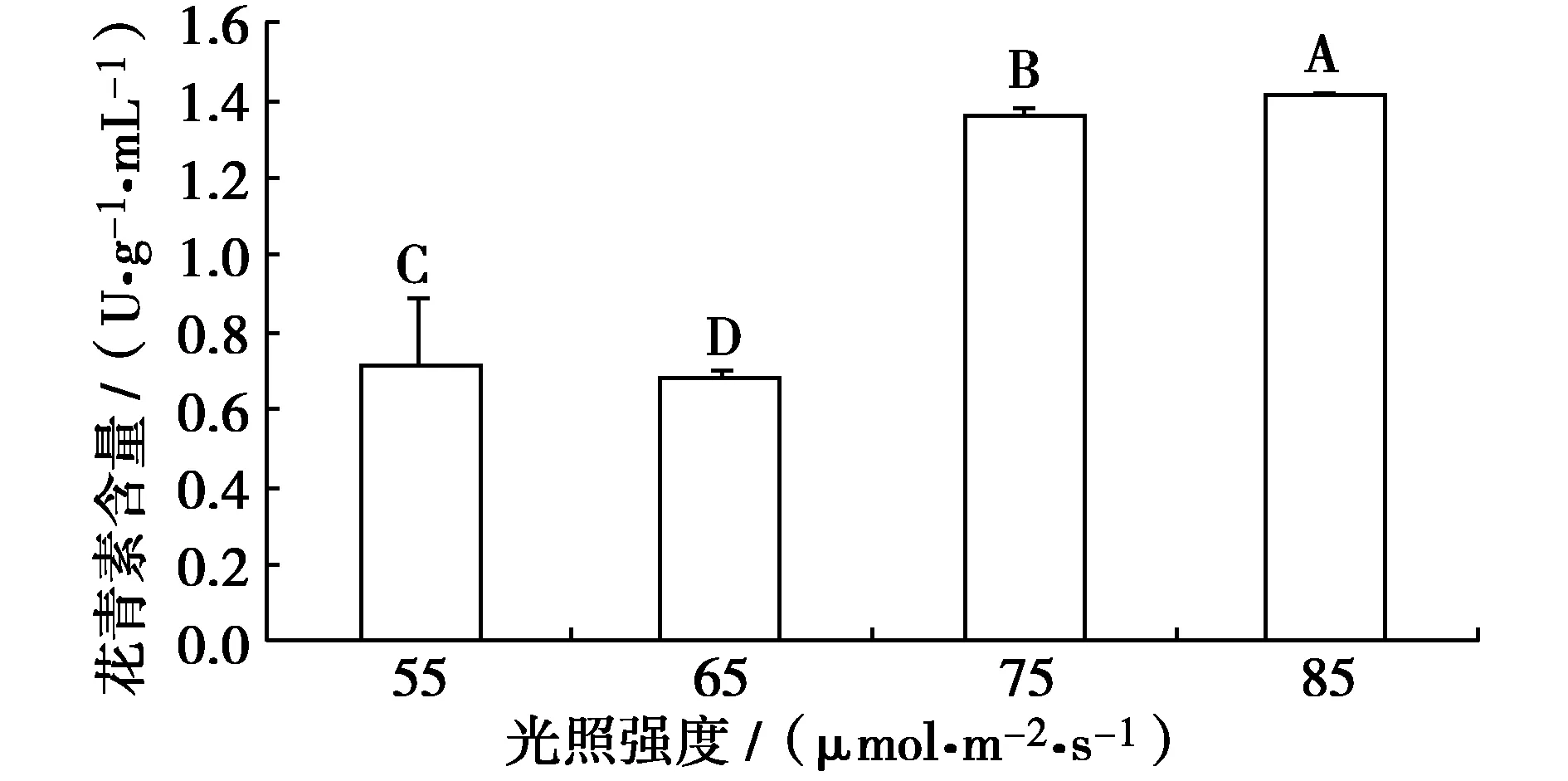
图11 光照强度对微枝花青素含量的影响Fig.11 Effects of illumination intensity on content of anthocyanin in microscopes of Royal Frost Betula
不同光照强度对叶片中花青素与叶绿素、类黄酮、类胡萝卜素和总酚等物质含量比例关系的影响如图12所示。不同处理中,75 μmol/m2·s处理的花青素比例最高(3.07%,叶片紫红色),其次是85 μmol/(m2·s)处理(2.99%,叶片紫红色),其余两种光照强度下叶片为深绿色。光照强度在55 μmol/(m2·s)增加到75 μmol/(m2·s)的范围内,随着花青素比例增加,叶绿素a比例增加。当光照强度超过75 μmol/(m2·s)时,叶绿素a比例大幅减小,叶绿素b比例大幅增加。当光照强度为75 μmol/(m2·s)时,虽然花青素比例最大,但微枝高度最小,地径最细。这表明,较强的光照强度虽然可以提高叶片中花青素含量、增加微枝的观赏性,但同时微枝的生长速度减慢,生物量积累下降。

图12 光照强度对紫叶白桦叶片色素组成的影响Fig.12 Effects of illumination intensity on color change and pigment composition of Royal Frost Betula leaves
2.3 光照强度对再生植株花青素等含量的影响
光照强度对生根后再生植株叶片中花青素含量的影响和多重比较结果如图13所示。方差分析结果表明,2种光照条件对叶片中花青素含量的影响均达到极显著水平(P﹤0.01)。2种处理中,110 μmol/(m2·s)处理的叶片花青素含量最高,达到1.65 U/(g·mL),与28 μmol/(m2·s)处理的叶片花青素含量(0.39 U/(g·mL))差异极显著(P﹤0.01)。
不同光照强度对叶片中花青素与叶绿素、类黄酮、类胡萝卜素和总酚等物质含量比例关系的影响如图14所示。2种处理中,110 μmol/(m2·s)处理的叶片中花青素含量所占比例最高(4.54%,叶片紫红色),而28 μmol/(m2·s)处理的非常低(0.88%,叶片绿色)。低光照强度下,花青素比例减小,类黄酮和总酚含量减小,叶绿素比例增加,类胡萝卜素比例增加。因此认为强光照可以促进花青素的积累,但降低了叶绿素的含量和比例,强光下紫叶白桦叶片可以保持紫红色的特征,但由于叶绿素含量较少,使得植株光合作用减弱,植株高生长受到抑制。反之,低光照强度虽然减少了花青素的合成,但叶绿素含量增加,因此植株光合作用较强,植株生长较快,高生长旺盛。

图13 光照强度对再生植株叶片花青素含量的影响Fig.13 Effects of illumination intensity on contents of anthocyanin of regeneration plant leaves of Royal Frost Betula

图14 光照强度对对紫叶白桦叶片再生植株色素组成的影响Fig.14 Effects of illumination intensity on color change and pigment composition in regeneration plant leaves of Royal Frost Betula
综上所述,在紫叶白桦试管苗增殖培养过程中,低盐浓度的WPM培养基有利于叶片花青素合成。培养基中添加激素不利于花青素合成,随着激素浓度增加,抑制花青素合成作用增强,且这种抑制作用没有激素种类的差异。培养基中缺乏蔗糖,会削减花青素积累,但当蔗糖浓度高过临界点时,蔗糖浓度会限制花青素积累。较低pH和温度有利于花青素积累。延长光照时间有利于花青素积累。在紫叶白桦试管苗的增壮培养过程中,较高强度光照可增加叶片中花青素含量。强光照可促进生根后再生植株叶片中花青素积累,但降低了叶绿素含量和比例。因此,虽然强光下紫叶白桦叶片可以保持紫红色的特征,但由于叶绿素含量较少,植株高生长受到抑制。
3 讨论
3.1 培养基种类对花青素含量影响
花青素主要在植物液泡中积累,是构成植物花和果实颜色的主要色素之一[6]。培养基种类对于花青素的积累起着十分重要的作用[7]。本研究表明,与MS和1/2MS相比较,WPM培养基更有利于紫叶白桦茎芽增殖培养中叶片花青素的合成。在4种离子中,Cu2+和Zn2+对其稳定性影响较大,Na+和Ca2+的影响较小[8]。所以,在不同种类培养基所含Cu2+和Zn2+相同的情况下,可能是微量元素对花青素的积累形成起到大的促进作用,但仍需进一步研究证实。
3.2 植物生长调节物质对花青素含量影响
激素不仅直接影响细胞分裂的速度,还参与细胞内的多种生理生化反应,因此植物激素也是影响植物细胞培养生产花青素的重要因素[9]。植物细胞培养最常用的生长素有:2,4-D、IAA、NAA等,不同的植物细胞对生长素的种类与含量要求不同。大量研究发现,低浓度的生长素促进花青素的合成,而高浓度则抑制其合成[10]。Zhou等[11]在烟草愈伤组织中研究发现,0.02 mg/L的2,4-D或NAA产生的花青素最多,而0.2 mg/L的2,4-D或2 mg/L的NAA则使花青素的含量降低一半,表明高浓度的2,4-D或NAA可以抑制花青素的合成。这与本研究结果相一致,培养基中不添加2,4-D和NAA产生的花青素含量最高,增殖培养基中添加任何种类生长调节剂都抑制茎芽花青素的合成。另外有研究发现,植物激素调节花青素的生物合成是通过影响花青素合成过程中的酶活性来调节的[12]。通过外源2,4-D或NAA处理葡萄果实,抑制花青素生物合成所有结构基因的表达[13]。Ji等[14]通过高通量测序技术揭示了高浓度2,4-D或NAA抑制花青素合成结构基因和调节基因的表达。
3.3 蔗糖浓度对花青素含量影响
有机物中对花青素积累影响较大的是碳源[15]。蔗糖作为产生花青素最好的碳源之一,通过多途径影响植物花青素的合成。首先,蔗糖作为能源物质保证植物生长和花青素的生物合成;其次,蔗糖是花青素的合成前体,参与花色素合成相关结构基因表达的调控;第三,蔗糖作为转导过程中的初级信使因子,参与植物生长周期各个阶段的活动[16]。但若碳源含量过高,会使植物细胞出现过早死亡的现象,不利于花青素的产生和积累,故需要根据细胞的不同来选择不同种类和浓度较为适宜的碳源[12]。喜树(Camptotheca acuminata)细胞可以通过较高的蔗糖含量来促进花青素的产生,当蔗糖浓度为292 mmol/L时产生花青素含量最高[17]。拟南芥(Arabidopsis thaliana)的生长发育和叶片着色需要蔗糖[18-19]。Moalem等[20]的研究表明,GA3对牵牛花冠(Petunia Corollas)细胞花青素积累及其相关基因表达的诱导依赖于糖。本研究结果表明,培养基中缺乏蔗糖,会削减紫叶白桦花青素的积累,但当蔗糖浓度高过某一临界点时,蔗糖浓度会限制花青素的积累。
3.4 培养基酸碱度对花青素含量影响
花青素类色素也受pH值的影响[12]。在紫色大白菜[Brassica campestris L.ssp.pekinensis(Lour)Olsson]花青素稳定性的研究中发现[21],pH值对其稳定性影响明显,pH值为3时紫色大白菜花青素的保存率随时间延长基本保持不变;而pH值为5~7时,随处理时间延长有所降低,pH值为9时花青素的保存率却随着时间的延长有先降低后升高现象。这与本研究结果相似,微酸性培养基更有利于茎芽增殖培养中叶片花青素的合成,碱度过大不利于花青素合成。
3.5 培养温度对花青素含量影响
温度对花青素生物合成相关基因的表达起着至关重要的作用,低温会诱导花青素苷合成相关基因的表达,如可使PAL、CHS、CHI和DFR基因的转录水平升高几倍,会促进花青素的合成;高温抑制基因的表达,导致花青素合成减少和分解增加[22]。使花青素苷含量降低合适的温度可促使植物细胞生长,植物细胞最适生长温度一般在20~25℃[9]。对其他很多物种如玉米、拟南芥和矮牵牛等的研究中发现,低温则已证实可以诱导多种植物幼苗花青素积累[23]。本研究结果得出,相同光照时间(20 h)下,25℃比30℃处理的花青素含量高,达到1.28 U/(g·mL),说明低温度更有利于紫叶白桦花青素的积累。
3.6 光照对花青素含量的影响
在绿色组织(如叶片、花芽和茎等)以及组织培养的细胞中,光通过激活花青素苷代谢途径中相关基因的表达来促进花青素苷的积累[3]。但光对花青素的影响是两方面的,首先光是花青素生物合成的重要因子,与此同时光又会加速花青素的降解[24]。本研究中,光照强度对花青素含量的影响非常显著。110 μmol/(m2·s)处理的叶片花青素含量最高,达到1.65 U/(g·mL),是28 μmol/(m2·s)处理的4倍以上。这说明,较高的光照强度有利于紫叶白桦幼苗叶片保持紫红色特征,但由于花青素所占的比例较高,叶绿素合成受到抑制,所以表现为植株矮小,而低光照条件下,虽然花青素含量受到抑制,但叶绿素含量相对比较高,因此植株高生长旺盛,这种植株相对强光照条件下培养的具有紫红色叶片的植株生长较快,高度增加很多。分析原因是强光下培养的植株由于叶绿素含量较少,使得植株光合作用减弱,植株高生长受到抑制。而低光照强度虽然减少了花青素的合成,但叶绿素含量增加,因此植株光合作用较强,植株生长较快,高生长旺盛。这个研究结果提示我们,在紫叶白桦苗木培育过程中,为了加快苗木培育速度,可以先用较低强度的光照培养紫叶白桦苗木,获得高生长旺盛的苗木;当苗木高度达到理想的要求时,适当增加光照强度,促进苗木叶片中花青素的合成,从而达到缩短苗木培育周期,获得高质量的观赏性强的紫叶白桦苗木的目的。
3.7 色素比对叶片颜色的影响
高等植物叶片中的色素主要有三大类:一为叶绿素,其中包括叶绿素a和叶绿素b;二为类胡萝卜素,主要包括类胡萝卜和叶黄素;三为类黄酮,包括黄酮类 、黄酮醇类、黄烷酮类、花色素苷等。不同的色素在外观上表现出不同的颜色,叶绿素a表现为蓝绿色,叶绿素表现b为黄绿色,类胡萝卜素表现为橙黄色,叶黄素表现为黄色,类黄酮的颜色取决于B环上的代甲基团,当甲基取代时产生变红的效应,花色素苷与黄酮醇或贡酮结合,产生蓝色效应[25]。彩叶植物呈现彩色的直接原因是叶片中的色素种类和比例发生了变化[26]。其中花色素苷和类胡萝卜素含量变化是植物呈现彩色的根本因素,其含量变化受遗传因素和外界各种因素的影响[27]。本研究中发现,影响叶片颜色变化的不是叶片中花青素的含量,而与叶绿素等色素含量的比例有关。
[1]杨玲,沈海龙.紫叶白桦茎芽快繁体系的建立及影响因素分析[J].经济林研究,2012,30(1):81-87.
[2]邱尚志,巩志清,刘虹男,等.观赏性树种紫叶白桦扦插和嫁接成活影响因素[J].森林工程,2016,32(4):7-12.
[3]胡可,韩科厅,戴思兰.环境因子调控植物花青素苷合成及呈色的机理[J].植物学报,2010,45(3):307-317.
[4]王庆菊,李晓磊,王磊,等.紫叶稠李叶片花色苷及其合成相关酶动态[J].林业科学,2008,44(3):45-49.
[5]张宪政,陈凤玉,王荣富.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,1994:150-151.
[6]贾赵东,马佩勇,边小峰,等.植物花青素合成代谢途径及其分子调控[J].西北植物学报,2014,34(7):1496-1506.
[7]王惠珍,周景芳,刘笑芬,等.培养基组分对鸡冠花愈伤组织生长及花青素积累的影响[J].佛山科学技术学院学报(自然科学版),2004,22(2):64-66.
[8]刘会超,贾文庆,尤扬,等.红叶石楠叶片中花色苷提取及稳定性研究[J].广东农业科学,2010,37(2):119-121.
[9]郭成栓,欧阳蒲月,杜敏.培养条件对植物细胞培养生产花青素影响的研究进展[J].安徽农业科学,2010,38(12):6109-6111.
[10]赵杰堂.激素调控植物花青素合成分子机制的研究进展[J].分子植物育种,2016,14(7):1884-1891.
[11]Zhou H,Kui LW,Wang HL,et al.Molecular genetics of blood-fleshed peach reveals activation of anthocyanin biosynthesis by NAC transcription factors[J].Plant Journal,2015,82(1):105-121.
[12]丁悦,吴秋云,宋勇,等.植物体内花青素累积的外源调控机制研究进展[J].中国农学通报,2014,36(19):86-91.
[13]Jeong ST,Goto-Yamamoto N,Kobayashi S,et al.Effects of plant hormones and shading on the accumulation of anthocyanins and the expression of anthocyanin biosynthetic genes in grape berry skins[J].Plant Science,2004,167(2):247-252.
[14]Ji XH,Zhang R,Wang N,et al.Transcription profiling reveals auxin suppressed anthocyanin biosynthesis in red-fleshed apple callus (Malusseverelyf.niedzwetzkyana)[J],Plant Cell,Tissue and Organ Culture,2015,123(2):389-404.
[15]晋恺娜.观赏海棠叶片再生体系的建立及外界因素对叶片花色苷代谢的影响[D].北京:北京农学院,2012.
[16]杨瑞娟,龚一富,郭伦,等.蔗糖对紫色土豆微型薯形成及花青素含量的影响[J].生物学杂志,2015,32(2):53-57.
[17]Pasqua G,Monacelli B,Mulinacci N,et al.The effect of growth regulators and sucrose on anthocyanin production inCamptothecaacuminatecell cultures[J].Plant Physiology and Biochemistry,2005,43(3):293-298.
[18]Ohto M,Onai K,Furukawa Y,et al.Effects of sugar on vegetative development and floral transition in Arabidopsis[J].Plant Physiology,2001,127(1):252-261.
[19]杨少华,王丽,穆春,等.蔗糖调节拟南芥花青素的生物合成[J].中国生物化学与分子生物学报,2011,27(4):364-369.
[20]Moalem-Beno D,Tamari G,Leitner-Dagan Y,et al.Sugar-Dependent Gibberellin-Induced Chalcone Synthase Gene Expression inPetuniaCorollas[J].Plant Physiology,1997,113(2):419-424.
[21]林文超,王德森,刘维信.不同环境条件对紫色大白菜花青素稳定性的影响[J].山东农业科学,2012,44(1):51-53.
[22]黄鸿曼,袁利兵,彭志红,等.花青素的生物合成与环境调控研究进展[J].湖南农业科学,2011,(13):118-120.
[23]Zhang YQ,Zheng S,Liu ZJ,et al.Both HY5 and HYH are crucial regulators for low temperature-induced anthocyanin accumulation inArabidopsisseedlings[J].Journal of Plant Physiology,2011,168(4):367-374.
[24]孙建霞,张燕,胡小松,等.花色苷的结构稳定性与降解机制研究进展[J].中国农业科学,2009,42(3):996-1008.
[25]徐华金,张志毅,王莹.彩叶植物研究开发现状及展望[J].四川林业科技,2007,28(1):44-49.
[26]洪丽,王金刚,龚束芳.彩叶植物叶色变化及相关影响因子研究进展[J].东北农业大学学报,2010,41(6):152-156.
[27]吴慧,王爱波,潘一展.彩叶植物叶片色素含量影响因素研究进展[J].北方园艺,2016,(8):197-200.
Analysis of Factors Influencing on Anthocyanin Content in Leaves of Tissue Culture Plantlet of Royal FrostBetula
Yang Ling,Liu Hongnan,Zhang Dongyan,Shen Hailong*
(State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University Harbin 150040)
The Content of anthocyanin of plantlets leaves and the proportion of anthocyanin,chlorophyll,flavonoid,carotenoid and total phenol was measured in vitro rapid propagation by taking royal FrostBetulaas the experimental material.The effects of environmental factors on the color change of leaves and the content of anthocyanins were analyzed.The results showed that WPM proliferation medium was useful to the accumulation of anthocyanins.The synthesis of anthocyanin was inhibited with the increase of hormone concentration.There were no differences in hormone types during the inhibitory effect.Lacking sucrose in the medium reduced the accumulation of anthocyanins.The lower PH value and temperature had positive effects on the accumulation of anthocyanins.Prolonged illumination time can facilitate the accumulation of anthocyanins as well.Strong illumination can improve the contents of anthocyanin in microscopes of tissue culture and leaves of regeneration plant while the content and proportion of chlorophyll decreased.Contents of flavonoid and total phenol decreased with the anthocyanin decreasing.The proportion of chlorophyll and carotenoid increased with the decrease of anthocyanin.The results of this research provided the theory guidance and reference for cultivating quality ornamental nursery stock of Royal FrostBetula.
Royal FrostBetula;in vitro rapid propagation;anthocyanin;chlorophyll
2016-09-14
黑龙江省博士后科研启动金资助项目(LBH-Q14003)
杨玲,博士,副教授。研究方向:树木微繁和林木种苗培育原理与技术。
*通信作者:沈海龙,博士,教授。研究方向:林木种苗培育原理与技术。E-mail:shenhl-cf@nefu.edu.cn
杨玲,刘虹男,张冬严,等.紫叶白桦组培苗叶片花青素含量影响因素分析[J].森林工程,2017,33(2):33-40.
S 687
A
1001-005X(2017)02-0033-08

