POC/PLA生物医用材料的制备与性能研究
邹方东 孙晓霞 王新厚, 2
1. 东华大学纺织学院,上海201620;2. 东华大学纺织面料技术教育部重点实验室,上海201620
POC/PLA生物医用材料的制备与性能研究
邹方东1孙晓霞1王新厚1, 2
1. 东华大学纺织学院,上海201620;2. 东华大学纺织面料技术教育部重点实验室,上海201620
利用静电纺丝法在自制的静电纺丝装置上制备聚1, 8-辛二醇-柠檬酸酯(POC)/聚乳酸(PLA)生物医用材料,并对POC/PLA生物医用材料的表面形貌、红外光谱特征、亲水性能、体外降解性能及拉伸力学性能进行研究。结果发现:随着POC/PLA生物医用材料中POC质量分数的增加,纳米纤维的直径逐渐下降、亲水性逐渐增加、降解速率加快;且POC/PLA生物医用材料的拉伸力学性能发生了突破性的变化,其断裂强度、断裂伸长率和弹性模量都得到了显著改善。
POC,PLA,静电纺丝,生物医用材料,表面形貌,红外光谱,亲水性能,体外降解性能,拉伸力学性能
组织工程是应用细胞生物学和工程学原理,研究和开发具有修复和改善损伤组织功能的生物替代物的一门新兴科学。组织工程的出现和发展为组织缺损的修复和组织的再生提供了一种新的有效方法。组织细胞、支架和生长因子是组织工程的三大要素,其中支架材料在组织工程中发挥着核心作用[1]。
制备纳米纤维支架的方法有自组装法[2-3]、相分离法[4-5]及静电纺丝法[6-7]等。其中,静电纺丝法由于所纺纳米纤维具有高的比表面积和孔隙率,且可以模拟细胞外基质(ECM)的结构,为细胞的生长提供良好的环境,故而在生物医用材料的制备方面具有广阔的前景。此外,可通过设计不同的接收装置以满足不同的组织结构的需求。
聚乳酸(PLA)材料具有良好的生物相容性和可降解性,加之对人体无毒等优点,被广泛应用于生物医用材料的制备[8-11];同时,它还得到了美国食品和药物协会 (FDA)临床应用的认可。PLA的降解形式主要是通过亲水性酯键的裂解而实现的[12],降解产物最终以二氧化碳和水的形式从体内排出。然而,PLA材料弹性有限(不能承受大的弹性变形)、降解周期可控性差、亲水性差,这些都限制了其在生物医用材料领域的应用。
聚1,8-辛二醇-柠檬酸酯(POC)是一种新型的弹性材料,其具有合成单体无毒、供应丰富且价格便宜、合成条件相对温和、合成时不需要添加催化剂及交联剂、可以通过改变摩尔比及合成条件使POC弹性材料具备可控的部分力学性能及可调的降解周期、对多种细胞都具有固有的表面亲和性等优点,现已得到学者的广泛关注[13-14]。但POC弹性材料强力较难以控制,且不能单独用于静电纺丝制备纳米纤维。
因此,本课题首先利用1,8-辛二醇与柠檬酸合成了具有生物降解性能的POC,然后与PLA以一定的比例混合溶解于六氟异丙醇中,得到一定质量分数的溶液,最后利用静电纺丝法在自制的静电纺丝装置上制备POC/PLA生物医用材料,并对该生物医用材料的表面形貌、共混性能、亲水性能、体外降解性能及拉伸力学性能进行了表征。
1 试验材料及仪器
所用试验材料及仪器归纳于表1和表2。

表1 试验材料

表2 试验仪器
2 POC/PLA生物医用材料的制备
2.1 POC的合成
按摩尔比1∶1称取1,8-辛二醇与柠檬酸并投放到三颈圆底烧瓶中,在常压(101 kPa)、160~165 ℃条件下油浴磁力搅拌15 min,等待反应单体1,8-辛二醇与柠檬酸完全熔融;之后,温度降到140~145 ℃, 熔融反应40~60 min直至磁力搅拌困难(接近凝胶点),即得POC;随后,将POC溶解于无水乙醇中,并在去离子水中沉淀(溶解除去未反应的单体),其中无水乙醇和去离子水的体积比为1∶5;最后,对POC进行收集并真空冷冻干燥24 h,得到纯化的POC。
2.2 静电纺丝用POC/PLA溶液的制备
将POC与PLA分别以质量比10∶90、 25∶75、 40∶60充分混合并溶解于六氟异丙醇溶剂中,得到质量浓度为12 g/mL的POC/PLA溶液。制备质量浓度为12 g/mL的纯PLA纺丝液用于后续对比。
2.3 POC/PLA生物医用材料的制备
静电纺丝在自制的静电纺丝设备上进行。如图1所示,将上述配制好的POC/PLA溶液转移至10 mL 的注射器内,并在21G(即内径为0.51 mm) 的平口针头上加载15 kV的电压,负极接地;POC/PLA溶液以1 mL/h的纺丝速率挤出,并在平口针头处形成泰勒锥,挤出的纺丝液滴在静电场内受电场力牵伸形成纳米纤维,并接收于直径为50.00 mm的包覆铝箔的圆形滚筒上,其中平口针头到接收滚筒的距离为120.00 mm。将收集于滚筒上的纺丝膜连同铝箔一起揭下,置于真空烘箱中烘燥3 h,以去除纺丝膜内的残存溶剂,烘箱温度设置为30 ℃。所得纤维膜即为POC/PLA生物医用材料。
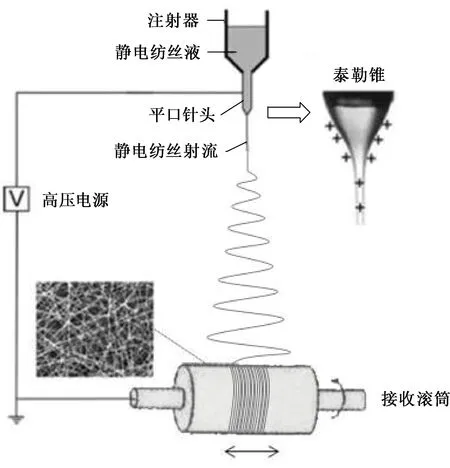
图1 静电纺丝示意
3 POC/PLA生物医用材料的表征
3.1 表观形貌
为评价POC/PLA生物医用材料的表观形态与纤维直径,分别取不同混合比例的POC/PLA生物医用材料样品表面喷金,然后采用JSM-5600LV型扫描电子显微镜观察它们的表面形态,得到样品的扫描电镜照片,再利用Image-Pro Plus软件在扫描电镜照片上随机选取50根纤维,计算出纤维直径的平均值和标准差。
3.2 红外光谱
为确定POC/PLA生物医用材料的成分组成及结构信息,采用NEXUS-670型红外光谱仪,通过衰减全反射法,在频率范围4 000~650 cm-1内经10次扫描进行测定,以表征 POC、PLA及其共混材料的红外光谱特征。
3.3 亲水性能
生物医用材料表面的亲水性能在一定程度上决定着细胞的黏附与增殖。为评价POC/PLA生物医用材料的亲水性能,采用OCA15EC型接触角测量仪,在室温条件下对POC/PLA生物医用材料的静态接触角进行测试,每个样品随机测试5个点,结果取平均值。
3.4 体外降解性能
3.4.1 失重率
为了解POC/PLA生物医用材料随时间在体外降解的失重情况,裁剪正方形试样(长、宽皆为30.00 mm, 厚度约为0.15 mm),将其浸泡在100 mL、 pH=7.4的PBS溶液中,于37 ℃条件下分别进行4、 8、 12、 16、 20、 24、28 d的体外降解,并计算出失重率:

式中:W0——试样的初始质量;
Wt——试样在PBS溶液中降解处理后的质量。
3.4.2 体外降解后扫描电镜测试
为更直观地观察POC/PLA生物医用材料经体外降解后的纤维形态,分别取不同混合比例的经体外降解后的POC/PLA生物医用材料样品表面喷金,采用JSM-5600LV型扫描电子显微镜观察其表面形态,得到样品的扫描电镜照片。
3.5 拉伸力学性能
为评价POC/PLA生物医用材料的拉伸力学性能,采用XQ-1C型高强高模纤维强力仪测定其断裂强度、断裂伸长率。将不同混合比例的POC/PLA生物医用材料裁剪成长方形试样(长×宽为50.00 mm× 3.00 mm,厚度约为0.15 mm),每组5个试样,拉伸速度为40 mm/min,得到POC/PLA生物医用材料的拉伸应力-应变曲线,计算出其弹性模量。
4 结果与讨论
4.1 表面形貌
不同混合比例的POC/PLA生物医用材料的SEM照片如图2所示:纯纺PLA纳米纤维的直径为(885±136) nm,POC/PLA(10/90)纳米纤维的直径为(768±120) nm,POC/PLA(25/75)纳米纤维的直径为(716±122) nm,POC/PLA(40/60)纳米纤维的直径为(592±98) nm。显然,随着混纺纳米纤维膜中POC质量分数的增加,纳米纤维的直径在逐渐减小。ZHANG等[15]将聚左旋乳酸(PLLA)与聚右旋乳酸(PDLA)进行共混电纺,得到的纳米纤维的直径为(529±104) nm,而纯纺PLLA纳米纤维的直径为(761±262) nm,说明混纺会使纳米纤维的直径减小。本课题得出的结论与其是一致的。

(a) 纯纺PLA

(b) POC/PLA(10/90)

(c) POC/PLA(25/75)

(d) POC/PLA(40/60)
4.2 红外光谱
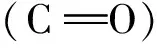
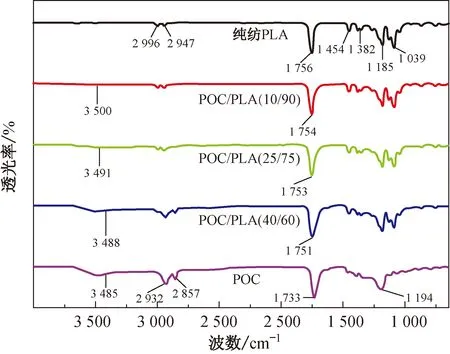
图3 不同混合比例POC/PLA生物医用材料及POC的红外光谱
由图3还可以明显看出:随着POC/PLA生物医用材料中POC质量分数的增大,氢键缔合羟基的伸缩振动峰波数逐渐减小,并靠近POC中氢键缔合羟基的伸缩振动峰的波数,但其强度则逐渐增大,这表明POC/PLA生物医用材料中增加了羟基,而羟基的含量将影响POC/PLA生物医用材料的亲水性能;而酯羰基的伸缩振动峰波数和强度并没有随POC质量分数的增大而发生比较明显的变化,因为PLA与POC都是酯聚合物。
4.3 亲水性能
材料的亲水性能通常用接触角来表征。当材料的接触角处在0.0~90.0°时,则说明该材料的亲水性能较好;当材料的接触角处在90.0°~180.0° 时,则认为该材料的亲水性能较差。表3归纳了不同混合比例POC/PLA生物医用材料的接触角测试结果。
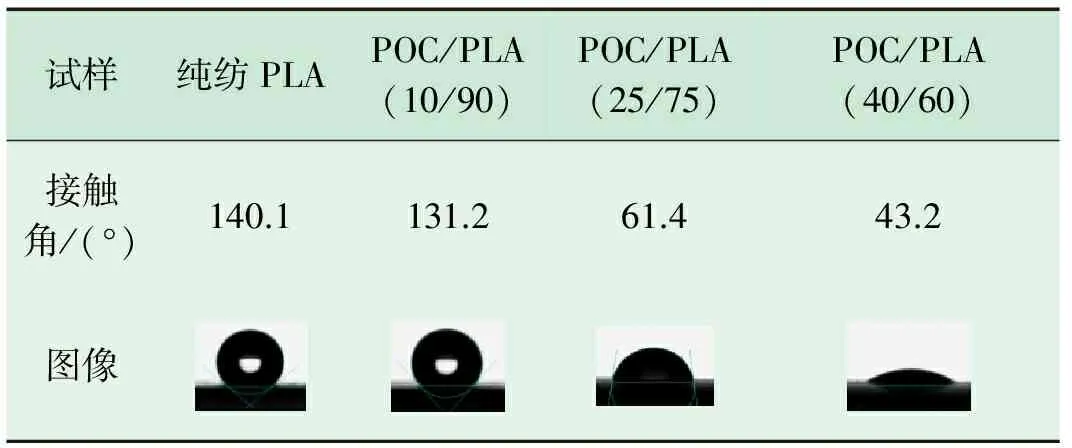
表3 不同混合比例POC/PLA生物医用材料的接触角
由表3可以看出:纯纺PLA的接触角为140.1°,显然其亲水性能较差;随着POC/PLA生物医用材料中POC质量分数增加至10%、 25%、 40%,接触角依次变为131.2°、 61.4°、 43.2°,由此可以推断POC/PLA生物医用材料的亲水性能随着POC质量分数的增加而得到了突破性的改善。
4.4 体外降解性能
4.4.1 失重率
不同混合比例的POC/PLA生物医用材料的失重率曲线如图4所示。
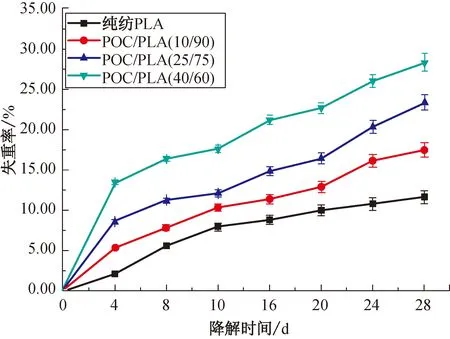
图4 不同混合比例POC/PLA静电纺丝生物医用材料的失重率曲线
由图4可以明显看出:在相同的降解时间内,随着POC质量分数的增加,POC/PLA生物医用材料的失重率明显增大。在37 ℃、 pH=7.4的PBS溶液中降解处理28 d后,纯纺PLA的失重率为11.62%;随着POC/PLA生物医用材料中POC的质量分数增加至10%、 25%、 40%,其失重率依次为17.50%、 23.42%、 28.34%。这是因为降解速率主要受材料的化学结构和亲水性能的影响,而失重率越大则降解速率越快。PLA与POC在PBS溶液中的主要降解方式为水解,且部分水解产物可在短时间内溶于水,因此,随着POC/PLA生物医用材料中POC的质量分数增加,其亲水性能逐渐增强,相同的时间内失重率加大,降解速率加快。
4.4.2 体外降解后扫描电镜
图5为不同混合比例的POC/PLA生物医用材料在PBS溶液中体外降解4 d后的扫描电镜照片,结合图4的失重率曲线可知:由于PLA的疏水性,PLA在PBS溶液中的降解非常缓慢;随着POC质量分数的增加,POC/PLA生物医用材料的亲水性能逐渐得到改善,因此其降解速率也逐渐加快,其中当POC的质量分数增加至40%时,其降解速率最快、降解效果最明显,图5(d)中箭头所指处即为交织点处的降解。

(a) 纯纺PLA

(b) POC/PLA(10/90)

(c) POC/PLA(25/75)

(d) POC/PLA(40/60)
4.5 拉伸力学性能
不同混合比例POC/PLA生物医用材料的应力-应变曲线如图6所示。从图6可得到POC/PLA生物医用材料的断裂强度、断裂伸长率和弹性模量,分别列于表4中。
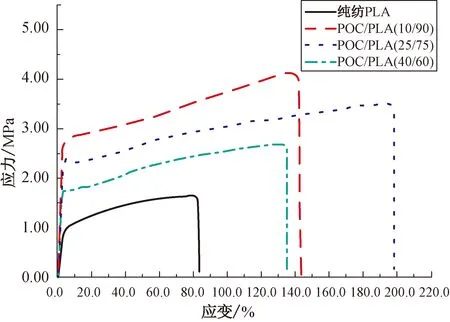
图6 不同混合比例POC/PLA生物医用材料的应力-应变曲线
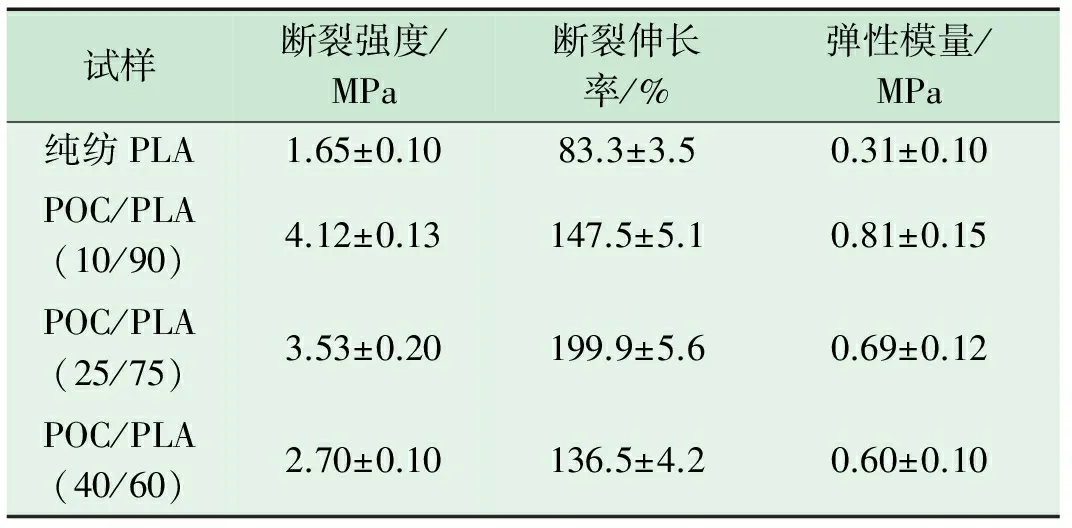
表4 不同混合比例POC/PLA生物医用材料的拉伸力学性能
从表4可以看出:未添加POC的纯纺PLA纳米纤维膜的断裂强度、断裂伸长率和弹性模量分别为(1.65±0.10)MPa、(83.3±3.5)%及(0.31±0.10)MPa。当POC的质量分数增加至10%时,POC/PLA生物医用材料的力学性能发生了突破性的变化,其断裂强度、断裂伸长率和弹性模量分别达到(4.12±0.13)MPa、(147.5±5.1)%和(0.81±0.15)MPa。这主要是因为在纯纺PLA纳米纤维膜中,纤维之间是彼此分离,没有黏结在一起的,故整体结构受力时纤维易产生滑移,纯纺PLA纳米纤维膜断裂强度、断裂伸长率及弹性模量相对而言比较小。当在PLA中加入POC混纺以后,由于POC具有良好的黏弹性,其会使彼此分离的纤维通过黏结点互相交叉黏结,从而使纳米纤维膜的力学性能发生突破性的变化,其断裂强度、断裂伸长率及弹性模量都得到显著增强。随着POC的质量分数继续增加,POC/PLA生物医用材料的断裂强度和弹性模量继续减小,断裂强度从(4.12±0.13)MPa减小到(2.70±0.10)MPa、弹性模量从(0.81±0.15)MPa减小到(0.60±0.10)MPa,但断裂伸长率先增大后减小,在POC质量分数为25%时达到最大值(199.9±5.6)%。这主要是因为在对POC/PLA生物医用材料进行拉伸力学性能试验时,在拉伸初始阶段,PLA纳米纤维主要承担着拉伸作用;随着拉伸的继续,无规排列的PLA纳米纤维被逐渐拉直、绷紧并达到拉伸的屈服点;待POC/PLA生物医用材料拉伸曲线过屈服点后,继续拉伸则PLA与POC将共同承担拉伸作用,直至POC/PLA生物医用材料被拉伸断裂。因此,随着POC质量分数的继续增加,POC/PLA生物医用材料的断裂强度和弹性模量逐渐减小。而由于POC具有良好的黏弹性,故POC/PLA生物医用材料的断裂伸长率逐渐增大,并在POC的质量分数为25%时达到最大值;当POC的质量分数持续增加至40%时,PLA的质量分数也相应减少至60%,但因整个POC/PLA生物医用材料的拉伸过程中PLA始终承担着主体作用,因此当PLA的质量分数降到一定程度即60%时,POC/PLA生物医用材料的断裂伸长率也相应降至(136.5±4.2)%,但仍高于纯纺PLA纳米纤维膜。
5 结论
(1) 利用1, 8-辛二醇与柠檬酸合成了具有生物降解性能的POC弹性材料,并与PLA以一定的质量比混合溶解于六氟异丙醇当中,得到一定质量分数的溶液,最后利用静电纺丝法在自制的静电纺丝装置上成功制备POC/PLA生物医用材料。
(2) 随着POC/PLA生物医用材料中POC质量分数的增加,静电纺纳米纤维的直径逐渐减小,亲水性逐渐增加,降解速率加快;且POC/PLA生物医用材料的力学性能发生了突破性的变化,其断裂强度、断裂伸长率和弹性模量都得到了显著改善。
[1] LANGER R, VACANTI J P. Tissue engineering[J]. Science, 1993, 260:920-926.
[2] ZHANG S. Fabrication of novel biomaterials through molecular self-assembly[J]. Nature Biotechnology, 2003, 21(10):1171-1178.
[3] WU Zhemin, LI Dongqiong. Self-assembly fabrication[M]// Encyclopedia of Microfluidics and Nanofluidics. NewYork:Springer,2015:1805-1806.
[4] FORMHALS A. Process and apparatus for preparing artificial threads: US1975504[P]. 1934-10-02.
[5] FORMHALS A. Method and apparatus for spinning:US2349950[P].1939-06-06.
[6] LO H, PONTICIELLO M S, LEONG K W. Fabrication of controlled release biodegradable foams by phase separation[J]. Tissue Engineering, 1995, 1(1):15-28.
[7] NAM Y S, PARK T G. Porous biodegradable polymeric scaffolds prepared by thermally induced phase separation[J]. Journal of Biomedical Materials Research, 1999, 47(1):8-17.
[8] ZHAO Minli,SUI Gang,DENG Xuliang,et al.PLLA/HA electrospin hybrid nanofiber scaffolds:Morphology,in vitro degradation and cell culture potential[J].Advanced Materials Research,2006(11-12):243-246.
[9] 顾书英, 任杰, 诸静. 聚乳酸的静电纺丝行为及其纤维结构研究[J]. 材料导报, 2005, 19(F11):383-385.
[10] RYUJI I,MASAYA K, SEERAM R.Structure and properties of electrospun PLLA single nanofibers[J].Nanotechnology,2005,16(2):208-213.
[11] CHEN J P,LEE S F,CHIANG I P. Plasma-treated and collagen-coated PLLA nanofiber membrane for cartilage tissue engineering[J].Nanotech,2005(1):100-103.
[12] LIN A S P, BARROWS T H, CARTMELL S H,et al. Microarchitectural and mechanical characterization of oriented porous polymer scaffolds[J]. Biomaterials,2003, 24(3): 481-489.
[13] YANG J, WEBB A, AMEER G. Novel citric acid-based biodegradable elastomers for tissue engineering[J]. Advanced Materials, 2004, 16(6):511-516.
[14] PRABHAKARAN M P, NAIR A S, DAN K, et al. Electrospun composite scaffolds containing poly(octanediol-co-citrate) for cardiac tissue engineering [J]. Biopolymers, 2012, 97(7):529-538.
[15] ZHANG X, KOTAKI M, OKUBAYASHI S, et al. Effect of electron beam irradiation on the structure and properties of electrospun PLLA and PLLA/PDLA blend nanofibers[J]. Acta Biomaterialia, 2010, 6(1): 123-129.
Study on the preparation and properties of POC/PLA biomedical materials
ZouFangdong1,SunXiaoxia2,WangXinhou1, 2
1. College of Textiles, Donghua University, Shanghai 201620, China; 2. Key Laboratory of Textile Science & Technology, Ministry of Education, Donghua University, Shanghai 201620, China
Poly (1, 8-octanediol-co-citric acid) (POC)/ polylactic acid (PLA) biomedical materials were prepared by the electrospinning method on self-made devices, and their surface appearance, infrared spectra characteristics, hydrophilicity, in-vitro degradation and tensile mechanical properties were studied. The results showed that, with the addition of the mass fraction of POC, nanofibers’ diameter gradually reduced, hydrophilicity gradually increased and degradation rate accelerated; and the tensile mechanical properties of POC/PLA biomedical materials achieved a great breakthrough, and their breaking strength, breaking elongation and elastic modulus were improved significantly.
POC, PLA, electrospinning, biomedical material, surface appearance, infrared spectra characteristic, hydrophilicity, in vitro degradation, tensile mechanical property
2016-10-10
邹方东,男,1991年生,在读硕士研究生,主要研究方向为纺织工程
王新厚,E-mail:xhwang@dhu.edu.cn
TS176.+9
A
1004-7093(2017)03-0015-07

