三江源区退化高寒草地土壤酶活性研究
刘育红

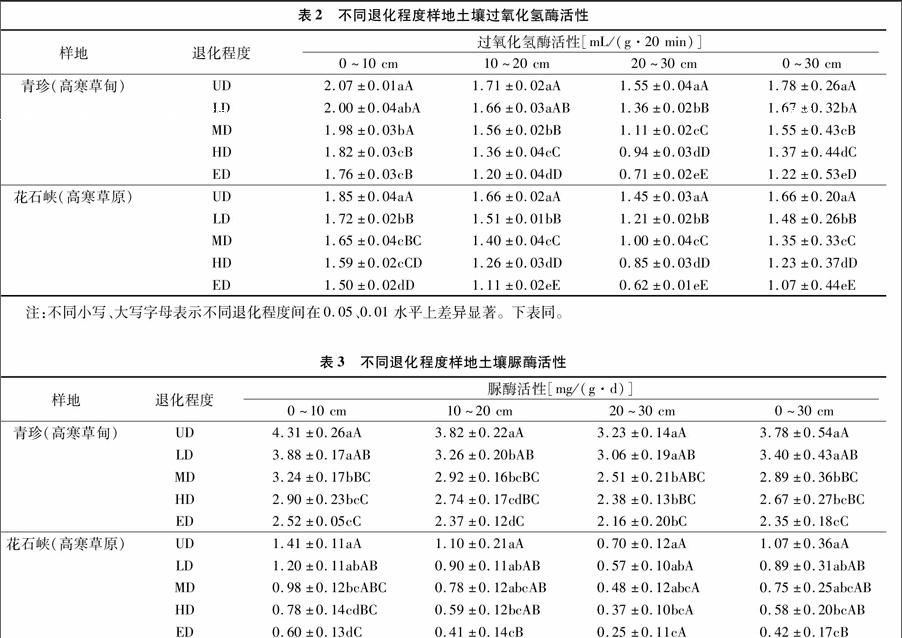

摘要:在青海省三江源区选择果洛州甘德县青珍乡高寒草甸和玛多县花石峡镇高寒草原典型样区,各划分5种不同退化程度样地(未退化、轻度退化、中度退化、重度退化、极度退化),分层采集0~10、10~20、20~30 cm不同深度土层样品,分析土壤过氧化氢酶、脲酶和蔗糖酶的活性。结果表明,研究区内高寒草地土壤表土过氧化氢酶、脲酶和蔗糖酶的活性均随退化程度的加剧和土层的加深呈明显下降趋势,表土(0~30 cm)过氧化氢酶和蔗糖酶的活性各退化程度间均差异显著(P<0.05)。与原生植被相比,轻度退化、中度退化、重度退化和极度退化下0~30 cm土层过氧化氢酶、脲酶和蔗糖酶的活性在青珍样地上平均降低6.18%、12.92%、23.03%、31.46%;10.05%、23.54%、29.37%、37.83%;8.28%、17.93%、24.14%、34.83%。在花石峡样地上分别降低10.84%、18.67%、25.90%、35.54%;16.82%、29.91%、45.79%、60.75%;8.64%、21.81%、28.40%、40.74%。表层土壤过氧化氢酶、脲酶和蔗糖酶的活性在生态系统退化下的变化剧烈,不同退化程度不同土层高寒草甸土壤过氧化氢酶、脲酶和蔗糖酶的活性均高于高寒草原土壤。研究退化高寒草地的土壤酶活性,对高寒草地生态系统养分循环及退化草地的恢复重建具有重要的意义。
关键词:青海省;三江源区;退化程度;高寒草地;土壤酶活性
中图分类号: S812.29文献标志码: A文章编号:1002-1302(2017)06-0243-04
土壤酶主要来源于动植物的分泌及其残体、微生物的分泌等[1],在土壤生态系统的物质循环和能量转化过程中起着重要作用,是生态系统的生物催化剂。土壤酶活性反映了土壤中各种生物化学过程的强度和方向,可以作为评价土壤肥力状况和反映土壤质量的生物活性指标[2-6]。其中,过氧化氢酶与土壤有机质的转化有密切关系,直接影响土壤氧化还原,参与生物呼吸过程的物质代谢,同时可以解除在呼吸过程中产生的对活细胞有害的过氧化氢,表示土壤氧化过程的强度[7];蔗糖酶的活性可以反映土壤中碳的转化与呼吸强度;土壤脲酶直接参与土壤中含氮有机化合物的转化,活性强度常用来表征土壤氮素转化和供应强度[8]。三江源区高寒草地在气候变化等自然因素和超载过牧等人为因素的共同扰动下,导致区域生态系统严重退化,对当地社会、经济的发展和资源的可持续利用以及生存环境构成严重威胁,并且退化一经出现,恢复与重建将是漫长的过程。本研究通过对三江源区高寒退化草地土壤酶活性的分析,了解在高寒草地退化过程中土壤质量的变化特征,以期为高寒草地的恢复重建提供依据。
研究样地位于青海省果洛州甘德县青珍乡和玛多县花石峡镇(以下称青珍样地和花石峡样地)。青珍样地海拔 4 025 m,位于100°12′18″E、34°08′54″N,高原大陆性半湿润气候[9],无四季,只有冷、暖季之分,年均气温-2 ℃,年均降水量520 mm,太阳辐射强,年日照时数2 313~2 607 h,牧草生长季150 d,无绝对无霜期;土壤类型为高寒草甸土[10],土层薄、质地差、易侵蚀,草地植物主要有高山嵩草(Kobresia pygmaea)、羊茅(Festuca ovina)、早熟禾(Poa annua)、苔草(Carex sp.)、高山紫菀(Aster alpinus)、高山唐松草(Thalictrum alpinum)、黄帚槖吾(Ligularia virgaurea)、短穗兔耳草(Lagotis brachystachya)、垫状棱子芹(Pleurospermum hedinii)、露蕊乌头(Aconitum gymnandrum)等。花石峡样地海拔3 876 m,位于99°07′55″E、35°19′27″N,高寒草原气候[9],1年之中无四季,只有冷、暖季之分,冬季漫长严寒、干燥多风,年均气温 -4.1 ℃,年均降水量304 mm,太阳辐射强,年日照时数 2 373~2 716 h,牧草生长季120 d,无绝对无霜期;土壤类型为高寒草原土[10],土层薄、易侵蚀,草地植物主要有紫花针茅(Stipa purpurea)、早熟禾、苔草、委陵菜(Potentilla chinensis)、火绒草(Leontopodium japonicum)、棘豆(Oxytropis sp.)等。
1材料与方法
1.1不同退化程度样地选择
于2015年7月进行土壤采样。按照文献[11]的方法对试验样地高寒草地植物群落及退化状况进行调查,结合地表及水土流失状况、鼠害危害程度等指标综合判断将试验样地划分为未退化(undegradation,简称UD)、轻度退化(light degradation,简称LD)、中度退化(moderate degradation,简称MD)、重度退化(heavy degradation简称HD)和极度退化(extreme degradation,简称ED)共5种退化程度(表1)。
1.2植物、土壤采样与样品分析
按“收割样方法”采集植物地上部分生物量[12]。在样地内按照不同退化程度分别随机设置10个1 m2的观测样方,测定植物群落,主要包括植被覆盖度、地上生物量等。土壤样品采用剖面法分层采集,自上而下用移除法分别采集0~10、10~20、20~30 cm等3个深度的土样,样品盛于塑料自封袋,运回实验室。除去植物残根和石砾等,自然风干后,土样过1 mm筛后,土壤过氧化氢酶采用高锰酸钾滴定法,土壤脲酶、蔗糖酶测定分别采用靛酚蓝比色法、3,5-二硝基水杨酸比色法[1]。采集土样的同时,分土层測定土壤含水量和土壤温度等。
1.3数据整理与统计分析
采用Excel、SPSS 19.0(Anove、Duncans)整理试验数据分析。
2结果与分析
2.1不同退化程度高寒草地土壤过氧化氢酶活性
由表2可见,高寒草甸5种退化程度下土壤各层过氧化氢酶活性均随退化程度的加剧呈下降趋势,即UD>LD>MD>HD>ED。0~10 cm土层UD、MD、HD间土壤过氧化氢酶活性均差异显著(P<0.05),HD与ED、UD与LD以及LD与MD间差异不显著(P>0.05),UD、LD、MD分别与HD、ED间差异极显著(P<0.01);10~20 cm土层UD和LD差异不显著(P>0.05),但分别与MD、HD和ED间差异显著(P<005),UD、MD、HD和ED相互间均差异极显著(P<0.01);20~30 cm土层各退化程度间均差异极显著(P<0.01);0~30 cm土层UD与LD间差异显著(P<0.05),但分别与MD、HD和ED间差异极显著(P<0.01)。与UD相比,LD、MD、HD、ED退化下0~30 cm土壤过氧化氢酶活性分别平均降低6.18%、12.92%、23.03%、31.46%。相应地,0~10 cm土层过氧化氢酶活性分别降低3.38%、4.35%、12.08%、1498%,10~20 cm土层分别降低 2.92%、8.77%、20.47%、29.82%,而20~30 cm土层分别降低12.26%、28.39%、3935%、54.19%。
高寒草原各层土壤中过氧化氢酶活性均随退化程度的加剧呈下降趋势,即UD>LD>MD>HD>ED。0~10 cm土层除了MD和HD间土壤过氧化氢酶活性差异不显著(P>005)外,其他各退化程度间土壤过氧化氢酶活性均差异显著(P<0.05),UD与其他各退化程度、LD与HD和ED、MD与ED间均差异极显著(P<0.01);10~20、20~30 cm土层各退化程度间均差异极显著(P<0.01);0~30 cm土层各退化程度间也均差异极显著(P<0.01)。与UD相比,LD、MD、HD、ED退化下0~30 cm土壤過氧化氢酶活性分别平均降低10.84%、18.67%、25.90%、35.54%。相应地,0~10 cm土层过氧化氢酶活性分别降低7.03%、10.81%、14.05%、1892%,10~20 cm土层分别降低 9.04%、15.66%、2410%、33.13%,而20~30 cm土层分别降低16.55%、3103%、41.38%、57.24%。
2.2不同退化程度高寒草地土壤脲酶活性
由表3可见,高寒草甸各层土壤中脲酶活性均随退化程度的加剧呈下降趋势,即UD>LD>MD>HD>ED。0~10 cm 土层UD与LD间土壤脲酶活性差异不显著(P>005),UD与MD、HD、ED间差异极显著(P<0.01),LD与HD和ED间差异极显著(P<0.01),MD与ED间差异显著(P<005);10~20 cm土层UD与LD、LD与HD以及MD与ED间差异显著(P<0.05),UD与MD、HD、ED以及LD与ED间差异极显著(P<0.01);20~30 cm 土层UD、LD分别与MD以及LD与HD间土壤脲酶活性差异显著(P<0.05),UD与HD、ED以及LD与ED间差异极显著(P<0.01);0~30 cm 土层LD分别与MD、HD以及MD与ED间差异显著(P<005),UD与MD、HD、ED以及LD与ED间差异极显著(P<0.01)。与UD相比,LD、MD、HD和ED退化下0~30 cm 土壤脲酶活性平均降低10.05%、23.54%、29.37%、37.83%。相应地,0~10 cm 土层过氧化氢酶活性分别降低9.98%、2483%、32.71%、41.53%,10~20 cm土层分别降低1466%、23.56%、28.27%、37.96%,而20~30 cm土层分别
降低 5.26%、22.29%、26.32%、33.13%。
高寒草原各层土壤中脲酶活性均随退化程度的加剧呈下降趋势,即UD>LD>MD>HD>ED。0~10 cm 土层UD与MD、HD、ED间土壤脲酶活性差异显著(P<0.05),LD与HD和ED、MD与ED间差异显著(P<0.05),UD与HD、ED,LD与ED间差异极显著(P<0.01);10~20 cm土层UD与HD,LD与ED间土壤脲酶活性差异显著(P<0.05),UD与ED间差异极显著(P<0.01);20~30 cm土层UD与HD、ED,LD与ED间土壤脲酶活性差异显著(P<0.05);0~30 cm土层UD与HD,LD与ED间土壤脲酶活性差异显著(P<0.05),UD与ED间差异极显著(P<0.01)。与UD相比,LD、MD、HD、ED退化下0~30 cm土壤脲酶活性平均降低16.82%、2991%、45.79%、60.75%。相应地,0~10 cm土层过氧化氢酶活性分别降低14.89%、30.50%、44.68%、57.45%,10~20 cm 土层分别降低18.18%、29.09%、46.36%、62.73%,而20~30 cm土层分别降低18.57%、31.43%、47.14%、64.29%。
2.3不同退化程度高寒草地土壤蔗糖酶活性
由表4可见,高寒草甸各层土壤中蔗糖酶活性均随退化程度的加剧呈下降趋势,即UD>LD>MD>HD>ED。0~10 cm 土层各退化程度间土壤蔗糖酶活性均差异极显著(P<0.01);10~20、20~30 cm土层除MD与HD蔗糖酶活性均差异显著(P<0.05)外,其他各退化程度间土壤蔗糖酶活性均差异极显著(P<0.01);0~30 cm土层各退化程度间土壤蔗糖酶活性均差异极显著(P<0.01)。与UD相比,LD、MD、HD、ED退化下0~30 cm土壤蔗糖酶活性平均降低 8.28%、17.93%、24.14%、34.83%。相应地,0~10 cm土层蔗糖酶活性分别降低5.67%、10.67%、20.33%、33.00%,10~20 cm土层分别降低8.93%、19.59%、23.02%、34.71%,而20~30 cm 土层分别降低10.39%、24.37%、28.67%、36.56%。
高寒草原各层土壤中蔗糖酶活性均随退化程度的加剧呈下降趋势,即UD>LD>MD>HD>ED。0~10、10~20、20~30、0~30 cm土层各退化程度间的差异显著性均与高寒草甸相同。与UD相比,LD、MD、HD和ED退化下0~30 cm土壤蔗糖酶活性平均降低8.64%、21.81%、28.40%、40.74%。相应地,0~10 cm土层蔗糖酶活性分别降低 6.37%、1195%、22.31%、35.46%,10~20 cm土层分别降低738%、23.36%、27.87%、41.80%,而20~30 cm土层分别降低11.54%、30.34%、35.47%、44.44%。
3结论与讨论
高寒草地在气候变化等自然因素和超载过牧等人为因素的共同扰动下,出现草地植物群落逆向演替和土壤退化现象,严重破坏了脆弱的高寒草地生态环境,并且退化一经出现,恢复与重建将是一个漫长的过程。土壤酶活性作为评价土壤肥力状况以及反映土壤质量的生物活性指标,随着高寒草地退化程度的加剧,土壤酶活性呈下降的变化趋势。在高寒草甸草地,土壤过氧化氢酶活性由未退化时的1.78 mL/(g·20 min)
降低到极度退化时的1.22 mL/(g·20 min),脲酶由 3.78 mg/(g·d)降低到2.35 mg/(g·d),蔗糖酶由2.90 mg/(g·d)降低1.89 mg/(g·d);在高寒草原草地,土壤过氧化氢酶活性由未退化时的1.66 mL/(g·20 min) 降低到极度退化时的1.07 mL/(g·20 min),脲酶活性由 1.07 mg/(g·d) 降低到0.42 mg/(g·d),蔗糖酶由 2.43 mg/(g·d) 降低到1.44 mg/(g·d)。
从高寒草地2种草地类型高寒草甸和高寒草原土壤酶活性的研究结果看,表土(0~30 cm)过氧化氢酶和蔗糖酶的活性各退化程度间均差异显著(P<0.05)。与原生植被相比,轻度退化、中度退化、重度退化和极度退化下0~30 cm土层过氧化氢酶、脲酶和蔗糖酶的活性在高寒草甸样地平均降低6.18%、12.92%、23.03%、31.46%,10.05%、23.54%、2937%、37.83%,8.28%、17.93%、24.14%、34.83%。在高寒草原样地分别降低10.84%、18.67%、25.90%、35.54%,16.82%、29.91%、45.79%、60.75%,8.64%、21.81%、2840%、40.74%。結合样地植被群落构成看,高寒草甸草地以莎草科嵩草属植物及杂类草为主,并且草地退化后,高寒草甸地上部生物学量较高寒草原高,加之嵩草属植物较禾本科植物根系相对发达,地下生物量较大,根际土壤酶活性相对较高,是引起高寒草甸土壤酶活性大于高寒草原的原因之一。另外,高寒草甸草地的含水量高于高寒草原草地,也是引起土壤酶活性高寒草甸大于高寒草原的原因。
高寒草地的退化对表层土壤的影响往往大于对较深土层的影响。研究发现,表层土壤过氧化氢酶、脲酶和蔗糖酶的活性在生态系统退化下的变化剧烈,并且呈0~10 cm>10~20 cm>20~30 cm趋势。这与侯彦会等的“土壤酶活性存在表层富集效应”的结论[13-15]一致。主要原因在于土壤表层累积了较多的枯枝落叶和腐殖质,有机质含量高,有充分的营养源,有利于土壤微生物的生长,再加之水热条件和通气状况,微生物生长旺盛,代谢活跃,呼吸强度加大而使表层积聚了较高的土壤酶活性。随着土层的加深,土壤有机质含量急剧下降,地下生物量减少,土壤熟化程度、肥力水平及土壤营养元素状况等趋向不利于微生物的活动与繁殖,导致土壤酶活性降低[16]。结果表明,不同土层高寒草甸土壤过氧化氢酶、脲酶和蔗糖酶的活性均高于高寒草原土壤。由于草地退化加剧了土壤退化,严重影响土壤酶活性。因此,深入研究土壤酶活性的变化规律,对人工调控与促进草地群落的正向演替,加快退化高寒草地的生态恢复与重建具有重要作用。
参考文献:
[1]关松荫. 土壤酶及其研究法[M]. 北京:中国农业出版社,1986.
[2]曹慧,孙辉,杨浩,等. 土壤酶活性及其对土壤质量的指示研究进展[J]. 应用与环境生物报,2003,9(1):105-109.
[3]万忠梅,吴景贵. 土壤酶活性影响因子研究进展[J]. 西北农林科技大学学报(自然科学版),2005,33(6):87-92.
[4]杜伟文,欧阳中万. 土壤酶研究进展[J]. 湖南林业科技,2005,32(5):76-82.
[5]Brookes P C,Landman A,Pruden G,et al. Chloroform fumigation and the release of soil nitrogen:arapid direct extraction method to measure microbial biomass in soil[J]. Soil Biology and Biochemistry,1985,17(6):837-842.
[6]Powlson D S,Prookes P C,Christensen B T. Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw incorporation[J]. Soil Biology and Biochemistry,1987,19(2):159-164.
[7]高秀君,张仁陟,杨招弟. 不同耕作方式对旱地土壤酶活性动态的影响[J]. 土壤通报,2008,39(5):1012-1016.
[8]周礼恺. 土壤酶学[M]. 北京:中国农业出版社,1987.
[9]黎与. 青海三江源“黑土滩”形成的自然、人为因素和生物学机制[J]. 草业与畜牧,2007(4):27-29.
[10]青海省农业资源区划办公室. 青海土壤[M]. 北京:中国农业出版社,1997.
[11]任继周. 草业科学研究方法[M]. 北京:中国农业出版社,1998.
[12]李凌浩,刘先华,陈佐忠. 内蒙古锡林河流域羊草草原生态系统碳素循环研究[J]. 植物学报,1998,40(10):955-961.
[13]侯彦会,周学辉,焦婷,等. 甘肃永昌县放牧草地土壤脲酶活性与土壤肥力的关系初探[J]. 草业学报,2009,18(4):111-116.
[14]贾伟,周怀平,解文艳,等. 长期秸秆还田秋施肥对褐土微生物碳、氮量和酶活性的影响[J]. 华北农学报,2008,23(2):138-142.
[15]高明,周保同,魏朝富,等. 不同耕作方式对稻田土壤动物、微生物及酶活性的影响研究[J]. 应用生态学报,2004,15(7):1177-1181.
[16]杜社妮,梁银丽,徐福利,等. 施肥对日光温室土壤微生物与酶活性变化的影响[J]. 中国生态农业学报,2007,15(4):68-71.叶维雁,吴海波,刘惠民,等. 2株番木瓜根际促生菌的解磷解钾作用[J]. 江苏农业科学,2017,45(6):247-251.
doi:10.15889/j.issn.1002-1302.2017.06.064

