试管捕捉实时荧光RT—PCR法同时检测烟草花叶病毒病和马铃薯Y病毒病
任锡毅+刘永翔+黄永会++刘作易


摘要:为建立一套简单、快速、有效的病毒病检测方法,避开病毒病检测中分子生物学方法检测时RNA提取这一复杂、费时、费力的过程,且能在同一个反应中同时检测多种病毒病,对我国常见的 2种烟草病毒的外壳蛋白基因部分序列设计引物和TaqMan探针,结合实时荧光逆转录PCR(RT-PCR)和试管捕捉RT-PCR法,对实时荧光RT-PCR法加以改进,与双抗夹心酶联免疫法(double antibody sandwich enzyme-linked immunosorbant assay,简称DAS-ELISA)和试管捕捉RT-PCR法进行比较,并在此基础上构建多重试管捕捉实时荧光RT-PCR检测体系。结果首次成功构建能同时检测烟草花叶病毒和马铃薯Y病毒的多重试管捕捉实时荧光RT-PCR检测体系。该技术无须提取RNA,包括叶片研磨、捕捉、反转录、荧光PCR 扩增等步骤,简单快捷、省时省力,具有高效性、系统性和经济简便性等特点。
关键词:烟草花叶病毒;马铃薯Y病毒;实时荧光RT-PCR;检测
中图分类号: S435.72文献标志码: A文章编号:1002-1302(2017)06-0096-05
烟草花叶病毒(tobacco mosaic virus,简称TMV)和马铃薯Y病毒(potato virus Y,简称PVY)是侵染烟草的主要病毒病害,在世界范围内分布广泛,严重影响烟草的产量和质量,造成重大的经济损失,对烟草生产造成很大威胁[1-2],尚无有效的防治药剂,烟叶生产中,多采用截断传播途径进行预防[3]。由于TMV多是通过农事操作等进行传播,而PVY多以带毒蚜虫刺吸烟株进行传播,要截断其传播途径,必须提前对2种病毒进行有效、快速和准确的诊断和预测预报[4]。目前在对植物病毒进行检测中,主要方法有生物学测定法、血清学检测法、电子显微镜检测法、分子生物学检测方法等[5-6]。生物学植物病毒检测方法较慢,而且也受到季节和气候等因素的限制,灵敏度不高,某些病毒因无法找到鉴别寄主而不能运用这种检测方法。血清学植物病毒检测方法对操作环境和操作人员的要求都很高,且检测成本较高,目前常用的血清学检测方法有酶联免疫吸附法、快速免疫滤纸法、免疫荧光技术、斑点免疫测定法以及免疫胶体金技术等;应用电子显微镜检测方法检测之前一定要先了解不同病毒组具备何种形态以及典型病毒的特点,而且检测的样品应该含有较高浓度的病毒。目前常用的分子检测方法有普通逆转录PCR(reverse transcription polymerase chain reaction,简称RT-PCR)法、实时荧光RT-PCR法(real time fluorescent reverse transcription polymerase chain reaction)、试管捕捉RT-PCR(tube capture reverse transcription polymerase chain reaction,简称TC-RT-PCR)法、免疫捕捉RT-PCR(immunocapture reverse transcription polymerase chain reaction,简称IC-RT-PCR)法。普通RT-PCR、实时荧光RT-PCR、IC-RT-PCR法需要抗原抗体结合,成本高且费时[5-6]。随着分子生物学检测技术的发展,实时荧光RT-PCR以高特异性、高灵敏度以及快速等优点,被越来越多地应用于检测疫病,其原理是在常规PCR的基础上,加入1条特异性的荧光探针,随着探针的水解与信號的积累,实现对特异性产物的定性与定量分析,随着荧光染料技术的发展,实时荧光RT-PCR技术已经可以同时检测多种样品,缺点是当大量样品和几种样品复合侵染时,大批量的RNA或DNA的提取不仅工作量大,特别是RNA的提取对操作环境要求较高,费时费力[7-11]。TC-RT-PCR是将离心管与病毒颗粒非特异性结合和反转录PCR扩增结合起来的一种病毒检测和基因克隆的方法,该技术包括叶片研磨、包被、反转录、PCR扩增和电泳检测等步骤,但该方法检测后期需要凝胶电泳检测和接触DNA染料等对人体有害的物质[12-14]。本研究在实时荧光RT-PCR和TC-RT-PCR方法基础上进行改进,旨在建立一套不需要RNA提取,避开RNA提取这一复杂费时费力的过程,且能在同一个反应中同时检测多种病毒病的多重试管捕捉实时荧光反转录PCR(tube capture real time fluorescent RT-PCR)法,检测烟草花叶病毒和马铃薯Y病毒,为大量病毒病样品和多种病毒病复合侵染的检测提供一种简单、快速有效的方法,对危害烟草的病毒进行有效和快速检测以及预防和控制烟草病毒病都具有一定的理论和现实意义。
1材料与方法
1.1番茄与马铃薯病叶
番茄与马铃薯病叶采自贵州省主要的产烟区,经贵州省农业生物技术重点实验室检测鉴定为阳性的TMV和PVY染病烟叶和TMV与PVY复合侵染的病叶。
1.2主要试剂
rTaq酶、dNTP、莫洛尼(氏)鼠白血病病毒[Moloney murine leukemia virus,简称M-MuLV]反转录酶、Oligo(dT)18、RNA酶抑制剂购自TaKaRa[宝生物工程(大连)有限公司]。MakerⅡ购自天根生化科技(北京)有限公司,条带大小依次为100、300、500、700、900、1 200 bp。洗涤缓冲液和样品提取缓冲液所需药品均购自生工生物工程(上海)股份有限公司。TMV双抗夹心酶联免疫法的DAS-ELISA检测试剂盒购自美国Agdia公司。
洗涤缓冲液:氯化钾(KCl)0.2 g、氯化钠(NaCl)8 g、磷酸二氢钾(KH2PO4)0.2 g、磷酸氢二钠(Na2HPO4·12H2O)2.9 g、吐温20(Tween-20)500 μL,调节pH值至7.4,加蒸馏水定容至1 000 mL,4 ℃条件下贮存备用。
样品提取缓冲液:亚硫酸钠(Na2SO3)1.3 g、聚乙烯基吡咯烷酮(MV24000-4000,简称PVP)20 g、叠氮钠(NaN3)0.2 g、吐温20(Tween-20)20 mL,溶解于800 mL洗涤缓冲液中,调节pH值至7.4,加洗涤缓冲液定容至1 000 mL,4 ℃条件下贮存备用。
1‰焦碳酸二乙酯(diethyl pyrocarbonate,简称DEPC)水:将DEPC水用ddH2O稀释1 000倍,高压灭菌后备用。
1.3TaqMan探针及相应引物设计
参考GenBank中已报道的TMV和PVY的外壳蛋白基因序列(GenBank登录号分别为AJ239099和EU719650),按照TaqMan探针和特异性引物的设计原则,实时荧光RT-PCR检测用的TaqMan探针和相应的扩增引物利用Primer Express 3.0设计,TC-RT-PCR用引物用Primer5.0软件设计,均由上海捷瑞生物工程有限公司合成,如表1所示。
1.4方法
1.4.1TMV和PVY烟草病毒病的TC-RT-PCR检测
1.4.1.1磨样取0.1 g病叶,按质量 ∶体积=1 g ∶10 mL加入样品提取缓冲液,充分研磨,4 ℃、10 000 r/min离心 10 min,获得病毒提取液。
1.4.1.2捕捉取病毒提取液1 00 μL包被0.2 mL PCR管,于37 ℃水浴3 h或4 ℃过夜;PBST洗管3次,DEPC水洗1次。
1.4.1.3反转录直接在PCR管中进行反转录,向已捕捉抗原的PCR管中同时加入10 μmol/μL病毒反向引物TMVA1/PVYA11.0 μL、1‰DEPC水11.5 μL、5×M-MuLV反转录酶缓冲液4 μL、10 mmol/L dNTPs 2.0 μL、0.1 mol/L Oligo(dT)18 1.0 μL,70 ℃水浴预变性10 min处理,然后立即置于冰上冷却5 min,再加入40 U/μL RNA酶抑制剂0.5 μL、200 U/μL M-MuLV反转录酶1.0 μL;经42 ℃ 1 h,70 ℃ 10 min 合成cDNA,在-20 ℃下保存备用。
1.4.1.4PCR 扩增加入10 μmol/μL正反向引物TMVS1&TMVA1/ PVYS1&PVYA1各1.0 μL;再加入10×PCR buffer 2.5 μL、2.5 mmol/L dNTP 2.0 μL、5 U/μL Taq酶 0.25 μL、cDNA5 μL,用ddH2O补足至25 μL。PCR反应程序:94 ℃ 4min;94 ℃ 45s,52 ℃ 45 s,72 ℃ 50 s,共30个循环;72 ℃延伸10 min。PCR反应结束后,取10 μL PCR产物用1.2%琼脂糖凝胶进行电泳,经溴化乙锭染色后在凝胶成像仪上观察结果。
1.4.2试管捕捉实时荧光RT-PCR检测TMV和PVY烟草病毒病
1.4.2.1前3个步骤同“1.4.1”节。
1.4.2.2实时荧光PCR采用25 μL PCR反应体系:加入10 μmol/μL正反向引TMVS & TMVA/PVYS & PVYA各1.0 μL;再加入10×PCR 缓冲液2.5μL、2.5mmol/L dNTPs 20 μL、5 U/μL Taq酶0.25 μL、cDNA 5 μL,TaqMan探针 1.5 μL,用ddH2O补足25 μL。反应程序:94 ℃ 3 min;94 ℃ 15 s,60 ℃ 1 min,共40个循环。
1.4.3试管捕捉实时荧光RT-PCR法同时检测TMV和PVY烟草病毒病
1.4.3.1磨样取0.1 g病叶,按质量 ∶体积=1 g ∶10 mL加入樣品提取缓冲液,充分研磨,4 ℃、10 000 r/min离心 10 min,获得病毒提取液。
1.4.3.2捕捉按表2分别对同一管中加入TMV和PVY病毒提取液;包被0.2 mL PCR管,在37 ℃水浴3 h或4 ℃过夜;PBST洗管3次,DEPC水洗1次。
1.4.3.3反转录向已捕捉抗原的PCR管中同时加入 10 μmol/μL 反向引物TMVA和PVYA各1.0 μL、1‰ DEPC水8.5 μL、5×M-MuLV反转录酶缓冲液4 μL、10 mmol/L dNTPs 2.0 μL、0.1 mol/L Oligo(dT)18 1.0 μL、RNA 2 μL,70 ℃ 水浴预变性10 min处理,然后立即置于冰上冷却 5 min,再加入40 U/μL 的RNasin 0.5 μL、200 U/μL M-MuLV反转录酶1.0 μL;经42 ℃、1 h,70 ℃、10 min合成cDNA,在-20 ℃保存备用。
1.4.3.4实时荧光PCR采用25 μLPCR反应体系:同时加入10 μmol/μL正反向引TMVS & TMVA/PVYS & PVYA各1.0 μL;再加入10×PCR Buffer2.5 μL、2.5 mmol/L dNTPs 2.0 μL、5 U/μL Taq酶0.25 μL、cDNA 5 μL,同时加入TMV和PVY的TaqMan探针各1.5 μL,用ddH2O补足 25 μL。反应程序:94 ℃ 3 min;94 ℃ 15 s,60 ℃ 1 min,共40个循环。
1.4.4试管捕捉实时荧光RT-PCR法与DAS-ELISA和TC-RT-PCR法的比较取TMV病叶0.1 g,按质量 ∶体积=1 g ∶10 mL加入样品提取缓冲液,充分研磨,4 ℃、10 000 r/min 离心10 min,获得病毒提取液,分别在酶联免疫板内进行DAS-ELISA(参考美国Agdia公司TMV DAS-ELISA检测试剂盒说明书)试验。最后结果用ELX-800 UV自动酶标检测仪在405 nm处测定样品的D405 nm)、TC-RT-PCR(参照“1.4.1”节)和试管捕捉实时荧光RT-PCR试验(参照“1.4.2”节),并将粗提液作梯度稀释:100.00、10.00、1.00、0.10、0.01 mg/mL;1.000、0.200、0.040、0.008 μg/mL;1.600、0.320、0064 ng/mL,共12个处理,每个梯度取3份,用于DAS-ELISA、TC-RT-PCR和试管捕捉实时荧光 RT-PCR 灵敏度试验。
2结果与分析
2.1TMV和PVY的TC-RT-PCR检测结果
试管捕捉时捕获温度在35~39 ℃较好,且36~37 ℃最佳,捕获时间3~5 h均能得到较好的结果;反转录时预变性时间在6~8 min都能得到较好的结果,反转录时dNTPs浓度在 18 mmol/L 以上,M-MuLV反转录酶浓度在140~260 U/μL 时,RNA酶抑制剂浓度在16 U/μL以上,Oligo (dT)18 浓度在 0.09 mol/μL 以上,反向引物浓度在 0.5 μmol/μL 以上,均能得到较好的结果;PCR扩增时rTaq酶浓度在1~3 U/μL均能得到较好结果,dNTPs浓度在 3.75 mmol/μL 以上,正反向引物浓度在 10 μmol/μL 以上,均能得到较好的结果(图1、图2)。
2.2TMV和PVY的试管捕捉实时荧光RT-PCR检测结果
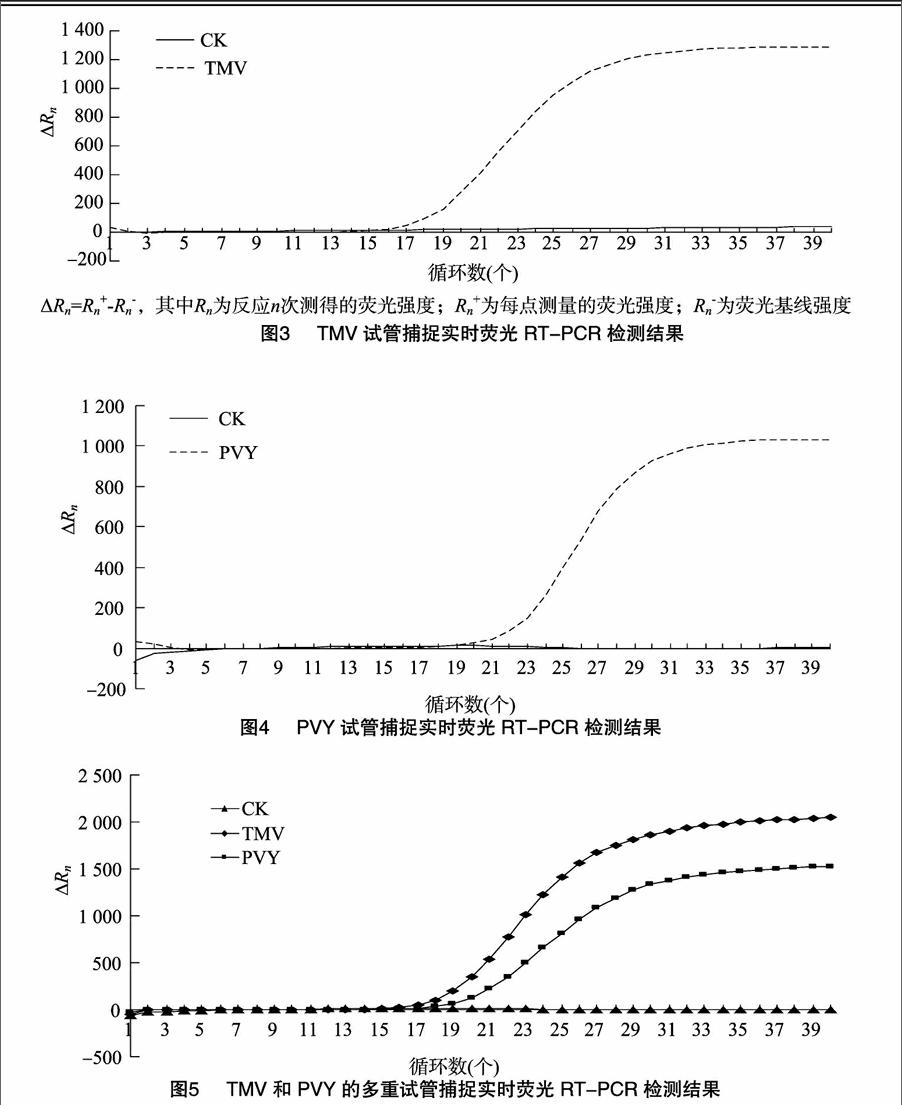
由图3、图4可知,当检测结果呈阳性时,曲线呈“S”形,而阴性对照呈水平直线,根据TMV和PVY的保守序列设计引物和 TaqMan 探针,分别以带有TMV和PVY的烟草病毒病样品作为检测对象,可以特异性地扩增目的条带(循环阈值分别为17.71、21.82 ),而对健康的样品和空白对照均没有扩增,呈阴性;检测发现10 μmol/μL的TaqMan探针加入量在 25 μL 体系中为1.0 μL以上均能得到較好的结果。
2.3TMV和PVY的试管捕捉实时荧光RT-PCR同时检测结果
通过试验发现,由于样品中带毒量和病毒的稳定性不一,所以同时捕捉时,对于带毒量低、稳定性差、易降解的病毒样品,加样时应多加,才能得到较好的检测结果,对于带毒量高、稳定性好的病毒样品,加样时少加也能得到好的效果,本试验中若要在同一个管中同时检测到TMV和PVY,同一个管中加入的TMV量至少要达到3.5 mg/μL以上才能捕获成功,PVY的加样量至少达到6.0 mg/μL以上才能捕获成功。当每个反应管中2对引物和2对探针同时存在时,只有对应模板被加入才发生相应的实时荧光PCR扩增反应;2个模板同时加入时,既不发生交叉反应也不影响各自反应效率(图5)。说明针对TMV、PVY设计的引物和探针特异性强,多重试管捕捉实时荧光RT-PCR法构建成功,且检测效果理想。
2.4DAS-ELISA法、TC-RT-PCR和试管捕捉实时荧光RT-PCR检测方法的比较
针对本研究中选用DAS-ELISA法、TC-RT-PCR和试
管捕捉实时荧光RT-PCR法。从检测时间上来看,试管捕捉实时荧光RT-PCR耗时最短,检测1个病毒病样品所用时间为100 min左右。DAS-ELISA耗时最长,检测1个病毒病样品所用的时间基本为5 h左右。从检测费用上看,DAS-ELISA法远高于TC-RT-PCR和试管捕捉实时荧光RT-PCR法。从检测灵敏度上来看,DAS-ELISA法检测灵敏度在 0.2 μg/mL;TC-RT-PCR法检测灵敏度在0.32 ng/mL(图6);试管捕捉实时荧光RT-PCR法反应灵敏度 1.6 ng/mL(图7)。
3结论与讨论
本试验结合TC-RT-PCR法与实时荧光RT-PCR法,构建了试管捕捉实时荧光RT-PCR法,并在此基础上构建了双重试管捕捉RT-PCR法,目前用于检测广泛发生于烟草上的主要的2种病毒病TMV和PVY,利用2种TaqMan荧光探针实时检测2个目的基因的扩增,在同一管中RT-PCR与探针检测同时进行,整个检测过程只需90 min左右,且只需在加样时打开1次盖子,其后的过程完全是闭管操作,不需要PCR后处理,消除了PCR产物的污染,减少了检测步骤,节省了时间,解决了以往同时检测TMV和PVY方法存在的不足之处,在同一个反应管中,利用多重试管捕捉和同一波段的不同荧光染料同时标记多种待测样品,使得单管反应就能同时检测出多种病毒病,对于大量病毒病的检测,大大缩短了检测时间,检测方便快捷、经济实惠、操作简单、准确,灵敏度高,针对2种不同病毒病和2种病毒病复合侵染的情况,可经1个反应1次就检测出来,省时省力,省去了RNA的提取步骤,进而省去了RNA提取时所需的试剂费,从而避免了RNA提取时的复杂操作,尤其是多种病毒同时检测时,前期几种RNA的提取更费时费力,此技术只须要将几种病毒病的粗提液同时加入同一个管中,操作简单、省时省力、特异性强,收集荧光在较高的退火温度进行,排除了模板的非特异性扩增,无交叉反应,可用于2种病毒特异性的实时PCR检测,且操作快速简单、结果直观准确。因所有试验在封闭系统内完成,可变因素大大减少,避免了普通PCR方法容易产生交叉污染而发生非特异性的扩增,因为不需要后期处理,可防止强致癌物溴化乙锭对操作人员的危害,也不需要通过测序来对病毒进行判定,但检测时可能由于一些病毒病样品的带毒量与稳定性不一致,所以捕捉时,对于稳定性差、带毒量低的样品,加样时应多加,才能得到较好的检测结果,对于稳定性好、带毒量高的病毒加样时少加也能得到好的效果,如TMV和PVY同时检测时,PVY的量达到60 μL以上才能捕获成功,而TMV却只要加入35 μL以上就能捕获成功,具有诸多优点的试管捕捉双重实时荧光技术在病毒检测方面有广阔的应用前景。此外该方法的建立在农业生产、种子流通及种子检验检疫中具有一定意义,该方法的构建成功,使TC-RT-PCR法变得更高效,丰富了病毒病的检测方法,对病毒病的检测具有重要的理论和现实意义。
参考文献:
[1]朱贤朝,王彦亭,王智发. 中国烟草病害[M]. 北京:中国农业出版社,2002.
[2]马国胜,何博如. 烟草病毒研究现状与展望[J]. 中国生态农业学报,2006,14(2):150-153.
[3]李基光,肖启明,唐前君,等. 烟草病毒病的发生及综合防治方法研究进展[J]. 农药研究与应用,2009,13(5):13-16.
[4]张世兰. 烟草病毒病防治技术[J]. 现代农业科技,2011(23):232-236.
[5]黎建,袁木林. 烟草病毒病及其检测鉴定技术[J]. 南方农业(园林花卉版),2011,5(10):73-75.
[6]翟玉俊,刘红海,李星亮,等. 烟草病毒检测技术研究进展[J]. 农产品加工·学刊,2009(4):83-88.
[7]闻伟刚,谭钟,张颖. 实时荧光RT-PCR检测香蕉苞片花叶病毒方法的建立[J]. 植物保护学报,2009,36(5):417-420.
[8]易汪雪,陈舜胜,杨翠云,等. 单管实时荧光 RT-PCR 方法同时检测大豆种子中的菜豆荚斑驳病毒和烟草环斑病毒[J]. 植物病理学报,2011,41(1):85-92.
[9]朱建裕,黃秋霞,高必达,等. 建立基于 TaqMan 探针的李坏死环斑病毒实时荧光RT-PCR检测方法[J]. 微生物学通报,2011,38(8):1295-1299.
[10]Mumford R A,Walsh K,Barker I,et al. Detection of potato mop top virus and tobacco rattle virus using a multiplex real-time fluorescent reverse-transcription polymerase chain reaction assay[J]. Phytopathology,2000,90(5):448-453.
[11]Korimbocus J,Coates D,Barker I,et al. Improved detection of sugarcane yellow leaf virus using a real-time fluorescent (TaqMan) RT-PCR assay[J]. Journal of Virological Methods,2002,103(2):109-120.
[12]邱又彬,陶刚,黄永会,等. TC-RT-PCR技术在马铃薯病毒检测及其基因克隆上的应用[J]. 西南农业学报,2009,22(2):329-331.
[13]沈建国,林双庆,蔡伟,等. TC/IC-RT-PCR 检测黄瓜绿斑驳花叶病毒[J]. 福建农林大学学报(自然科学版),2012,41(1):13-17.
[14]Kajihara H,Muramoto K,Fuji S,et al. Simultaneous detection of Japanese yam mosaic virus and yam mild mosaic virus from yam leaves using a tube capture reverse transcription-polymerase chain reaction assay[J]. Journal of General Plant Pathology,2009,75(1):72-75.胡肖肖,唐宇力,贾梅,等. 干旱胁迫对13个杜鹃品种生理特性的影响[J]. 江苏农业科学,2017,45(6):101-105.
doi:10.15889/j.issn.1002-1302.2017.06.025

