芒果细菌性黑斑病病菌rep—PCR遗传多样性
漆艳香++张贺+蒲金基++张欣++谢艺贤++陆英++喻群芳++张辉强
摘要:采用REP、ERIC和BOX引物对22株从海南、四川、广西芒果产区采集的芒果细菌性黑斑病菌菌株和1株源自美国菌种保藏中心(ATCC)的标准菌株进行rep-PCR分析,并根据DNA指纹特征,用 NTSYS 软件进行聚类分析。结果表明,3组引物共扩增出463条带,其中有302条多态性条带,多态检测率为65.23%。综合分析3组引物组合的指纹图谱数据,以相似系数0.65为阀值时,供试的23株菌株可以分为A和B 2个遗传相似组,其中来自四川米易县的2株菌株与标准菌株ATCC11637聚在A组,而来自海南省、广西省的所有菌株均聚在B组。取相似系数为087时,A组群又可分为2个亚组,而B组群则进一步分为6个亚组。研究结果表明,芒果细菌性黑斑病菌菌株有丰富的遗传多态性和较大的遗传变异,但各遗传聚类组群菌株来源广泛,与地理来源及芒果品种均无明显相关性。
关键词:芒果细菌性黑斑病菌;遗传多样性;REP;ERIC;BOX
中圖分类号: S436.67+9文献标志码: A文章编号:1002-1302(2017)06-0088-04
由野油菜黄单胞杆菌芒果致病变种(Xanthomanas campestris pv. mangiferaeindicae,Xcm)引起的芒果细菌性黑斑病是芒果上一种常发性重要病害,该病严重影响芒果产量和果品商品价值,是芒果外销产业的重要限制因子[1-2]。选育抗病品种是防治此病害最经济和有效的措施,而品种抗性是寄主与病原物相互作用的结果,因此,了解与掌握芒果细菌性黑斑病病原菌的群体分化,可为芒果抗病品种选育提供依据和参考。
重复序列PCR(rep-PCR)主要是基于细菌基因组中重复序列元件(REP、ERIC和BOX等)的保守区域设计引物,通过PCR选择性扩增不同的基因组区域,揭示病原菌不同种或种下的不同菌株的遗传变异情况[3-4]。该技术具有分辨率高、快速简单、重复性好的特点,在国内外已广泛应用于黄单胞菌属植物病原细菌的群体遗传多样性分析,如柑橘溃疡病病菌(X. citri subsp. citri)[5-7]、水稻白叶枯病菌(X. oryzae pv. oryzae)[8-9]、水稻条斑病病菌(X. oryzae pv. oryzicola)[10-11]、红掌细菌性疫病病菌(X. axonopodis pv.dieffenbachiae)[12-13]和十字花科黑腐病病菌(X. campestris pv. campestris)[14-15]等。
目前,国内对于芒果细菌性黑斑病的研究多集中于检测鉴定[16-17]与防控[18-20],有关Xcm遗传分化等方面的研究报道甚少[21]。本试验首次对22株从海南省、四川省、广西省芒果产区分离的Xcm菌株和1株源自美国菌种保藏中心(ATCC)的Xcm标准菌株进行rep-PCR分析,以期揭示我国3省(区)Xcm的遗传多样性,为芒果品种合理布局、黑斑病的流行监测及防治提供参考依据。
1材料与方法
1.1供试菌株
Xcm标准菌株ATCC11637由国家质检总局动植物检疫检验研究所赵文军博士馈赠;其余22株Xcm菌株由笔者从海南省、四川省、广西省芒果产区的病组织中分离所得,单菌落经不断纯化、回接及鉴定保存。菌株相关信息如表1所示。
1.2菌株的培养和基因组DNA的制备
将供试菌株接种到NA固体平板培养基上划线培养,28 ℃ 恒温培养3 d后,挑取单个菌落于NA液体培养液中,在28 ℃恒温摇床上培养24 h,直接用于DNA提取或4 ℃保存备用。细菌基因组DNA的提取参考Biomiga公司的试剂盒(Bacterial gDNA kit)说明书进行,-20 ℃保存备用。
1.3rep-PCR
rep-PCR采用REP、ERIC和BOX寡核苷酸引物[3],REP
引物均由上海英骏生物技术有限公司合成。
按照文献[3]中的方法对PCR扩增反应体系和条件进行适当调整,所有扩增反应均在PTC200 PCR仪(MJ RESEARCH)上进行。优化后的反应体系如下:2.5 μL 10×PCR缓冲液(Mg2+ Plus),2 μL dNTP混合物(2.5 mmol/L),各 0.5 μL 上、下游引物(20 μmol/L),0.2 μL Taq酶(5 U/μL),100 ng模板DNA,无菌超纯水补足至25 μL。rep-PCR扩增条件:95 ℃预变性 7 min,30个循环(94 ℃ 1 min,40 ℃退火 1 min,65 ℃延伸 8 min),最后 65 ℃ 延伸15 min。ERIC-PCR和BOX-PCR扩增条件中,除退火温度分别为52、53 ℃外,其余扩增步骤均同rep-PCR。扩增结束后,取6 μL反应产物在1.5%琼脂糖胶上进行电泳检测。
1.4数据分析
参照rep-PCR扩增结果的琼脂糖凝胶电泳图谱,每1条DNA条带均为1个分子标记,代表1个引物结合位点。根据各分子标记的迁移率及其有无统计所得位点的二源数据,即有带记为“1”,无带记为“0”,制成Excel文件用于聚类分析。使用NTSYS-pc 2.10e软件按UPGMA绘制聚类图,并进行菌株的分组分析。
2结果与分析
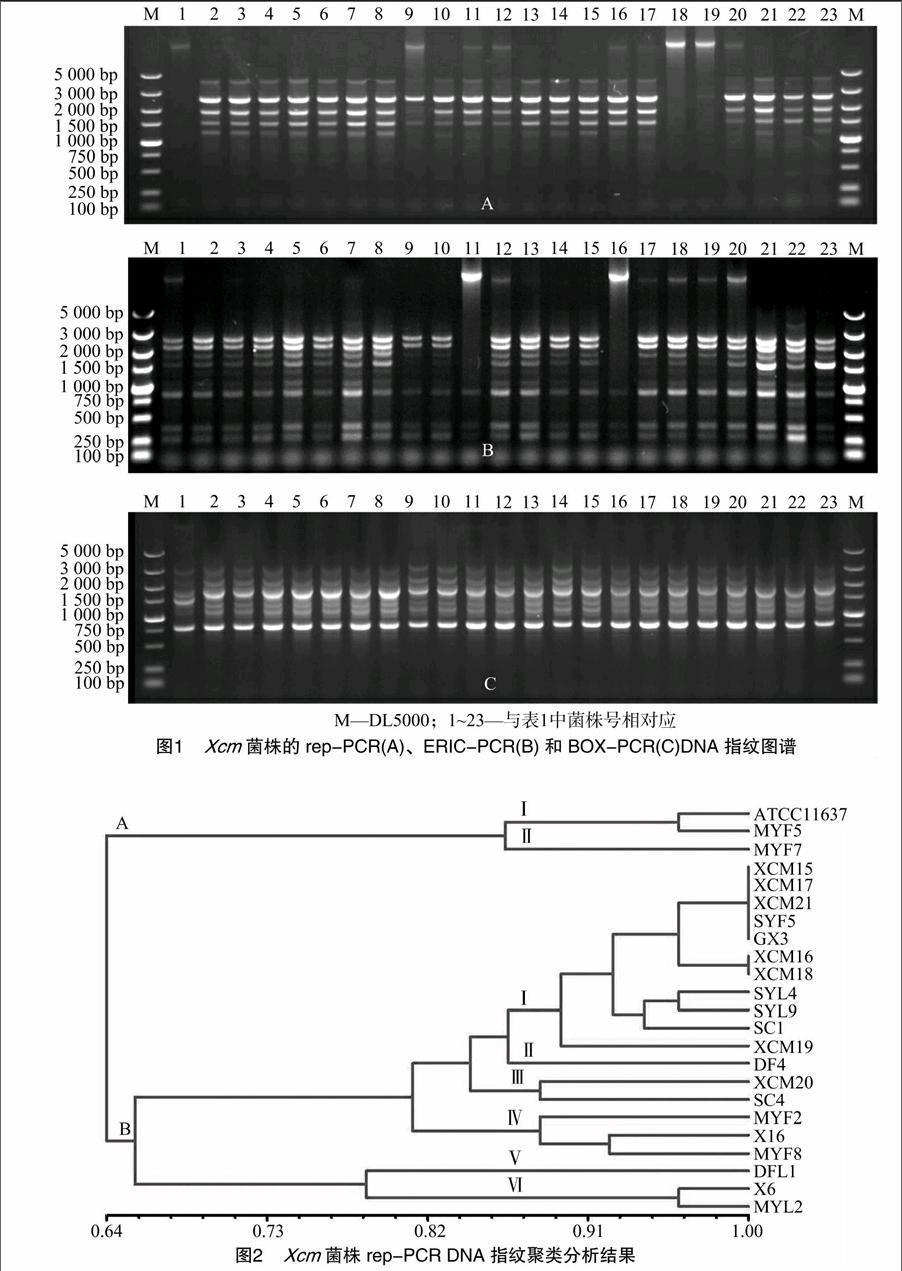
2.1Xcm基因组DNA的rep-PCR指纹图谱分析
采用3组引物(REP、ERIC和BOX)对23株Xcm的基因组DNA分别进行PCR扩增,均获得较清晰的电泳图谱,分别扩增出1~7、4~12、5~7条分子量不等的DNA条带,多态性比率分别为100.00%、75.00%、42.86%,片段大小主要集中在100~5 000 bp之间。3组引物对所有供试菌株的基因组DNA共扩增出463条带,其中多态性条带302条,多态检测率为65.23%,初步表明供试病菌种群在DNA水平上变异较大,存在丰富的多态性,且各芒果产区Xcm种群的DNA指纹谱型也表现出明显差异。如图1所示,同一地点相同品种相同组织分离出的部分菌株指纹图谱差异明显,如DFL1、X6、X16与XCM15~XCM21,MYL2与MYL7,MYF2与MYF5,但也有例外,如XCM15~XCM21;不同地点不同品种不同组织分离出的部分菌株指纹图谱有较大差异,如MYF5、MYL7与海南省分离株及广西省分离株。
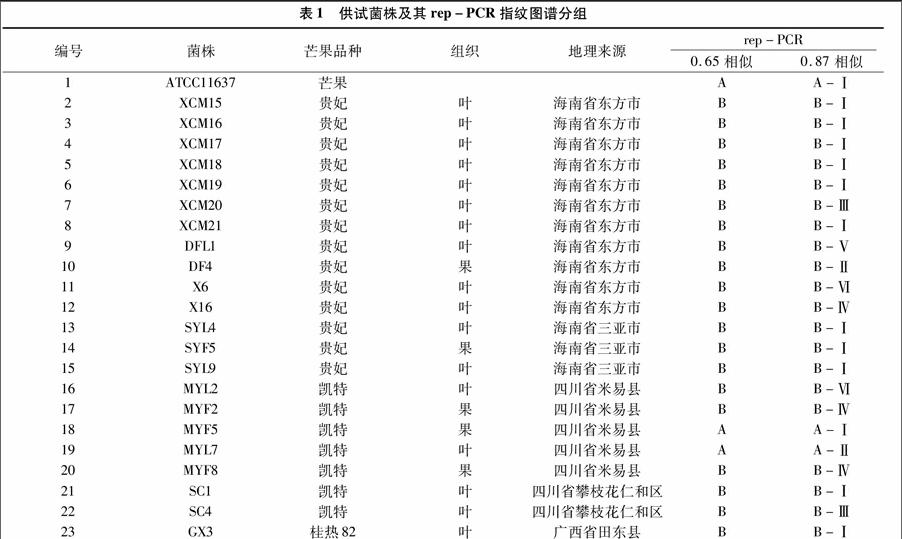
2.2Xcm基因组DNA的rep-PCR聚类分析
本试验采用NTSYS-pc 2.1聚类分析软件SHAN程序估算DNA相似系数,综合分析了3组引物组合的指纹图谱数据,用UPGMA方法绘制了23株供试菌株的系统聚类树状图。结果(图2)表明,以相似系数0.65为阈值时,供试的23株菌株可以分为A和B 2个遗传相似组,其中B含20个菌株,为主要遗传组。以相似系数为0.87为阈值时,A组群可分为2个亚组,B组群则可分为6个遗传亚组,其中B-Ⅰ含11个菌株,为主要遗传亚组。
如图2所示,聚类分析结果表明,23株供试菌株在相似系数为0.65时,可以分为A、B 2组,其中A组与B组又各自进一步分为2个和6个亚组。A组由2株来自四川省米易县的菌株与标准菌株ATCC11637组成,其中ATCC11637与1株来自米易县的菌株进一步聚成A-Ⅰ亚组,A-Ⅱ亚组只有1株来自米易县的菌株。B组则由14株来自海南省、5株
来自四川省及1株来自广西省的菌株组成。B-Ⅰ亚组以6株来自海南省东方市和3株来自海南省三亚市的菌株为主,另外2株菌株则分别来自广西省田东县和四川省攀枝花仁和区;B-Ⅱ亚组只有1株来自四川省米易县的菌株;B-Ⅲ包括来自四川省攀枝花仁和区及海南省东方市的菌株各1株。B-Ⅳ亚组包括2株来自四川省米易县及1株来自海南省东方市的菌株;B-Ⅴ亚组仅有1株来自海南省东方市的菌株;B-Ⅵ亚组包括2株分别来自四川省米易县及海南省东方市的菌株。
3讨论
应用分子生物学技术分析Xcm群体遗传结构研究,国外已有相关研究与报道[22-24]。Gagnevin等采用hrp探针对127株Xcm进行了RFLP分析,结果表明供试菌遗传多样性丰富,可分为4个组群,且遗传分化与菌株的寄主及地理来源有明显的相关性[22]。Kishun等对6株印度Xcm进行RAPD分析,结果证明供试菌株遗传多样性较丰富,可划分为2个组群,组群与供试菌株地理来源没有相关性[23]。Pruvost等对299株Xcm进行MLVA、IS1595-LM PCR及AFLP分析,结果证明供试菌株具有丰富的遗传多样性,可分别划分为231、29、125种单倍型,但单倍型的划分与菌株的地理来源没有相关性[24]。迄今为止,国内尚未见应用分子生物学技术进行Xcm遗传分化的研究报道。
本试验采用REP、ERIC和BOX引物对23株来源于海南省、四川省、广西省及美国菌种保存中心的Xcm进行了遗传多样性的分子指纹分析,结果表明,REP和ERIC引物能扩增出多种条带,并显示出多态性丰富的特点,而BOX-PCR虽可扩增出条带,但用于分析Xcm群体内的遗传变异的效果不理想。
为了准确反映供试菌株间基因组之间的差异,本试验综合分析了3组引物的DNA指纹图谱,结果表明,供试菌株群体具有丰富的遗传多样性,不同地区的部分Xcm菌株DNA指纹谱型具有较明显的差异,另外,来源于同一县市的Xcm,其部分菌株的DNA指纹谱型也表现出一定差异。进一步分析发现,来自不同产区与不同芒果品种的Xcm可以聚成一组,由此说明芒果细菌性黑斑病病原菌的遗传组与地理来源及芒果品种均无明显相关性,这一研究结果与文献报道[23-24]一致,这也从侧面说明了该病是带菌苗木、接穗调运引起的。
4结论
本试验采用rep-PCR指纹分析初步揭示了Xcm基因组间的遗传多样性,结果表明,Xcm群体有丰富的遗传多态性和较大的遗传变异,且各遗传聚类组群菌株来源广泛,与地理来源及芒果品种均无明显相关性。由于所用的菌株数量有限,其代表程度有一定局限性。在以后的研究中,应该大范围地收集菌株以研究我国Xcm的群体结构和遗传多样性。
参考文献:
[1]文衍堂,黄圣明. 芒果细菌性黑斑病症状与病原菌鉴定[J]. 热带作物学报,1994,15(1):79-85.
[2]漆艳香,蒲金基,张欣,等. 芒果细菌性黑斑病菌XcmR基因的克隆与序列分析[J]. 热带作物学报,2011,32(4):663-667.
[3]Versalovic J,Schneider M,De Bruijn F J,et al. Genomic fingerprinting of bacteria using repetitive sequence-based polymerase chain reaction[J]. Methods in Molecular and Cellular Biology,1994,5(1):25-40.
[4]Louws E J,Fulbright D W,Stephens C T,et al. Specific genomic fingerprints of phytopathogenic Xanthomonas and Pseudomonas pathovars and strains generated with repetitive sequences and PCR[J]. Applied and Environmental Microbiology,1994,60(7):2286-2295.
[5]姚廷山,胡軍华,唐科志,等. 利用rep-PCR技术研究我国9省柑橘溃疡病菌遗传多样性[J]. 果树学报,2010,27(5):819-822.
[6]Arshadi F,Sijam K,Awang Y B. Genetic diversity of Xanthomonas citri subsp. citri causal agent of citrus canker[J]. Journal of Plant Protection Research,2013,53(4):312-316.
[7]魏楚丹,丁钿,叶凎,等. 广东和江西省柑橘溃疡病菌的遗传多样性分析[J]. 华南农业大学学报,2014,35(4):71-76.
[8]高玲玲,黄琼,陈小龙. 中国西南水稻白叶枯病菌遗传多样性垂直分布格局[J]. 中国生态学报,2014,22(9):1086-1092.
[9]Cruz C M V,Leach J E,Ardales E Y,et al. Measurement of haplotypic variation in Xanthomonas oryzae pv. oryzae within a single field by rep-PCR and RFLP analyses[J]. Phytopathology,1996,86(12):1352-1359.
[10]张立新,何涛,于建红,等. 安徽省水稻条斑病菌群体遗传结构分析[J]. 植物病理学报,2014,44(5):521-526.
[11]Gonzalez C,Szurek B,Manceau C,et al. Molecular and pathotypic characterization of new Xanthomonas oryzae strains from West Africa[J]. Molecular Plant-Microbe Interactions,2007,20(5):534-546.
[12]付贝,周晓云,罗建军,等. 广东红掌细菌性疫病病原菌的遗传多样性分析[J]. 华中农业大学学报,2014,33(2):40-45.
[13]Donahoo R S,Jones J B,Lacy G H,et al. Genetic analyses of Xanthomonas axonopodis pv. dieffenbachiae strains reveal distinct phylogenetic groups[J]. Bacteriology,2013,103(3):237-244.
[14]Singh D,Dhar S,Yadava D K. Genetic and pathogenic variability of Indian strains of Xanthomonas campestris pv. campestris causing black rot disease in crucifers[J]. Current Microbiology,2011,63(6):551-560
[15]朱平川,卢洁,张昭颖,等. 广西十字花科黑腐病菌致病性分化及遗传多样性分析[J]. 基因组学与应用生物学,2015,34(3):541-547.
[16]芒果细菌性黑斑病菌检疫鉴定方法:GB/T 28094—2011[S]. 北京:中国标准出版社,2011.
[17]芒果细菌性黑斑病原菌分子检测技术规范:NY/T 2257—2012[S]. 北京:中国农业出版社,2012.
[18]张贺,漆艳香,谢艺贤,等. 芒果细菌性黑斑病病原细菌室内药剂筛选[J]. 中国农学通报,2010,26(12):344-347.
[19]刘晓妹,刘文波,范秀利. 芒果细菌性黑斑病生防菌的筛选及防效测定[J]. 中国生物防治,2006,22(增刊1):94-97.
[20]刘晓妹,刘文波,蒲金基,等. 芒果对细菌性黑斑病抗病性测定[J]. 果树学报,2009,26(3):349-352.
[21]漆艳香,谢艺贤,张贺,等. 海南省芒果细菌性黑斑病原菌生理生化特性初步研究[J]. 中国农学通报,2014,30(28):301-305.
[22]Gagnevin L,Leach J E,Pruvost O. Genomic variability of the Xanthomonas pathovar mangiferaeindicae,agent of mango bacterial black spot[J]. Applied and Environmental Microbiology,1997,63(1):246-253.
[23]Kishun R,Gupta V K. Detection of genetic diversity among Indian strains of Xanthomonas campestris pv. mangiferaeindicae using PCR-RAPD[J]. Nature Precedings,2008:1-19.
[24]Pruvost O,Vernière C,Vital K,et al. Insertion sequence- and tandem repeat-based genotyping techniques for Xanthomonas citri pv. mangiferaeindicae[J]. Phytopathology,2011,101(7):887-893.常征,王蓉,李洪潮,等. 菌株YS(r)-19分離鉴定及对三七根腐病菌的抑菌活性[J]. 江苏农业科学,2017,45(6):92-95.
doi:10.15889/j.issn.1002-1302.2017.06.023

