次黄嘌呤核苷酸脱氢酶对猪链球菌2型ZY05719基因转录谱的影响
周俊明++何孔旺++倪艳秀++祝昊丹+俞正玉+茅爱华++吕立新
摘要:次黄嘌呤核苷酸脱氢酶(IMPDH)是猪链球菌2型的毒力相关因子,该基因的丢失降低了猪链球菌2型菌株ZY05719黏附HEp-2、PK15细胞的能力。为全面掌握IMPDH对ZY05719致病力的影响机制,采用定制的Agilent猪链球菌2型基因表达谱芯片,比较了亲本菌株ZY05719(ZY)和impdh敲除菌株(ΔZY)的基因转录情况。结果显示,impdh的丢失影响了254个基因的转录,其中包括impdh的下调基因177个,上调基因77个。对差异基因进行同类群聚类(Clusters of Orthologous Groups,COG)分析,显示差异基因主要集中于氨基酸、碳水化合物的转运代谢,以及核糖体、细胞壁、细胞膜的生物合成和防御机制。本研究较为全面地分析了impdh对猪链球菌2型基因转录谱的影响,为解释impdh在猪链球菌致病中发挥的作用提供了数据支持。
关键词:猪链球菌2型;表达谱芯片;同类群聚类;次黄嘌呤核苷酸脱氮酶;基因转录谱
中图分类号: S858.285.1+1文献标志码: A文章编号:1002-1302(2017)06-0027-03
猪链球菌(Streptococcus suis)是有荚膜的革兰氏阳性球菌,是世界范围内流行的一种重要的猪病原菌[1],该菌往往引起保育猪或断奶仔猪发生脑膜炎、败血症、关节炎[2]。依据荚膜多糖抗原可将S. suis分为33个血清型(包括1~31、33、1/2型)[3],其中S. suis 2致病力最强、流行范围最广,并且能够引起人发生脑膜炎和严重的毒性休克综合征[4-6]。1998、2005年分别在我国江苏省、四川省部分地区暴发了人感染猪链球菌病,病原菌即为猪链球菌2型[7]。S. suis已成为越南南部地区成人细菌性脑膜炎的主要病因[8],人可通过与发病猪的直接接触感染S. suis,而人与人之间的传播目前尚未得到证实。对S. suis 2的研究陆续发现了荚膜、溶血素、纤连蛋白结合蛋白、血清浑浊因子等毒力相关因子[9]。笔者所在研究室的前期工作中,对SS2-H、ZY05719菌株的impdh基因进行敲除,发现与亲本株相比,缺失株对猪的致病力均有所下降,提出IMPDH为S. suis 2的毒力相关因子[10-11],但IMPDH对S. suis 2致病力的影响还缺少系统性认识。本研究采用猪链球菌2型的表达谱芯片,比较了亲本菌株ZY05719(ZY)和impdh敲除菌株(ΔZY)的基因转录谱,并对差异基因进行了归类分析。
1材料与方法
1.1细菌培养
本研究涉及2株猪链球菌2型菌株,包括强毒菌株ZY、ΔZY。ZY为2005年分离自四川省资阳市发生猪链球菌病的猪组织(由南京农业大学动物医学院微生物组惠赠);ΔZY为敲除impdh的ZY菌株,由笔者所在研究室构建获得。
细菌在THB(Todd-Heitt broth,BD)平板上进行培养,无菌挑取菌落进入THB液体培养基中,于37 ℃下培养过夜。将此培养物按照1%的接种比例接入新的THB液体培养基中,于37 ℃下培养至细菌对数生长期,革兰氏染色观察细菌形态。
1.2RNA提取和纯化
采用TRIzol Reagent(Life technologies,US)并根据生产厂商提供的标准操作流程进行样品的细菌总RNA抽提。采用Biomate 3S型超微量紫外可见分光光度计(Thermo,US)测定抽提所得总RNA样品的浓度及D260 nm/D280 nm比值,另外经Agilent Bioanalyzer 2100型电泳(Agilent technologies,US)质检合格后使用RNeasy mini kit(Qiagen,Germany)和RNase-Free DNase Set(Qiagen,Germany),纯化总RNA。
1.3样品RNA的放大和标记
采用Agilent表达谱芯片配套试剂盒、Low RNA Input Linear Amplification kit(Agilent technologies,US)、5-(3-aminoallyl)-UTP(Ambion,US)、Cy3 NHS ester(GE healthcare Biosciences,US),按照标准操作流程对样品总RNA中的mRNA进行放大和标记,并用RNeasy mini kit(QIAGEN,Germany)纯化标记后的cRNA。
1.4芯片杂交
依据SS2-05ZYH33菌株基因序列,定制Agilent公司的8×15 kbp表达谱芯片,该芯片包含2 178个探针(每个探针含60个碱基)。按照Agilent表达谱芯片配套提供的杂交标准流程和配套试剂盒,采用Gene Expression Hybridization Kit(Agilent technologies,US),在Hybridization Oven型滚动杂交炉(Agilent technologies,US)中以65 ℃、10 r/min滾动杂交 17 h,杂交cRNA上样量为1.65 μg,并在staining dishes型洗缸(Thermo Shandon,US)中洗片,洗片所用试剂为Gene Expression Wash Buffer Kit(Agilent technologies,US)、Stabilization and Drying Solution(Agilent technologies,US)。
1.5结果扫描
完成杂交的芯片采用Agilent Microarray Scanner(Agilent technologies,US)进行扫描,用Feature Extraction software 10.7软件(Agilent technologies,US)读取数据,最后采用Gene Spring Software 11.0软件(Agilent technologies,US)对数据进行Quantile算法的归一化处理。每个菌株设3个重复,比较亲本株与缺失株之间差异2倍以上且具有统计学意义(P<0.05)的基因。以上内容均由上海伯豪生物技术有限公司完成。
1.6差異基因的同类群聚类(COG)
参照文献[12]中的方法,将上述筛选的差异基因进行同源群聚类(clusters of orthologous groups,COG)分析。
1.7数据统计方法
对ZY、ΔZY 2组样品的3个重复分别采用随机方差 t-检验,测算2组样品间每个转录本差异表达的显著性强度,差异基因P<0.05有统计学意义。
2结果与分析
2.1细菌形态
ZY与ΔZY经过革兰氏染色,通过显微镜观察1 000倍放大下的形态,可见蓝紫色球菌排列成链状的细菌,ΔZY成链稍长于ZY(图1)。
2.2RNA的质量检测
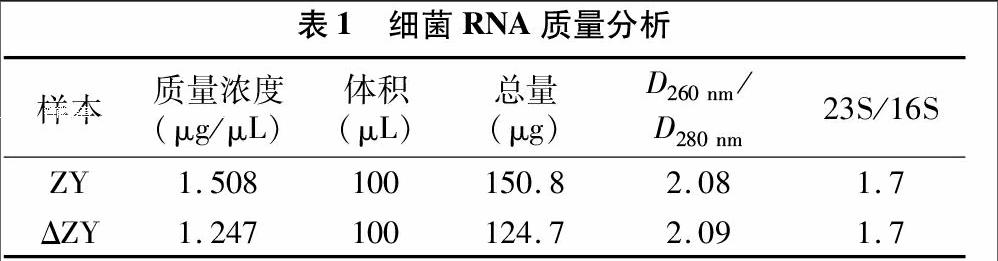
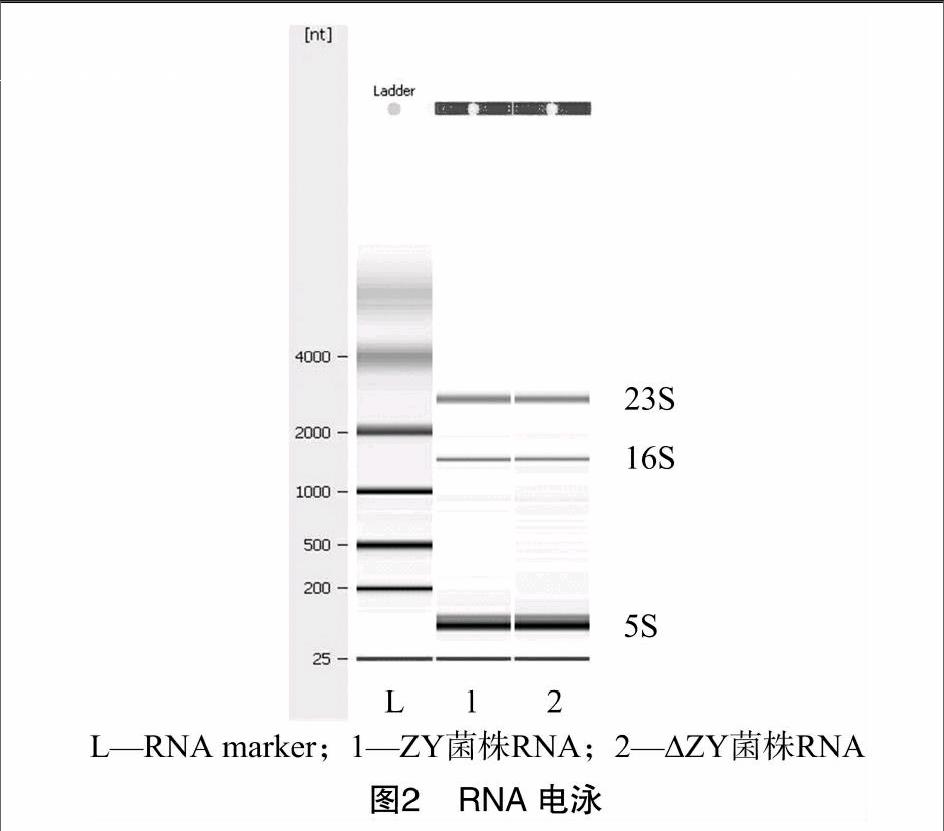
提取生长对数期细菌的RNA,测定D260 nm、D280 nm,依据D260 nm×稀释倍数×40 μg/mL计算RNA的浓度以及 D260 nm/D280 nm 比值。每个RNA样品电泳后可见3条条带,由大到小依次为23S、16S、5S,依据条带灰度值计算23S/16S比值。D260 nm/D280 nm≥1.8、23S/16S>0.7为合格RNA样本,结果见表1、图2。
2.3ZY和ΔZY表达谱芯片的比较
利用定制的Agilent表达谱芯片比较ZY和ΔZY基因的转录情况。结果表明,有254个基因的转录发生2倍以上显
著水平(P<0.05)的变化,ΔZY菌株中177个基因下调,其中impdh转录下调了99.97%以上,另外ΔZY中上调基因有77个。对这些差异基因进行COG归类,发现impdh的丢失引起了ZY菌株多数基因的转录下调,主要集中于氨基酸、碳水化合物的转运代谢,以及核糖体、细胞壁、细胞膜的生物合成和防御机制,结果见表2。
3结论与讨论
溶菌酶释放蛋白(MRP)和胞外因子(EF)早前被作为 S. suis 2的毒力标记物[13],后续研究发现,敲除这些因子的S. suis 2后仍对仔猪具有致病力[14-15]。目前尚未明确 S. suis 2关键的毒力标记物,从而限制了对S. suis 2致病机制的认识,同时也阻碍了该病的防控技术研究,因此对S. suis 2毒力因子的进一步研究非常重要。IMPDH已被证实为 S. suis 2一类重要的毒力相关因子,本研究通过定制S. suis 2表达谱芯片,比较了亲本株ZY和impdh缺失株ΔZY之间转录本的差异。结果表明,ΔZY下调基因中直接关系到核糖体蛋白大、小亚基合成的相关基因有18个,占表达谱芯片此类基因总数的32%以上;而ΔZY上调基因中没有关系到核糖体蛋白大、小亚基合成的基因。核糖体是蛋白质合成的机器,由蛋白质和RNA组成,提示impdh基因的丢失下调部分核糖体蛋白质编码基因的转录,可能干扰了核糖体的正常合成,影响细菌蛋白质的正常合成,前期试验表明猪链球菌2型菌株GN061215中也有类似发现[16]。
荚膜为S. suis 2细胞壁外的结构,能够增强细菌抵抗吞噬细胞吞噬的能力,是目前较为公认的毒力因子[17-18]。荚膜组成包括半乳糖、葡萄糖、N-乙酰葡糖胺、唾液酸,表达谱芯片中包含了荚膜合成基因(cps2A、B、C、E、D、F、H、I、J)和唾液酸合成基因。结果显示,与ZY相比,ΔZY中cps2F、H、I均出现67%以上的显著下调,提示impdh的丢失可能影响ΔZY荚膜的合成。ΔZY防御机制的相关基因中有6个下调,包括ABC多药转运系统、 β-内酰胺酶。ABC系统能够摄取营养、信号分子,并能提供细菌产生耐药性,与细菌毒力密切相关[19];β-内酰胺酶能够水解一些药物β-内酰胺环而使药物失活,这是病原菌常见的β-内酰胺类抗生素(青霉素类、头孢菌素类)耐药的主要方式[20],提示ZY可能比ΔZY更容易产生针对此类药物的耐受力。
ZY菌株丢失impdh基因后,引起较多基因的转录下调,且其中部分基因与细菌的致病力存在联系,较全面地解释了ΔZY毒力下降的现象。
致谢:感谢华中农业大学金梅林教授提供猪链球菌2型SS2-05ZYH33基因表达谱芯片探针序列。
参考文献:
[1]Gottschalk M. Streptococcocis[M]//Straw B E,Zimmerman J J,DAllaire S,et al. Diseases of swine. Ames,IA,USA:Blackwell Publishing,2012:841-855.
[2]Wertheim H F,Nghia H D,Taylor W A. Streptococcus suis:an emerging human pathogen[J]. Clinical Infectious Diseases,2009,48(5):617-625.
[3]Hill J E,Gottschalk M,Brousseau R,et al. Biochemical analysis,cpn60 and 16S rDNA sequence data indicate that Streptococcus suis serotypes 32 and 34,isolated from pigs,are Streptococcus orisratti[J]. Veterinary Microbiology,2005,107(1/2):63-69.
[4]Wei Z G,Li R,Zhang A D,et al. Characterization of Streptococcus suis isolates from the diseased pigs in China between 2003 and 2007[J]. Veterinary Microbiology,2009,137(1/2):196-201.
[5]Kim D,Han K,Oh Y,et al. Distribution of capsular serotypes and virulence markers of Streptococcus suis isolated from pigs with polyserositis in Korea[J]. Canadian Journal of Veterinary Research-Revue Canadienne de Recherche Veterinaire,2010,74(4):314-316.
[6]Gottschalk M,Lacouture S,Bonifait L,et al. Characterization of Streptococcus suis isolates recovered between 2008 and 2011 from diseased pigs in Quebec,Canada[J]. Veterinary Microbiology,2013,162(2/3/4):819-825.
[7]Yu H J,Jing H Q,Chen Z H,et al. Human Streptococcus suis outbreak,Sichuan,China[J]. Emerging Infectious Diseases,2006,12(6):914-920.
[8]Mai N T,Hoa N T,Nga T V,et al. Streptococcus suis meningitis in adults in Vietnam[J]. Clinical Infectious Diseases,2008,46(5):659-667.
[9]Feng Y J,Zhang H M,Wu Z W,et al. Streptococcus suis infection an emerging/reemerging challenge of bacterial infectious diseases?[J]. Virulence,2014,5(4):477-497.
[10]Zhang X H,He K W,Duan Z T,et al. Identification and characterization of inosine 5-monophosphate dehydrogenase in Streptococcus suis type 2[J]. Microbial Pathogenesis,2009,47(5):267-273.
[11]Zhou J M,Zhang X E,He K W,et al. Characterization and proteome analysis of inosine 5-monophosphate dehydrogenase in epidemic streptococcus suis serotype 2[J]. Current Microbiology,2014,68(5):663-669.
[12]Willenborg J,Fulde M,de Greeff A,et al. Role of glucose and CcpA in capsule expression and virulence of Streptococcus suis[J]. Microbiology,2011,157(6):1823-1833.
[13]Vecht U,Wisselink H J,Jellema M L,et al. Identification of two proteins associated with virulence of Streptococcus suis type 2[J]. Infection and Immunity,1991,59(9):3156-3162.
[14]Berthelot-Herault F,Gottschalk M,Morvan H,et al. Dilemma of virulence of Streptococcus suis:Canadian isolate 89-1591 characterized as a virulent strain using a standardized experimental model in pigs[J]. Canadian Journal of Veterinary Research-Revue Canadienne de Recherche Veterinaire,2005,69(3):236-240.
[15]Smith H E,Vecht U,Wisselink H J,et al. Mutants of Streptococcus suis types 1 and 2 impaired in expression of muramidase-released protein and extracellular protein induce disease in newborn germfree pigs[J]. Infection and Immunity,1996,64(10):4409-4412.
[16]周俊明,何孔旺,倪艷秀,等. 次黄嘌呤核苷酸脱氢酶对猪链球菌2型GN061215生物学特性及蛋白质表达的影响[J]. 江苏农业学报,2013,29(1):114-120.
[17]Charland N,Harel J,Kobisch M,et al. Streptococcus suis serotype 2 mutants deficient in capsular expression[J]. Microbiology,1998,144(Pt2):325-332.
[18]Smith H E,Damman M,van der Velde J,et al. Identification and characterization of the cps locus of Streptococcus suis serotype 2:the capsule protects against phagocytosis and is an important virulence factor[J]. Infection and Immunity,1999,67(4):1750-1756.
[19]Davidson A L,Chen J. ATP-binding cassette transporters in bacteria[J]. Annual Review of Biochemistry,2004,73:241-268.
[20]Fernandez-Rojas M A,Vaca S,Reyes-Lopez M A,et al. Outer membrane vesicles of Pasteurella multocida contain virulence factors[J]. MicrobiologyOpen,2014,3(5):711-717.唐伟,朱治任,汪财生,等. 基于COⅠ基因的DNA条形码在鳖科动物鉴定上的应用[J]. 江苏农业科学,2017,45(6):30-36.
doi:10.15889/j.issn.1002-1302.2017.06.006

