神经生长抑制因子Nogo—A在大鼠脑梗死后功能恢复中的作用机制
玛依拉·吐尔逊+阿加尔·木合大+萨努巴儿·买买提+吐尔逊·沙比尔


[摘要] 目的 探討大鼠脑梗死后功能恢复过程中神经生长抑制因子Nogo-A的表达水平。 方法 选取雄性SD大鼠60只,采用随机数字表法分为对照组和模型组,每组各30只。模型组制备MCAO模型,对照组行假手术处理,各组于术后第3、7、28天三个时间点随机取10只进行检测,原位杂交法和Western blot法检测Nogo-A mRNA和蛋白表达,采用Longa评分标准对神经功能评分,HE染色观察分析神经元形态。 结果 模型组术后Nogo-A mRNA和蛋白表达明显高于对照组(P < 0.05);模型组术后第7天Nogo-A mRNA和蛋白表达量明显高于术后第3、28天(P < 0.05),而术后第28天明显低于术后第3天(P < 0.05);HE染色显示,对照组神经元形态正常,模型组神经元形态异常,其中模型组第7天细胞形态、梗死状况及周围炎性反应较第3、28天重;模型组术后神经功能评分明显高于对照组(P < 0.05);模型组术后第28天神经功能评分明显低于术后第3、7天(P < 0.05)。 结论 大鼠脑梗死后Nogo-A表达明显升高,可能与损伤后神经再生障碍有关。
[关键词] 脑梗死;Nogo-A;MCAO模型;大鼠
[中图分类号] R743.3 [文献标识码] A [文章编号] 1673-7210(2017)03(b)-0016-04
Action mechanism of neuronal inhibitory factor Nogo-A on rats in functional recovery after cerebral infarction
Mayila·Tuerxun1 Ajiaer·Muheda1 Sanubaer·Maimaiti2 Tuerxun·Shabier1
1.Department of Neurology, the First Affiliated Hospital of Xinjiang Medical University, Xinjiang Uygur Autonomous Region, Urumqi 830054, China; 2.Department of Neurology, the Fifth Affiliated Hospital of Xinjiang Medical University, Xinjiang Uygur Autonomous Region, Urumqi 830011, China
[Abstract] Objective To discuss Nogo-A expression of nerve growth inhibitor in cerebral infarction rats during functional recovery. Methods 60 male SD rats were randomly divided into two groups: control group and model group by random number table method, 30 rats in each group. The model group were prepared with MCAO model, and the control group were treated with sham operation. 10 rats were randomly chosen to tested from each group in postoperative 3, 7, 28 d. Neuronal morphology was observed by using HE staining, and the Nogo-A mRNA and protein expression were tested in situ hybridization and Western blot method, Longa score standard were used to scored nerve function. Results Nogo-A mRNA and protein expression in model group was significantly higher than that in control group (P < 0.05). Nogo-A mRNA and protein expression in postoperative 7 d of model group were significantly higher than that in postoperative 3, 28 d (P < 0.05). Nogo-A mRNA and protein expression in postoperative 28 d were significantly lower than that in postoperative 3 d (P < 0.05). HE staining showed normal morphology of neurons in control group and abnormal morphology of neurons in model group, and the cell morphology, myocardial infarction and peripheral inflammatory response in model group of 7 days were more serious than 3, 28 d. The neurological function scores in model group was significantly higher than that in control group (P < 0.05). The neurological function score in postoperative 28 d was significantly lower than that in postoperative 3, 7 d (P < 0.05). Conclusion Nogo-A expression significantly increase in cerebral infarction in rats, which may be related to the nerve regeneration disorders after injury.
[Key words] Cerebral infarction; Nogo-A; MCAO model; Rat
脑梗死是一种由多因素作用引起的脑部缺血、缺氧进而诱发的局限性脑组织缺血性坏死或软化疾病。本病存在明显高危特征,具有极高致死和致残率,严重威胁人类安全[1-3]。脑梗死发病后患者神经系统存在明显损伤,并且介入治疗后恢复难度也较大,其原因可能为:①患者中枢神经系统内在特性损伤,缺乏再生能力;②中枢神经系统内某些物质抑制而出现再生功能损伤[4]。目前,临床认为第二种因素是脑梗死神经系统损伤的主要原因,并且认为神经生长抑制因子Nogo-A在其中扮演着重要角色[5]。本研究选取雄性SD大鼠30只进行MCAO造模研究,旨在分析神经生长抑制因子Nogo-A在脑梗死中的作用机制。
1 材料与方法
1.1 材料与分组
选取雄性清洁级SD大鼠60只,体重(300±20)g,6~8周龄,大鼠购自于新疆医科大学(动物合格证号编号XJYKDX-20151211007)。采用随机数字表法分为对照组和模型组,每组各30只,各组于术后第3、7、28天三个时间点各取10只进行取材。实验过程中动物饲养及取材均遵守实验动物管理和保护的有关规定并得到新疆医科大学动物实验中心的批准。
完全蛋白酶抑制剂由Sigma公司生产(Sigma-P-4265);Nogo-A兔多克隆抗体由武汉博士德公司生产(BSD-1502);Western免疫印迹化学发光试剂盒由北京科美生物技术有限公司生产。荧光倒置显微镜由日本Olympus公司生产;FACSAria流失细胞仪由美国BD公司生产;凝胶图像分析仪由日本Kodak公司生产。
1.2 实验方法
1.2.1 模型制备 模型组MCAO模型制备方法如下:给予大鼠腹腔麻醉后,颈部备皮,消毒,纵切口暴露颈动脉,结扎颈外动脉、颈总动脉,动脉夹钳夹颈内动脉。于颈总动脉做0.5 mm切口,将肝素消毒尼龙线置入颈总动脉切口内,并插入至颈内动脉10 mm,阻断大鼠大脑动脉,结扎颈总动脉线,缝合皮肤。对照组单纯纵切口暴露颈动脉,然后缝合,行假手术;模型组腦组织的TTC染色见图1(染色成功即代表造模成功)。
1.2.2 原位杂交实验 术后24 h处死大鼠,开颅取出梗死脑组织,固定切片,滴入15 g/L聚乙烯吡咯烷+15 g/L葡聚糖+0.05 mmol/L氯化钠+450 g/L甲酰胺+80 g/L硫酸葡聚糖进行预杂交,振荡均匀后于室温环境下孵化2 h,滴入1.5 mol/L地高辛标记Nogo-A,同时加入0.05 mg/L蛋白酶K+0.8 mmol/L EDTA进行杂交,振荡均匀后,室温下孵化60 min,而后选用高辛显色,脱水,中性树胶封片,同时进行相同原点杂交操作。
1.2.3 Nogo-A蛋白检测 将梗死脑组织切碎后置入玻璃管内研碎,悬液3000 r/min离心,取上清,加入上样缓冲液,煮沸,5000 r/min,3 cm半径离心10 min,取上清,置入SDS-聚丙烯酞胺凝胶孔内,常规电泳,而后将样本放置于PVDF膜上,封闭60 min,加入10 mL 0.5% Nogo-A兔多克隆体进行一抗,孵化1 h,室温摇床50 r/min,TBST洗膜2次,每次10 min,加入0.5%封闭稀释液二抗,孵化1 h,室温摇床50 r/min,TBST洗膜2次,每次10 min,化学发光法显示,选用去离子水漂洗纤维膜,滤纸吸干,将膜贴于发光液上,孵化2min后送入X-光片盒内,于暗室内X线片显影,检测仪器选用KONTROMBAS 2.0全自动图像分析仪。
1.2.4 HE染色 梗死脑组织切片后进行常规包埋,5 μm切片,置于pH 6.0的柠檬酸抗原中修复,洗涤2次,加入50 μL 5%过氧化氢孵化30 min,滴入50 μL羊血清封闭20 min,加入50 μL Nogo-A兔多克隆体(1∶500)进行一抗,4℃冷藏过夜,取出待其正常回温后洗涤2次,滴入50 μL兔多克隆抗NgR抗体进行二抗,室温下孵化40 min,洗涤2次,吸取周围水分,滴入30 μL辣根酶标记卵霉链白素,室温孵化30 min,洗涤2次,吸取水分,BAD显色,苏木素复染,梯度酒精脱水,中性树脂封片,镜检。对切片反应产物阳性信号进行检测,即根据检测区域的灰度级、面积以及阳性反应产物灰度级、面积计算阳性单位值(PU)。
1.2.5 神经功能评定 根据Longa评分标准进行[6]:大鼠苏醒1 h后,无神经损伤0分;侧肢弯曲、内收或伴霍纳征为1分;行走向对侧画圈为2分;行走向对侧倾倒为3分;无法行走或伴意识障碍为4分。
1.3 统计学方法
采用SPSS 19.0统计软件对数据进行分析和处理,计量资料以均数±标准差(x±s)表示,采用t检验,以P < 0.05为差异有统计学意义。
2 结果
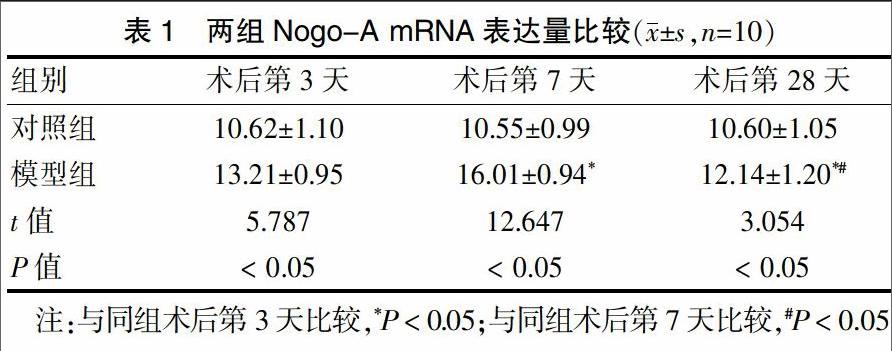
2.1 两组Nogo-A mRNA表达量比较
模型组术后第3、7、28天Nogo-A mRNA表达量明显高于对照组(P < 0.05);模型组术后第7天Nogo-A mRNA表达量明显高于术后第3、28天(P < 0.05),而术后第28天明显低于术后第3天(P < 0.05)。见表1。
2.2 两组Nogo-A蛋白表达量比较
模型组术后Nogo-A蛋白表达量明显高于对照组(P < 0.05);模型组术后第7天Nogo-A蛋白表达量明显高于术后第3、28天(P < 0.05),而术后第28天明显低于术后第3天(P < 0.05)。见表2、图2。
2.3 HE染色图像分析
HE染色显示,对照组神经元形态正常,核仁清晰,神经细胞数量多且排列整齐。模型组神经元体积明显减小,形态呈多角形或扇形,其中模型组第7天细胞形态和梗死状况及周围炎性反应较第3、28天重。见图3。
2.4 两组神经功能评分比较
模型組术后第3、7、28天神经功能评分明显高于对照组(P < 0.05);模型组术后第28天神经功能评分明显低于术后第3、7天(P < 0.05)。见表3。
3 讨论
脑梗死发病后,患者病灶区域脑组织神经细胞微环境存在明显改变,大量的促突触再生相关神经营养因子,以及轴突再生相关抑制因子被合成,参与患者中枢神经损伤的发生、发展[7-8]。临床研究认为,如无法解除这些相关神经细胞因子异常表达情况,中枢神经系统的再生功能将无法恢复至正常水平[9]。
神经生长抑制因子Nogo-A是目前发现的最具有代表性的神经纤维再生抑制因子[10-11]。Nogo-A属于网状蛋白质家族,主要分布于中枢神经系统少突胶质细胞内,可与高尔基体及内质网相互作用[12]。Nogo-A具有188个氨基羧基末端,并且66个氨基酸残基构成了Nogo-66。Nogo-66位于Nogo-A细胞表面,其对神经元具有特异性作用,可抑制神经轴突生长[13]。脑梗死发病后,患者梗阻区域内的Nogo-A可与其受体NgR相互作用,并激活RhoA信号路径,促进这一区域内的生长锥萎缩,进而抑制神经再生[14-15]。
NgR作为Nogo-A的受体,是一种糖基脂酰肌醇(GPI)结合细胞表面蛋白,主要分布于灰质、脑桥以及海马等区域,其可与Nogo-A细胞表面的GPI偶联蛋白相互作用,并介导Nogo-66的神经轴突生长抑制效应[16-17]。本次研究中,模型组术后Nogo-A mRNA和蛋白表达明显高于对照组;模型组术后第7天Nogo-A mRNA和蛋白表达量为16.01±0.94和4.27±0.95,明显高于术后第3、28天,而术后第28天为12.14±1.20和1.05±0.73,明显低于术后第3天,提示MCAO造模后大鼠存在明显的脑梗死症状,其脑神经功能损伤明显。分析大鼠造模术后Nogo-A mRNA和蛋白表达量第7天高于第3、28天及第28天低于第3天的原因可能与第7天大鼠脑缺血后再灌注损伤及损伤组织代偿应激反应到达峰值有关,并且这种应激反应在第7天后逐步降低,到了第28天应激反应达到最低谷,故大鼠第28天的Nogo-A mRNA和蛋白表达量明显低于第3天。
本次研究中,HE染色显示,对照组神经元形态正常,核仁清晰,神经细胞数量多且排列整齐。模型组神经元肿胀,体积增大,形态呈多角形或扇形,模型组第7天细胞形态和梗死状况,及周围炎性反应较第3、28天重,这也可能与再灌注损伤有关。已有研究证实,危重病性多发性神经病的神经保护作用存在快速相和延迟相两个保护期,快速相即发生于缺血即刻,通常持续1~2 h;延迟相则出现在发病1 d后,并在3~7 d达到高峰[18]。本次研究中,大鼠预计再灌注时间为3 d,此时大鼠脑应激反应最为强烈。因此,对比两组大鼠神经功能评分可知,模型组术后神经功能评分明显高于对照组;并且模型组术后第28天神经功能评分为(1.30±0.84)分,明显低于术后第3、7天。术后第3、7天大鼠神经功能评分相对较高的原因可能与再灌注诱导的缺血耐受机制有关。
有学者[19-20]在大鼠实验中,对大鼠大脑皮质进行了高压氧预处理发现,大鼠大脑皮质内的Nogo-A表达明显降低,该学者分析认为对脑缺血进行预处理后,大鼠神经损伤可显著下降,这将是脑缺血相关疾病治疗的重要研究方向。综上所述,大鼠MCAO脑梗死造模后Nogo-A表达明显升高,大鼠神经功能评分显著下降,其机制可能与Nogo-A介导Nogo-66的神经轴突生长抑制效应,导致脑组织神经再生障碍有关。
[参考文献]
[1] 郭立军,景宏菲,曹阳,等.双重抗血小板治疗对急性脑梗死合并脑微出血患者的影响[J].中国医药导报,2016, 13(11):68-71.
[2] Lynch AM,Cleveland M,Prinjha R,et al. Non-clinical development of ozanezumab:a humanised antibody targeting the amino terminus of neurite outgrowth inhibitor A(Nogo-A) [J]. Toxicol Res,2015,4(5):1333-1343.
[3] 周娜,赵雅宁,李建民.参芎化瘀胶囊对全脑缺血大鼠海马区Notch1/GAP-43表达的影响[J].中国医药导报,2015, 12(23):8-11.
[4] Guzik-Kornacka A,van der Bourg A,Vajda F,et al. Nogo-A deletion increases the plasticity of the optokinetic response and changes retinal projection organization in the adult mouse visual system [J]. Brain Struct Funct,2016, 221(1):317-329.
[5] Anderson DM,Cannavino J,Li H,et al. Severe muscle wasting and denervation in mice lacking the RNA-binding protein ZFP106 [J]. Proceed Nat Acad Sci,2016,113(31):4494-4503.
[6] 朱士光,杨荣礼,耿德勤,等.局灶性脑缺血大鼠Z-Longa评分的MRI研究[J].国际老年医学杂志,2012,33(5):199-201.
[7] Liu GM,Luo YG,Li J,et al. Knockdown of Nogo gene by short hairpin RNA interference promotes functional recovery of spinal cord injury in a rat model [J]. Mol Med Rep,2016,13(5):4431-4436.
[8] 程曼,张瑜,姚源蓉.血脂變量与脑梗死复发及颅内血管狭窄程度的相关性[J].中华老年心脑血管病杂志,2016, 18(3):243-246.
[9] 钱芳,朱榆红,李燕,等.缺血后适应对大鼠缺血再灌注损伤时Bcl-2及GAP-43表达变化的影响[J].昆明医科大学学报,2014,35(12):12-17.
[10] Theotokis P,Touloumi O,Lagoudaki R,et al. Nogo receptor complex expression dynamics in the inflammatory foci of central nervous system experimental autoimmune demyelination [J]. J Neuroinflammation,2016,13(1):265-266.
[11] 田甜,车念聪,龙建飞,等.大脑中动脉栓塞大鼠缺血半暗区神经可塑性蛋白及神经因子的表达[J].中国神经精神疾病杂志,2015,41(1):15-19.
[12] Thiede-Stan NK,Tews B,Albrecht D,et al. Tetraspanin-3 is an organizer of the multi-subunit Nogo-A signaling complex [J]. J Cell Sci,2015,128(19):3583-3596.
[13] Yazdi IK,Taghipour N,Hmaidan S,et al. Antibody-mediated inhibition of Nogo-A signaling promotes neurite growth in PC-12 cells [J]. J Tissue Eng,2016,7:2041731416 629767.
[14] Yu J,Luan X,Lan S,et al. Fasudil,a Rho-associated protein kinase inhibitor,attenuates traumatic retinal nerve injury in rabbits [J]. J Mol Neurosci,2016,58(1):74-82.
[15] 陈吉祥,林浴坤,吴羽楠,等.电针对脑缺血再灌注大鼠学习记忆功能及海马组织Nogo-A/NgR表达的影响[J].中国康复医学杂志,2015,30(3):219-223.
[16] 王杰华,李国前.脂肪干细胞移植抑制脑缺血大鼠梗死灶周围组织Nogo-A的表达[J].细胞与分子免疫学杂志,2016,32(1):39-43.
[17] 张士发,周燕,张开京,等.沉默Nogo-66受体的表达对宫内感染所致早产大鼠脑损伤的神经保护作用[J].中国当代儿科杂志,2016,18(10):1035-1043.
[18] Ruschel J,Hellal F,Flynn KC,et al. Systemic administration of epothilone B promotes axon regeneration after spinal cord injury [J]. Science,2015,348(6232):347-352.
[19] Li C,Wen H,Wang Q,et al. Exercise training inhibits the Nogo-A/NgR1/Rho-A signals in the cortical peri-infarct area in hypertensive stroke rats [J]. Am J Phys Med Rehabil,2015,94(12):1083-1094.
[20] 惠浩,张磊,苏宁,等.高压氧预处理诱导缺血-再灌注损伤耐受的研究进展[J].中华神经外科疾病研究杂志,2016,15(1):92-94.

