丝网印刷电极的电化学发光生物传感器*
刘 帅, 童朝阳, 刘 冰
(国民核生化灾害防护国家重点实验室,北京 102205)
综述与评论
丝网印刷电极的电化学发光生物传感器*
刘 帅, 童朝阳, 刘 冰
(国民核生化灾害防护国家重点实验室,北京 102205)
对丝网印刷电极及其应用于电化学发光检测的功能化及信号放大修饰进行综述,归纳了该检测体系在抗体、核酸、氧化酶底物、肿瘤细胞、病原菌、抗生素等物质检测中的应用,最后对该领域的发展进行了展望。
丝网印刷电极; 电化学发光生物传感器; 功能化; 信号放大; 应用
0 引 言
电化学发光(electrochemiluminescence,ECL)传感器将电化学与化学发光相结合,具有灵敏度高、检测范围宽、可控性好、响应快速、抗干扰能力强等优势,特别适用于复杂物质的痕量、超痕量检测,近年来在环境分析、生物检测、医疗卫生等领域发展迅速,并已出现成熟的商业化设备。但是传统ECL传感器构架过大,比较笨重,往往只能在实验室、医院等固定环境使用,很难便携应用到野外环境;且使用前后需要仔细清洗,不仅消耗大量时间和试剂,也可能因清洗不净给检测带来干扰。
丝网印刷电极(screening printed electrode,SPE)采用丝网印刷技术制备而成,能够简单、快速、高效地批量生产,电极重现性强且成本很低。SPE可作为微型反应池使用,能够促进ECL传感器的小型化改进,为野外现场环境监测、生化战剂检测等创造了良好条件。同时由于成本较低,电极可一次性使用,能够避免传统ECL反应池因清洗不净产生的背景干扰。基于丝网印刷电极的电化学发光传感器(SPE-ECL传感器)具有种种优势,在发展微型化、集成化、智能化的原位检测设备方面拥有广阔的应用前景,成为近年来ECL传感器研究的热点,本文主要在相关方面进展进行阐述。
1 丝网印刷电极材料、基底及结构体系
1.1 SPE材料
SPE一般由工作电极、对电极、参比电极和导电轨组成。其中,工作电极主要分为碳电极和金属电极。碳电极是应用最广泛的工作电极,印刷油墨为碳浆,由石墨粉和一些疏水性的粘合剂组成,具有材料廉价、制作简单等优势。金属电极最常用的原料是金膏。金电极具有极强的导电性和稳定的化学性质,更重要的是,强大的金硫键作用使得电极表面极容易形成自组装层,有利于含硫物质的固定和其生物活性的保留,这些优势可大幅提高检测灵敏度和操作便捷性,只是较高的成本对其应用有所限制,此外Pt,Ag,Au-Pt合金等金属电极也有使用。对电极的材料一般和工作电极一致。参比电极主要采用Ag/AgCl混合油墨制备,导电轨的材料为银浆,银是SPE制备中除碳以外最常用的材料。
1.2 SPE基底
SPE基底拥有大量可选择材质,最普遍使用的是塑料和陶瓷,它们来源广泛、成本低廉、疏水且惰性、适用范围广。此外,一些常见的柔性基底材料如纸张和布匹也有使用,它们赋予了SPE一些新颖设计。
1) 陶瓷
陶瓷是典型的硬性材质,具有耐磨、耐高温、耐腐蚀特性,尤其适用作金属电极的基底。但是陶瓷硬度过大而韧性较差,与电子设备的兼容性往往有所不足。
2)塑料
塑料质地轻、耐酸碱、价格极低,相比于陶瓷耐温性能差,但具有更好的韧性。常用塑料类型有PVC(聚氯乙烯)、PET(聚对苯二甲酸乙二醇脂)、PC(聚碳酸酯)等。
3)纸张
以纸张作为电极基底的思路来源于Whitesides等人设计的微流纸基分析设备[1~3]。纸基电极以三维折叠结构最为巧妙,将三电极分别印刷于两面经过疏水处理的纸张,使用时将纸张对叠即可形成完整的三电极电化学小室。三维折叠纸基电极具有价格低廉、制备简单、便于携带、易于操作等特点,常应用到ECL传感器中[4~6]。
4)布匹
受纸基电极的启发,也有学者将布基电极应用于ECL检测[7]。布基电极与纸基电极类似,具有便于制备、材料广泛、环境友好等优势。甚至有学者[8]将SPE印到衣物上,通过与皮肤接触监测血压、心率等体征,利用传感设备远程监测病人病情,可对潜在的中风和糖尿病病情变化进行预警,是极具实用性的创新。
1.3 SPE结构体系
应用于ECL传感器的SPE一般均采用三电极系统。从构造上看,三电极系统根据工作电极数目的不同,可以分为单通路体系和多通路体系。另外还有一种特殊的三电极体系:双极性电极(bipolar electrode,BPE)体系。
1)单通路三电极体系
单通路三电极体系是SPE最常用的结构体系,由1个工作电极、1个参比电极和1个对电极组成。
2)多通路三电极体系
多通路体系拥有2个或更多工作电极。对每个工作电极施加不同电势进行ECL反应,可用于测量样品中的多种物质,而无需更换电极。
3)双极性电极体系
BPE体系比较新颖,2001年首次引入ECL检测技术[9]。BPE由2个驱动电极和1个工作电极组成。驱动电极连接电源,工作电极浸入中间溶液池,与外电源分隔,靠近阳极驱动电极的一侧起着阴极的作用,另一侧相反,因此同一块工作电极具有阴阳两极属性。溶液池尺寸足够小而阻抗极大,以至于BPE两端的实际电压与其长度呈线性关系。当电压足够大时,BPE两极同时发生氧化还原过程,从而根据产生的ECL反应进行测量。目前已有多名学者运用BPE进行ECL检测[10,11],未来具有非常广阔的发展空间。
2 SPE-ECL传感器的电极功能化修饰及信号放大修饰
2.1 基于SPE-ECL传感器的电极功能化修饰
SPE可作为多种ECL传感器的芯片,其功能化修饰决定了传感器的特异性和灵敏度。常见SPE-ECL传感器的功能分子有酶、抗体、适配体、分子印迹聚合物(molecularly imprinted polymers,MIPs)等,根据其特性选择相应的功能化方法。
1)氧化酶:作为ECL酶传感器的功能分子,氧化酶的固定通常采用包埋法,用聚合物将其包裹覆盖到电极表面,通过聚合物孔隙与底物接触并反应。常用的包埋物有聚丙烯酰胺、聚丙烯醇、壳聚糖、全氟磺酸膜(Nafion膜)等。
2)抗体:抗体功能化方法较多,主要有戊二醛交联法、EDC-NHS法、自组装法、生物素—亲和素法等。其中自组装法和生物素—亲和素法应用较广,前者主要用于金电极或者金纳米材料修饰电极,利用金硫键作用将抗体吸附在电极表面,其优点是简单直接,能够有效保留抗体生物活性;后者主要通过亲合素的“桥梁”作用,将生物素化抗体固定在SPE表面。1个亲和素分子能够结合4个生物素分子,可有效增加抗体固载量,提高传感灵敏度。
3)适配体:适配体容易进行巯基化、氨基化和生物素化修饰,因此常用自组装法、EDC-NHS法和生物素—亲和素法固定,处理流程与抗体类似。适配体可以和靶分子特异性、高强度结合,在不同检测模式的ECL传感器中得到了广泛应用[12~14]。
4)分子印迹聚合物:MIPs利用分子印迹技术制备而成,具有特异性识别功能,可作为捕获探针构建新型的分子印迹传感器,这是ECL检测领域的全新方向[15]。MIPs通常在电极表面通过电聚合、光聚合、溶胶—凝胶法等直接合成。比较新颖的方法是合成磁性MIPs,利用磁力作用吸附在电极表面[16],检测完成后将其洗去,电极可重复利用多次。
2.2 基于SPE-ECL传感器的电极信号放大修饰
为提高传感器的检测灵敏度,除基本的功能化修饰外,采用纳米材料对电极进行信号放大是最有效的方法。一方面纳米材料巨大的比表面积可以大幅提高ECL标签的富集密度;另一方面其独特的表面效应、宏观量子隧道效应、介电限域效应等使其具有不同寻常的电、热、光、磁特性,能够有效提高电极性能。常用于SPE修饰的纳米材料有:
1)石墨烯
石墨烯是碳的二维同素异形体,是由单原子层组成的稳定正六边形结构,具有极其出色的光电特性[17~19]。作为新世纪的明星分子,石墨烯不仅常用作信号放大材料[4,5],同时也能够制备出量子点作为ECL标签使用[20]。
2)碳纳米管
碳纳米管拥有巨大的比表面积、优秀的导电性能和独特的管状结构,逐渐成为ECL信号放大的基础材料。碳纳米管便于装载其它纳米粒子组成复合材料[21],常掺杂在Nafion等聚合物膜中对电极修饰[22],能够有效提高传感灵敏度。
3)金属纳米材料
Au纳米粒子制备成熟,尺寸可控,物化性质长期稳定,具有极好的导电性和生物相容性,对部分ECL反应还有催化功能[23]。同时Au修饰电极表面适用自组装方法,可简化含硫功能分子的固定,并有效保留生物活性。这些优势使它成为电极修饰中最常用的纳米粒子。其它金属如Pt,Pd,Ag纳米粒子应用相对较少,但也有良好的增敏作用[21,24,25]。
除颗粒形态外,一类纳米多孔材料应用越加广泛,其主要特点是:孔隙分布均匀,连续性结构使它们更容易在电极固定;相互关联的中空通道有利于大规模的电子运输,提高电极的导电性能;巨大的比表面积和一定的孔容积,使其具有强吸附性和固载能力。纳米多孔金(nanoporous gold,NPG)、纳米多孔银(nanoporous silver,NPS)作为多孔金属材料的典型代表,近年来在ECL检测中受到很多学者的青睐[5,6]。
4)金属氧化物纳米材料
金属氧化物中比较常用的纳米材料有TiO2和ZnO,两者均为半导体材料。TiO2粘附力强,物化性质稳定,主要以纳米粒子[26]和纳米管阵列[27]两种形态修饰电极。其中,TiO2纳米管阵列是经特殊处理形成的中空纳米尺度材料,具有大表面积和空隙容积,以及垂直于基底表面的规则阵列,可有效增强检测信号。
ZnO纳米粒子是球状透明材料,具有良好的生物相容性和电化学性能。作为第二副族和氧族元素的化合物,ZnO和CdS,CdSe等量子点类ECL标签具有相似的结构组成,常和纳米修饰材料或量子点组成复合物,用以提高ECL检测效果[12,22]。
5)非金属氧化物纳米材料(SiO2)
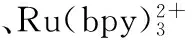
3 SPE-ECL传感器在生物检测中的应用
电极完成功能化和信号放大修饰后,即可进行检测。常见检测包括蛋白质、核酸、氧化酶底物、肿瘤细胞、病原菌、抗生素等,如表1所示。
3.1 蛋白质
1)抗体
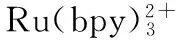
2)肿瘤标志物
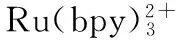
3.2 核 酸
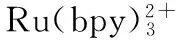
3.3 氧化酶底物
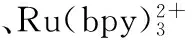
3.4 细胞与细胞生物体
1)肿瘤细胞
肿瘤患者除利用各种标志物表征病情外,还可直接用细胞数进行衡量。Yu课题组以碳量子点包被的ZnO毫微球作为ECL标签,用NPG修饰电极,依靠形成的适配体—K562细胞—ECL标签的夹心结构,对白血病细胞K562的检测范围达到1.0×102~2.0×107cell/mL,检出限为46 cell/mL,具有很高的临床应用价值[12]。
2)病原菌
Anna-Maria等人[41]使用丝网印刷金电极阵列对土拉热弗朗西丝菌进行ECL检测,分别采用全抗体和Fab抗体片段作为捕获探针,检测限相应为70,45 cell/mL。除此以外,也可通过检测细菌源DNA进行间接定量。他们[42]利用三核酸夹心结构,同时检测炭疽芽孢杆菌、马尔他布鲁杆菌、土拉热弗朗西丝菌、鼻疽伯克霍尔德菌、伯内特考克斯体、苏云金芽孢杆菌6种病原菌,检测限分别为1.2,1.0,0.8,0.8,0.6,0.8 nmol/L。
3.5 抗生素
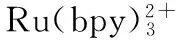
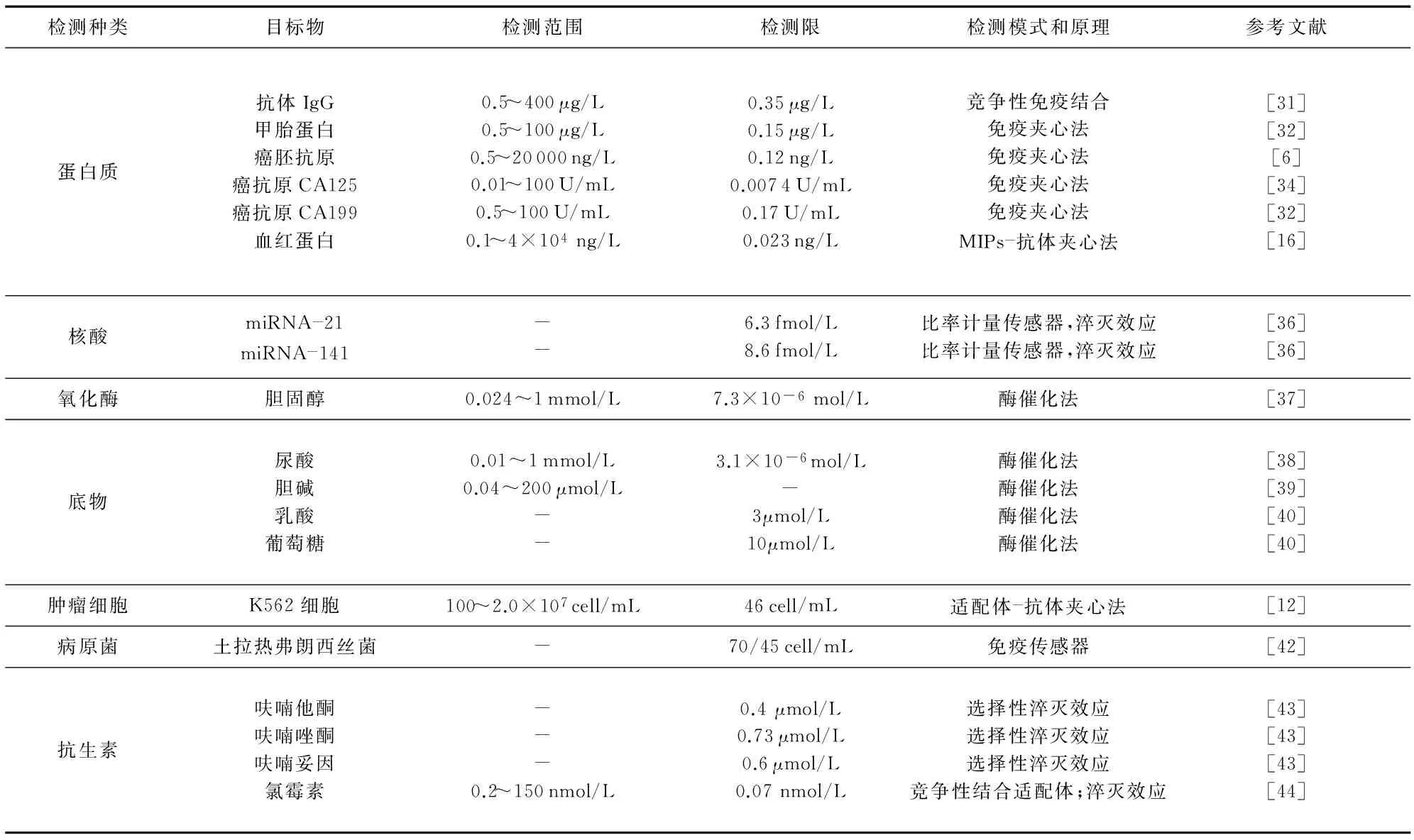
表1 基于丝网印刷电极的电化学发光传感器在生物检测中的应用
4 结 论
SPE-ECL传感器具有小型化优势,可便携至野外进行原位测量;电极可一次性使用,避免检测前后的清洗工作,操作便捷且没有因清洗不净带来的干扰。同时还具有传统ECL传感器的灵敏度高、重现性和可控性好、分析速度快等优势,具有广阔的发展前景。目前,SPE-ECL分析技术已成功检测抗体、肿瘤标志物、核酸、氧化酶底物、肿瘤细胞、病原菌、抗生素等物质,极低的检测限和宽检测范围展示了该传感系统巨大的应用价值和发展空间。但是,目前整个系统的理论研究还不够深入,电极的信号放大修饰方案不够系统化。从近期来看,应当着眼于信号放大材料的选择与组合,针对待测物的性质,逐步完善ECL增敏的电极修饰方案,结合不同功能材料和ECL标签的检测效果,筛选建立最适合的检测模式和流程。从长远来看,ECL反应的细致机理及精确的动力学过程还需深入探究,ECL标签和信号放大材料仍可进一步发现和筛选。未来应当结合材料学和表面物理学等相关学科建立改善电极性能的操作方法,使检测效果更加精细和可控,推动SPE-ECL传感器向着微型化、集成化、智能化的方向快速发展。
[1] Martinez A W,Phillips S T,Whitesides G M,et al.Patterned paper as a platform for inexpensive,low-volume,portable bioassay-s[J].Angew Chem Int’l Ed,2007,46:1318-1320.
[2] Martinez A W,Phillips S T,Whitesides G M.Diagnostics for the developing world:Microfluidic paper-based analytical devices[J].Analytical Chemistry,2010,82(1):3-10.
[3] Whitesides G M.What comes next[J].Lab on a Chip,2011,11:191-193.
[4] Yan Jixian,Yan Mei,Yu Jinghua,et al.An origami electrochemiluminescence immunosensor based on gold/graphene for specific,sensitive point-of-care testing of arcinoembryonic antigen[J].Sensors and Actuators B,2014,193:247-254.
[5] Li Li,Li Weiping,Yu Jinghua,et al.Paper-based electrochemiluminescence immunodevice for carcinoembryonic antigen using nanoporous gold-chitosan hybrids and graphene quantum dots functionalized Au@Pt[J].Sensors and Actuators B,2014,202:314-322.
[6] Li Weiping,Li Long,Yu Jinghua,et al.3D origami electrochemiluminescence immunodevice based on porous silver-paper electrode and nanoporous silver double-assisted signal amplification[J].Sensors and Actuators B:Chemical,2013,188:417-424.
[7] Guan Wenrong,Liu Min,Zhang Chunsun.Electrochemiluminescence detection in microfluidic cloth-based analytical devices[J].Biosensors and Bioelectronics,2016,75:247-253.
[8] Chuang M C,Lou S L,Wang J.Thick-film textile-based amperometric sensors and biosensors[J].The Analyst,2010,135(6):1230-1234.
[9] Arora A,Eijkel J C T,Morf W E,et al.A wireless electrochemiluminescence detector applied to direct and indirect detection for electrophoresis on a micro-fabricated glass device[J].Anal Chem,2001,73:3282-3288.
[10] Liu Rui,Liu Min,Zhang Chunsun.Open bipolar electrode-electrochemiluminescence imaging sensing using paper-based microflui-dics[J].Sensors and Actuators B,2015,216:255-262.
[11] Chen Lu,Zhang Chunsun,Xing Da.Paper-based bipolar electrode-electrochemiluminescence(BPE-ECL)device with battery energy supply and smartphone read-out:A handheld ECL system for biochemical analysis at the point-of-care level[J].Sensors and Actuators B,2016,237:308-317.
[12] Zhang Meng,Liu Heng,Yu Jinghua,et al.A disposable electrochemiluminescence device for ultrasensitive monitoring of K562 leukemia cells based on aptamers and ZnO@carbon quantum dot-s[J].Biosensors and Bioelectronics,2013,49:79-85.
[13] Zhu D B,Zhou X M,Xing D.Ultrasensitive aptamer-based bio bar code immunomagnetic separation and electrochemiluminescence method for the detection of protein[J].Analytica Chimica Acta,2012,725:39-43.
[14] Bin Na,Li Weili,Yin Xuehua,et al.Electrochemiluminescence aptasensor of TiO2/CdS:Mn hybrids for ultrasensitive detection of cytochrome c[J].Talanta,2016,160:570-576.
[15] 杨钰昆,王小敏,方国臻,等.基于分子印迹技术的电化学发光分析[J].化学进展,2016,28(9) :1351-1362.
[16] Zhou Jing,Gan Ning,Li Tianhua,et al.A single antibody sandwich electrochemiluminescence immunosensor based on protein magne-tic molecularly imprinted polymers mimicking capture probes[J].Sensors and Actuators B,2013,186:300-307.
[17] Li X S,Zhu Y W,Cai W W,et al.Transfer of large-area grapheme films for high-performance transparent conductive electrode[J].Nano Lett,2009,9(12):4359-4363.
[18] Bolotin K I,Sikes K J,Jiang J,et al.Ultrahigh electron mobility in suspended grapheme[J].Solid State Commun,2008,146(9-10):351-355.
[19] Morozov S V,Novoselov K S,Katsnelson M I,et al.Giant intrinsic carrier mobilities in grapheme and its bilayer[J].Phys Rev Lett,2008,100(1):601-602.
[20] Xu Yuanhong,Lou Baohua,Wang Erkang,et al.Paper-based solid-state electrochemiluminescence sensor using poly(sodium 4-styrenesulfonate)functionalized graphene/nafion composite film[J].Analytica Chimica Acta,2013,763:20-27.
[21] Behzad Haghighi,Somayyeh Bozorgzadeh.Enhanced electrochemiluminescence from luminol at multi-walled carbon nanotubes de-corated with palladium nanoparticles:A novel route for the fabrication of an oxygen sensor and a glucose biosensor[J].Analytica Chimica Acta,2011,697:90-97.
[22] Behzad Haghighi,Somayyeh Bozorgzadeh.Fabrication of a highly sensitive electrochemiluminescence lactate biosensor using ZnO nanoparticles decorated multiwalled carbon nanotubes[J].Talanta,2011,85:2189-2193.
[23] Cui H,Xu Y,Zhang Z F.Muti-channel electrochemiluminescence of luminol in neutral and alkaline aqueous solutions on a gold nanoparticles self-assembled electrode[J].Anal Chem,2014,76:4002-4010.
[24] He Ying,Chai Yaqin,Yuan Ruo,et al.An ultrasensitive electrochemiluminescence immunoassay based on supersandwich DNA structure amplification with histidine as a co-reactant[J].Biosensors and Bioelectronics,2013,50:294-299.
[25] Li Meng,Wang Yanhu,Yu Jinghua,et al.Graphene functionalized porous Au-paper based electrochemiluminescence device for detection of DNA using luminescent silver nanoparticles coated calcium carbonate/carboxymethyl chitosan hybrid microspheres as label-s[J].Biosensors and Bioelectronics,2014,59:307-313.
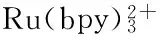
[27] Song Y Y,Zhuang Q L,Li C Y,et al.CdS nanocrystals functiona-lized TiO2nanotube arrays:Novel electrochemiluminescence platforms for ultrasensitive immunosensors[J].Electrochem Commun,2012,16(1):44-48.
[28] Qian K J,Zhang L,Yang M L,et al.Preparation of luminol-doped nanoparticle and its application in DNA hybridization analysi-s[J].Chinese Journal of Chemistry,2004,22(7):702-707.
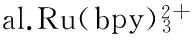
[30] Liu Weiyan,Ma Chao,Yang Hongmei,et al.Electrochemilumine-scence immunoassay using a paper electrode incorporating porous silver and modified with mesoporous silica nanoparticles functio-nalized with blue-luminescent carbon dots[J].Microchim Acta,2014,181:1415-1422.
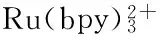
[32] Ge Lei,Yan Jixian,Yu Jinghua,et al.Three-dimensional paper-based electrochemiluminescence immunodevice for multiplexed measurement of biomarkers and point-of-care testing[J].Biomaterials,2012,33:1024-1031.
[33] Li Weiping,Li Meng,Yu Jinghua,et al.Battery-triggered ultrasensitive electrochemiluminescence detection on microfluidic paper-based immunodevice based on dual-signal amplification strateg-y[J].Analytica Chimica Acta,2013,767:66-74.
[34] Wang Shaowei,Ge Lei,Yu Jinghua,et al.3D microfluidic origami electrochemiluminescence immunodevice for sensitive point-of-care testing of carcinoma antigen 125[J].Sensors and Actuators B,2013,176:1-8.
[35] Li Long,Zhang Yan,Yu Jinghua,et al.Ultrasensitive electrochemiluminescence immunoassay for tumor marker based on quantum dots coated carbon nanospheres[J].Journal of Luminescence,2013,144:6-12.
[36] Feng Xiaobin,Gan Ning,Li Tianhua,et al.Ratiometric biosensor array for multiplexed detection of microRNAs based on electrochemiluminescence coupled with cyclic voltammetry[J].Biosensors and Bioelectronics,2016,75:308-314.
[37] Ballesta-Claver J,Salinas Velázquez P,Capitán-Vallvey L F,et al.SPE biosensor for cholesterol in serum samples based on electrochemiluminescent luminol copolymer[J].Talanta,2011,86:178-185.
[38] Ballesta-Claver J,Rodríguez-Gómez R,Capitán-Vallvey L F.Disposable biosensor based on cathodic electrochemiluminescence of tris(2,2-bipyridine)ruthenium(II)for uric acid determina-tion[J].Analytica Chimica Acta,2013,770:153-160.
[39] Leca B D,Verdier A M,Blum L J.Screen-printed electrodes as disposable or reusable optical devices for luminol electrochemiluminescence[J].Sensors and Actuators B,2001,74:190-193.
[40] Corgier B P,Marquette C A,Blum L J.Screen-printed electrode microarray for electrochemiluminescent measurements[J].Analy-tica Chimica Acta,2005,538:1-7.
[41] Spehar-Délèze A M,Gransee R,Dulay S B,et al.Electrochemiluminescence(ECL)immunosensor for detection of Francisella tularensis on screen-printed gold electrode array[J].Anal Bioanal Chem,2016(408):7147-7153.
[42] Spehar-Délèze A M,Dulay S,Julich S,et al.Electrochemiluminescence DNA sensor array for multiplex detection of biowarfare agents[J].Anal Bioanal Chem,2015,407(22):6657-6667.
[43] Narin Taokaenchan,Tanin Tangkuaram,Pusit Pookmanee,et al.Enhanced electrogenerated chemiluminescence of tris(2,2′-bipyridyl)ruthenium(II)system by L-cysteine-capped CdTe quantum dots and its application for the determination of nitrofuran antibio-tics[J].Biosensors and Bioelectronics,2015,66:231-237.
[44] Feng Xiaobin,Gan Ning,Li Tianhua,et al.A novel“dual-potential”electrochemiluminescence aptasensor array using CdS quantum dots and luminol-gold nanoparticles as labels for simultaneous detection of malachite green and chloramphenicol[J].Biosensors and Bioelectronics,2015,74:587-593.
童朝阳(1972-),通讯作者,男,博士,研究员,从事生物传感与生物检测工作,E—mail:billzytong@126.com。
Electrochemiluminescence biosensor based on screening printed electrode*
LIU Shuai, TONG Zhao-yang, LIU Bing
(State Key Laboratory of NBC Protection for Civilian,Beijing 102205,China)
Screening printed electrode and its functionalized and signal amplified modifications for the electrochemiluminescence detection are reviewed,applications of the detection system in antibodies,nucleic acids,oxidase substrates,tumor cells pathogens,antibiotics and so on are generalized,and its future developments are prospected.
screening printed electrode; electrochemiluminescence biosensor; functionalization; signal amplification; application
10.13873/J.1000—9787(2017)05—0001—05
2017—03—06
国家重大科学仪器设备开发专项资助项目(2016YFF0103103)
TP 212
A
1000—9787(2017)05—0001—05
刘 帅(1993-),男,硕士研究生,研究方向为电化学发光传感技术。

