青枯雷尔氏菌拮抗放线菌的筛选及其抗菌活性物质的分离
罗文建,刘雨虹,施河丽,谭 军,王 瑞,赵秀云,向必坤*
青枯雷尔氏菌拮抗放线菌的筛选及其抗菌活性物质的分离
罗文建1,刘雨虹1,施河丽2,谭 军2,王 瑞2,赵秀云1,向必坤2*
(1.华中农业大学农业生命科学技术学院,武汉 430070;2.湖北省烟草公司恩施州公司,湖北恩施 445000)
烟草青枯病是由青枯雷尔氏菌引起的土传性病害。从健康土壤中分离到对青枯雷尔氏菌具有明显拮抗作用的放线菌LC-7,经初步鉴定为链霉菌属(sp.)。链霉菌LC-7的发酵液用氯仿、正丁醇萃取后,通过捷克八溶剂系统分析,判定该抗菌物质为碱性水溶性抗生素。抗菌物质进一步采用离子交换树脂纯化,并经醇沉后,获得抗生素的结晶,再用HPLC进一步纯化后并进行质谱分析可得出,LC-7所产抗菌活性物质为一种新的氨基糖苷类抗生素,其分子量为365.1。田间试验表明,链霉菌LC-7对烟草青枯病具有显著的防治效果,防效为85.48%。
放线菌;青枯雷尔氏菌;氨基糖苷类抗生素;分离纯化
烟草青枯病是细菌性土传性病害,由青枯雷尔氏菌()引起。其寄主及危害范围广泛,造成了巨大的经济损失[1]。筛选有效的生防菌对青枯病进行防治是烟草生产的迫切需要。近年来有许多拮抗细菌如放线菌、芽胞杆菌、假单胞杆菌等被应用到烟田中防治青枯病[2],能有效控制植物病害的放线菌主要是链霉菌属[3]。放线菌一方面通过寄生于植物组织内诱导产生抗生素对致病菌发挥生防作用[4],另一方面可以通过抗生作用[5]、竞争作用、重寄生和捕食作用[6]降低病原菌的致病性和侵染性,从而达到防治的效果。本研究拟从健康烟田土壤中筛选出对青枯病菌具有良好抗性的放线菌,并选取抑菌活性最高的菌株进行鉴定,对其所产生的活性物质进行分离、纯化与鉴定,为开发新型高效绿色生防菌剂及抗生素提供技术和物质支持,以丰富烟草青枯病生物防治的药剂和方法,改善烟草青枯病生防药剂单一的现状。
1 材料与方法
1.1 供试病原菌
烟草青枯雷尔氏菌(),从发病烟草植株上分离,为本实验室保存。
1.2 土壤样品的采集
采集地:湖北恩施州健康烟田。
1.3 放线菌的分离和纯化
1.3.1 土壤放线菌的分离 从恩施州健康烟田中采集烟草根际土壤,称取5 g土样放于含15~20个小玻璃珠无菌三角瓶中,加入45 mL无菌水后室温下振荡20 min,将所得土壤浸液按梯度稀释,最后取100 µL浓度为10-2~10-4的土壤浸液,均匀地涂布于含有50 µg/mL重铬酸钾的高氏一号培养基平板上,28 ℃下培养5 d。挑取平板上的单菌落保存。
1.3.2 目的生防放线菌的筛选 将分离所得的放线菌单菌落点接至PDA平板中央,于28 ℃培养3 d,然后将培养至对数期的青枯雷尔氏菌喷雾至放线菌长好的平板上。28 ℃培养24 h后,观察抑菌圈直径大小。
1.3.3 放线菌的鉴定 对检测到具有显著抗菌活性的一株放线菌LC-7进行16S rRNA和形态鉴定。取其48 h培养液,用常规方法提取放线菌的基因组DNA,以16S rRNA的通用引物进行PCR[7],正向引物:F 5′-AAGGAGGTGATCCAGCCGCA-3′,反向引物:R 5′-AGAGTTTGATCCTGGCTCAG-3′。PCR反应体系为:ddH2O 19 μL,10×PCR缓冲液 2.5 μL,正反引物各1 μL,dNTP 1 μL,Taq酶 0.5 μL。程序为:94 ℃变性2 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸2 min,30个循环;72 ℃延伸8 min。PCR产物纯化后,交上海生工公司测序。
1.3.4 田间试验 2015年在宣恩县椒园镇凉风村开展田间试验。该试验地历年种植烟草,青枯病发生严重,土壤属黄棕壤,肥力中等,地势平坦,光照条件较好,海拔850 m。供试品种为云烟87。
将放线菌LC-7接种到PDA培养基中于28 ℃,180 r/min摇床培养120 h,获得发酵液。试验共设置3个处理:处理1,72%硫酸链霉素稀释1000倍后淋灌烟株,每株烟草灌200 mL;处理2,放线菌LC-7发酵液稀释50倍后淋灌烟株,每株烟苗灌根200 mL;处理3,CK,灌清水200 mL/株。每个处理3个小区,每小区栽60棵烟。各处理在移栽后10、30和50 d进行根部灌淋,移栽后60 d调查各处理青枯病的发病情况,并计算发病率、病情指数、相对防效。烟草青枯病的调查方法参照中华人民共和国国家标准GB/T 3222—2008[8]。
1.4 LC-7抗菌活性物质的分离纯化
1.4.1 发酵液的萃取 使用高氏一号培养基[9]培养放线菌LC-7菌株48 h,过滤去除发酵液中的杂质和菌体。将发酵液分别用氯仿、正丁醇等体积萃取3次,并将萃取相与萃余相分别在50 ℃条件下,旋转蒸干,加纯水溶解,测定其抗菌活性[10]。以青枯雷尔氏菌为检定菌,点样10 µL于直径5 mm滤纸片上,测定抑菌圈直径大小。
1.4.2 捷克八溶剂系统分析 采用Doskochilova溶剂系统[11],层析试验在玻璃试管(0.25 cm×20 cm)中进行,采用上行展层,取正丁醇萃余相,点样量5 μL。待溶剂到达滤纸前沿,取出晾干。用生物学显迹法把层析纸条贴于琼脂平板上,使纸上相应部位的组分扩散渗入到培养基中,将青枯雷尔氏菌均匀喷洒至平板上,于28 ℃培养24 h后,观察结果并测比移值(f),重复3次。
1.4.3 阳离子交换柱层析 732阳离子树脂按照文献[12]的方法转为Na+型装柱。上样样品为正丁醇萃余相。
洗脱:用2~6%氨水梯度洗脱,分段收集洗脱液。将洗脱液50 ℃蒸干,纯水重溶。用滤纸片法检测各段洗脱液的抗菌活性,收集保留具有抗菌活性的组分A。
1.4.4 阴离子交换柱层析 201×4阴离子交换树脂按照文献[12]的方法转为OH–型装柱。上样样品为1.4.3中得到的组分A。将得到的各段洗脱液50 ℃分别真空旋转蒸干,纯水重溶。用滤纸片法检测各段洗脱液的抗菌活性。收集保留具有抗菌活性的组分B。
1.4.5 结晶 将1 mL经过离子交换纯化后的B组分用2 mol/L H2SO4调至pH 8.5(pH值经预试验确定),然后按1:1的体积比加入无水乙醇,振荡混匀后置于4 ℃静置1 h,醇沉,12,000 r/min离心5 min,收集上清液,沉淀分别用95%和75%的乙醇洗涤1次,离心。收集并合并3次离心的上清液,混匀,室温静置15 min,待晶体析出。弃上清,将晶体晾干,加入100 µL纯水重溶。使用滤纸片法验证晶体的活性,以青枯雷尔氏菌为检定菌。
1.5 抗菌活性物质的HPLC纯化和质谱鉴定
1.5.1 高效液相色谱法 采用反相高效液相色谱法对纯化得到的抗生素样品进行分析。采用C18反相柱,检测波长为210 nm,流速为1.0 mL/min,分别用4种不同流动相进行分析:①5%~100%乙腈;②0.02 mol/L三氟醋酸溶液-甲醇(95:5);③0.02 mol/L三氟醋酸溶液-丙酮(9:1);④5%~100%甲醇。
1.5.2 质谱鉴定与分析 将结晶后的样品用1 mL纯净水重溶,使用安捷伦公司HPLC-Q-TOF MS 1260/G6540A正离子模式进行检测,离子源参数为气体温度350 ℃,气体流速9 L/min,雾化器压力为0.2756 MPa,参比质核比()为121.0509和922.0098,质谱检测范围100~1700/,采集速率1.5 spectra/s。HPLC使用安捷伦C18反相柱(RR 2.1×100 mm 3.5-Micron),进样量1 µL,流动相为5%乙腈,流速为0.3 mL/min。
2 结 果
2.1 拮抗放线菌的分离
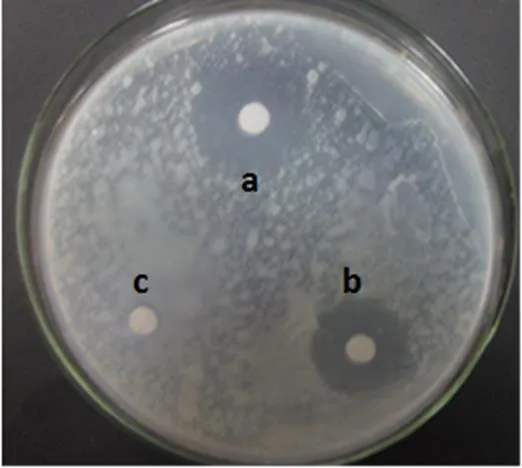
从土壤中经稀释涂布法[13],共分离得到20株放线菌,在大多数放线菌单菌落周围有明显的抑菌圈存在。根据抑菌圈的大小可以判断菌种对青枯雷尔氏病菌的抑菌效果,筛选到一株抑菌效果较好的放线菌LC-7,抑菌圈直径可达60 mm(图1)。
2.2 LC-7的菌落形态及其孢子微观形态
放线菌LC-7生长初期为白色,孢子产生后呈淡紫色(图2A)。采用插片法观察放线菌自然生长状态,可见放线菌LC-7的气生菌丝和基内菌丝(图2B)。其孢子丝的形状为直形,孢子是杆状,其表面为褶皱状(图2C)。
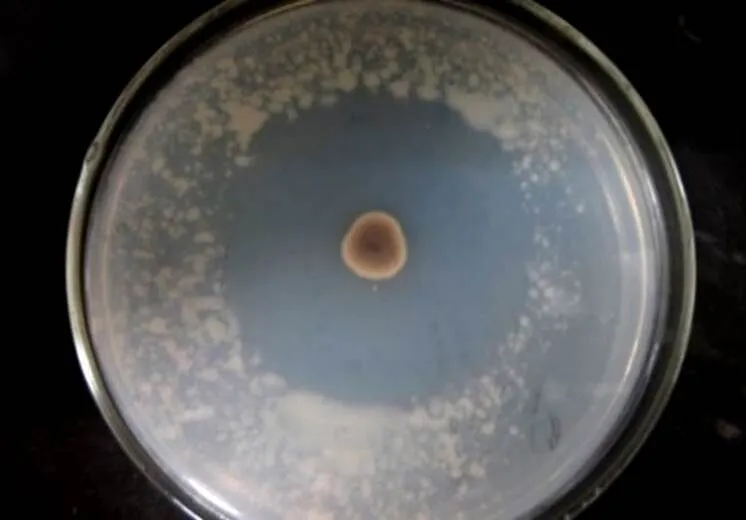
图1 拮抗放线菌LC-7抑制青枯雷尔氏菌的生长
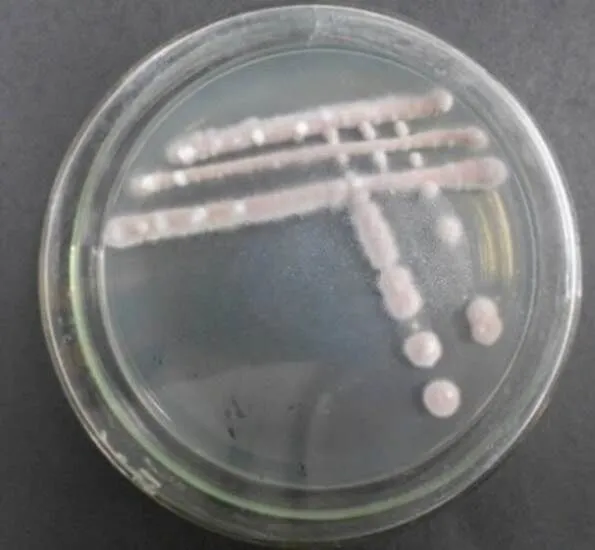
A 菌落形态 B 菌丝形态 C 孢子形态
2.3 放线菌16S rRNA分析
测序结果表明,放线菌LC-7的16S rRNA基因序列与弗氏链霉菌(subsp. acinicolor)的16S rRNA gene同源性为98%,与酒红土褐链霉菌(strain FX-139)的16S rRNA gene同源性为97%,测序比对序列确定该菌株属于链霉菌属(),命名为链霉菌LC-7菌株(sp. LC-7)(图3)。
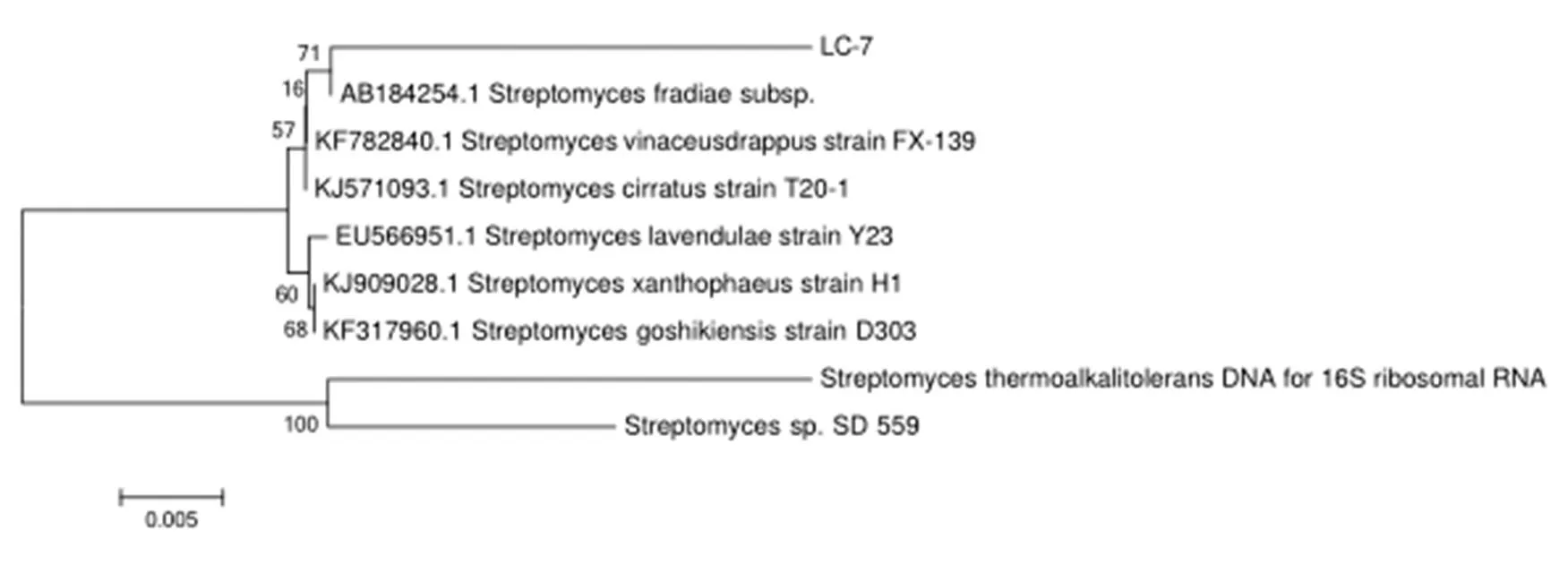
图3 放线菌LC-7的系统发育树
2.4 放线菌LC-7对烟草青枯病的防治效果
田间试验结果见表1。通过田间试验验证,链霉菌LC-7防治烟草青枯病效果较好,显著降低了青枯病的发病率和危害程度,对青枯病的防效达到了85.48%,明显优于硫酸链霉素。
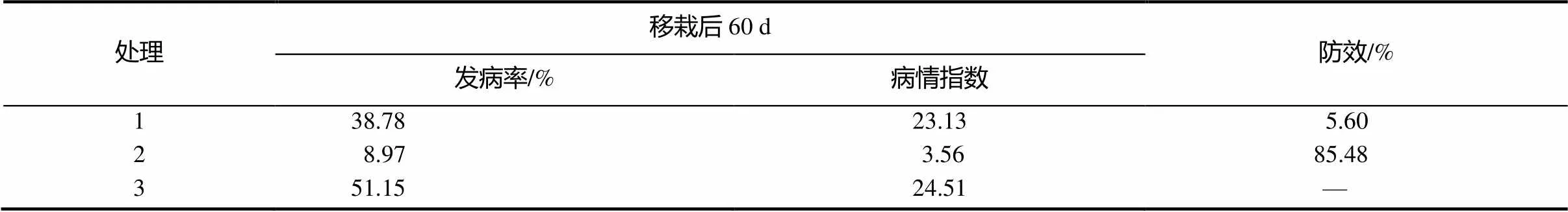
表1 田间试验放线菌对烟草青枯病的防效
2.5 抗菌物质的分离纯化
2.5.1 发酵液的萃取 链霉菌LC-7发酵液用氯仿、正丁醇进行等体积萃取,并分别检验萃取相与萃余相的抗菌活性,结果显示,氯仿和正丁醇的萃取相都无活性,萃余相则有明显的抗菌活性(图4)。由相似相溶原理可知,氯仿萃取非极性物质,正丁醇萃取的物质极性较大。经过验证氯仿和正丁醇萃余相抑菌活性较强,萃取相活性较弱。说明活性物质主要存在于萃余相,萃取可以去除发酵液中一部分亲水和亲脂的杂质。保留萃余相进一步分离纯化。
2.5.2 捷克八溶剂系统纸层析确定抗生素的类别 在捷克八溶剂系统纸层析中,由于各类抗生素的酸碱性、极性和溶解度的不同,其在不同溶剂系统呈现的f值也不相同[14]。根据f值所作曲线图谱特征可以初步判定被分析物质的类别。如图5所示,LC-7产生的抗菌物质(正丁醇萃余相)在溶剂系统5和6中f值较大,在其他系统中f值较小,其f值的连线类似帆船,推断此类活性物质属于氨基糖苷类抗生素,典型代表如链霉素、卡那霉素等[11]。
A B
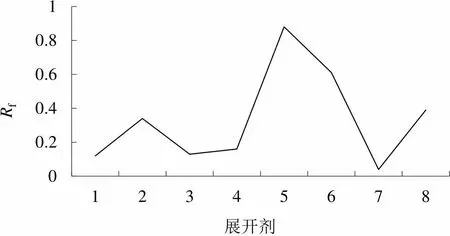
图5 捷克八溶剂系统图谱
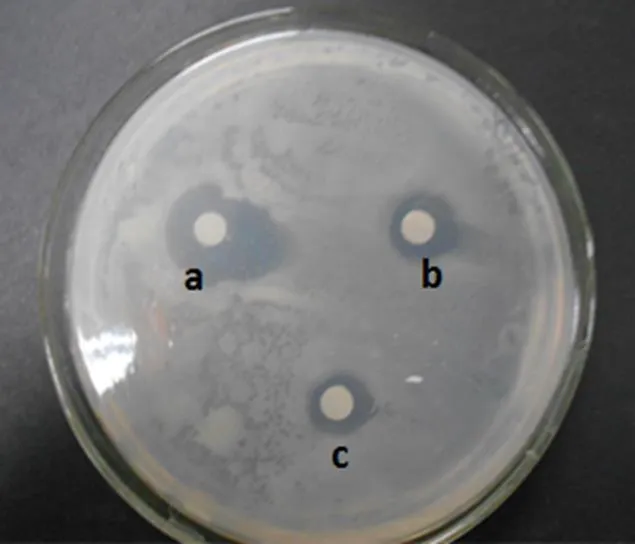
2.5.3 离子交换柱层析的分离及结晶 发酵液萃余相经阳离子和阴离子交换柱层析纯化和浓缩后,色素显著减少,由原来的淡黄色变为无色。用H2SO4调节浓缩液的pH,经醇沉后得到晶体。晶体经纯水重溶后通过抑菌试验证实,具有强烈的抑菌活性(图6)。
2.6 抗菌活性物质的HPLC纯化和质谱鉴定
将晶体以纯水溶解,用高效液相色谱法对样品进行纯度分析。洗脱开始后3 min左右出峰,5 min左右出峰结束,之后没有其他峰出现(图7A)。收集样品后进行质谱分析,发现该抗生素的分子量为365.1(图7B)。
A B C
注:A. 阳离子树脂纯化后样品抗菌活性的检测:a.阳离子树脂纯化后的样品,b.正丁醇萃余相,c.发酵原液。
B. 阴离子树脂纯化后样品抗菌活性的检测:a. 阴离子树脂纯化后的样品,b.正丁醇萃余相,c.发酵原液。C. 结晶。
图6 离子交换层析纯化活性物质及结晶
Fig. 6 Ion exchange chromatography purification of active substances and crystallization.
3 讨 论
放线菌可产生多种抗生素,对多种植物病原细菌和真菌都具有较强的抑制作用[15]。目前,人们从土壤中筛选了多株能抑制青枯雷尔氏菌的放线菌。例如,从健康烟田土壤分离出娄彻氏链霉菌(),与其他生防菌剂连同有机肥一起施用于田间时,可通过控制土壤微生物区系的结构来控制青枯病[16]。陆铮铮等[17]从烟草根围土壤中筛选出3株拮抗放线菌:玫瑰暗黄链霉菌()、橄榄绿链霉菌()和黄麻链霉菌()。熊仕俊等[18]筛选出3株对番茄青枯病菌拮抗效果较好的放线菌:鲜黄链霉菌(galbus)、栗褐链霉菌()和酸疮痂链霉菌()。龙克启等[19]筛选出拮抗辣椒青枯菌的淡紫灰链霉菌()。弗吉尼亚链霉菌()菌株 Y30 和 E36在盆栽试验中能显著抑制番茄青枯病的发生[20]。农用链霉素在田间防治效果不甚理想,且单一抗生素类物质的长期使用,易导致青枯雷尔氏菌产生耐药性。
本研究筛选得到1株抑菌效果明显的链霉菌LC-7,对其产生的抑菌活性物质进行了分离纯化与结构鉴定,发酵液预处理除去菌体等杂质后,用氯仿、正丁醇萃取,去除杂蛋白和一些杂质。考虑到氯仿毒性较大,因此后续纯化均用正丁醇萃余相。用离子交换层析进一步纯化,将纯化后的物质进行结晶,晶体重溶后具有抑菌活性。抗菌活性物质的分子量为365.1,是一类新型氨基糖苷类抗生素。氨基糖苷类抗生素含有丰富的氨基和环醇,性质稳定,水溶性好,代表抗生素有链霉素、卡那霉素、庆大霉素等。产氨基糖苷类抗生素的微生物多数为链霉菌()和小单孢菌()[21]。
通过田间试验验证,链霉菌LC-7防治烟草青枯病效果好,为烟草青枯病的生物防治提供了新的药剂。
4 结 论
链霉菌LC-7产生的抑菌活性物质对青枯雷尔氏菌具有显著的抑制作用,对其进行了分离纯化与结构鉴定后,判断该活性物质属于一类新型的氨基糖苷类抗生素,分子质量为365.1,在微生物农药方面具有发展潜力。
[1] 易龙,肖崇刚. 烟草赤星病防治研究进展[J]. 植物保护2003,29(5):10-14.
[2] 陈程,黎定军,陈武. 烟草青枯病生物防治研究进展[J].作物研究,2012,25(6):639-642.
[3] 陈勇,金晨钟. 烟草青枯病的发生与防治[J]. 现代农业科技,2009(10):91-93.
[4] 番华彩,唐嘉义,秦小萍. 烟草青枯病防治研究进展[J].云南大学学报(自然科学版),2008(S1):31-35.
[5] 霍沁建,张深,王若焱. 烟草青枯病研究进展[J]. 植物保护科学,2007,23(8):364-368.
[6] 黄路枝. 代谢农药活性物质稀有放线菌的筛选[D]. 西安:西北农林科技大学,2007.
[7] LIU Y, SHI J, FENG Y. Tobacco bacterial wilt can be biologically controlled by the application of antagonistic strains in combination with organic fertilizer[J]. Biology and fertility of soils, 2013, 49(4): 447-464.
[8] 孙立广,张洪春,赵秀云,等. 烟草青枯病拮抗菌在有机肥中的定殖效率及田间防治效果[J]. 中国烟草科学,2016,37(4):48-53.
[9] 安德荣,慕小倩,刘翠娟,等. 土壤拮抗放线菌的分离和筛选[J]. 微生物学杂志,2002(5):1-3.
[10] 李毅,王国平,张克诚. 拮抗放线菌LJ50和MJ52的分离与初步鉴定[J]. 湖南农业大学学报,2005(3):310-313.
[11] 周德庆. 微生物实验手册[M]. 上海:上海科学技术出版社,1997,339-345.
[12] 陈丽琼,郭永夏,马国秋. 抗生素4-215的分离、提取和鉴定[J]. 微生物学报,1980,20(1):94-99
[13] 陈丽,疏秀林,安德荣,等. 土壤拮抗放线菌S-5210-6活性产物抑菌谱及其作用机制[J]. 植物保护学报,2007(3):277-282.
[14] TAN H M, ZHOU S N, DENG Z J, et al. Ribosomal- sequence-directed selection for endophytic streptomycete strains antagonistic toto control tomato bacterial wilt[J]. Biological Control 2011, 59: 245-254.
[15] 梁亚萍,宗兆锋,马强. 6株野生植物内生放线菌防病促生作用的初步研究[J]. 西北农林科技大学学报,2007,35(7):131-136.
[16] 蒋承耿,刘琼,陈鹏. 烟草青枯病防治药剂室内筛选及田间药效研究[J]. 安徽农业科学,2013(3):1098-1099.
[17] 陆铮铮,彭丽娟,丁海霞,等. 烟草青枯菌拮抗放线菌的筛选及鉴定[J]. 中国烟草科学,2013,34(2):54-58.
[18] 熊仕俊,孙成龙,施闯,等. 番茄青枯病菌拮抗放线菌的筛选及鉴定[J]. 北方园艺,2014(5):114-117.
[19] 龙克启,陆铮铮,吴石平,等. 一株放线菌对辣椒青枯菌的拮抗作用及其鉴定[J]. 河南农业科学,2012,41(11):92-95.
[20] 王东胜. 秦岭主峰太白山北坡5种生境中微生物区系及拮抗放线菌资源研究[D]. 西安:西北农林科技大学,2014.
[21] 李定刚. 氨基糖苷类抗生素的研究应用概述[J]. 北方牧业,2008(2):27-27.
The Selection of AntagonisticActinomycetes againstand Purification of Antibacterial Substance
LUO Wenjian1, LIU Yuhong1, SHI Heli2, TAN Jun2, WANG Rui2, ZHAO Xiuyun1, XIANG Bikun2*
(1. College of Life Science and Technology, Huazhong Agricultural University, Wuhan 430070, China; 2. Enshi Tobacco Company of Hubei Province, Enshi, Hubei 445000, China)
Tobacco bacterial wilt is a soil-borne disease caused by. A strain ofLC-7 with obvious antagonistic activities againstwas isolated from healthy soils and identified assp. The fermentation broth ofsp. LC-7 was extracted with chloroform and n-butanol. The analysis through the Czech eight solvent systems revealed that the antibacterial substance was an alkaline water-soluble antibiotic. The antibacterial material was purified by exchange column, and precipitated with alcohol to obtain the crystal. The crystal was further purified by HPLC and analyzed by mass spectrometry. The results showed that the antimicrobial active substance was a new aminoglycoside antibiotic with a molecular weight of 365.1. In the field experiment,sp. LC-7 had significant control effect on tobacco bacterial wilt. The control efficacy was 85.48%.
actinomycetes;; aminoglycoside antibiotics; isolation and purification
S435.72
1007-5119(2017)02-0069-06
10.13496/j.issn.1007-5119.2017.02.012
中国烟草总公司科技重点项目“基于宏基因组学的植烟土壤健康评价研究与应用”(110201402016)
罗文建(1991-),男,硕士,研究方向为微生物农药。E-mail:746794072@qq.com。
,E-mail:xiangbikun@126.com
2016-10-22
2017-03-17

