金钗石斛多糖上调锌指蛋白A20表达减轻大鼠缺血性脑损伤
詹 剑, 李小琼, 郝仁方
金钗石斛多糖上调锌指蛋白A20表达减轻大鼠缺血性脑损伤
詹 剑1, 李小琼2, 郝仁方1
目的 观察金钗石斛多糖调控锌指蛋白A20表达抑制NF-κB信号通路减轻大鼠缺血-再灌注脑损伤的作用机制。方法 SD大鼠随机分为假手术组、脑缺血-再灌注模型组、金钗石斛多糖治疗组(200 mg/kg)、金钗石斛多糖治疗+A20沉默组和金钗石斛多糖治疗+空病毒载体组。建立局灶性脑缺血-再灌注模型,观察金钗石斛多糖对锌指蛋白A20 mRNA和蛋白表达的影响。比较各组大鼠神经功能评分和脑梗死体积,检测磷酸化IKKβ蛋白和胞核p65蛋白的表达量。结果 分别从再灌注6 h和12 h开始,金钗石斛多糖治疗组大鼠脑组织A20 mRNA和蛋白水平均较脑缺血-再灌注模型组明显增高(均P<0.01)。同脑缺血-再灌注模型组相比,金钗石斛多糖治疗组大鼠神经功能评分明显改善(P<0.001),脑梗死体积明显减小(P<0.01),脑组织磷酸化IKKβ和胞浆p65表达水平均明显下降(分别为P<0.001,P<0.01);而A20沉默则逆转了金钗石斛多糖上述治疗效果,各项指标均明显恶化(均P<0.01)。结论 金钗石斛多糖通过上调锌指蛋白A20表达抑制NF-κB信号通路减轻大鼠缺血性脑损伤。
金钗石斛多糖; 脑缺血-再灌注损伤; 锌指蛋白A20; NF-κB信号通路
众所周知,脑缺血-再灌注早期诱发的炎症过度反应激活多种病理机制,造成严重的继发性脑损伤。NF-κB信号通路则是激活和维持脑缺血-再灌注早期炎症过度反应的中心环节。研究表明,IKKβ磷酸化是NF-κB信号通路激活的关键。而锌指蛋白A20则通过阻断IKKβ磷酸化,抑制NF-κB信号通路激活,发挥强大的抗炎作用[1]。我们在前期研究[2]中发现金钗石斛多糖能够降低LPS诱导的小鼠巨噬细胞TNF-α、NO等的释放,显著抑制炎症反应;并在后续研究[3]中发现,金钗石斛多糖明显降低大鼠脑缺血-再灌注区炎症反应减轻脑损伤和抑制NF-κB信号通路激活有关,但具体机制尚需明确。因此,本研究进一步观察金钗石斛多糖对大鼠脑缺血-再灌注区锌指蛋白A20表达的影响,揭示金钗石斛多糖上调锌指蛋白A20表达水平抑制NF-κB信号通路的作用机制。为深入理解金钗石斛多糖抗炎作用的分子生物学机制提供证据。
1 材料与方法
1.1 动物 体重280~320 g的无特定病原(SPF)级雄性Sprague-Dawley 大鼠购于第三军医大学医学实验动物中心,许可证号:SCXK(渝)2012-0005,所有动物在处置前均适应性饲养至少1 w。
1.2 药品 根据我们前期的研究成果[4]并加以改进,采用水提醇沉法提取金钗石斛粗多糖,再用DEAE Sepharose Fast Flow色谱柱纯化,经真空冷冻干燥后得到白色粉末,用苯酚-硫酸法测出金钗石斛多糖含量为98.1%,满足实验需要。
1.3 主要的试剂和仪器 A20 shRNA慢病毒购自上海吉凯基因公司,2,3,5-氯化三苯基四氮唑(TTC)购自美国Sigma-Aldrich公司;Trizol试剂盒、逆转录试剂盒(PrimeScriptTM RT with gDNA Eraser)和SYBR Green 反应体系(SYBR Premix Ex TaqTM Ⅱ)均购自日本Takara Biotechnology公司;所使用的一抗包括:抗-A20 兔单克隆抗体(ab92324)购自美国Abcam公司,抗-磷酸化IKKβ(Ser176/180)兔单克隆抗体和抗-NF-κB p65小鼠单克隆抗体购自美国Cell Signaling Technology公司;相应的辣根过氧化物酶标记的羊抗兔二抗和羊抗小鼠二抗购自美国Proteintech公司。所需仪器均由所在实验室提供。
1.4 动物分组和给药 SD大鼠随机分为5组:假手术组(Sham)、脑缺血-再灌注模型组(MCAO)、金钗石斛多糖治疗组(MCAO+DT,200 mg/kg)、金钗石斛多糖治疗+A20沉默组(MCAO+DT+LV-shA20)和金钗石斛多糖治疗+空病毒载体组(MCAO+DT+Vehicle)。术前7 d开始灌胃给药,每天一次。假手术组和单纯脑缺血-再灌注组给予等体积的生理盐水灌胃。每项试验每组均随机选取5只大鼠供检测。
1.5 局灶脑缺血-再灌注大鼠模型的建立 参考Zea Longa等[5,6]的方法, 10%的水合氯醛(0.35 ml /100 g)腹腔注射麻醉大鼠,沿正中线切开颈部皮肤,分离并结扎右侧颈总动脉和右侧颈外动脉根部。将MCAO栓线(直径约0.24 mm,沙东生物公司,北京)圆头端从右侧颈总动脉距分叉处约4 mm剪一小口插入并进入颈内动脉,插入深度为18~20 mm,实现大脑中动脉供血区局灶性脑缺血。经过缺血2 h后,缓慢拔出栓线约10 mm,实现大脑中动脉复流,再灌注24 h 进行相关检查。手术后保温,常规饲养。假手术组不插入线栓,其余同模型组。
1.6 A20基因沉默 在造模前10 d,将慢病毒(LV-shA20,浓度为5×108TU/ml)5 μl经侧脑室注射转染脑组织,并用相应浓度和剂量的空病毒(LV-Vehicle)作为阴性对照。A20基因干扰的效果由实时荧光定量PCR和蛋白免疫印迹检测证实。
1.7 局灶性缺血-再灌注后脑损害的评价
1.7.1 神经功能评分 再灌注24 h,参照Bederson等[7]的5分评分法对大鼠神经功能进行盲评:0分:无明显神经功能缺损症状;1分:提尾悬空时,左前肢屈曲,但不伴有其他异常;2分:大鼠置于光滑地面,用手推左侧肩,其抵抗力较右侧下降,但自由活动时不转圈;3分:置于光滑地面爬行时向左侧倾倒或不自主向左侧转圈;4分:肢体无自发活动或意识不清。评分在1~3分者,视为造模成功。
1.7.2 TTC染色法脑梗死体积的测定 再灌注24 h 将大鼠处死后迅速断头取脑,放入-20 ℃ 冰箱冷冻20 min,然后从额极后5 mm处开始从前至后连续切出2 mm厚的冠状位脑片,并在37 ℃ 避光条件下于2% TTC 溶液中浸泡30 min。这时脑片中苍白部分为梗死区域,其余部分显示为鲜红色。将脑片依次排列好,拍照后传入图像分析软件进行检测。脑梗死体积以占大脑总体积的百分比标示。
1.8 RT-qPCR检测 于再灌注24 h,在无菌灭酶的条件下,取出大鼠缺血脑组织充分匀浆,采用Trizol试剂盒提取总RNA,并按制造商的说明将总RNA逆转录为cDNA,-20 ℃ 保存待用。RT-qPCR采用SYBR Green 反应体系在PCR测定仪上进行检测,反应参数设定为:复温95 ℃,30 sec;退火60 ℃,30 sec,40循环。计算相对mRNA表达量。目的基因A20上游引物为:5’-GACCACGGCACGACTCACCT-3’,下游引物为:5’-GGACAGTTGGG CGTCTCACAT-3’;内参β-actin的上游引物为:5’-ACGGTCAGGTCATCA CTATCG-3’,下游引物为:5’-GGCATAGAGGTCTTTACGGATG-3’。
1.9 Western blot检测 于再灌注24 h处死大鼠,选取缺血区脑组织放入蛋白酶抑制剂裂解缓冲液中充分匀浆,经过4 ℃ 12000 rpm 离心10 min后,抽取上清液。并采用胞核蛋白提取试剂盒(no.P0027,碧云天公司,上海,中国)提取胞核蛋白。利用10%的SDS-PAGE凝胶电泳分离,再将蛋白电转到PVDF膜上,用含有5%的脱脂奶粉的TBST 缓冲液进行非特异性抗原封闭,然后在4 ℃ 孵育一抗(1∶500稀释)过夜。经过充分洗膜后,用相应的二抗(1∶2000稀释)在37 ℃ 孵育2 h。用凝胶成像仪对条带显影,并对免疫印迹进行蛋白含量检测。

2 结 果
2.1 金钗石斛多糖明显上调大鼠缺血-再灌注脑组织中A20的表达 从再灌注6 h开始,各时间点金钗石斛多糖治疗组大鼠A20 mRNA表达水平均较脑缺血-再灌注组明显增高(各时间点P<0.001),并且高峰期提前到再灌注12 h;虽然单纯缺血-再灌注组大鼠A20 mRNA表达水平较假手术组也有明显升高(各时间点P<0.001)(见图1A),但再灌注24 h之后迅速下降。相似地,从再灌注12 h开始,各时间点金钗石斛多糖组大鼠A20 蛋白表达水平均较缺血-再灌注模型组明显增高(分别为P<0.001,P<0.001,P<0.01,P<0.01);而缺血-再灌注模型组仅在再灌注12 h、24 h、48 h 3个时间点较假手术组明显升高(分别为P<0.05,P<0.001,P<0.05)(见图1B、1C)。
2.2 A20基因沉默极大地削弱了金钗石斛多糖的脑保护作用 同脑缺血-再灌注模型组相比,金钗石斛多糖治疗组大鼠神经功能评分明显改善(P<0.001),脑梗死体积明显减小(P<0.01);而金钗石斛多糖治疗+A20沉默组大鼠同金钗石斛多糖治疗组相比,神经功能评分明显恶化(P<0.001),脑梗死体积明显增大(P<0.01);金钗石斛多糖治疗+空病毒载体组和金钗石斛多糖治疗组大鼠之间的神经功能评分和脑梗死体积则没有明显的差异性(P>0.05)(见表1)。以上实验结果提示金钗石斛多糖明显减轻大鼠脑缺血-再灌注损伤,而上调锌指蛋白A20表达在金钗石斛多糖的脑保护机制中发挥关键作用。
2.3 A20基因沉默同样削弱了金钗石斛多糖对NF-κB信号通路的抑制作用 于再灌注24 h,同假手术组相比,脑缺血-再灌注模型组p-IKKβ和nuclear-p65表达水平明显升高(分别为P<0.001,P<0.001);而同脑缺血-再灌注模型组相比,金钗石斛多糖治疗组p-IKKβ和nuclear-p65表达水平均明显下降(分别为P<0.001,P<0.01);随着A20基因沉默,金钗石斛多糖治疗+A20沉默组p-IKKβ和nuclear-p65表达水平比金钗石斛多糖治疗组均明显升高(分别为P<0.001,P<0.001);而金钗石斛多糖治疗组和金钗石斛多糖治疗+空病毒载体组p-IKKβ和nuclear-p65表达水平则无显著性差异(分别为P>0.05,P>0.05)(见图2)。
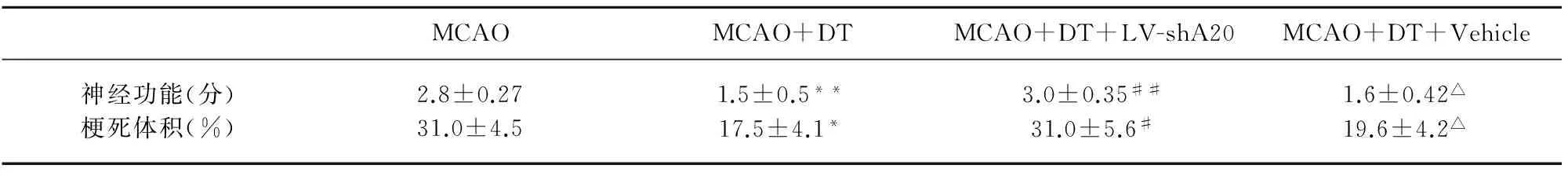
表1 锌指蛋白A20对金钗石斛多糖发挥缺血-再灌注脑保护作用的影响
与单纯缺血-再灌注组比较*P<0.01,**P<0.001;与金钗石斛多糖治疗组比较△P>0.05,#P<0.01,##P<0.001
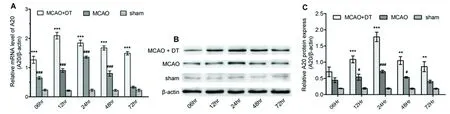
A:再灌注各时间点,金钗石斛多糖对A20 mRNA水平的影响。与单纯缺血-再灌注组比较***P<0.001;与假手术组比较###P<0.001。B、C:再灌注各时间点,金钗石斛多糖对A20蛋白水平的影响。与单纯缺血-再灌注组比较**P<0.01,***P<0.001;与假手术组比较#P<0.05,###P<0.001
图1 金钗石斛多糖对大鼠局灶性缺血/再灌注脑区A20表达的影响
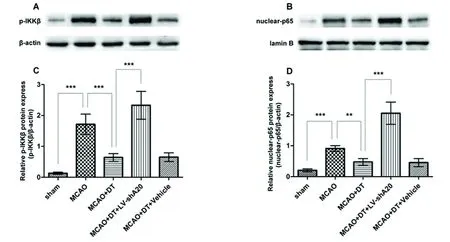
A、C:再灌注24 h,免疫印迹法检测各组大鼠缺血/再灌注脑组织p-IKKβ表达水平***P<0.001。B、D:再灌注24 h,免疫印迹法检测各组大鼠缺血-再灌注脑组织nuclear-p65表达水平,**P< 0.01,***P< 0.001。β-actin作为总蛋白内参,lamin B作为胞核蛋白内参
图2 A20对金钗石斛多糖抑制NF-κB信号通路作用的影响
3 讨 论
本研究所采用的大脑中动脉线栓大鼠模型,适用于模拟人类脑缺血/再灌注后的病理生理过程。我们在既往研究[3]中发现,大鼠缺血-再灌注区脑组织TNF-α、IL-1β等促炎因子水平明显升高,炎症细胞激活聚集,而高剂量组金钗石斛多糖(200 mg/kg)能够显著抑制该区域炎症反应,减轻脑组织损伤,揭示金钗石斛多糖治疗脑梗死的药用价值,但具体作用机制需要进一步阐明。锌指蛋白A20最初是作为TNF-α诱导的抗炎因子而被发现[8,9],现已经明确A20对IL-1β、TOLL样受体等多条炎症信号途径均有阻断作用,被认为是炎症反应中关键性的内源性保护因子[10~12]。Renata等[13]发现在脑组织中A20表达是抑制炎症反应必不可少的环节。而在本研究中,我们发现单纯缺血-再灌注组大鼠脑组织中A20 mRNA和蛋白水平均较假手术组明显增加,提示A20参与了脑缺血-再灌注后炎症反应的调控过程。值得重视的是,在金钗石斛多糖调节A20表达的检测中,我们发现,金钗石斛多糖治疗组大鼠脑组织与单纯缺血-再灌注组相比,A20 mRNA表达峰值提前,表达水平显著提高, A20蛋白合成也相应明显增多并且高表达的持续时间延长,表明金钗石斛多糖能够明显上调大鼠缺血-再灌注脑组织锌指蛋白A20的表达。并且再灌注24 h,金钗石斛多糖治疗组大鼠与单纯缺血-再灌注组大鼠相比,神经功能评分明显下降,脑梗死体积明显缩小,有统计学意义,提示金钗石斛多糖可能通过上调锌指蛋白A20的表达减轻脑缺血-再灌注损伤,我们进一步采用基因沉默的方法,阻断大鼠脑组织中锌指蛋白A20表达。这时我们发现,金钗石斛多糖治疗+A20沉默组大鼠与金钗石斛多糖治疗组大鼠相比,神经功能评分明显升高,脑梗死体积明显扩大,说明阻断锌指蛋白A20表达将严重削弱金钗石斛多糖的脑保护作用,从而证实锌指蛋白A20确是金钗石斛多糖发挥缺血-再灌注后脑保护作用的关键调控靶点。
如前所述,NF-κB信号通路是激活和维持脑缺血-再灌注早期炎症过度反应的中心环节,IKKβ磷酸化是NF-κB信号通路激活的枢纽,而锌指蛋白A20则通过多种泛素编辑机制阻断IKKβ磷酸化[14~17]。在正常生理条件下,NF-κB信号通路处于两者严格的调控机制之下,能够避免过度持续激活对机体带来的伤害。而在本研究则发现,再灌注24 h,单纯缺血/再灌注组大鼠脑组织中锌指蛋白A20虽有升高(较假手术组升高约3.9倍),但远不及磷酸化IKKβ升高明显(较假手术组升高约13.2倍),说明脑组织发生缺血-再灌注损伤后,该信号通路抑制和激活两方面的调控力量失去平衡,锌指蛋白A20不能有效抑制IKKβ磷酸化,导致下游NF-κB信号通路活化,启动炎症反应持续过度激活;引起血脑屏障损伤和脑水肿,这是卒中后患者早期死亡的主要原因[18,19],还能激活溶酶体反应,氧化应激反应等多种病理损伤机制[20],加重脑缺血-再灌注损伤。而在金钗石斛多糖治疗组大鼠脑组织中,随着锌指蛋白A20表达水平明显上调(较假手术组升高约9.7倍),磷酸化IKKβ水平显著下降(较假手术组仅升高约4.8倍),此消彼长,NF-κB信号通路活性被控制,因而金钗石斛多糖抑制了脑缺血-再灌注早期发生的炎症过度反应。
为进一步印证上调锌指蛋白A20表达确实是金钗石斛多糖抑制NF-κB信号通路的关键机制,我们仍然采用A20基因沉默的方法。果然,阻断大鼠脑组织中锌指蛋白A20表达极大地削弱了金钗石斛多糖抑制IKKβ磷酸化和NF-κBp65核转位的作用。综上所述,本研究从分子生物学角度阐明了上调锌指蛋白A20表达是金钗石斛多糖抑制NF-κB信号通路减轻大鼠缺血性脑损伤的关键机制。
[1]Vereecke L,Beyaert R,Loo G V.The ubiquitin-editing enzyme A20 (TNFAIP3) is a central regulator of immunopathology[J].Trends Immunol,2009,30(8):383-391.
[2]李小琼,金 徽,葛晓军,等.金钗石斛多糖对脂多糖诱导的小鼠腹腔巨噬细胞分泌TNF-α NO的影响[J].安徽农业科学,2009,37(28):13634-13635.
[3]詹 剑,李小琼,郝仁方.金钗石斛多糖对局灶性脑缺血-再灌注大鼠的作用[J].中国脑血管病杂志,2017,14(1):25-31.
[4]李小琼,葛晓军,郑斯卓,等.金钗石斛多糖的提取及部分理化性质分析[J].江苏大学学报(医学版),2008,18(5):446-447.
[5]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]徐叔云,卞如濂,陈 修.药理实验方法学[M].第3版,北京:人民卫生出版社,2002.1066-1067.
[7]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[8]Brammer SG,Merrick GS,Wallner KE,et al.Tumor necrosis factor-alpha induction of novel gene products in human endothelial cells including a macrophage-specific chemotaxin[J].J Biol Chem,1990,265(5):2973-2978.
[9]Jr OA,Boguski MS,Dixit VM.The A20 cDNA induced by tumor necrosis factor alpha encodes a novel type of zinc finger protein[J].J Biol Chem,1990,265(25):14705-14708.
[10]Catrysse L,Vereecke L,Beyaert R,et al.A20 in inflammation and autoimmunity[J].Trends Immunol,2014,35(1):22-31.
[11]Zammit NW,Grey ST.Emerging roles for A20 in islet biology and pathology[M].The Multiple Therapeutic Targets of A20.Springer,New York:2014.141-162.
[12]Parvatiyar K,Harhaj EW.Regulation of inflammatory and antiviral signaling by A20[J].Microbes Infect,2011,13(3):209-215.
[13]Guedes RP,Csizmadia E,Moll HP,et al.A20 deficiency causes spontaneous neuroinflammation in mice[J].J Neuroinflammation,2014,11(1):1-16.
[14]Skaug B,Chen J,Du F,et al.Direct,noncatalytic mechanism of IKK inhibition by A20[J].Mol Cell,2011,44(4):559-571.
[15]Shembade N,Ma A,Harhaj EW.Inhibition of NF-kappaB signaling by A20 through disruption of ubiquitin enzyme complexes[J].Science,2010,327(5969):1135-1139.
[16]Wertz IE,O’Rourke KM,Zhou H,et al.De-ubiquitination and ubiquitin ligase domains of A20 downregulate NF-kappaB signalling[J].Nature,2004,430(7000):694-699.
[17]Wertz IE,Newton K,Seshasayee D,et al.Phosphorylation and linear ubiquitin direct A20 inhibition of inflammation[J].Nature,2015,528(7582):1-6.
[18]Candelario-Jalil E,Yang YG.Diverse roles of matrix metalloproteinases and tissue inhibitors of metalloproteinases in neuroinflammation and cerebral ischemia[J].Neuroscience,2009,158(3):983-994.
[19]Vahedi K,Hofmeijer J,Juettler E,et al.Early decompressive surgery in malignant infarction of the middle cerebral artery:a pooled analysis of three randomised controlled trials[J].Lancet Neurology,2007,6(3):215-222.
[20]Worthmann H,Tryc AB,Deb M,et al.Linking infection and inflammation in acute ischemic stroke[J].Ann N Y Acad Sci,2010,1207(1):116-122.
Dendrobium nobile polysaccharides mitigate SD rats cerebral ischemia injury by upregulating zinc finger protein A20
ZHANJian,LIXiaoqiong,HAORenfang.
(DepartmentofNeurology,AffiliatedHospitalofMedicalCollege,Zunyi563000,China)
Objective To observe the effects of Dendrobium nobile polysaccharides regulating A20 to mitigate rat cerebral ischemia-reperfusion injury.Methods SD male rats were randomly allocated into Sham group,MCAO group,MCAO+DNP therapy (DT,200 mg/kg) group,MCAO+DT+LV-shA20 group,MCAO+DT+Vehicle group.By establishing MCAO rat model,the effects of DNP on A20 mRNA and protein expression were detected by RT-qPCR and Western blot.At same time rats neurological deficit score and infarct volume were compared in groups,and their phosphorylated IKKβ (p-IKKβ) protein and nuclear p65 protein levels were further investigated by Western blot.Results Compared with MCAO group,A20 mRNA and protein levels significantly elevated in MCAO+DT group at each time point (each time pointP<0.01) beginning from reperfusion 6 h and 12 h respectively in MCAO+DT group.Compared with MCAO group,MCAO+DT group rats shown significant improved neurological deficit score,smaller infarct volume,and decreased brain tissue p-IKKβ and nuclear p65 protein (P<0.001,P<0.01,P<0.001,P<0.01,respectively);however,A20 silencing significant worsen all the above index (eachP<0.01),as compared with MCAO+DT group.Conclusion DNP inhibit NF-κB signaling and attenuate SD rats cerebral ischemia injury by upregulating zinc finger protein A20.
Dendrobium nobile polysaccharides; Cerebral ischemia-reperfusion; Zinc finger protein; NF-κB signaling
1003-2754(2017)04-0332-04
2016-12-23;
2017-03-30
贵州省科学技术基金项目,黔科合J字LKZ(2012)18号;贵州省科技厅、遵义医学院附属医院联合基金项目,黔科合LH字(2015)7476号;遵义医学院硕士启动基金项目,编号F-336
(1.遵义医学院附属医院神经内科,贵州 遵义 563000;2.遵义医学院生物化学教研室,贵州 遵义 563000)
李小琼, E-mail:lxq94@163.com
R743.3
A

