惠州市假反应性无偿献血者归队检测策略探讨
李雪群 严凤好 钟展华 万小春 蓝建崇 李康生
惠州市假反应性无偿献血者归队检测策略探讨
李雪群 严凤好 钟展华 万小春 蓝建崇 李康生
目的 通过对假反应性献血者的追踪检测,探讨灰区保留意义以及适用于基层血站的归队检测策略。方法 选取2014年1月~2016年2月单试剂反应(含灰区)无偿献血标本712例,按ELISA检测结果把标本分成灰区组及单试剂反应组。经过6个月以上的屏蔽期,对召回的献血者标本进行ELISA双试剂检测,NAT单检及确证试验确认。结果 初次ELISA检测中,经NAT(或TPPA)确认后,HBsAg、抗-TP的灰区组与单试剂反应组之间假反应率的差异有统计学意义(P<0.05);而抗-HCV在两组间假反应率的差异无统计学意义。经过6个月以上屏蔽期的拟归队检测中,灰区组213例中的1例NAT反应但不被确证试验证实,单试剂反应组268例中的3例NAT反应性且确证试验阳性。结论 在当前普遍开展核酸检测的检测模式下,仍保留灰区设置,致使假反应性标本比例增高,导致血液浪费。
假反应性 无偿献血者 归队 核酸检测
随着ELISA试剂的灵敏度不断提高,我国的血液安全水平也有了长足的进步。然而,把高灵敏度的ELISA试剂应用于低危健康献血人群的筛查,难免出现假反应性结果。以往大多数采供血机构采用的是两遍ELISA检测,对于反应性的标本,根据《血站技术操作规程》的要求,将对应的血液及由其制备的所有成分隔离并报废。为避免献血者因为假反应而被淘汰,既保证受血者安全又能保护假反应性献血者权益的归队程序程序亟待实施。
献血者归队是证明已被屏蔽的献血者符合献血者健康检查要求,准许其再次献血的程序,该程序适用于检测结果为假反应性,尤其是需要经过一段时间后做其他血清学试验和NAT以检出血清阳转的献血者[1]。国内对归队检测的策略尚在探索中,且各有侧重[2,3]。FDA 发布的献血者归队导则,没有将确证试验作为确定献血者的假反应性状态和献血者归队的必需项目[4]。澳大利亚红十字输血服务中心对于抗-HIV 和抗-HCV筛查反应性标本,使用第2种 ELISA 筛查试剂做补充试验,同时加做NAT,如果第2种ELISA 试剂和NAT 均为无反应性,则无需通过确证试验即可判定该献血者原筛查试剂反应性为生物学假性反应[5]。结合国内外先进经验,参照我国于2013年制定的《反应性献血者屏蔽与归队指南》,立足于基层血站实际工作需要,笔者通过对假反应性献血者的追踪检测,以期建立一个适合基层血站的假反应性归队检测方案。
材料与方法
1 材料 2014年1月~2016年2月139 527例无偿献血者的标本中,经抗HIV、抗-HCV、HBsAg、抗-TP两种不同厂家的ELISA试剂检测,单试剂反应性,NAT无反应性的标本共712份,实际召回481份,其中包括HBsAg(108/132)、抗-HCV(190/232)、抗-HIV(113/244)、抗-TP(70/104),总召回率为(481/712) 67.56%。根据初次ELISA检测分成灰区(Border area,BA)组和单试剂反应(single-reagent-reactive,SR)组。召回对象均知情同意。
2 仪器与试剂 HBsAg试剂(伯乐和新创生物工程有限公司),抗-HCV抗体试剂(奥拓和万泰生物工程有限公司),抗-HIV抗体试剂盒(索林和万泰生物工程有限公司),抗-TP抗体试剂(万泰和科华生物工程有限公司),HBV、HCV、HIV(1+2)型(苏州华益美生物科技有限公司),HIV-1 RNA、HCV RNA、HBV DNA 鉴别试剂(苏州华益美公司)。HBsAg确认试剂盒(珠海丽珠试剂股份有限公司),抗-HCV 重组免疫试验试剂盒 (美国Chiron 公司),梅毒螺旋体明胶颗粒凝集试验(富士瑞必欧株式会社)。抗-HIV反应性标本送惠州市疾控中心确认。所有试剂均为中国药品生物制品检定所批检合格,在有效期内使用并严格按照试剂说明书进行操作。仪器采用STAR全自动加样仪(瑞士HAMILTON),FAME24/20全自动酶免分析系统(瑞士HAMILTON);Ampli STAR 全自动核酸提取纯化仪(瑞士HAMILTON),ABI7500 荧光定量PCR 仪(美国ABI)。
2.1 检测流程见图1。
3 统计学处理 采用SPSS19.0统计软件对数据进行分析,计数资料采用χ2检验,P<0.05表示差异有统计学意义。
结 果
1 献血标本检测 ELISA检测灰区(BA)及单试剂反应性(SR)标本经NAT 检测后,HBsAg、抗-TP灰区组与单试剂反应性标本组之间假反应率的差异有统计学意义,P<0.05。而抗-HCV两组间假反应率的差异无统计学意义。见表1。
2 归队检测 召回的献血者经ELISA、NAT、确证试验检测,召回人群中灰区(BA)组与单试剂反应(SR)组献血者ELISA检测阳性率比较,除HBsAg外,其余三项的差异均有统计学意义,P<0.05。灰区组中只有1例呈HCVNAT单检反应性,但RIBA试验为不确定。单试剂反应性组共3例被NAT检出,分别被中和试验(2例)和RIBA(1例)被证实。见表2。
讨 论
本站将ELISA检测发现的反应性标本(含灰区),经过双孔复查,均无反应性,以及NAT无反应性,血液用于临床。若复查仍呈反应性,血液报废,NAT单检有反应性者永久屏蔽,NAT单检无反应性者进入归队程序。本站把屏蔽的时间统一为6个月,涵盖了最长的HCV病毒血清转换前窗口期,避免了工作人员及献血者的混乱。进入归队程序的献血者由专人电话通知,进行解释工作,告知其归队的流程,并在三个月时短信温馨提示,假如将更换联系方式请按要求编辑短信反馈至短信平台;在屏蔽期已满六个月再次电话通知,告知献血者可以到就近的采血点或者流动采血车上采集标本。标本随即进入归队检测流程。

表1 ELISA检测灰区及单试剂反应性标本核酸检测结果
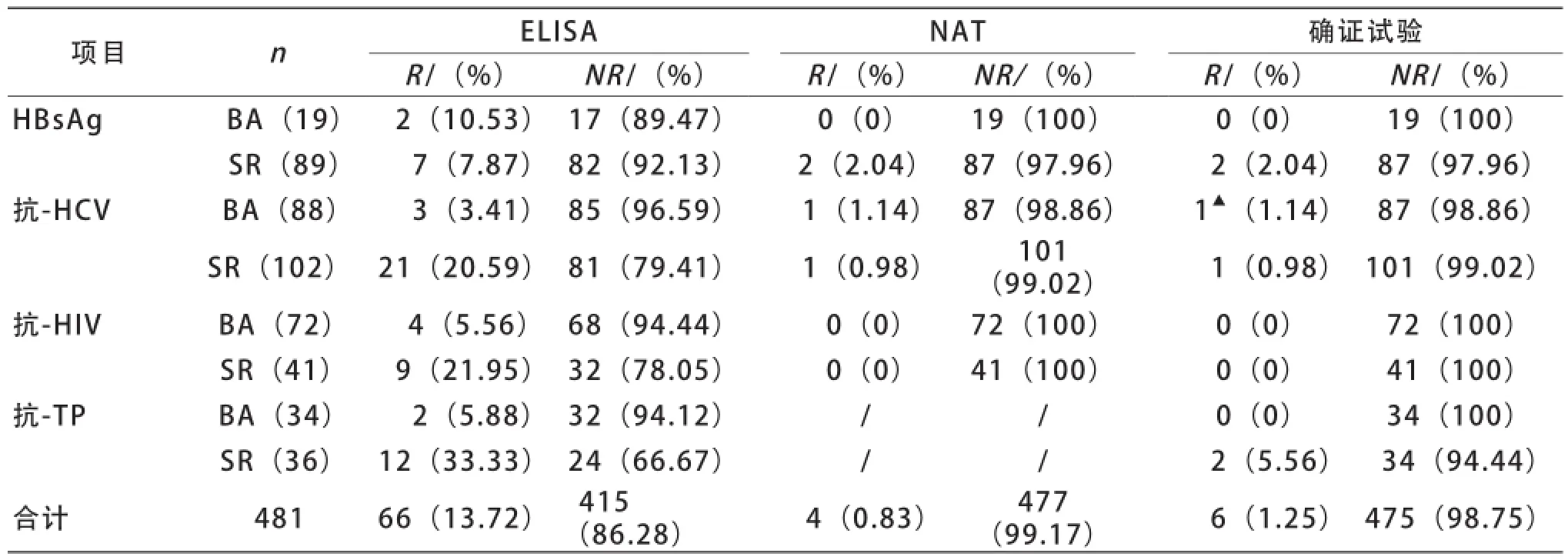
表2 拟归队的原灰区组与原单试剂反应组献血者检测情况比较
以往大多数采供血机构均选用两种不同ELISA试剂作为传染病筛查的方法,一般认为灰区的样本提示有一定的抗体活性存在,为保障血液制品的安全,采供血单位将其作可疑标本对待,报废该血液制品,屏蔽献血者处理。灰区是ELISA中处于阳性判断值周围一定范围内的测定结果。有学者认为用于血液筛查检测的ELISA试剂盒有必要确定一个灰区的下限,尽管这样可能会导致一些正常血液的废弃,但对于保证输血安全极有意义[6]。目前,国内对灰区的设置无统一的标准,本站的灰区范围制定为:0.5≤S/CO<1,进口试剂0.7≤S/CO<1。但在本研究中,初次检测标本经核酸确认发现,灰区组的假反应率为97.18%(344/354),较之单试剂反应性假反应率71.88%(368/512)高,两者之间差异有统计学意义,P<0.001。
在经半年以上的屏蔽期的归队检测中,虽然试剂和操作人员改变,但ELISA对灰区组与单试剂反应组的召回献血者还有相当的反应性,灰区组与单试剂反应组献血者ELISA检测阳性率比较,除HBsAg外,其余三项两组间的差异均有统计学意义,灰区组的反应性率低于单试剂反应组。经NAT确认有1例反应性结果,但不被确证试验证实。本次研究中,无论初次检测或者半年后的拟归队检测,灰区组的标本都有较高的假反应性,故此,应对灰区设置实行动态评估,以便及时作出调整。
2016年3月颁布的《血站技术操作规程》(2015版)规定:实施核酸检测试剂批签发之前,HIV、HBV和HCV感染标志物应采用2遍血清学检测和1遍核酸检测。在广泛开展灵敏度更高、特异性更好的核酸检测下,血液安全得到进一步的提升,保留灰区设置意义不如从前。保留灰区致使假反应性标本比例增高,导致血液浪费,损害献血者的身心和名誉,给其家庭带来不必要的误会和困扰,极大地伤害献血者的热情及其权益。
以第一次检测为时间起点,拟归队检测的时间间隔为180~392d,中位数为193d。在本研究单试剂反应组中有2例HBsAg、1例抗-HCV经NAT及确证试验证实,2例HBsAg召回时间间隔为263d、306d,另1例抗-HCV为322d。由于间隔时间过长,不能排除归队前的屏蔽期感染。本研究中,NAT检测与确证试验相比,灵敏度为100.00%(3/3),特异性为99.75%(407/408)。与检测抗原抗体的ELISA相比,NAT是检测病原体的核酸,具有窗口期短、不受免疫静默感染影响,以及灵敏度更高的优点[7]。有报道显示,NAT对处于窗口期的标本有也一定比例的检出率[8]。随着NAT技术在临床上的应用日臻成熟,NAT技术用于献血者的归队检测,能降低输血残余风险,保障临床血液安全,同时,减少了因为ELISA假反应而造成的血源浪费,而且不增加额外的检测成本和技术。本研究的局限性在于,标本量少,受召回人群构成的局限,但不影响本次结论的获得。
总之,无偿献血者的归队检测策略,在符合法律法规的要求以及保障输血安全的前提下,应根据实验室的具体情况作相应的调整,在保证受血者安全和不浪费血液两者间找个平衡点。NAT技术用于献血者的归队检测,具有灵敏度高、特异性好的特点,能有效降低输血残余风险,提高输血安全的作用。在同时进行核酸检测时,ELISA的灰区可以取消设置,以减少血源流失、血液浪费,减少假反应性归队的人员数,有效缓和临床用血的供应紧张。
1 郭永建,姚凤兰,林授,等.HIV-1 和HCV核酸检测、血液处置和献血者屏蔽与归队指引( 上)[J].中国输血杂志,2011,24( 1) :79-85.
2 Li L,Xu T,Yang T,et al. Establishing a Reentry Procedure for HIV Screening Reactive Donors in China[J].Transfusion,2016,56(1):195-202.
3 杨涛,牛丽彬,李玲,等.抗-HCV酶免筛查反应性献血者确证策略研究[J].中国输血杂志,2016,29(1):13-16.
4 FDA.Guidance for industry. nucleic acid testing(NAT)for humanimmunodeficiency virus type 1 (HIV-1 ) and hepatitis C virus(HCV):testing,product disposition,and donor deferral and reentry,2010-05[J].
5 Philip K,Erica W.Can we improve the management of blood donorswith nonspecific reactivity in viral screening and confirmatory as-says?[J]. Transfus Med Rev,2005,19(1):58-65.
6 李金明.血液感染性疾病标志物筛检中应重视的若干问题[J].中华检验医学杂志,2005,28(6):569-571.
7 曾劲峰,郑欣,许晓绚.ELISA 检测与NAT 在血液筛查应用中的互补性研究[J].中国输血杂志,2011,24(1) :79-85.
8 VermeulenM,vanDrimmelenH,ColemanC. Mathematical approach to estimate the efficacy of individual-donation and minipool nucleic acid amplificationtest options in preventing transmission risk by window period and occult hepatitis B virus infections[J]. Transfusion,2014,54(10):2496-2504.
Discussion on Re-entry Detective Strategy for Unpaid Blood Donors with False-reactive Results in Huizhou
LI Xue-qun,YAN Feng-hao,ZHONG Zhan-hua,et al.
Huizhou Central Blood Station,Huizhou 516003
Objective To investigate the sense of keeping the border area, find the re-entry detective strategy, follow-up detection were used to check the blood donors with false-reactive results in basic-level blood station. Methods during January 2014 to February 2016, 712 cases which reacted in single reagent(including border area)were selected. Based on ELISA test results, specimens were divided into border area group and single-reagent-reactive group. After more than six months of shielding,re-entry specimens were tested by ELISA in double reagent, nucleic acid testing (NAT) and confirmatory test. Results In the first ELISA test, the result were confirmed by NAT(or TPPA) , the difference of the falsereactive rate of HBsAg and anti-TP in the border area group and single-reagent-reactive group was statistically significant, P<0.05.While the difference of anti-HCV false-reactive rate between the two groups has no statistical significance. After more than six months of shielding, the re-entry test showed that, 1 of 213 in the border area group was reactive in NAT, but not confirmed by the confirmatory test, 3 of the 268 in the single-reagent-reactive group were confirmed by NAT and confirmatory test. Conclusion Since NAT was carried out broadly under the present detection mode, if keep on setting border area, it will increase the false-reactive specimens, may result in blood waste.
False-reactive Unpaid blood donor Re-entry Nucleic acid testing
R193.2 R392.11
C
1671-2587(2017)02-0194-04
2016-11-11)
(本文编辑:姚萍)
10.3969/j.issn.1671-2587.2017.02.030
516003 汕头大学医学院微生物与免疫学教研室(李雪群,李康生);惠州市中心血站(李雪群,严凤好,钟展华,万小春,蓝建崇)
李雪群(1981–),女,广东肇庆人,主管技师,学士,主要从事疑难配血及血液质量控制工作,(E-mail)42793630@qq.com。
李康生,男,教授,博士生导师,主要从事神经免疫与抗感染免疫研究,(E-mail)ksli@stu.edu.cn。

