双氯芬酸钠肠溶缓释片的制备及体外释放度的研究
刘思佼,王明旭
(西安交通大学,陕西西安 710061)
双氯芬酸钠肠溶缓释片的制备及体外释放度的研究
刘思佼,王明旭
(西安交通大学,陕西西安 710061)
以HPMC K15M、HPMC K4M制备双氯芬酸钠亲水凝胶骨架片,采用肠溶欧巴代进行包衣,并研究了肠溶缓释片的体外释放度。缓释片处方为主药∶HPMC K15M∶HPMC K4M∶MCC∶乳糖∶硬脂酸镁=75∶50∶20∶115∶40∶3;包衣材料为12%的肠溶欧巴代水溶液,药片增重3%~4%;体外释放情况为2h:37.2%,6h:70.9%,12h:92.2%,对药物的释放情况进行拟合,符合一级方程。
双氯酚酸钠,缓释片,肠溶片,体外释放度
双氯芬酸钠为芳基乙酸类非甾体抗炎药,广泛应用于各类慢性骨关节疼痛[1]。与同类药物相比,其镇痛、消炎及解热作用比吲哚美辛强2~2.5倍,比阿司匹林强26~50倍[2],是一种新型的强效抗炎镇痛药。非甾体类抗炎药最典型的不良反应为对胃肠道的损害[3],其针对的主要病症大都是一些需要长期服药维持治疗的慢性疾病,我们研究了市场上的缓释片,发现其在胃内约有6%~20%的溶出,为了减小该药物对胃的损害,充分发挥其疗效,所以研究该药物的肠溶缓释片非常有必要。
1 仪器与试药
仪器:单冲压片机(DP/30,北京国药龙立科技有限公司);小型包衣机(BY300A型,上海黄浦药检仪器厂);智能溶出试验仪(RC8MD,天大天发科技有限公司);智能片剂硬度仪(YD-20,天津大学无线电厂);高效液相色谱仪(Dionex U3000 紫外检测器);色谱柱(Thermo Scientific C18 150×4.6mm 5μm)。
试药:双氯芬酸钠对照品(中国食品药品检定研究院,批号100334-200302);双氯芬酸钠原料药(安阳九州药业有限责任公司,批号201503009);HPMC K15M(美国陶氏公司);HPMC K4M(上海卡乐康包衣技术有限公司,批号:20150726);MCC(国药集团化学试剂,批号:20160321);乳糖(批准文号:苏药准字F10427702,镇江市康富生物工程有限公司);硬脂酸镁(批准文号:皖药准字F20120001,安徽药辅有限责任公司);PVP(上海蓝季科技发展有限公司,批号:20150315);肠溶欧巴代(上海卡乐康包衣技术有限公司,批号:20150324);甲醇(色谱纯),乙醇、乙酸钠为分析纯。
2 实验部分
2.1 双氯芬酸钠肠溶缓释片的制备
2.1.1 缓释片的制备
主药与辅料均过80目筛,称取主药75g,HPMC K15M 50g,HPMC K4M 20g,MCC 115g,乳糖40g于不锈钢盆中,过80目筛混合4次,分3次向混匀的药粉中加入5% PVP乙醇(80%)溶液150mL,20目筛制粒。60℃干燥3h,过20目筛整粒,加入3g硬脂酸镁,总混,8kg~10kg压片。
2.1.2 缓释片的包衣
取缓释片50片(15g)至小型包衣机中,转速40r/min,温度60℃,压力为0.1MPa。喷入12%的肠溶欧巴代水溶液27mL,药片增重3.3%。
2.2 体外释放度测定方法学考察
2.2.1 色谱条件
色谱柱:Thermo Scientific C18150×4.6mm 5μm,流动相:pH 7.4磷酸盐缓冲液-甲醇(35∶65)[4],流速:0.8mL/min,检测波长:281nm,进样量:20μL。
2.2.2 线性
精密称取双氯芬酸钠对照品12.25mg置50mL容量瓶中,加流动相稀释至刻度,震荡均匀,作为对照品储备液(浓度为245.0μg/mL)。
吸取储备液进行二级稀释制备浓度为61.25μg/mL、30.625μg/mL、15.3125μg/mL、7.65625μg/mL的对照品溶液。分别吸取上述对照品溶液20μL注入色谱柱,HPLC测定,以浓度为横坐标,峰面积为纵坐标,得回归方程:y=1.0171x-0.2112,R2=0.998。实验结果表明双氯芬酸钠在7.65625μg/mL~245.0μg/mL范围内有良好的线性关系。
2.2.3 精密度
依据2015版中国药典四部精密度项下重复性试验方法,取30.625μg/mL的对照品溶液,重复进样8针,HPLC测定,样品的平均浓度为30.320μg/mL,SD=0.139,RSD=0.0459%,符合2015版药典要求。
2.2.4 准确度
依据2015版中国药典四部准确度项下试验方法,分别称取6份3mg的双氯芬酸钠对照品于50mL容量瓶中,溶出介质稀释至刻度。HPLC测定,回收率平均值为0.996726,RSD远小于3%,符合2015版药典要求。
2.2.5 稳定性
取双氯芬酸钠对照品(30.625μg/mL),分别在0h、1h、2h、5h、10h、15h、20h、25h进样,HPLC测定,样品平均浓度为30.378μg/mL,SD=0.0546,RSD=0.1798%,说明双氯芬酸钠对照品溶液在0~25h内稳定。
3 结果与讨论
3.1 释放度的测定结果
依据2015版中国药典四部0931溶出度与释放度测定法项下肠溶制剂方法2进行实验,测定结果见表1。

表1 双氯芬酸钠肠溶缓释片体外累积释放情况(%)Table 1 Diclofenac Sodium enteric-coated sustained-release tablets in vitro release
续表1
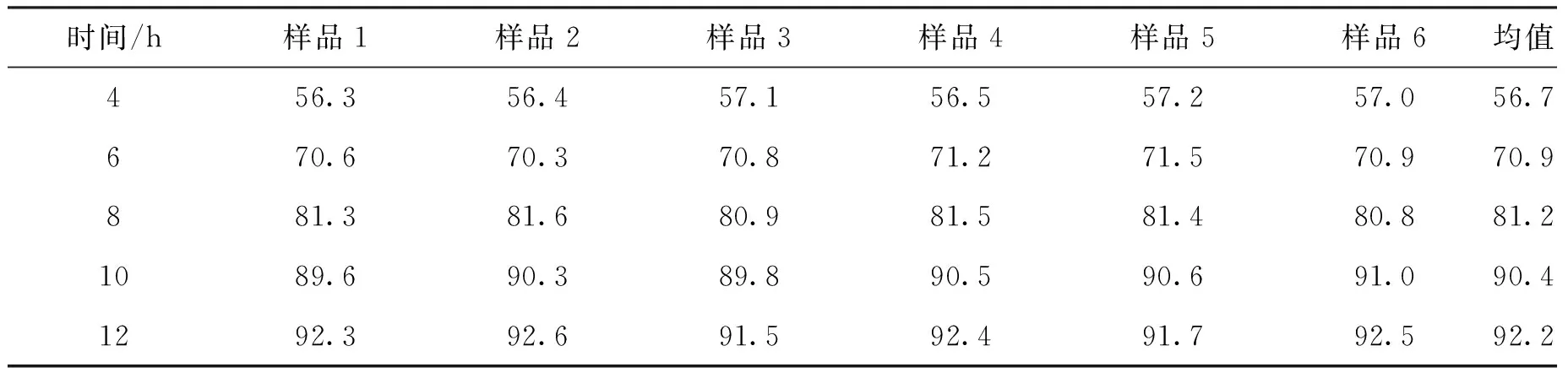
时间/h样品1样品2样品3样品4样品5样品6均值456.356.457.156.557.257.056.7670.670.370.871.271.570.970.9881.381.680.981.581.480.881.21089.690.389.890.590.691.090.41292.392.691.592.491.792.592.2
实验结果显示:酸中未溶出,符合肠溶片的一般要求。包衣后的肠溶片溶出趋势与素片相似,溶出延迟了约30min。对释药模型进行拟合[5],符合一级方程:y=-0.218x+0.0056,R2=0.991。
3.2 处方的筛选
以EC、HPMC K15M、HPMC K4M为缓释材料,制备了双氯芬酸钠不溶性骨架片和亲水凝胶骨架片。制备工艺方面采用了干粉直压和湿法制粒两种方法,分别讨论了不同处方下缓释片的体外释放情况,结果发现亲水凝胶型骨架片药物释放更加完全,12h接近100%。干粉直压的缓释片药物释放较湿法制粒的缓释片快,但相差不大。考虑到生产的可行性和环保型,最终确定最优方案为亲水凝胶骨架片,湿法制粒。最优处方为主药∶HPMC K15M∶HPMC K 4M∶MCC∶乳糖∶硬脂酸镁为75∶50∶20∶115∶40∶3。
3.3 包衣工艺的筛选
采用丙烯酸树脂Ⅱ号、Ⅲ号的混合液及肠溶欧巴代对缓释片进行包衣,考察了不同转速、不同温度、不同包衣液用量对肠溶片的影响。两种包衣液均能满足肠溶包衣的要求,所得包衣片色泽均匀,表面光滑。但与丙烯酸树脂混合包衣液相比,肠溶欧巴代显示出包衣方面的优势,配置方法简单,包衣过程容易操作。而丙烯酸树脂混合物配置较繁琐,往往需要提前48h用无水乙醇浸泡,包衣过程中有粘片现象发生,所得包衣片总体外观较欧巴代差。所以确定以欧巴代为肠溶衣膜材料,最佳包衣参数为:转速 40r/min,温度60℃,压力0.1MPa,药片增重3%~4%。
[1] 王晓明,秦凌浩.双氯芬酸钠-β-环糊精聚合物缓释微球的制备与释药考察[N].医药导报,2014,33(2):248-253.
[2] 刘晓辉.药理学[M].上海:上海出版社,2001:321.
[3] 施文,王永铭,程能能,等.非甾体类抗炎药不良反应研究进展[J].中国临床药理学杂质,2003,19(1):57-62.
[4] 刘洪海,侯晓峰. HPLC法测定双氯芬酸钠缓释片的含量[J].中国药师,2006,9(8):772.
[5] 国家药典委员会.中华人民共和国药典2015年版四部[S].中国医药科技出版社,2015:369.
Study on Diclofenac Sodium Enteric-coated Sustained-release Tablets Preparation and in Vitro Release
LIU Si-jiao,WANG Ming-xu
(Xi’an Jiaotong University,Xi’an 710061,Shaanxi,China)
We use HPMC K15M&HPMC K4M to make preparation of Diclofenac Sodium hydrophlic gel matrix sustained-release tablets,the enteric material is Opadry. And study the in vitro dissolution rate of enteric-coated sustained-release tablets. The formulation of sustained release tablets is Drug∶HPMC K15M∶HPMC K4M∶MCC∶lactose∶=75∶50∶20∶115∶40∶3. The coating materials is 12% enteric Opadry aqueous solution,tablet weight increase of 3% to 4%;In vitro release of 2h:37.2%,6h:70.9%,12h:92.2%,fitting the release of the drug with the first-order equation.
diclofenac sodium,enteric-coated,sustained-release,in vitro release
王明旭,医学博士,二级教授,西安交通大学博士研究生导师;E-mail:wangmx601@mail.xjtu.edu.cn;Tel:13991815026
R 927.2;TQ 460.4

