凝胶渗透色谱—固相萃取结合色谱—质谱法测定乳制品中18种溴系阻燃剂
李健 王翼飞��周显青 施致雄
摘要 采用索氏提取、凝胶渗透色谱和固相萃取技术作为前处理方法,建立乳制品中6种新型溴系阻燃剂、8种多溴联苯醚、四溴双酚A和α、β、γ六溴环十二烷异构体共18种溴系阻燃剂的同时提取与净化方法,并结合气相色谱负化学源质谱法(GCNCI/MS)和高效液相色谱电喷雾电离串联质谱法(HPLCESIMS/MS)进行检测。奶样经冷冻干燥后以正己烷丙酮(1KG-3∶KG-51,V/V)索氏提取,采用凝胶渗透色谱结合酸化硅胶柱净化,随后以LCSi固相萃取柱分离气相和液相待测物。以GCNCI/MS测定6种新型溴系阻燃剂和8种多溴联苯醚,以HPLCMS/MS检测四溴双酚A和六溴环十二烷异构体,内标法定量。结果表明,以空白牛奶样品为加标基质,多数待测物平均回收率为80.1%~114.7%,方法具有良好的精密度(多数待测物相对标准偏差(RSD)在0.87%~14.9%)和灵敏度(检出限在0.2~119.2pg/g之间),可满足乳制品中多种溴系阻燃剂同时提取、净化和检测需求。
关键词溴系阻燃剂;气相色谱负化学源质谱;高效液相色谱串联质谱;乳制品;固相萃取
1引言
自20世纪70年代以来,溴系阻燃剂(BFRs)被广泛应用于各类产品中,但其在生产、使用和产品废弃过程中不断释放到周围环境中,并通过食物链富集放大,由此带来的环境污染和人群健康危害已成为热点问题[1,2\]。多溴联苯醚(PBDEs)、四溴双酚A(TBBPA)和六溴环十二烷(HBCD)是当前产量最大及使用时间最长的3种溴系阻燃剂。在2009年《关于持久性有机污染物的斯德哥尔摩公约》缔约方大会已明确将多溴联苯醚中的五溴和八溴联苯醚列为持久性有机污染物并建议禁用。TBBPA已被欧盟列入优先控制化学品名单,我国则由于TBBPA产量和消费量巨大,已成为TBBPA污染最严重的国家[3\]。HBCD于2013年被确定为持久性有机污染物,我国目前也是HBCD的主要生产和使用國[4\]。
随着传统阻燃剂陆续禁限用,新型溴系阻燃剂(NovelBFRs,NBFRs)逐步推广。例如十溴二苯乙烷(DBDPE)作为十溴二苯醚替代品,自2005年在我国投产以来,年均增幅达80%[5\]。其它NBFRs(如五溴甲苯(PBT))也逐渐推广。在大气、河流底泥、生物体等多基质中均已发现NBFRs残留[6\],甚至在青藏高原和极地地区也发现了BTBPE等NBFRs,表明部分NBFRs也具有持久性有机污染物的特征[7\]。
乳制品是当前消费量快速增长的一大类食品,尤其是婴幼儿配方乳消费量巨大,因此乳制品中环境污染物的污染水平需持续监控。现有研究多针对PBDEs和HBCD等传统BFRs,极少涉及乳制品中NBFRs的监测[8\]。本研究采用凝胶渗透色谱结合固相萃取技术建立乳制品中多种BFRs的同时前处理技术,并采用色谱质谱技术建立仪器分析方法,本方法稳定可靠,适用于乳制品中BFRs的多残留检测,也可用于母乳或其它富含脂肪的食品样本的检测。
2实验部分
2.1仪器与试剂
Agilent7890B5977A气相色谱质谱仪、Agilent12006410高效液相色谱三重四级杆质谱仪(美国安捷伦公司);AccuPrepMPS全自动凝胶渗透净化系统(美国J2Scientific公司)。
农残级或色谱级正己烷、甲醇、二氯甲烷、丙酮、环己烷、乙酸乙酯(美国J&T.Baker公司或迪马公司);硅胶(德国默克公司),使用前经500℃烘烤5h后加入98%浓H2SO4制成44%酸化硅胶;优级纯浓H2SO4(98%)、无水Na2SO4(北京化工厂)。LCSi固相萃取柱(500mg,3mL,美国Supelco公司)。PBDEs混合标准样品(BDECM)包括美国环境保护署1614草案中列出的环境中优先关注的8种PBDEs单体:BDE28,47,99,100,153,154,183和209;新型溴系阻燃剂单体,五溴甲苯(PBT)、五溴乙苯(PBEB)、六溴苯(HBB)、2,3二溴丙基2,4,6三溴苯基醚(DPTE)、1,2双(2,4,6三溴苯氧基)乙烷(BTBPE)和十溴二苯乙烷(DBDPE);内标:3,3′,4,4′,四溴联苯醚(BDE77)和2,2′,3,3′,4,4′,六溴联苯醚(BDE128),上述标准品均购于美国AccuStandard公司。αHBCD,βHBCD,γHBCD和TBBPA及同位素内标13C12BDE209,13C12αHBCD,13C12βHBCD,13C12γHBCD和13C12TBBPA均购自美国WellingtonLaboratories公司。
2.2样品处理
提取:纯牛奶、酸奶、奶粉等奶制品或母乳样品,根据脂肪含量取3~15g(确保脂肪含量约1g),经冷冻干燥机冻干后,于研钵中研碎后置于纤维素提取套筒中,加入内标BDE77、BDE128各1ng,13C12BDE209、13C12TBBPA与13C12α,β,γHBCD各10ng,加标实验时需再加入不同浓度的待测物混合标准液,随后以正己烷/丙酮(1KG-3∶KG-51,V/V)索氏提取16h以上。
自动凝胶色谱净化:索氏提取后蒸去溶剂,以重量法计算脂肪含量,加入乙酸乙酯/环己烷(1KG-3∶KG-51,V/V)复溶至6mL。自动凝胶净化系统采用低压填充柱,填料为50gBioBeadsSX3,柱规格50cm×2cmi.d.;紫外检测器检测波长240nm;流动相为乙酸乙酯/环己烷(1KG-3∶KG-51,V/V),流速5mL/min,进样量5mL,收集20~45min流出组分并减压蒸发至近干,加2mL正己烷复溶,待下一步净化。
酸化硅胶净化:采用自制酸化硅胶净化柱,于20cm×1cm玻璃柱中自下而上依次装填1cm高无水Na2SO4,5g酸化硅胶,1cm高无水Na2SO4。酸化硅胶柱经10mL正己烷淋洗后上样,先用30mL正己烷,再用10mL二氯甲烷洗脱待测物,洗脱液旋转蒸发至近干,加2mL正己烷复溶,待固相萃取柱分离。
气相与液相待测物分离:采用LCSiSPE柱分离气相与液相待测物。SPE柱经6mL正己烷活化后上样,先用6mL正己烷洗脱PBDEs和NBFRs,再用6mL丙酮洗脱TBBPA和HBCD。正己烷洗脱液经氮气吹干后,加入100μL正己烷复溶,待GCNCI/MS检测;丙酮洗脱液经氮气吹干后,加入200μL甲醇复溶,待HPLCMS/MS检测。
2.3色谱质谱条件
2.3.1GCNCI/MS分析条件
GC分析条件:用于检测三至七溴联苯醚(TriHeptaBDE)及PBT,PBEB,HBB,DPTE和BTBPE的色谱柱为30mDB5MS毛细管柱(30m×0.25mm,0.25μm,美国安捷伦公司),色谱柱升温程序:100℃(保持1.5min),以20℃/min升溫至240℃,以5℃/min升温至270℃,以15℃/min升温至300℃(保持7min);载气流速在初始至17min为1.5mL/min,之后升至3mL/min。用于检测BDE209和DBDPE的色谱柱为15mDB5MS毛细管柱(15m×0.25mm,0.1μm,美国安捷伦公司),色谱柱升温程序:100℃(保持1.5min),以25℃/min升温至200℃,以15℃/min升温至300℃,保持6min,柱流量为1.5mL/min。其余条件均相同:载气为He(纯度>99.995%);不分流进样,进样量1μL;进样口温度270℃;传输线温度300℃。
NCI/MS分析条件:甲烷反应气压力0.2MPa;离子源温度200℃,溶剂延迟时间5min。扫描方式为选择离子监测(SIM),BDE209定量离子为m/z486,定性离子为m/z488,13C12BDE209定量离子为m/z494,定性离子为m/z492,其它待测物检测离子均为m/z79和81。以BDE77作为三至六溴联苯醚以及PBT,PBEB,HBB和DPTE的内标,BDE128作为BDE183和BTBPE的内标,13C12BDE209作为BDE209和DBDPE的内标。
2.3.2HPLCMS/MS分析条件HPLC条件色谱柱为EclipsePlusC18柱(100mm×2.1mm,3.5μm,美国安捷伦公司);柱温40℃;进样体积20μL;流速0.3mL/min。流动相A为甲醇,流动相B为水,梯度洗脱:0~0.5min,40%A;0.6~5.0min,40%~80%A;5.1~9.0min,80%~85%A;9.1~13.0min,85%~100%A;13.1~15.0min,100%A。
质谱条件:电喷雾电离源,负电离模式\[ESI(-)\];毛细管电压3.5kV;脱溶剂气温度:350℃;脱溶剂气为N2,流量10L/min;检测模式为多反应监测(MRM);监测离子对为(括号中为碰撞能量):TBBPAm/z542.6/80.9及542.6/78.9(60eV),13C12TBBPAm/z554.6/80.9及554.6/78.9(60eV),HBCDm/z640.7/78.9及640.7/80.9(10eV),13C12HBCDm/z652.7/78.9及652.7/80.9(10eV)。
3结果与讨论
3.1样品前处理条件优化
生物基质中BFRs的提取多采用混合溶剂液固萃取法,如索氏提取或加速溶剂萃取,该方法操作简单且萃取效率较高[9\]。样本提取后的净化操作中需尽可能去除共萃取出来的油脂成分以避免杂质干扰测定。因在凝胶色谱上待测物流出时间为20~45min,脂肪类杂质流出时间为10~25min。因此本实验中先采用凝胶渗透色谱法去除大部分脂肪,再采用酸化硅胶去除剩余脂肪。
由于HBCD的3种异构体在高温下易互相转化,TBBPA因含有酚羟基采用气相测定需衍生化,因此测定HBCDs和TBBPA的最佳方法为HPLCMS/MS,然而GCNCI/MS是测定PBDEs和本实验所检测的几种NBFRs的首选方法。因此前处理过程中若能有效分离HBCD/TBBPA与PBDEs/NBFRs,各待测物便均可在最佳条件下进行检测。本研究表明,在LCSiSPE柱上可实现两部分待测物的分离,以正己烷为溶剂时,PBDEs和NBFRs在LCSi柱中不被保留,随正己烷流出,HBCD/TBBPA则被LCSi填料吸附,并可在PBDEs和NBFRs完全流出后再应用强极性溶剂洗脱。分离操作时,上样后再加6mL正己烷,即可完全洗脱PBDEs和NBFRs。随后采用强极性溶剂丙酮可完全洗脱HBCD/TBBPA。
3.2色谱质谱条件优化
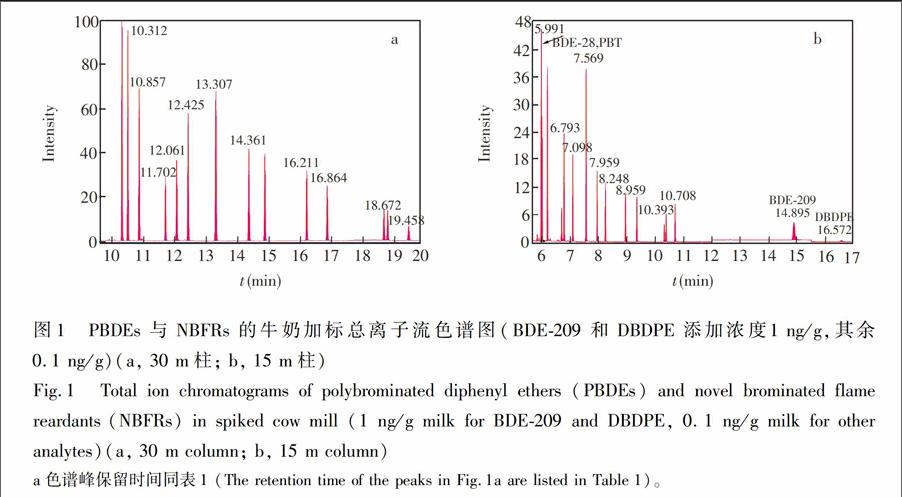
PBDEs测定常采用15m或30m毛细管柱。本研究表明,BDE28和PBT在15m柱上共流出(图1b),在30m柱上两者可以获得良好分离,但在30m柱上高溴代的BDE209和DBDPE由于保留时间过长,导致高温分解无法出峰,因此采用30m柱检测除BDE209及DBDPE外其余化合物(图1a),采用15m柱检测BDE209和DBDPE(图1b)。NCI/MS是测定PBDEs最常用方法,通过对6种NBFRs测定条件的摸索发现待测NBFRs与PBDEs类似,在NCI/MS下响应明显高于EI/MS,且在NCI源中产生的最主要离子同样是Br
,该结果与现有文献结果相同[10,11\]。TBBPA和HBCD的质谱优化结果与现有文献结果类似,均在ESI源的负离子模式下呈现出最高响应[12\]。
3.3方法学考察
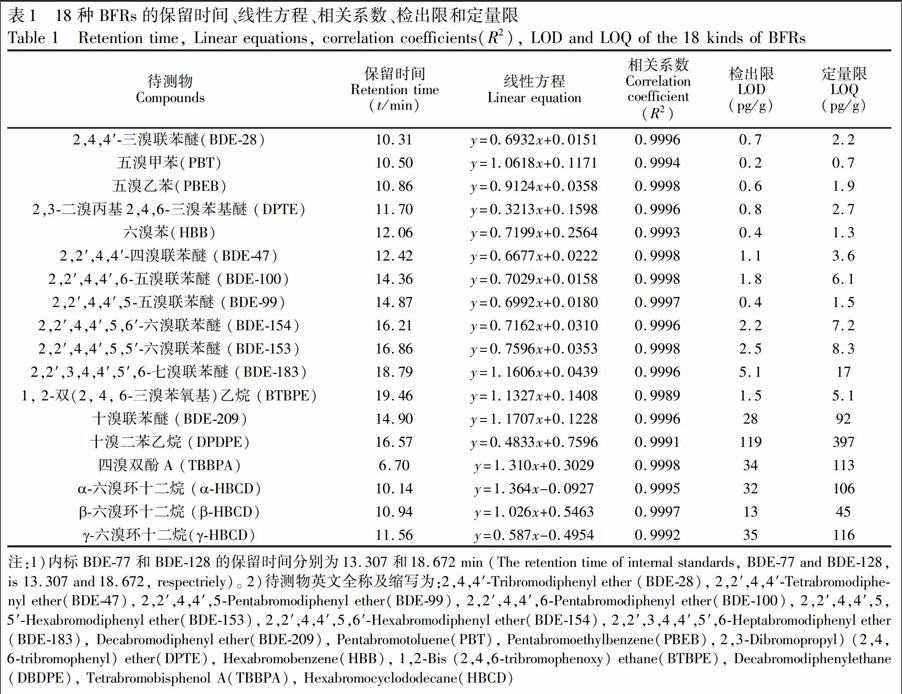
3.3.1线性实验与检出限用正己烷配制PBDEs和NBFRs系列混合标准溶液,其中三溴至七溴联苯醚以及PBT,PBEB,HBB,DPTE和BTBPE的浓度为1~100pg/μL,BDE209和DBDPE的浓度为10~1000pg/μL。内标BDE77和BDE128浓度均为10pg/μL,13C12BDE209浓度为100pg/μL。用甲醇配制HBCD和TBBPA系列混合标准溶液,浓度5~500pg/μL,内标13C12α,β,γHBCD和13C12TBBPA浓度均为50pg/μL。按照2.3节所述方法采集各标准溶液色谱图,以各待测物与相应内标物峰面积的比值为纵坐标,各待测物与内标物含量的比值为横坐标,绘制标准曲线,得到的线性回归方程和相关系数见表1。
方法的检测限(LOD)实验以牛奶为加标基质,测定最低加标水平的响应,计算信噪比(S/N),以S/N=3和S/N=10时对应的浓度为检出限(LOD)和定量限(LOQ)。各化合物的保留时间、线性方程、相关系数(R2)、LOD和LOQ结果见表1。各待测物的标准曲线的相关系数R2为0.9989~0.9998,表明标准曲线线性良好。
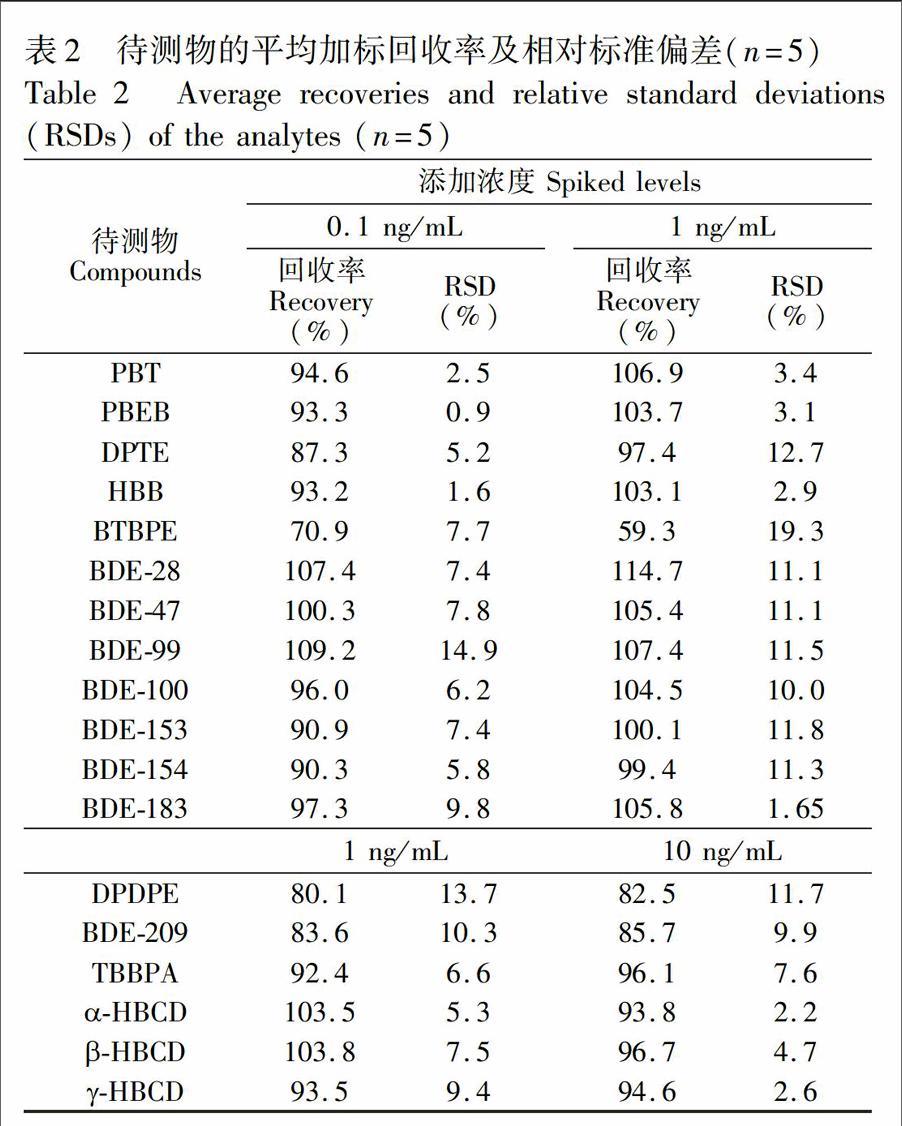
3.3.2加标回收实验以经检测无待测物残留的某品牌纯牛奶为空白基质进行加标回收实验,取样量10g,加标水平如表2所示,每个加标水平按本方法平行测定5次,加标回收率及RSD列于表2。BTBPE回收率普遍偏低且RSD值较高,说明BTBPE在前处理过程中不稳定且有较高损失,其余待测物平均回收率在80.1%~114.7%之間,RSD在0.87%~14.9%之间。
3.3.3基质效应采用提取后添加法考察HPLCMS/MS分析中的基质效应,即比较两组溶液的待测物信号峰面积,其中组1为标准品溶液,组2为某空白纯牛奶样提取液中添加标准品所得溶液,则基质效应(ME)=基质溶液中待测物峰面积/纯溶剂中待测物峰面积。通过对0.1,1.0和10ng/g3个浓度水平的测定,发现乳制品测定时存在基质抑制效应,HBCD和的基质效应比TBBPA更加明显。TBBPA的ME在0.84~0.95之间,αHBCD的ME为0.71~0.93,βHBCD和γHBCD的ME比较接近,均在0.6~0.8之间。为降低基质效应的影响,除了对样品前处理方法和检测条件进行优化之外,采用稳定性核素标记物(13C12HBCD和13C12TBBPA)作为内标是必不可少的。
3.4实际样品测定
应用所建立方法检测8份市售奶制品样本以ZH(及从某妇幼保健院采集的2份母乳样本,结果见表3。在PBDEs、TBBPA和HBCD3种传统阻燃剂中,BDE28,47和99检出率较高,但BDE209污染水平较高,TBBPA和HBCD在母乳中的污染水平比乳制品要高,因为BFRs多具有生物蓄积性,因此处在食物链高端的人类体内BFRs含量普遍高于处在食物链低端的食草类动物。HBCD的3个异构体中,由于代谢速度差异和体内生物转化,导致βHBCD和γHBCD在生物体内含量普遍低于αHBCD,本研究中αHBCD检出率较高而βHBCD和γHBCD均未检出,与文献\[13\]结果类似。在NBFRs中,DBDPE可能由于检出限较高的关系均未检出。PBT在所有样本中均可检出,HBB,DBTE和BTBPE检出率也较高,说明随着NBFRs的迅速推广应用,食品中NBFRs的污染水平也可能随之升高,需持续关注。ZH)
3.5小结
以索氏提取、凝胶色谱和固相萃取为前处理方法,GCNCI/MS和HPLCMS/MS为仪器分析方法,建立了乳制品中18种溴系阻燃剂的检测方法,并实现了18种溴系阻燃剂的同时提取与净化。本方法稳定可靠,可用于食品及生物样品中溴系阻燃剂的多残留分析。
References
1(#FrommeH,BecherG,HilgerB,VolkelW.Int.J.Hyg.Environ.Health,2016,219(1):1-23
2YuG,BuQ,CaoZ,DuX,XiaJ,WuM,HuangJ.Chemosphere,2016,150:479-490
3TIANYuPing,WUJianJun,WANGDongHui,LIYiRui,ZHAYueZhen.JournalofInstrumentalAnalysis,2007,26(z1):652-653
田玉平,吴建军,王东辉,李易瑞,查月珍.HTK分析测试学报,2007,26(z1):652-653
4LiuK,LiJ,YanS,ZhangW,LiY,HanD.Chemosphere,2016,148:8-20
5ZHANGSheng,GUXiaoYu.PlasticsAdditives,2013,6:12-15
张胜,谷晓昱.HTK塑料助剂,2013,6:12-15
6HESongJie,LIMingYuan,JINJun,WANGYing,HEChang,BUYunJie,TIANYang.ChineseJ.Anal.Chem.,2012,40(10):1519-1523
何松洁,李明圆,金军,王英,何畅,卜云洁,田旸.HTK分析化学,2012,40(10):1519-1523
7XiaoH,ShenL,SuY,BarresiE,DejongM,HungH,LeiYD,WaniaF,ReinerEJ,SverkoE,KangSC.Environ.Pollut.,2012,161:154-161
8FrommeH,BecherG,HilgerB,VlkelW.Int.J.Hyg.Environ.Health,2016,219:1-23
9PapachlimitzouA,BarberJL,LosadaS,BersuderP,LawR.J.Chromatogr.A,2012,1219:15-28
10MontieEW,LetcherRJ,ReddyCM,MooreMJ,RubinsteinB,HahnME.Mar.Pollut.Bull.,2010,60(8):1160-1169
11StapletonHM,AllenJG,KellySM,KonstantinovA,KlosterhausS,WatkinsD,McCleanMD,WebsterTF.Environ.Sci.Technol.,2008,42(18):6910-6916
12LIMinJie,JINFen,YANGLiLi,WURiNa,SHAOHua,JINMaoJun,WANGJing.ChineseJ.Anal.Chem.,2014,42(9):1288-1294
李敏潔,金芬,杨莉莉,乌日娜,邵华,金茂俊,王静.HTK分析化学,2014,42(9):1288-1294
13BarghiM,ShinES,SonMH,ChoiSD,PyoH,ChangYS.Environ.Pollut.,2016,213:268-277)
AbstractAnovelmethodwasdevelopedforthesimultaneousdeterminationof6novelbrominatedflameretardants(NBFRs),8polybrominateddiphenylethers(PBDEs),tetrabromobisphenolA(TBBPA)andα,β,γhexabromocyclododecane(α,β,γHBCD)indairyproduct.Dairyproductsampleswereextractedusingsoxhletextractionwithacetone/hexane(1KG-3∶KG-51,V/V).Theremovalofcoextractedmaterialswasachievedbygelpermeationchromatographyfollowedbyacidifiedsilicatreatment.ThefractionationofthePBDEs/NBFRsandHBCD/TBBPAwasperformedusingaSupelcoLCSiSPEcartridge.ThedetectionofthePBDEsandNBFRswasthenperformedbyGCNCI/MS,andthatoftheHBCDsandtheTBBPAwasperformedusingHPLCMS/MS.Arecoverytestwasperformedusingamatrixspikingtestandformostoftheanalytestherecoveriesrangedfrom80.1%to114.7%withRSDsequaltoorlowerthan14.9%.TheLODswere0.2-119.2pg/g.Thismethodologywasvalidatedtobeaccurateandsensitiveforthesimultaneouspretreatmentandanalysisofbrominatedflameretardantsindairyproduct.
KeywordsBrominatedflameretardants;Gaschromatographynegativechemicalionizationmassspectrometry;Highperformanceliquidchromatographytandemmassspectrometry;Dairyproduct;Solidphaseextraction
HQWT6JY(Received30March2016;accepted23June2016)

