牡蛎多糖锌配合物对脂多糖刺激断奶仔猪生长性能和肠道健康的影响
马茂涛 林少伟 殷光文 黄志坚
(福建农林大学动物科学学院,福建省动物药物工程实验室,福州350002)
牡蛎多糖锌配合物对脂多糖刺激断奶仔猪生长性能和肠道健康的影响
马茂涛 林少伟 殷光文 黄志坚*
(福建农林大学动物科学学院,福建省动物药物工程实验室,福州350002)
本试验旨在探讨牡蛎多糖锌配合物对断奶仔猪生长性能和脂多糖刺激断奶仔猪血清抗氧化能力以及空肠黏膜抗炎性因子含量和二糖酶活性的影响。试验选取30头(28±1)日龄的仔猪,按体重相近的原则,随机分为空白对照组(Ⅰ组)、应激对照组(Ⅱ组)、牡蛎多糖低剂量组(Ⅲ组)、牡蛎多糖中剂量组(Ⅳ组)和牡蛎多糖高剂量组(Ⅴ组),每组6个重复,每个重复1头猪。Ⅰ组和Ⅱ组饲喂基础饲粮,Ⅲ、Ⅳ、Ⅴ组分别饲喂在基础饲粮中添加1 000、3 000和5 000 mg/kg牡蛎多糖锌配合物的试验饲粮。饲养试验30 d后,Ⅱ、Ⅲ、Ⅳ、Ⅴ组试验猪按体重腹腔注射100 μg/kg的脂多糖,Ⅰ组注射等量的生理盐水。各组于注射后3 h采血,测定血清抗氧化能力;采集空肠黏膜,酶联免疫吸附试验检测白细胞介素(IL)-2、IL-10和肿瘤坏死因子-α(TNF-α)含量以及二糖酶活性。试验结果显示:1)与Ⅰ组和Ⅱ组相比,Ⅳ组和Ⅴ组平均日增重显著提高(P<0.05),Ⅲ、Ⅳ和Ⅴ组料重比有降低趋势(P>0.05)。2)与Ⅰ组相比,Ⅲ、Ⅳ和Ⅴ组血清总超氧化物歧化酶显著提高(P<0.05);与Ⅱ组相比,Ⅲ、Ⅳ和Ⅴ组血清谷胱甘肽过氧化物酶活性显著提高(P<0.05),血清丙二醛含量显著降低(P<0.05)。3)与Ⅰ组相比,Ⅲ、Ⅳ和Ⅴ组空肠黏膜IL-2和IL-10含量显著提高(P<0.05),其中,Ⅳ组IL-10含量还显著高于Ⅱ组(P<0.05);与Ⅱ组相比,Ⅲ组和Ⅳ组空肠黏膜TNF-α含量显著降低(P<0.05)。4)与Ⅱ组相比,Ⅲ、Ⅳ和Ⅴ组空肠蔗糖酶、麦芽糖酶和乳糖酶活性都有显著性地提高(P<0.05)。由此可见,饲粮中添加牡蛎多糖锌配合物能有效提高断奶仔猪血清抗氧化能力和免疫耐受能力,提高空肠黏膜二糖酶的活性,对免疫应激有明显的缓解作用,其中以饲粮中添加3 000 mg/kg牡蛎多糖锌配合物效果最佳。
牡蛎多糖锌配合物;断奶仔猪;生长性能;抗氧化能力;炎性细胞因子;二糖酶
多糖具有降血脂、抗氧化、调节免疫、抗突变、抗病毒及抗肿瘤等作用,而且对正常的细胞没有毒副作用,因此越来越受到研究人员的重视[1]。利用多糖等免疫药物作为免疫增强剂,提高动物的免疫力,成为畜牧业病害防治的重要方向。李志[2]研究表明牡蛎多糖(oyster polysaccharides,OPS)具有抗肿瘤、抗氧化衰老、抗菌抗病毒以及提高机体免疫功能等作用。而锌是所有动物必需的一种微量元素,它几乎存在于机体所有组织和器官中。机体内至少300种酶中含有锌,这些锌承担着不同的生物功能,在动物的生长发育、免疫、物质代谢及繁殖等多方面起着重要作用[3]。孙国君[4]的研究结果显示锌对断奶仔猪的肠道上皮细胞的免疫功能有调节作用。岳双明[5]的研究结果显示在仔猪饲粮中添加锌可以提高仔猪生长性能,同时可以增强仔猪抗氧化能力以及提高肠道黏膜免疫功能,保护肠道健康。现代药理研究表明,天然药物有效成分与金属离子形成的配合物具有更强的药理活性[6-8]。赵姝雯等[9]关于比较研究金针菇多糖与锌螯合前后的抗肿瘤作用与其体外抗氧化活性的研究,其结果显示金针菇多糖锌配合物抗氧化活性较螯合前有所提高。
脂多糖(lipopolysaccharide,LPS)可引发机体炎症。革兰氏阴性细菌感染时,细菌或LPS进入血循环,激活多种炎症细胞并诱导释放炎性介质,引起炎症反应。同时,机体产生大量自由基,促进机体的氧化反应过程[10]。LPS具有致热、抗肿瘤、增强抗感染力等多种生物学功能,是目前建立免疫应激模型最有效的免疫应激原[11]。
罗刚等[12]和陈腾腾[13]的研究结果表明OPS可以促进断奶仔猪的生长性能并对免疫应激仔猪的肠道健康有缓解作用。本试验在他们试验的基础上,在一定反应条件下,通过OPS和微量元素锌发生螯合反应,形成OPS锌配合物(Zn-OPS),探究Zn-OPS对断奶仔猪生长性能的影响,以及对由LPS引起的处于免疫应激状态下断奶仔猪血清抗氧化能力、肠道黏膜抗炎性因子含量及二糖酶活性的影响,分析饲粮中添加Zn-OPS对由LPS引起的断奶仔猪免疫应激是否有缓解作用和对肠道健康是否有帮助,从而为Zn-OPS应用于猪饲养生产提供理论依据。
1 材料与方法
1.1 试验材料
断奶仔猪由福建省南平某猪场提供;Zn-OPS由实验室自制(火焰原子吸收法测定锌含量为4.6%)。LPS(大肠杆菌血清型O55∶B5,Sigma公司),酶联免疫吸附试验(ELISA)试剂盒(Cusabio公司);酶标仪(芬兰雷勃公司);过氧化氢酶(CAT)活性测定试剂盒,丙二醛(MDA)含量测定试剂盒,总超氧化物歧化酶(T-SOD)活性测定试剂盒,谷胱甘肽过氧化物酶(GSH-Px)活性测定试剂盒,总蛋白含量测定试剂盒(以上试剂盒均来自南京建成生物工程研究所)。
1.2 断奶仔猪免疫应激模型的建立
试验选取30头(28±1)日龄的杜洛克×长白×大白三元阉公仔猪,按体重、窝别等原则随机分为5个组,分别为空白对照组(Ⅰ组)、免疫应激对照组(Ⅱ组)、Zn-OPS低剂量组(Ⅲ组)、Zn-OPS中剂量组(Ⅳ组)和Zn-OPS高剂量组(Ⅴ组),每组6个重复,每个重复1头猪。Ⅰ和Ⅱ组饲喂基础饲粮,其组成及营养水平见表1,Ⅲ、Ⅳ和Ⅴ组分别饲喂在基础饲粮中添加1 000、3 000和5 000 mg/kg Zn-OPS的饲粮。试验预试期3 d,正试期30 d。试验结束,禁食12 h后,Ⅱ、Ⅲ、Ⅳ、Ⅴ组猪按体重腹腔注射100 μg/kg LPS,Ⅰ组注射等量的生理盐水。

表1 基础饲粮组成及营养水平(风干基础)
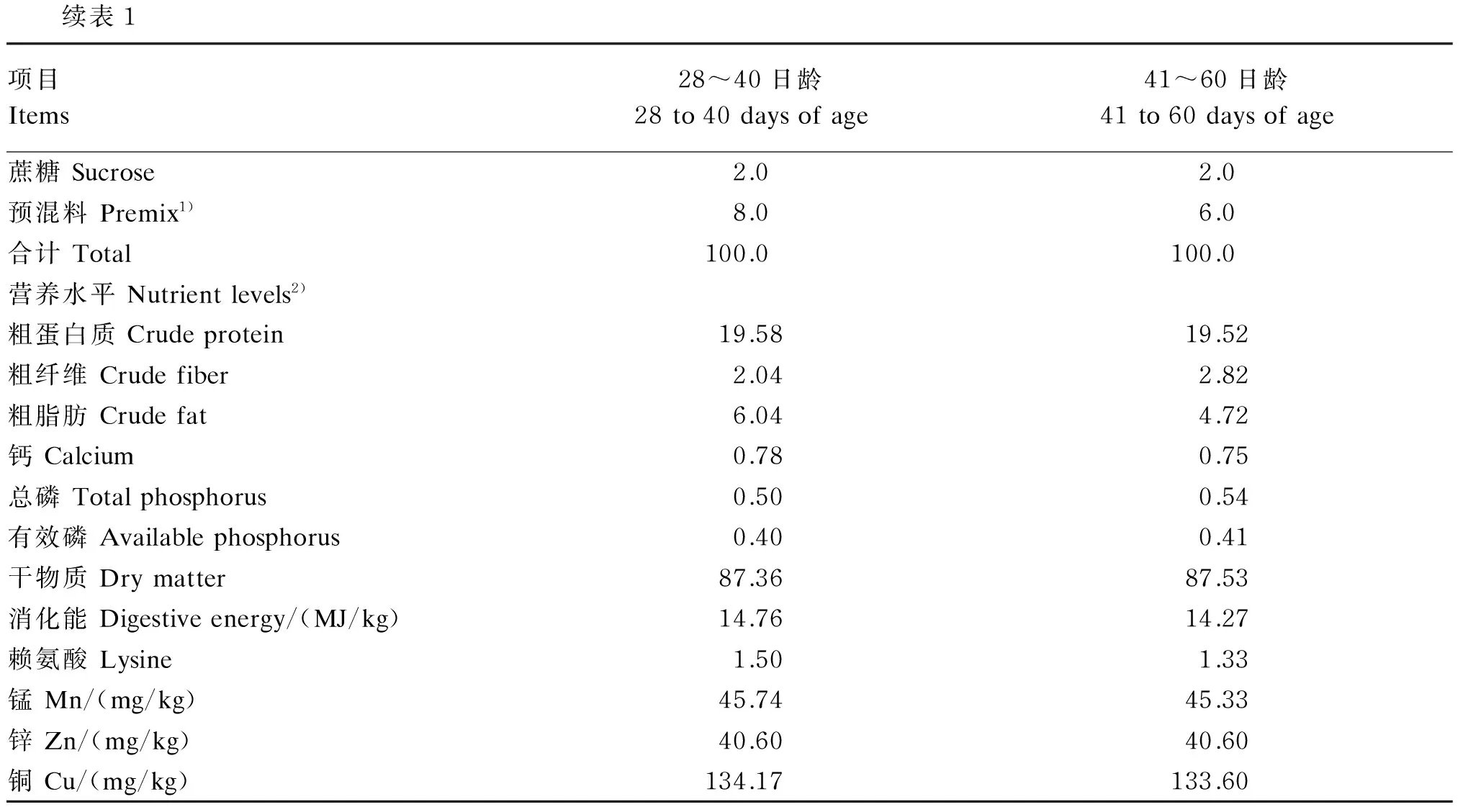
续表1项目Items28~40日龄28to40daysofage41~60日龄41to60daysofage蔗糖Sucrose2.02.0预混料Premix1)8.06.0合计Total100.0100.0营养水平Nutrientlevels2)粗蛋白质Crudeprotein19.5819.52粗纤维Crudefiber2.042.82粗脂肪Crudefat6.044.72钙Calcium0.780.75总磷Totalphosphorus0.500.54有效磷Availablephosphorus0.400.41干物质Drymatter87.3687.53消化能Digestiveenergy/(MJ/kg)14.7614.27赖氨酸Lysine1.501.33锰Mn/(mg/kg)45.7445.33锌Zn/(mg/kg)40.6040.60铜Cu/(mg/kg)134.17133.60
1)每千克预混料含有 One kilogram of premix contained:VA 2 400 IU,VD3240 IU,VE 60 IU,VK 8 IU,生物素 biotin 0.2 mg,氯化胆碱 choline chloride 400 mg,烟酸 niacin 30 mg,核黄素 riboflavin 16 mg,泛酸 pantothenic acid 20 mg,VC 70 mg,VB1240 μg,Cu 10 mg,I 0.15 mg,Fe 100 mg,Mn 20 mg,Se 0.30 mg,Zn 125 mg。
2)消化能为计算值,其他为实测值。DE was a calculated value, while the others were measured values.
1.3 样品的采集及测定
前腔静脉釆血,3 500 r/min离心10 min,分离血清用于抗氧化能力的测定。采用颈静脉放血处死,打开腹腔,将空肠从其肠系膜处取下后于冰上取样。于空肠1/2处截取20 cm左右肠段,剖开空肠,于0.9%生理盐水中轻轻冲洗除去肠壁上的内容物,放置于滤纸上吸干水分,用刀背刮取空肠黏膜10 g于无菌冻存管中,立即放入冰中带回。用匀浆管将空肠黏膜与10 mL蒸馏水充分研磨,3 500 r/min离心10 min,取上清液用于白细胞介素(IL)-2、IL-10、肿瘤坏死因子-α(TNF-α)含量和二糖酶活性的测定。
1.4 测定指标及方法
1.4.1 生长性能
试验仔猪在试验开始和结束时分别逐只空腹称重,每次称重前12 h停止喂食。试验期间记录各组试验仔猪的日采食量,计算平均日增重、平均日采食量和料重比。
1.4.2 血清抗氧化能力
CAT和GSH-Px活性采用比色法测定,MDA含量采用苯巴比妥法测定,T-SOD活性采用黄嘌呤氧化法测定。测定试剂盒购于购自南京建成生物工程研究所,所用仪器为PERSEE-TU1810紫外光分光光度计(北京普析通用仪器责任有限公司),具体操作步骤按试剂盒说明书进行。
1.4.3 空肠黏膜抗炎性因子含量
IL-2、IL-10、TNF-α含量均使用ELISA方法测定,测定试剂盒购于Cusabio公司,所用仪器为TECAN-F50酶标仪,测定方法按照试剂盒使用手册测量。
1.4.4 空肠二糖酶活性
麦芽糖酶、乳糖酶和蔗糖酶活性测定均按照测试试剂盒说明书测量,试剂盒购于南京建成生物工程研究所,所用仪器为PERSEE-TU1810紫外光分光光度计(北京普析通用仪器责任有限公司)。
1.5 数据统计分析
试验数据采用SPSS 17.0软件进行单因素方差分析,采用Duncan氏法进行多重比较,P<0.05为差异显著,试验结果使用“平均值±标准差”表示。
2 结 果
2.1 Zn-OPS对断奶仔猪生长性能的影响
由表2可知,Ⅳ和Ⅴ组的平均日增重较Ⅰ和Ⅱ组有显著性地提高(P<0.05),其中Ⅳ组的平均日增重相较于Ⅰ组提高了18.3%(P<0.05)。Ⅲ、Ⅳ和Ⅴ组的平均日采食量相较于Ⅰ和Ⅱ组有显著性地提高(P<0.05)。Ⅳ和Ⅴ组料重比相较Ⅰ、Ⅱ和Ⅲ组都有降低,但差异不显著(P>0.05)。

表2 Zn-OPS对断奶仔猪生长性能的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05). The same as below.
2.2 Zn-OPS对免疫应激断奶仔猪血清抗氧化能力的影响
由表3可知,Ⅱ组血清CAT活性较Ⅰ、Ⅲ、Ⅳ、Ⅴ组有显著性地提高(P<0.05),Ⅰ、Ⅲ、Ⅳ、Ⅴ组之间无显著性差异(P>0.05);Ⅱ组相较于Ⅰ、Ⅲ、Ⅳ、Ⅴ组血清GSH-Px活性显著性地降低(P<0.05),Ⅰ、Ⅲ、Ⅳ、Ⅴ组之间无显著性差异(P>0.05);Ⅰ、
Ⅲ、Ⅳ、Ⅴ组血清MDA含量较Ⅱ组分别显著降低了11.6%、5.9%、7.3%、5.4%(P<0.05),Ⅲ、Ⅳ、Ⅴ组之间无显著性差异(P>0.05);Ⅲ、Ⅳ、Ⅴ组血清SOD活性较Ⅱ组分别提高了0.9%(P>0.05)、2.5%(P<0.05)、0.9%(P>0.05),Ⅲ、Ⅳ、Ⅴ组之间无显著性差异(P>0.05)。
2.3 Zn-OPS对免疫应激断奶仔猪肠道黏膜抗炎性因子含量的影响
由表4可知,Ⅱ、Ⅲ、Ⅳ、Ⅴ组IL-2和IL-10含量较Ⅰ组都有显著性地提高(P<0.05),同时Ⅳ组IL-2含量较Ⅱ组提高了1.3%(P>0.05),Ⅲ、Ⅳ、Ⅴ组IL-10含量较Ⅱ组分别提高了14.5%(P>0.05)、27.1%(P<0.05)和20.3%(P>0.05)。Zn-OPS添加组各组之间IL-2和IL-10含量无显著性差异(P>0.05)。Ⅱ组TNF-α含量显著高于Ⅰ、Ⅲ和Ⅳ组(P<0.05),Ⅲ、Ⅳ和Ⅴ组TNF-α含量较Ⅱ组降低了23.5%(P<0.05)、35.3%(P<0.05)和5.9%(P>0.05)。
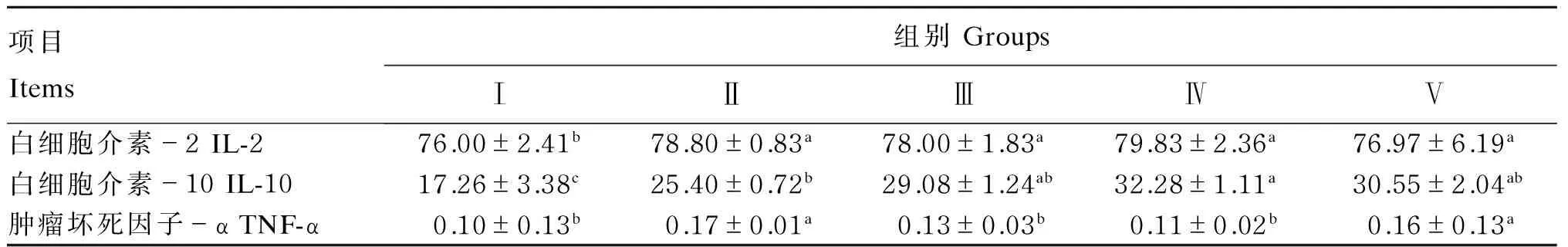
表4 Zn-OPS对免疫应激断奶仔猪肠道黏膜抗炎性因子的影响
2.4 Zn-OPS对免疫应激断奶仔猪空肠二糖酶活性的影响
由表5可知,Ⅰ、Ⅲ、Ⅳ、Ⅴ组各组之间的仔猪空肠乳糖酶、麦芽糖酶和蔗糖酶活性较Ⅱ组都有显著性地提高(P<0.05),Ⅲ组乳糖酶活性较Ⅰ、Ⅳ、Ⅴ组有显著性地降低(P<0.05),Ⅰ组麦芽糖酶活性相较于Zn-OPS添加组有显著性地提高(P<0.05),Zn-OPS添加组各组之间麦芽糖酶及蔗糖酶活性无显著性差异(P>0.05)。
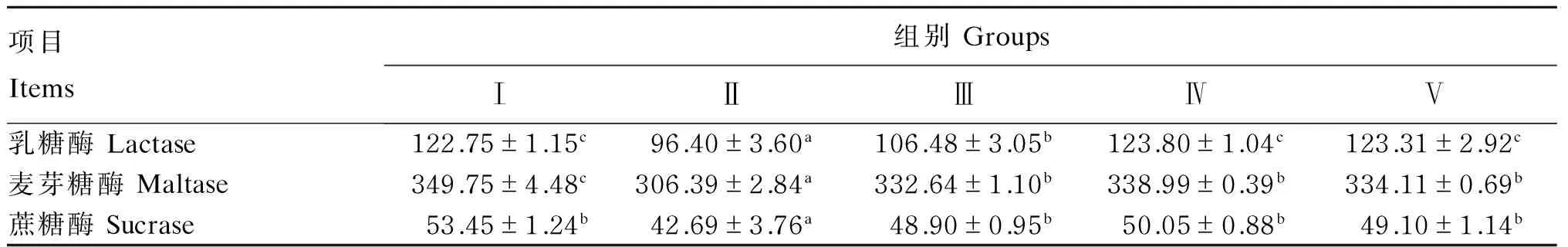
表5 Zn-OPS对免疫应激仔猪空肠二糖酶活性的影响
3 讨 论
3.1 Zn-OPS对断奶仔猪生长性能的影响
大量研究表明,仔猪饲粮中添加多糖能提高仔猪的平均日增重,有利于仔猪的健康生长[14]。陈腾腾[13]研究表明,饲粮中添加OPS可增加平均日增重,提高生长性能。宋志学等[15]研究表明,饲粮中添加红芪粗多糖可显著提高仔猪的生长性能。锌是仔猪生长必不可少的一种微量元素,锌可以增加仔猪的采食量,增强肠道消化能力,提高饲料利用率,促进仔猪生长[3,16]。岳双明[5]的研究表明,饲粮中添加高锌能提高仔猪的生长性能。
本试验结果显示,Ⅲ、Ⅳ和Ⅴ组相较于Ⅰ和Ⅱ组,平均日采食量、平均日增重和料重比都有改善,其中Ⅳ组相较于其他各组效果更为明显,这表明饲粮中添加Zn-OPS能增加仔猪的采食量,提高饲料利用率和断奶仔猪生长性能。可能的原因是Zn-OPS增强了仔猪肠道免疫能力,从而增进仔猪食欲,降低腹泻率。蔡旭滨等[17]关于太子参茎叶多糖应用于断奶仔猪的试验结果显示,饲粮中添加太子参茎叶多糖可以降低断奶仔猪的腹泻率,提高生长性能。
3.2 Zn-OPS对免疫应激断奶仔猪血清抗氧化能力的影响
LPS进入动物机体之后通过改变细胞膜氧化酶系统和微粒体代谢过程,释放大量自由基。自由基具有很强的氧化性,可与体内细胞膜、蛋白质及核酸发生氧化反应,改变它们的功能,对机体造成巨大危害[18]。机体内存在酶类抗氧化系统和非酶类抗氧化系统维持体内自由基的平衡,T-SOD、GSH-Px、CAT是酶类抗氧化系统的重要组成部分。T-SOD可清除超氧阴离子,使细胞和组织免受损害;CAT可以降低细胞中自由基前体的过氧化氢(H2O2)浓度;GSH-Px通过清除氢氧化物和脂质氧化物而抑制自由基的生成反应[19]。MDA作为由自由基引起的脂质过氧化的产物,可作为由于氧化作用而造成细胞损伤程度的重要指标[20-21]。
本试验结果显示,Ⅱ、Ⅲ、Ⅳ、Ⅴ组血清MDA含量和T-SOD活性较Ⅰ组有显著性地提高,CAT活性也呈现升高趋势。这与Ben-Shaul等[22]的研究结果一致,提示仔猪在注射LPS后,血清中自由基含量大量增加,机体进入免疫应激状态。Ⅱ组血清中GSH-Px活性相较于Ⅰ组有显著性地降低,可能的原因是注射LPS后,仔猪机体产生急性免疫应激,GSH-Px活性的降低导致了机体血清中自由基含量的上升[23-24]。此外,本试验中,Zn-OPS添加组的血清T-SOD和GSH-Px活性与Ⅱ组相比都有显著性地提高,血清MDA含量显著性地降低。大量研究均表明饲粮中添加锌和多糖都可以提高机体的抗氧化能力[25-27]。冷炜博等[28]的研究显示饲粮中添加天冬氨酸可以提高黏膜抗氧化酶的活性,显著降低空肠和回肠MDA的含量。宋志学等[15]的研究结果表明饲粮中添加红芪粗多糖可以有效增强仔猪在免疫应激状态的抗氧化能力。本次试验结果说明在饲粮中添加Zn-OPS可以使酶类自由基清除系统活性提高,增强机体的血清抗氧化能力。
3.3 Zn-OPS对免疫应激断奶仔猪肠道黏膜抗炎性因子含量的影响
LPS是革兰氏阴性菌外壁的主要化学成分,通过胃肠道进入动物机体后,可以刺激IL(如IL-2、IL-10)以及TNF-α等细胞因子,激活免疫细胞,增强特异性和非特异性免疫反应[11]。IL-2是T淋巴细胞分泌的一种具有提升免疫反应以及介导免疫耐受,具有双向免疫调节作用的细胞因子[29]。韩杰等[30]研究结果表明,在断奶仔猪饲料中添加多糖可以提高断奶仔猪血液中IL-2的含量。IL-10是由多种细胞分泌的一种多效价细胞因子,既有免疫抑制作用也有免疫刺激作用[31-32]。TNF-α是一个多功能的细胞因子,主要介导动物体的免疫及炎症反应。
本次试验结果显示,Ⅱ组和Zn-OPS添加组在腹腔注射LPS后,与Ⅰ组相比,肠道黏膜中的IL-2、IL-10和TNF-α含量显著性地提高,这与朱春甲等[33]和徐占云等[34]的研究结果一致。说明断奶仔猪在LPS的刺激已经进入免疫应激状态。Zn-OPS添加组与Ⅱ组对比,肠道黏膜中IL-2和IL-10含量有不同程度地提高,而TNF-α含量却有显著性地降低。罗刚等[12]关于OPS对免疫应激仔猪炎性细胞因子和过氧化物酶体增殖物活化受体γ(PPARγ) mRNA转录水平的影响以及周丹[35]关于TNF-α在大鼠早期炎症过程中的初步研究的研究结果均提示血清TNF-α含量的上升。本试验中TNF-α含量下降的原因可能有以下2点:1)Zn-OPS可以提升机体的免疫能力和免疫耐受能力,使得IL-2、IL-10含量上升和TNF-α含量下降,试验结果与施惠娟等[36]关于氧化苦参碱对银屑病小鼠模型血清中IL-2、IL-10、TNF-α含量的影响的研究结果基本一致。2)Zn-OPS中所含的锌元素对提升肠道免疫功能起到作用[4],提示Zn-OPS可以通过调节机体免疫系统对免疫应激仔猪肠道产生保护作用。
3.4 Zn-OPS对免疫应激断奶仔猪空肠二糖酶活性的影响
小肠是机体中食物消化最主要的部位,二糖不能被小肠黏膜直接吸收,所以小肠黏膜上二糖酶的活性对糖水化合物的吸收起着至关重要的作用,其中以麦芽糖酶、蔗糖酶和乳糖酶最为重要[31],其中以空肠二糖酶活性最高[37]。仔猪断奶会引起猪小肠二糖酶活性的下降[38]。本次试验结果显示:注射LPS的Ⅱ、Ⅲ、Ⅳ、Ⅴ组空肠二糖酶活性都显著性地低于Ⅰ组,说明LPS确实可以导致仔猪空肠二糖酶活性的降低[39]。Ⅲ、Ⅳ、Ⅴ组的二糖酶活性与Ⅱ组相比都有显著地提高。陈腾腾[13]关于OPS对LPS刺激断奶仔猪小肠健康的影响的研究结果显示腹腔注射LPS会导致断奶仔猪小肠二糖酶活性的下降,但是饲粮中添加OPS可显著提高二糖酶活性。许梓荣等[38]的研究结果显示微量锌可以提高小肠黏膜中蔗糖酶的活性,但是也一定程度上抑制小肠黏膜中麦芽糖酶的活性。郭彤等[40]研究结果显示Cu2+/ZnO-蒙脱石可以显著提高空肠黏膜二糖酶的活性。本次试验结果说明,Zn-OPS可以提高免疫应激断奶仔猪空肠黏膜的二糖酶活性,能有效缓解LPS引起的免疫应激。
4 结 论
饲粮中添加Zn-OPS可以提高断奶仔猪的生长性能,同时可以有效提高断奶仔猪血清的抗氧化能力,提高仔猪免疫耐受能力,对免疫应激有明显的缓解能力,并且可以显著提高仔猪空肠二糖酶的活性。本试验结果显示,在饲粮中添加3 000 mg/kg的Zn-OPS效果最佳。
[1] 俞慧红,竺巧玲,戴飞,等.多糖抗氧化作用的研究现状[J].食品研究与开发,2008,29(3):172-176.
[2] 李志.牡蛎多糖的分离纯化及生物学活性研究[D].硕士学位论文.福州:福建农林大学,2009.
[3] 吴文平.不同锌源及锌水平对断奶仔猪生产性能和血液生理生化指标的影响[D].硕士学位论文.长沙:湖南农业大学,2007.
[4] 孙国君.锌对仔猪及小肠上皮细胞免疫功能的调节作用[D].博士学位论文.雅安:四川农业大学,2009.
[5] 岳双明.不同蛋白水平日粮添加高锌对早期断奶仔猪生产性能、抗氧化作用和肠道粘膜免疫的影响[D].硕士学位论文.雅安:四川农业大学,2008.
[6] 王晓晖,白海泉,乌兰格日乐.多糖金属配合物的研究进展[J].内蒙古民族大学学报:自然科学版,2014,29(5):516-519.
[7] 马利华,秦卫东,陈学红,等.金针菇多糖-Fe(Ⅱ)螯合物的制备及抗氧化活性[J].食品科学,2010,31(20):202-207.
[8] 蒋伟.金莲花中荭草苷锌配合物合成、表征及其生物活性初步研究[D].硕士学位论文.张家口:河北北方学院,2013.
[9] 赵姝雯,夏宇,陈贵堂,等.金针菇多糖-Zn2+螯合物对L929肿瘤细胞的增殖抑制作用及其抗氧化活性[J].食品科学,2016,37(5):202-207.
[10] 杨帆,崔小强,杨秀荣.SPR生物传感器研究脂多糖与生物分子的相互作用[J].化学传感器,2005,25(2):30-31.
[11] 郭志有,李晶,周勤飞,等.细菌脂多糖在模拟仔猪断奶免疫应激模型上的应用[J].畜禽业,2011(3):46-48.
[12] 罗刚,黄志坚,陈腾腾,等.牡蛎粗多糖对免疫应激仔猪炎性细胞因子和PPARγmRNA转录水平的影响[J].畜牧兽医学报,2014,45(3):483-488.
[13] 陈腾腾.牡蛎粗多糖对脂多糖刺激断奶仔猪小肠健康的影响[D].硕士学位论文.福州:福建农林大学,2014.
[14] 刘祝英.复合多糖对断奶仔猪生产性能和免疫功能影响的研究[D].硕士学位论文.长沙:湖南农业大学,2007.
[15] 宋志学,杜天玺,孙红国,等.红芪粗多糖对免疫应激断奶仔猪生长性能、血清生化指标和抗氧化能力的影响[J].动物营养学报,2013,25(5):1062-1068.
[16] 张纯,陈代文,丁雪梅,等.不同锌源对断奶仔猪生长性能和血液指标的影响[J].西南农业学报,2006,19(3):515-518.
[17] 蔡旭滨,陈凌锋,檀新珠,等.太子参茎叶多糖对断奶仔猪生长性能和血清抗氧化指标、免疫指标及生化指标的影响[J].动物营养学报,2016,28(12):3867-3874.
[18] NISHI K,ODA T,TAKABUCHI S,et al.LPS induces hypoxia-inducible factor 1 activtion in macrophage-differentiated cells in a reactive oxygen species-dependent manner[J].Antioxidants & Redox Signaling,2008,10(5):983-995.
[19] 姜招峰.自由基医学的基础理论[J].齐齐哈尔医学院学报,1990,11(1):39-42.
[20] HORTON A A,FAIRHURST S,BUS J S.Lipid peroxidation and mechanisms of toxicity[J].Critical Reviews in Toxicology,1987,18(1):27-29.
[21] FREEMAN B A,CRAPO J D.Biology of disease:free radicals and tissue injury[J].Laboratory Investigation,1982,47(5):412-426.
[22] BEN-SHAUL V,LOMNITSKI L,NYSKA A,et al.The effect of natural antioxidants,NAO and apocynin,on oxidative stress in the rat heart following LPS challenge[J].Toxicology Letters,2001,123(1):1-10.
[23] 张伟,杨震国,侯永清,等.N-乙酰半胱氨酸对脂多糖刺激仔猪空肠黏膜抗氧化能力的影响[J].动物营养学报,2011,23(5):842-847.
[24] 田新强,许瑞龄,尹蕾.N-乙酰半胱氨酸对脂多糖诱导的小鼠肝MAPK磷酸化的影响[J].中国病理生理杂志,2008,24(8):1565-1569.
[25] 方洛云,邹晓庭,蒋林树,等.不同锌源对断奶仔猪免疫和抗氧化作用的影响[J].中国兽医学报,2005,25(2):201-203.
[26] 冯望宝,王丽,王安.微量元素锌在动物营养上的研究进展[J].饲料博览,2007(3):51-54.
[27] 杨保收,陈越,金久善.锌与自由基[J].中国兽医杂志,1999,25(11):42-44.
[28] 冷炜博,刘玉兰,李爽,等.天冬氨酸对脂多糖刺激断奶仔猪肠道形态结构和黏膜抗氧化能力的影响[J].中国畜牧杂志,2014,50(11):32-36.
[29] 翟志敏.IL-2对免疫激活和免疫耐受的双向调节作用[J].中国药理学通报,2013,29(3):319-322.
[30] 韩杰,边连全,张一然,等.刺五加多糖对脂多糖免疫应激断奶仔猪生长性能和血液生理生化指标的影响[J].动物营养学报,2013,25(5):1054-1061.
[31] 周琳,周光炎,路丽明.IL-10的双向免疫调节作用[J].细胞与分子免疫学杂志,2012,28(10):1100-1102,1106.
[32] 郭锦锦,孙万邦.IL-10受体及其信号转导研究进展[J].临床医学工程,2012,19(1):135-137.
[33] 朱春甲,朱红涛,汪坤,等.异丙肾上腺素对脂多糖诱导的大鼠肺泡巨噬细胞分泌TNF-α和IL-10及吞噬功能影响的研究[J].安徽医学,2009,30(6):656-658.
[34] 徐占云,秦睿玲,褚耀诚,等.枸杞多糖对雏鸡淋巴细胞体外增殖及分泌IL-2的影响[J].畜牧兽医学报,2013,44(2):322-328.
[35] 周丹.肿瘤坏死因子(TNF-α)在大鼠早期炎症过程中的初步研究[D].硕士学位论文.南通:南通大学,2009.
[36] 施惠娟,周茹,金少举,等.氧化苦参碱对银屑病小鼠模型血清中IL-2、IL-10、TNF-α水平的影响[J].华西药学杂志,2010,25(4):418-420.
[37] 宋小珍,刘风华,王恬,等.中药复方对热应激猪小肠二糖酶活性及葡萄糖转运蛋白表达的影响[C]//纪念中国畜牧兽医学会中兽医学分会成立30周年中国畜牧兽医学会中兽医学分会2009年学术年会、华东区第十九次中兽医科研协作与学术研讨会论文集.南昌,江西,中国:中国畜牧兽医学会,2009.
[38] 许梓荣,李卫芬,孙建义.猪胃肠道黏膜二糖酶的性质[J].动物学报,2002,48(2):202-207.
[39] 范伟,刘玉兰,孟国权,等.脂多糖刺激对断奶仔猪小肠结构的影响及机理[J].黑龙江畜牧兽医,2010(3):65-67.
[40] 郭彤,吴艳,李晓晨,等.Cu2+/ZnO-蒙脱石对断奶仔猪生长性能、肠道菌群、黏膜二糖酶活性及肠黏膜形态的影响[J].中国畜牧杂志,2016,52(17):48-53,59.
*Corresponding author, professor, E-mail: huangzj1999@sina.com
(责任编辑 田艳明)
Effects of Oyster Polysaccharide-Zinc Complex on Growth Performance and Intestinal Health of Weaned Piglets Induced by Lipopolysaccharide
MA Maotao LIN Shaowei YIN Guangwen HUANG Zhijian*
(EngineeringLaboratoryofAnimalPharmaceuticals,CollegeofAnimalScience,FujianAgricultureandForestryUniversity,Fuzhou350002,China)
This study was conducted to investigate the effects of oyster polysaccharide (OPS)-zinc complex (Zn-OPS) on growth performance of weaned piglets, and serum antioxidant capacity and anti-inflammatory factor content and disaccharidase activity in jejunum mucosa of immunized pigs with lipopolysaccharide (LPS). A total of thirty piglets of (28±1) days of age were randomly allocated into five groups named blank control (group Ⅰ), immunological stress control (group Ⅱ) and low OPS (group Ⅲ), medium OPS (group Ⅳ) and high OPS (group Ⅴ) with six replicates per group and one pig in each replicate according to the principle of similar weight. Piglets in groups Ⅰ and Ⅱ were fed basal diets, and in groups Ⅲ, Ⅳ and Ⅴ were fed basal diets supplemented with 1 000, 3 000 and 5 000 mg/kg Zn-OPS, respectively. The piglets were injected intraperitoneally with a dose of LPS (100 μg/kg BW) except in group Ⅰ which were injected with the same dose of normal saline after 30 days of feeding experiment. And three hours after injection, the serum samples were collected to measure antioxidant capacity, and the jejunum mucosa was collected for measuring contents of interleukin (IL)-2, IL-10 and tumor necrosis factor-α (TNF-α) and disaccharidase activity by enzyme linked immunosorbent assay. The results showed as follows: 1) compare with groups Ⅰ and Ⅱ, average daily gain of weaned piglets in groups Ⅳ and Ⅴ was significantly increased (P<0.05), and the ratio of feed to gain in groups Ⅲ, Ⅳ and Ⅴ was decreased in some tendency (P>0.05). 2) Compare with group Ⅰ, the serum total superoxide dismutase activity in groups Ⅲ, Ⅳ and Ⅴ was significantly increased (P<0.05). And compare with group Ⅱ, the serum glutathione peroxidase activity in groups Ⅲ, Ⅳ and Ⅴ was significantly increased (P<0.05), while the serum malondialdehyde content was significantly decreased (P<0.05). 3) Compare with group Ⅰ, the contents of IL-2 and IL-10 of jejunum mucosa in groups Ⅲ, Ⅳ and Ⅴ were significantly increased (P<0.05), and IL-10 content in group Ⅳ was significantly higher than that in group Ⅱ (P<0.05). Compare with group Ⅱ, TNF-α content of jejunum mucosa in groups Ⅲ and Ⅳ was significantly decreased (P<0.05). 4) Compare with group Ⅱ, the activities of sucrose, maltase and lactase of jejunum mucosa in groups Ⅲ, Ⅳ and Ⅴ were significantly increased (P<0.05). It is concluded that dietary Zn-OPS can improve the serum antioxidant capacity and immune tolerance of piglets, increase the jejunum mucosal disaccharidase activity, which can relieve the immune stress. The effect of Zn-OPS supplemented with 3 000 mg/kg is the best.[ChineseJournalofAnimalNutrition, 2017, 29(4):1359-1366]
Zn-OPS; weaned piglets; growth performance; antioxidant capacity; inflammatory cytokines; disaccharidase
10.3969/j.issn.1006-267x.2017.04.034
2017-01-16
福建省科技厅引导项目(2015N0017);国家自然科学基金——青年基金项目(31502058);校科技发展资金项目(KF2015017)
马茂涛(1991—),男,福建宁德人,硕士研究生,从事临床兽医学研究。E-mail: 452650019@qq.com
*通信作者:黄志坚,教授,硕士生导师,E-mail: huangzj1999@sina.com
S816.7
A
1006-267X(2017)04-1359-08

