对禾草源同型发酵和/或异型发酵乳酸菌发酵无芒雀麦青贮有氧稳定性的评价
塔 娜 魏日华 德庆哈拉 那日苏 王 海*
(1.中国农业科学院草原研究所/农业部草地生态与修复治理重点实验室,呼和浩特010010;2.嘉吉饲料(内蒙古)有限公司,包头014000;3.内蒙古家畜改良工作站,呼和浩特010010)
对禾草源同型发酵和/或异型发酵乳酸菌发酵无芒雀麦青贮有氧稳定性的评价
塔 娜1魏日华2德庆哈拉3那日苏1王 海1*
(1.中国农业科学院草原研究所/农业部草地生态与修复治理重点实验室,呼和浩特010010;2.嘉吉饲料(内蒙古)有限公司,包头014000;3.内蒙古家畜改良工作站,呼和浩特010010)
本研究旨在评价禾草源同型发酵和/或异型发酵乳酸菌发酵对无芒雀麦青贮有氧稳定性的作用效果。将从禾本科牧草上分离筛选出的2株同型发酵植物乳杆菌(Lactobacillusplantarum)和蒙氏肠球菌(Enterococcusmundtti)及1株异型发酵布氏乳杆菌(Lactobacillusbuchneri)制成发酵剂。选用开花期无芒雀麦,刈割切段至2~3 cm,根据所喷发酵剂菌株的不同,分为4个处理:1)对照处理(con处理),喷洒无菌去离子水;2)异型发酵处理(he处理),喷洒布氏乳杆菌液;3)同型发酵处理(ho处理),喷洒植物乳杆菌和蒙氏肠球菌混合液(2种菌1∶1混合);4)同型发酵+异型发酵处理(he+ho处理),喷洒布氏乳杆菌、植物乳杆菌和蒙氏肠球菌混合液(3种菌1∶1∶1混合)。各处理喷洒量均为10 mL/kg鲜牧草,喷洒总菌数约为5×105CFU/g鲜牧草,每个处理设5个重复。实验室常温发酵60 d后开封,通过测定无芒雀麦青贮营养成分、菌群数量及中心温度变化评价其有氧稳定性。结果显示:经60 d青贮发酵后,4个处理的pH均较青贮前显著降低(P<0.05),所有处理发酵效果均较好(pH≤4.3),尤以ho处理效果最优。而在有氧暴露试验期间,con和ho处理的pH迅速增加,至第8天时达到7以上;he+ho处理pH增加幅度略低于con和ho处理,其pH至第8天时为6.3,显著低于con和ho处理(P<0.05);he处理pH增加非常缓慢,至第8天时仅为4.4,显著低于其他处理(P<0.05)。经60 d青贮发酵后,可溶性碳水化合物(WSC)含量以ho处理最高,显著高于其他处理(P<0.05);con处理最低,显著低于其他处理(P<0.05)。而在有氧暴露试验期间,WSC含量在ho处理中迅速降低,在he处理中缓慢降低;至第8天时,WSC含量以he处理最高,he+ho处理显著低于前者(P<0.05),而con和ho处理则显著低于he和he+ho处理(P<0.05)。青贮发酵后霉菌数量明显受到抑制,且以单独添加异型发酵乳酸菌和混合添加同型发酵和异型发酵乳酸菌时抑制效果较优,这2个处理均未检出霉菌,且he+ho处理在有氧暴露至第5天时仍未检出霉菌,he处理在有氧暴露至第8天时仍未检出霉菌。在有氧暴露第3和5天时,he和he+ho处理酵母菌数量显著低于con、ho处理(P<0.05)。在有氧暴露第8天时,he+ho与he处理的乳酸、乙酸浓度均显著高于另2个处理(P<0.05)。he、he+ho、con和ho处理的有氧稳定性依次降低,分别为194、126、62和58 h。综合评价结果得出:布氏乳杆菌单独或与同型发酵乳酸菌蒙氏肠球菌和植物乳杆菌联合接种可有效抑制无芒雀麦青贮的有氧腐败,保证无芒雀麦青贮有氧暴露期间品质的稳定,且前者更有效;接种同型发酵乳酸菌蒙氏肠球菌和植物乳杆菌未能在提高无芒雀麦青贮有氧稳定性方面表现出积极的作用。关键词:无芒雀麦;同型发酵乳酸菌;异型发酵乳酸菌;青贮;有氧稳定性
青贮饲料在取饲过程中,空气易浸透入窖,诱发在厌氧阶段休眠的好氧微生物(酵母菌、霉菌等)增殖,使青贮饲料温度、pH升高,导致青贮好氧腐败,造成营养物质大量损失[1-2]。因此,防止或降低青贮好氧腐败,提高有氧稳定性是保证青贮饲料品质的关键环节。目前,有关青贮饲料有氧稳定性的研究中,常规评价主要通过3个方面:其一,青贮温度变化(一般以环境温度为参照,青贮有氧暴露后,其中心温度不高于环境温度2 ℃所持续的时间)[3];其二,化学分析[测定pH、有机酸含量、可溶性碳水化合物(WSC)含量、干物质(DM)含量变化及CO2生成量等][4-5];其三,微生物培养(乳酸菌、酵母菌、霉菌、丁酸菌等变化)[4-5]。
青贮饲料制备过程中应用的乳酸菌种质资源丰富,不同菌种在青贮发酵体系中生长、作用及功能区别很大。同型发酵乳酸菌(hoLAB)具有较快的发酵特性和有效抑制不良微生物的活性,且营养物质损失较小,能够较好的保存青绿饲料的营养价值,所以广泛应用于青贮饲料的生产与研究中[6-7]。然而,近几年随着青贮饲料有氧稳定性方面研究的深入,有研究指出基于同型发酵乳酸菌的青贮接种物对好氧稳定性几乎没有有益的效果,甚至会降低青贮饲料的有氧稳定性,容易引起青贮的好氧腐败[8-9]。而异型发酵乳酸菌(heLAB)对提高青贮有氧稳定性方面的积极作用开始受到人们的关注[10-11],以及同型和/或异型乳酸菌混合添加对青贮有氧稳定性的作用效果逐渐成为青贮乳酸菌添加剂方面的研究热点[12-13]。
在自然条件下禾本科牧草叶围附着乳酸菌数量较少,且不良微生物较多[14-15]。若想获得成功的青贮,必须添加乳酸菌,主导其发酵,促进养分较好的保存下来。成品青贮发酵剂种类繁多,来源不同,大多以引进国外的进口发酵剂为主,价格昂贵,且微生物的生长有其特定的环境与温度,其对国内环境的适应性及使用效果也有待证实。不同菌种具有不同的特性,对不同的青贮底物其作用效果也不尽相同[16-17]。本研究结合上述3种评价方法,对禾草源3株不同发酵类型乳酸菌对无芒雀麦青贮有氧稳定性的作用效果进行分析探讨,旨在为调制优质牧草青贮并使其养分稳定的保存和推广应用提供科学依据。
1 材料与方法
1.1 乳酸菌添加剂的制备
前期从禾本科牧草上分离筛选出3株供试菌株——植物乳杆菌(Lactobacillusplantarum)、蒙氏肠球菌(Enterococcusmundtti)和布氏乳杆菌(Lactobacillusbuchneri)。其中植物乳杆菌和蒙氏肠球菌为禾草源同型发酵乳酸菌,布氏乳杆菌为禾草源异型发酵乳酸菌。分别取1环上述供试菌株转接入5 mL MRS液体培养基中,30 ℃培养72 h,培养液中活菌数约为1×109CFU/mL。根据添加菌株的不同,取要求体积的培养液(其中单种菌的取2 mL,2种菌的各取1 mL,3种菌的各取0.7 mL),并分别用等量的无菌去离子水稀释10倍,喷洒前均匀混合,喷洒量为10 mL/kg鲜牧草,喷洒总菌数约为5×105CFU/g鲜牧草。
1.2 无芒雀麦青贮制作
采集锡盟正蓝旗人工种植的开花期无芒雀麦,刈割切段至2~3 cm,将制备好的乳酸菌液用喷壶均匀喷洒于材料牧草上,并充分混匀,装入3 L透明聚碳酸酯(PC)瓶中,每瓶约1.5 kg,压紧,密封。根据所喷菌株不同,分为4个处理:1)对照处理(con处理),喷洒无菌去离子水;2)异型发酵处理(he处理),喷洒布氏乳杆菌液;3)同型发酵处理(ho处理),喷洒植物乳杆菌和蒙氏肠球菌混合液;4)异型发酵+同型发酵处理(he+ho处理),喷洒布氏乳杆菌、植物乳杆菌和蒙氏肠球菌混合液。每个处理设5个重复。实验室常温发酵,试验期60 d。
1.3 样品采集与测定指标
分别在发酵第0天(发酵前)和第60天,采集原料牧草和无芒雀麦青贮样品测定营养物质含量,包括DM、粗蛋白质(CP)、酸性洗涤纤维(ADF)、中性洗涤纤维(NDF)和WSC含量。
发酵第60天后,每组取3个重复,开封后于第0(刚开封时)、1、3、5、8天时取无芒雀麦青贮样品,同一样品连续取5次,且取样后不再封口。取无芒雀麦青贮鲜样30 g,加入270 mL蒸馏水,浸泡60 min后用搅拌机充分搅拌,4层纱布过滤,取滤液,测定滤液pH及挥发性脂肪酸(VFA)、乳酸(LA)浓度。同时,监测开封后无芒雀麦青贮样品中乳酸菌、霉菌和酵母菌数量动态变化、WSC含量动态变化及有氧稳定性。
1.4 测定方法
样品中常规营养物质(DM、CP、ADF、NDF)含量参考张丽英[18]的方法测定,WSC含量采用蒽酮比色法[19]测定,pH直接用便携式pH计(Horiba,Twin-B-212)测定。
样品中VFA及LA浓度采用气相色谱法测定,测定原理为:LA与适当过量的四甲基氢氧化铵作用生成季铵盐,用二甲基甲酰胺将其溶解,在室温下季铵盐与过量碘甲烷完全反应生成相应甲酯衍生物。甲酯衍生物在15%的邻苯二甲酸二壬酯与5%的吐温-80混合固定相不锈钢色谱柱上进行分离,用保留时间定性、外标法定量测定。仪器:气相色谱仪(岛津GC-9A,日本),氢火焰离子化检测器;色谱柱:柱长2 m,内径3 mm,不锈钢柱;固定相:15%的邻苯二甲酸二壬酯与5%的吐温-80混合固定液,担体为Chromosorb HP(80~100目);温度:柱温100 ℃,检测器及汽化室温度150 ℃;气体流速:载气(氮气),30 mL/min;氢气,50 mL/min;空气,500 mL/min;进样量:1 μL。
样品中乳酸菌、霉菌和酵母菌数量采用平板计数法测定,分别选用MRS培养基、马丁培养基和马铃薯葡萄糖培养基,35 ℃恒温培养3 d,对菌落进行计数。
两组患者术中出血量、手术时间及术后住院时间均有记录。术后吞咽困难评判标准根据Bazaz[2]方法分为无、轻度、中度及重度。采用日本矫形外科学会(Japanese Orthopaedic Association,JOA)制定的17评分、视觉疼痛模拟评分(visual analogue scale,VAS)来评估临床效果。
有氧稳定性的测定方法如下:取2.5~3.0 kg发酵60 d的无芒雀麦青贮装入灭菌的塑料桶中,放置在室温[(23±1) ℃]下,将温度计插入无芒雀麦青贮中,每隔2 h记录无芒雀麦青贮几何中心的温度。有氧稳定性以中心温度不高于环境温度2 ℃所持续的时间表示。有氧稳定性测定期间无芒雀麦青贮样品要保持相对独立,不被外界影响[20]。
1.5 数据统计
试验数据采用SAS 9.0软件中单因素方差分析进行统计分析。采用Duncan氏法进行组间差异显著性分析,P<0.05代表差异显著,P<0.01代表差异极显著。
2 结果与分析
2.1 无芒雀麦青贮前后pH、营养成分含量及附着微生物数量变化
表1为无芒雀麦青贮前与青贮发酵60 d后pH、营养成分含量及附着的微生物数量的变化情况。经60 d青贮发酵后,4个处理的pH均较青贮前显著降低(P<0.05),从6.0降到4.3以下,所有处理发酵效果均较好,尤以ho处理效果最优。无芒雀麦营养成分经过青贮发酵后发生了不同程度的变化:各处理青贮前后DM、NDF和ADF含量差异均不显著(P>0.05);与无芒雀麦相比,4个处理无芒雀麦青贮CP含量均显著下降(P<0.05),其中以con处理CP损失最多,而he+ho处理CP损失最少,由此说明同型发酵和异型发酵乳酸菌均可以抑制牧草中蛋白质的降解,而同型发酵和异型发酵乳酸菌混合添加对牧草中蛋白质的降解抑制效果最好。青贮发酵过程使无芒雀麦WSC的含量显著下降(P<0.05),其中con处理WSC损失最多,ho处理WSC损失最少。
无芒雀麦经过青贮发酵后附着的乳酸菌数量明显增多,且添加乳酸菌的he、ho和he+ho处理的增殖效果略优于未添加乳酸菌的con处理;青贮前无芒雀麦附着的酵母菌数量较多,经过青贮发酵后其附着的酵母菌数量略有增加,其中添加同型发酵乳酸菌的ho处理增殖最多,而添加异型发酵乳酸菌的he处理增殖最少;青贮前无芒雀麦附着的霉菌数量较多,经过青贮发酵后霉菌数量明显受到抑制,且以单独添加异型发酵乳酸菌和混合添加同型发酵和异型发酵乳酸菌时抑制效果较优,这2个处理均未检出霉菌。
2.2 有氧暴露后无芒雀麦青贮pH的动态变化

表1 无芒雀麦青贮前后pH、营养成分含量及附着微生物数量变化
pH和营养成分含量同行数据肩标不同小写字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。
“—”表示未检出。下表同。
Values of pH and nutrient contents in the same row with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05).
“—” represented not detectable. The same as below.

表2 有氧暴露后无芒雀麦青贮pH的动态变化
同列数据肩标不同小写字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。下表同。
Values in the same column with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.3 有氧暴露后无芒雀麦青贮中有机酸浓度的动态变化
表3为有氧暴露后无芒雀麦青贮中有机酸浓度的动态变化。有氧暴露试验期间,随着有氧暴露时间的延长,各处理乳酸浓度均呈现下降趋势,ho处理下降幅度最大,说明添加蒙氏肠球菌和植物乳杆菌没能有效延缓无芒雀麦青贮pH的升高,抑制有氧腐败。青贮开封时he处理乳酸浓度在各处理中最低,但是在有氧暴露至第8天时,he处理乳酸仅损失0.79% DM,而con、ho和he+ho处理的损失量分别为2.33% DM、4.01% DM和2.25% DM。有氧暴露试验第8天he+ho与he处理的乳酸浓度差异不显著(P>0.05),均显著高于另2个处理(P<0.05),说明添加布氏乳杆菌可以显著抑制无芒雀麦青贮有氧暴露期间的乳酸损失,延缓pH上升,防止有氧腐败。
无芒雀麦青贮有氧暴露后乙酸浓度在各处理均随有氧暴露时间的延长呈下降趋势。有氧暴露至第8天时,con、he、ho、he+ho处理乙酸损失量分别为0.93% DM、0.45% DM、0.91% DM和0.51% DM,he和he+ho处理乙酸浓度均显著高于con和ho处理(P<0.05)。随着有氧暴露时间的延长,各处理丙酸浓度逐渐减少,直至未检出。各乳酸菌添加处理丁酸的检出率较低,con处理的丁酸浓度则较其他处理略高,但在整个有氧暴露试验期间也随有氧暴露时间的延长呈下降趋势。
2.4 有氧暴露后无芒雀麦青贮中微生物数量的动态变化
有氧暴露后无芒雀麦青贮中微生物数量的动态变化见表4。随着有氧暴露时间的延长,4个处理中乳酸菌数量无数量级上的变化。各处理酵母菌数量则随着有氧暴露试验时间的延长均略有增加,在第3和5天时,he、he+ho处理酵母菌数量显著低于con、ho处理(P<0.05),尤以he处理最低。
在整个试验期,he处理始终未检出霉菌存在,he+ho处理仅在有氧暴露第8天时检出霉菌,而con、ho处理则一直有霉菌检出,且ho处理霉菌数量还随着有氧暴露试验时间的延长而增加。
2.5 无芒雀麦青贮有氧暴露后WSC含量的动态变化
有氧暴露试验期间,随着有氧暴露时间的延长,4个处理WSC含量均出现了不同程度的下降,WSC含量的下降说明青贮饲料中微生物利用WSC作为底物大量繁殖。在整个有氧暴露试验期间,ho处理WSC含量下降的幅度最大且出现大幅下降的时间最早;he处理在有氧暴露试验前5 d WSC损失较少,在第8天WSC含量出现了明显下降;he+ho处理WSC在有氧暴露试验期间损失也较大,但WSC含量开始大量下降的时间比ho处理晚。在有氧暴露至第5和8天时,无芒雀麦青贮WSC含量均表现为he处理>he+ho处理>con处理>ho处理,除con与ho处理之间差异不显著(P>0.05)外,其他处理间差异显著(P<0.05)。这说明,添加布氏乳杆菌可以有效抑制好氧微生物的生长,减少无芒雀麦青贮有氧暴露试验期间WSC的损失。
2.6 不同发酵类型乳酸菌对无芒雀麦青贮有氧稳定性的影响
由图2可知,con、he、ho、he+ho处理的有氧稳定性分别为62、194、58、126 h。ho处理有氧稳定性比对con处理低4 h,he处理有氧稳定性比con处理高132 h,he+ho处理有氧稳定性比对con处理高64 h。这说明,添加布氏乳杆菌可以提高无芒雀麦青贮的有氧稳定性,而添加蒙氏肠球菌和植物乳杆菌对无芒雀麦青贮的有氧稳定性没有明显影响,而将3株菌混合添加亦可以提高无芒雀麦青贮的有氧稳定性。
3 讨 论
3.1 添加乳酸菌主导无芒雀麦青贮发酵
青贮原料上附着的微生物不仅对青贮发酵产生影响,也会对青贮微生物添加剂的应用产生影响。刈割后的青绿牧草含有各种不同的微生物,其种类及数量存在很大差异,其中好氧菌如霉菌、酵母菌等的数量较高,它们对青贮发酵及保藏过程无任何有益作用。刘晗璐[21]研究表明,披碱草和老芒麦新鲜牧草上附着的微生物主要以一般细菌、酵母菌、霉菌为主,乳酸菌的数量较少,最高数量低于5×104CFU/g FM(每克鲜牧草含菌落单位数),不能满足常规青贮乳酸菌的最低数量(>105CFU/g FM)需求。本研究中,新鲜无芒雀麦附着乳酸菌数量仅为3.72 lg(CFU/g FM),而酵母菌和霉菌数量则超过6 lg(CFU/g FM),因此要想获得优质的禾本科牧草青贮必须额外添加乳酸菌才能主导发酵进行。
pH是评定青贮发酵品质的重要指标,向青贮饲料中添加乳酸菌可以迅速降低青贮饲料的pH。青贮饲料pH的变化和发酵终pH与发酵过程中的主导菌群有着密切的关系。本研究中,蒙氏肠球菌在发酵初期生长速度快,可迅速降低青贮饲料的pH,植物乳杆菌耐酸,在较低的pH情况下仍能继续繁殖[21],因此添加蒙氏肠球菌和植物乳杆菌的处理在青贮发酵过程中pH下降最快,而且发酵终pH最低。布氏乳杆菌作为一种异型发酵乳酸菌,发酵过程中除了产生乳酸以外,还生成一些相对酸性较弱的酸,因此发酵过程的pH和发酵终pH也偏高。

同一时间点数据点标注不同小写字母表示差异显著(P<0.05)。
Value points at the same time with different small letters mean significant difference (P<0.05).
图1 无芒雀麦青贮有氧暴露后WSC含量的动态变化
Fig.1 Dynamic changes of WSC content inBromusinermisLeyss. silage after aerobic exposure
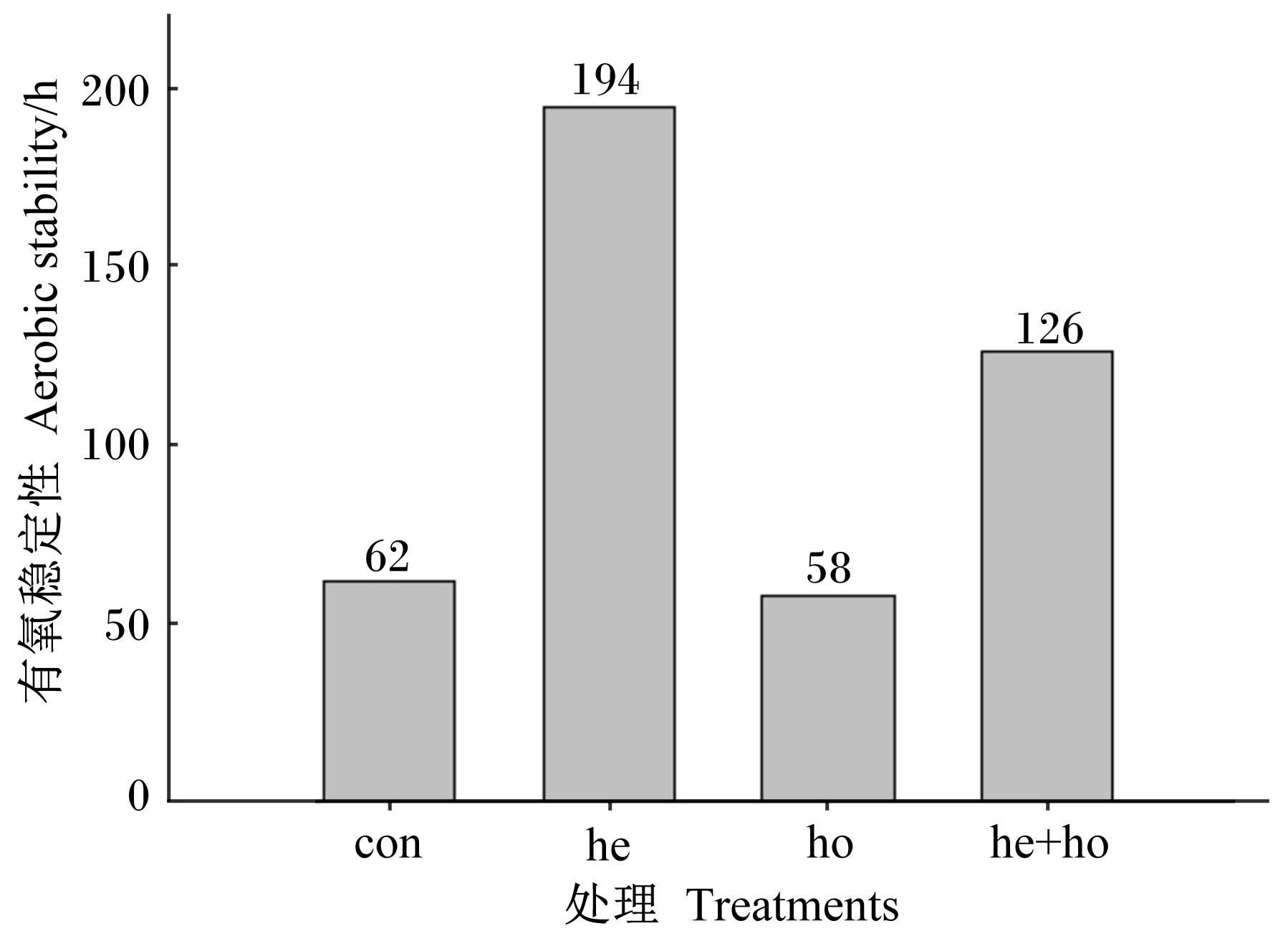
图2 各处理无芒雀麦青贮的有氧稳定性
青贮发酵过程中不可避免的会出现蛋白质降解而导致营养物质的损失。添加乳酸菌剂可快速降低青贮饲料的pH而抑制蛋白质水解酶的活性,达到降低蛋白质降解的目的[22]。本研究中所用乳酸菌均起到了抑制牧草中蛋白质降解的作用,其中同型发酵和异型发酵乳酸菌混合添加对牧草中蛋白质降解的抑制效果最好。由于开花期无芒雀麦WSC含量高,其上附着的酵母菌和霉菌数量较多,可能导致发酵过程中DM损失增加以及开窖后稳定性的降低,因此有必要开展添加异型发酵乳酸菌对有氧稳定性作用效果的优劣评价。本研究中,添加异型发酵乳酸菌可有效抑制发酵过程中霉菌的增殖,与青贮前相比,青贮发酵对酵母菌增殖的抑制作用不明显,但异型发酵乳酸菌单独或与同型发酵乳酸菌混合添加均表现出了优于同型发酵乳酸菌和未添加乳酸菌的作用效果。Taylor等[23]在研究中发现,在青贮发酵早期数量明显减少的酵母菌在发酵后期的检测中会出现数量再增加的情况,这与青贮发酵过程中乳酸菌与酵母菌数量存在此消彼长的动态变化有关。另有研究表明,青贮体系中存在较多种嗜酸酵母菌,其可耐受pH<3的环境且可利用乳酸和WSC供其生长,而较高浓度的丁酸可抑制这类酵母菌的生长[24]。本研究中获得的青贮发酵后期较高酵母菌数量可能与上述原因有关,但具体为哪种酵母菌还有待进一步分析探讨。
3.2 布氏乳杆菌对无芒雀麦青贮有氧腐败的抑制效果
布氏乳杆菌是一种专性异型发酵乳酸菌,在青贮发酵过程中能够产生高剂量乙酸抑制青贮饲料中的酵母菌和真菌的活性,从而使青贮饲料暴露于空气中时不易腐败变质[25]。在不同青贮原料(玉米、高粱、大麦、小麦、苜蓿、黑麦草、王草等)的接种效果研究中发现,布氏乳杆菌单独添加可以明显改善青贮饲料的有氧稳定性[26],尽管其对有氧稳定性的提高程度不尽相同,受添加剂量[23,27]、青贮开封时间[23,27]、不同地点[28]等的影响,但所表现的积极效应是稳定的。本研究中,无芒雀麦中单独添加布氏乳杆菌(he处理),其有氧腐败敏感性指标的变化均表现出不同于其他处理,具体为:1)有效抑制了无芒雀麦青贮在有氧暴露期间乳酸及挥发性脂肪酸的损失,使无芒雀麦青贮在有氧暴露期间pH保持在较低水平,当其他处理的pH增加到6.0以上时,he处理的pH则稳定在4.5以下;2)不论在开封时或暴露时,其高浓度乙酸有效抑制了无芒雀麦青贮的有氧腐败;3)随着有氧暴露时间的延长,各处理酵母菌数量均略有增加,而he处理增加程度最低,终酵母菌数量最少,且he处理未检出霉菌;4)开封后,随着无芒雀麦青贮中好氧微生物复苏及利用WSC作为底物开始繁殖,WSC含量均出现了不同程度的下降,但he处理终WSC含量显著高于其他处理;5)青贮温度变化所用时间则he处理用时最长。综合以上结果可表明,本研究所用禾草源布氏乳杆菌可有效抑制无芒雀麦青贮的有氧腐败,保证无芒雀麦青贮有氧暴露期间品质的稳定。
3.3 同型和/或异型乳酸菌混合添加对无芒雀麦青贮有氧稳定的作用效果
青贮饲料有氧暴露后的理化性质变化受发酵完成时的pH、青贮饲料中LA与VFA浓度、有氧暴露期间好氧菌的生长情况等多种因素影响,其变化能反映出青贮饲料的腐败速度和程度。许多同型发酵乳酸菌以发酵过程中产生更多的乳酸及较强的酸化作用,降低了营养物质损失[29],从而保证了较高的青贮发酵品质。但由于同型发酵乳酸菌在青贮发酵过程中降低了青贮饲料中抗真菌物质的含量,使青贮饲料在有氧暴露后稳定性下降[30];同时,相对较多的乳酸和残余的WSC可供好氧微生物分解利用,也不利于青贮饲料有氧暴露后的品质稳定[29]。在本研究中,无芒雀麦青贮发酵完成时因含有高浓度乳酸而有最低pH的同时添加蒙氏肠球菌和植物乳杆菌的ho+he处理,在有氧暴露期随着乳酸浓度迅速下降,导致pH急剧升高,且该处理在厌氧发酵过程中乳酸发酵占优势,乙酸的生成量少,在有氧暴露期间未能有效抑制无芒雀麦青贮腐败,有氧稳定性比con处理下降了4 h。因此,本研究所用蒙氏肠球菌和植物乳杆菌未能在提高无芒雀麦青贮有氧稳定性方面表现出积极的作用。
在有关青贮饲料中同型/异型乳酸菌混合添加而达到既可促进厌氧发酵也可提高有氧稳定性的“双重目的”的部分研究中,在高水分玉米、高粱、狗牙根和黑麦草青贮中的应用取得了较好的“双重功效”[13,31]。本研究中,当3种菌混合添加时,无芒雀麦青贮在有氧暴露试验第8天乳酸和乙酸浓度显著高于con与ho处理,酵母菌和霉菌数量则明显低于con与ho处理,且有氧暴露试验前5 d效果最优,其青贮温度变化所用时间则略低于he处理,但显著高于con与ho处理。因此,将本试验所用3种菌混合添加可以抑制开封后无芒雀麦青贮中腐败菌的生长,虽抑制效果没有单独添加布氏乳杆菌作用效果好,但也可以明显改善无芒雀麦青贮的有氧稳定性。
4 结 论
禾草源异型发酵乳酸菌——布氏乳杆菌可有效抑制无芒雀麦青贮的有氧腐败,保证无芒雀麦青贮有氧暴露期间品质的稳定;禾草源同型发酵乳酸菌——蒙氏肠球菌和植物乳杆菌未能在提高无芒雀麦青贮有氧稳定性方面表现出积极的作用;将上述3种菌混合添加可以抑制开封后无芒雀麦青贮中腐败菌的生长,虽抑制效果没有单独添加布氏乳杆菌效果好,但也可以明显改善无芒雀麦青贮的有氧稳定性。
[1] CHEN Y,WEINBERG Z G.Changes during aerobic exposure of wheat silages[J].Animal Feed Science and Technology,2009,154(1/2):76-82.
[2] TABACCO E,PIANO S,REVELLO-CHION A,et al.Effect ofLactobacillusbuchneriLN4637 andLactobacillusbuchneriLN40177 on the aerobic stability,fermentation products,and microbial populations of corn silage under farm conditions[J].Journal of Dairy Science,2011,94(11):5589-5598.
[3] 洪梅,刁其玉,姜成钢,等.布氏乳杆菌对青贮发酵及其效果的研究进展[J].草业学报,2011,20(5):266-271.
[4] NKOSI B D,MEESKE R,PALIC D,et al.Effects of ensiling whole crop maize with bacterial inoculants on the fermentation,aerobic stability,and growth performance of lambs[J].Animal Feed Science and Technology,2009,154(3/4):193-203.
[5] FILYA I,SUCU E,KARABULUT A.The effect ofLactobacillusbuchnerion the fermentation,aerobic stability and ruminal degradability of maize silage[J].Journal of Applied Microbiology,2006,101(6):1216-1223.
[6] CONTRERAS-GOVEA F E,MUCK R E,BRODERICK G A,et al.Lactobacillusplantarumeffects on silage fermentation andinvitromicrobial yield[J].Animal Feed Science and Technology,2013,179(1/2/3/4):61-68.
[7] 杨艳,潘宝海,孙笑非.植物乳杆菌的功能及在动物生产中的应用[J].饲料研究,2013(2):36-37.
[8] KELES G,DEMIRCI U.The effect of homofermentative and heterofermentative lactic acid bacteria on conservation characteristics of baled triticale-Hungarian vetch silage and lamb performance[J].Animal Feed Science and Technology,2011,164(1/2):21-28.
[9] NKOSI B D,MEESKE R,LANGA T,et al.Effects of bacterial silage inoculants on whole-crop maize silage fermentation and silage digestibility in rams[J].South African Journal of Animal Science,2011,41(4):350-359.
[10] SCHMIDT R J,HU W,MILLS J A,et al.The development of lactic acid bacteria andLactobacillusbuchneriand their effects on the fermentation of alfalfa silage[J].Journal of Dairy Science,2009,92(10):5005-5010.
[11] NKOSI B D,MEESKE R.Effects of ensiling totally mixed potato hash ration with or without a heterofermentative bacterial inoculant on silage fermentation,aerobic stability,growth performance and digestibility in lambs[J].Animal Feed Science and Technology,2010,161(1/2):38-48.
[12] FILYA I.The effect ofLactobacillusbuchneriandLactobacillusplantarumon the fermentation,aerobic stability,and ruminal degradability of low dry matter corn and sorghum silage[J].Journal of Dairy Science,2003,86(11):3575-3581.
[13] FILYA I.The effect ofLactobacillusbuchneri,with or without homofermentative lactic acid bacteria,on the fermentation,aerobic stability and ruminal degradability of wheat,sorghum and maize silages[J].Journal of Applied Microbiology,2003,95(5):1080-1086.
[14] 蔡义民,熊井清雄,廖芷,等.乳酸菌剂对青贮饲料发酵品质的改善效果[J].中国农业科学,1995,28(2):73-82.
[15] 侯美玲,格根图,孙林,等.甲酸、纤维素酶、乳酸菌剂对典型草原天然牧草青贮品质的影响[J].动物营养学报,2015,27(9):2977-2986.
[16] 敖晓琳,蔡义民,胡爱华,等.接种植物乳杆菌(Lactobacillusplantarum)对小规模饲料稻青贮品质的影响[J].微生物学通报,2014,41(6):1125-1131.
[17] 董艳.具有抑制娄地青霉的植物乳杆菌的筛选及其在青贮饲料中的应用研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2015.
[18] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007:48-78.
[19] OWENS V N,ALBRECHT K A,MUCK R E,et al.Protein degradation and fermentation characteristics of red clover and alfalfa silage harvested with varying levels of total nonstructural carbohydrates[J].Crop Science,1999,39(6):1873-1880.
[20] RANJIT N K,KUNG L,Jr.The effect ofLactobacillusbuchneri,Lactobacillusplantarum,or a chemical preservative on the fermentation and aerobic stability of corn silage[J].Journal of Dairy Science,2000,83(3):526-535.
[21] 刘晗璐.禾本科牧草乳酸菌发现及发酵品质检测与动物生产性能影响研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2008.
[22] 柯文灿.不同种类添加剂对紫花苜蓿青贮脂肪酸和蛋白质降解的影响[D].硕士学位论文.兰州:兰州大学,2015.
[23] TAYLOR C C,KUNG L,Jr.The effect ofLactobacillusbuchneri40788 on the fermentation and aerobic stability of high moisture corn in laboratory silos[J].Journal of Dairy Science,2002,85(6):1526-1532.
[24] CAI Y M,BENNO Y,OGAWA M,et al.Effect of applying lactic acid bacteria isolated from forage crops on fermentation characteristics and aerobic deterioration of silage[J].Journal of Dairy Science,1999,82(3):520-526.
[25] HOLZER M,MAYRHUBER E,DANNER H,et al.The role ofLactobacillusbuchneriin forage preservation[J].Trends in Biotechnology,2003,21(6):282-287.
[26] KUNG L,Jr.Aerobic stability of silages[C]//Proceedings of the 2nd International Symposium on Animal Production Under Grazing.Brazil:University of Vicosa,2008:233-248.
[27] DRIEHUIS F,OUDE ELFERINK S J W H,VAN WIKSELAAR P G.Fermentation characteristics and aerobic stability of grass silage inoculated with Lactobacillus buchneri,with or without homofermentative lactic acid bacteria[J].Grass and Forage Science,2001,56(4):330-343.
[28] SCHMIDT R J,KUNG L,Jr.The effects ofLactobacillusbuchneriwith or without a homolactic bacterium on the fermentation and aerobic stability of corn silages made at different locations[J].Journal of Dairy Science,2010,93(4):1616-1624.
[29] HUISDEN C M,ADESOGAN A T,KIM S C,et al.Effect of applying molasses or inoculants containing homofermentative or heterofermentative bacteria at two rates on the fermentation and aerobic stability of corn silage[J].Journal of Dairy Science,2009,92(2):690-697.
[30] KUNG L,Jr,TAYLOR C C,LYNCH M P,et al.The effect of treating alfalfa withLactobacillusbuchneri40788 on silage fermentation,aerobic stability,and nutritive value for lactating dairy cows[J].Journal of Dairy Science,2003,86(1):336-343.
[31] ADESOGAN A T,KRUEGER N,SALAWU M B,et al.The influence of treatment with dual purpose bacterial inoculants or soluble carbohydrates on the fermentation and aerobic stability of bermudagrass[J].Journal of Dairy Science,2004,87(10):3407-3416.
*Corresponding author, assistant professor, E-mail: grassland302@aliyun.com
(责任编辑 菅景颖)
Evaluation of Aerobic Stability ofBromusinermisLeyss.Silage Fermented by Homofermentative and/or Heterofermentative Lactic Acid Bacteria from Grass
Tana1WEI Rihua2Deqinghala3Narisu1WANG Hai1*
(1.InstituteofGrasslandResearchChineseAcademyofAgriculturalSciences/KeyLaboratoryofGrasslandEcologyandRestorationoftheMinistryofAgriculture,Hohhot010010,China; 2.CargillAnimalNutrition(InnerMongolia)Co.Ltd.,Baotou014000,China; 3.InnerMongolianLivestockImprovementStation,Hohhot010010,China)
This experiment was conducted to evaluate the action effect of homofermentative and/or heterofermentative lactic acid bacteria from grass on aerobic stability ofBromusinermisLeyss. silage. Two homofermentative lactic acid bacteria (LAB) (a strain ofLactobacillusplantarumand a strain ofEnterococcusmundtti) and a heterofermentative LAB (a strain ofLactobacillusbuchneri) from grass were selected and were used to prepare fermentation agents.BromusinermisLeyss. was harvested at the flowering stage, chopped to 2 to 3 cm lengths and treated with fermentation agents. Based on the bacteria type, four treatments were designed: 1) control treatment (con treatment), which was sprayed with sterile deionized water; 2) heterofermentative treatment (he treatment), which was sprayed withLactobacillusbuchneriliquid; 3) homofermentative treatment (ho treatment), which was sprayed with a mixed liquid ofLactobacillusplantarumandEnterococcusmundtti(1∶1); 4) heterofermentative+homofermentative treatment (he+ho treatment), which was sprayed with a mixed liquid ofLactobacillusplantarum,EnterococcusmundttiandLactobacillusbuchneri(1∶1∶1). The spraying dose of each treatment was 10 mL/kg fresh forage, and the total bacteria count was about 5×105CFU/g fresh forage. Each treatment had five replicates. After ensiling 60 days under lab condition, the aerobic stability ofBromusinermisLeyss. silage was evaluated by testing nutrient contents, microbial number and core temperature change. The results showed as follows: at the end of ensiling period (60 days), the pH of four treatments was significantly decreased compared with before silage (P<0.05), all treatments silage had a good fermentation quality (pH≤4.3) and especially ho treatment was the best. When exposed to air, the pH of con and ho treatments increased rapidly, and reached up to 7 on the 8th day of aerobic exposure; the increasing extent of pH of he+ho treatment was slightly lower than that of con and ho treatments, and the pH of he+ho treatment reached up to 6.3 on the 8th day of aerobic exposure which was significantly lower than that of con and ho treatments (P<0.05); the pH of he treatment increased slowly, and only was 4.4 on the 8th day of aerobic exposure which was significantly lower than that of other treatments (P<0.05). After 60 days of ensiling, the water soluble carbohydrate (WSC) content of ho treatment was the highest, and significantly higher than that of other treatments (P<0.05); the WSC content of ho treatment was the lowest, and significantly lower than that of other treatments (P<0.05). When exposed to air, ho treatment silage showed a sharp decline in the WSC content while he treatment decreased slowly. On the 8th day of aerobic exposure, the WSC content of he treatment was the highest, he+ho treatment was significantly lower than the former (P<0.05), while con and he treatments was significantly lower than he and he+ho treatments (P<0.05). The mold activity was obviously inhibited after silage fermentation, and the inhibitory effect of he and he+ho treatments was better in which mold was not detected. Moreover, the mold was not detected in the he+ho treatment until the 5th day of aerobic exposure, and it was not detected in the he treatment until the 8th day of aerobic exposure. The yeast quantity of he and he+ho treatments was significantly lower than that of con and he treatments on the 3rd and 5th day of aerobic exposure (P<0.05). Lactic and acetic acid concentrations of he and he+ho treatments were significantly higher than those of other 2 treatments on the 8th day of aerobic exposure (P<0.05). Aerobic stability of he, he+ho, con and ho treatments decreased systematically, which showed 194, 126, 62 and 58 h, respectively. Through synthetic analysis, the results indicate that inoculation withLactobacillusbuchnerialone or in combination with homofermentative lactic acid bacteriaLactobacillusplantarumandEnterococcusmundttican effectively inhibit the aerobic deterioration and ensure the stable quality ofBromusinermisLeyss. silage when exposed to air, even if the former is more effective. The results also confirm that inoculation with homofermentative lactic acid bacteriaLactobacillusplantarumandEnterococcusmundtticannot play an active role in the improvement of aerobic stability ofBromusinermisLeyss. silage.[ChineseJournalofAnimalNutrition, 2017, 29(4):1301-1311]
BromusinermisLeyss.; homofermentative lactic acid bacteria; heterofermentative lactic acid bacteria; silage; aerobic stability
10.3969/j.issn.1006-267x.2017.04.027
2016-10-24
中央级公益性科研院所基本科研业务费专项资金(中国农业科学院草原研究所1610332015023);“十二五”国家科技支撑计划项目(2012BAD13B07)
塔 娜(1980—),女,蒙古族,内蒙古苏尼特左旗人,副研究员,硕士,研究方向为动物营养与饲料科学。E-mail: Tana_1980@163.com
*通信作者:王 海,助理研究员,E-mail: grassland302@aliyun.com
S816.5+3
A
1006-267X(2017)04-1301-11

