锂离子电池锰基尖晶石正极材料研究进展及产业化前景
邓玉峰 赵世玺 郭双桃 毕坤 徐亚辉
纵观人类发展史,能源的开发、使用和储存贯穿其始终。从钻木取火到出石可燃(煤炭),从火井煮盐(天然气)到核能发电,人类开发出满足自身需求的各种能源形式和能源材料,带来了生产力的巨大飞跃。在能源短缺和环境污染的时代背景下,以绿色可再生能源替代化石能源为主要目标的新能源革命悄然兴起。锂离子电池被广泛应用于消费类电子产品、电动汽车和分布式储能设备,在新能源革命中扮演着十分重要的角色。锂离子电池的整体性能主要取决于其内部组成材料如隔膜、电解质、正极和负极。其中,作为锂离子电池的锂源,正极材料对电池的能量密度、放电电压、循环寿命、安全性能和生产成本起着决定性作用。
根据晶型的不同,常见的锂离子电池正极材料分为橄榄石结构〔如磷酸铁锂(LiFePO4)〕,、层状结构〔如钴酸锂(LiCoO2)、LiNi0.5Mn0.5O2和LiNi1/3Co1/3Mn1/3O2〕和尖晶石结构〔如锰酸锂(LiMn2O4)和镍锰酸锂(LiNi0.5Mn1.5O4)〕。在众多的锂离子电池正极材料中,锰基尖晶石(LiMn2O4和LiNi0.5Mn1.5O4)因其优异的安全性能、较高的工作电压、简单的制备工艺和低廉的原料价格等优点,在新能源行业极具应用前景。然而,锰基尖晶石的循环稳定性较差,尤其是在高温下容量衰减很快。要想实现尖晶石锰基正极材料的大规模工业化,就必须通过制备工艺的完善和改性手段的应用来改善其高温下的循环性能和倍率性能。
一、锰基尖晶石正极材料的晶体结构
锰基尖晶石正极材料主要包括LiMn2O4和LiNi0.5Mn1.5O4,后者是由前者衍生而来的。尖晶石LiMn2O4空间群为Fd3m,O2-占据32e位置作面心立方密堆积,Mn4+和Mn3+占据氧八面体间隙16d位置,Li+位于四面体8a位置,在尖晶石晶体结构中,存在一个三维Li+扩散通道(8a-16c-8a)。该晶型具有2种间隙位置,即氧四面体8a位和氧八面体16c位。实际上这2个位置都可以实现Li+的嵌脱,但仅8a位Li+位置嵌入和脱出时不会显著破坏LiMn2O4的晶体结构。
在对尖晶石结构LiMn2O4进行掺杂改性的基础上,发展出了LiNi0.5Mn1.5O4高电压正极材料。由于掺进去的Ni显+2价,会引起锰元素化合价的升高,当Ni的化学计量数达到0.5时,Mn的化合价会从+3.5价升高到+4价。同LiMn2O4略有不同的是,LiN0.5Mn1.5O4根据Mn和Ni在氧八面体间隙的排列方式分为Fd3m和P4332两种空间群,FTIR和Raman可以有效地区分这2种晶体结构。当过渡金属原子在氧八面体间隙位置有序分布时,LiN0.5Mn1.5O4属于P4332空间群,称之为有序相。此时Li处于8c位置,Ni位于4a位置,Mn位于12d位置,O占据8c和24e位置。当过渡金属原子在氧八面体间隙随机分布时,LiN0.5Mn1.5O4属于Fd3m空间群,称之为无序相。此时,Li位于8a位置,Ni和Mn无规分布在16d位置,O占据32e位置。完全的有序相或者无序相是不存在的,实际制得镍锰酸锂正极材料同时含有2种物相,若材料中有序相较多(无序相较少),称其具有较高的有序度(较低的无序度)。
二、锰基尖晶石正极材料的充放电机理
锂离子电池正极材料的充放电基本上都属于嵌入脱出机制,尖晶石LiMn2O4也不例外。充电时,Li+从氧四面体8a位置脱出,Mn3+被氧化为Mn4+,而放电过程则相反:
LixMn2O4放电时,锂离子分两步嵌回到四面体8a位置。当0
继续放电时,Li+还可嵌入到氧八面体16c位置(1
LiN0.5Mn1.5O4有着和LiMn2O4类似的充放电机理,不同之处在于氧化还原反应电子对已经不再是Mn4+/3+,而是Ni4+/2+。若在2.0~5.0V电化学窗口内考察,LiN0.5Mn1.5O4具有2个主要的电化学平台:4.7V区域的电压平台对应于锂离子在四面体8a位置的嵌脱,此时发生Ni2+和Ni4+之间的转换;2.7V区域的电压平台对应于锂离子在八面体位置16c位置的嵌脱。由于合成的LiN0.5Mn1.5O4存在因补偿氧空位而产生的少量Mn3+,故在4.0V区域也会存在一定比例的电压平台。
三、锰基尖晶石正极材料的容量衰减机理
研究表明,尖晶石LiMn2O4容量衰减的主要原因是Mn3+导致的Jahn-Teller效应以及电极材料同电解液的边界副反应带来的锰元素溶解。
1.Jahn-Teller效應
在尖晶石LiMn2O4正极材料中,Mn3+与Mn4+各占50%,由于Mn3+与Mn4+最外层电子分布的不同,会造成[MnO6]的形变,既原本规则的[MnO6]正八面体沿z轴方向拉长,在4.0V区域工作时,会发生局部过放电,导致强烈的Jahn-Teller效应[2],造成尖晶石晶粒开裂甚至粉化。
2.锰元素的溶解
锂离子电池中的有机电解液往往含有少量水分,这些水分会同电解质六氟磷酸锂(LiPF6)反应生成微量的氢氟酸(HF)。HF会诱导Mn的溶解,这是一个自催化反应:
温度升高会使上述反应更为剧烈,因而尖晶石LiMn2O4的高温循环稳定性很差。
对于高电压正极材料LiNi0.5Mn1.5O4而言,LiNi0.5Mn1.5O4晶体结构中除了存在少量氧空位导致的Mn3+外,绝大多数锰离子都为+4价,因而在尖晶石LiMn2O4结构中困扰其晶格稳定性的Jahn-Teller效应大为缓解[3]。然而高电压会达到商用有机电解液分解电压极限。因此,在LiNi0.5Mn1.5O4正极材料的循环过程中尤其是高温环境下或者大倍率充放电时极易发生电解液和活性物质的边界副反应,该副反应比尖晶石LiMn2O4更严重。反应式如下: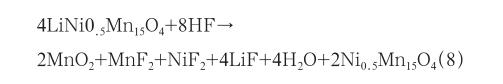
四、锰基尖晶石正极材料的制备工艺
影响尖晶石锰基正极材料电化学性能的因素可分为常规因素和特征因素2个方面。常规因素主要表现为结晶程度、物相纯度和颗粒尺寸对材料循环性能和倍率性能的影响,与制备工艺密切相关。LiMn2O4和LiNi0.5Mn1.5O4的合成方法主要有高温固相法、熔融浸渍法、溶胶凝胶法、水热合成法和共沉淀法等。
1.高温固相法
高温固相法是制备很多锂离子电池正极材料的传统方法,将锂源、锰源或(和)镍源通过球磨混合均匀后在空气气氛中高温(800℃左右)烧结即可得到锰系尖晶石正极材料。该方法工艺简单,易于实现产业化。但是,通过高温固相法制得的材料粒径分布不均匀,性能不够理想,分段烧结能够有效改善材料的电化学性能。Ding等人[4]将氢氧化锂(LiOH)和预先利用水热法制得的β-MnO2纳米管在高温下进行煅烧,通过离子交换反应合成了具有均一纳米管形貌和较高结晶度的LiMn2O4。Hu等人[5]通过水热法制备了发育良好的棒状γ-MnOOH单晶作为模板,通过拓扑转化原理,在高温下成功制备了具有棒状形貌的尖晶石型LiMn2O4。整个转化过程只需要从母相经历一个很小的原子重组过程,便可形成一个比原模板具有更高对称性的稳定结构。Gao等人[6]将氢氧化锂、乙酸锰和乙酸镍混合均匀后先在氮气气氛下热处理,然后在空气中高温烧结,制得了电化学性能优异的LiNi0.5Mn1.5O4。
2.熔融浸渍法
熔融浸渍法实际上是对高温固相法的改进,通过采用熔点较低的锂盐作为原料使制得的活性物质具有较高的结晶度;或者将锰系尖晶石材料同熔点较低的盐混合均匀后在其熔点之上保温若干小时促进尖晶石材料的再结晶。同传统高温固相法相比,熔融浸渍法能够极大地提高原料的反应活性。但是该方法操作复杂,不利于规模化生产。Helan等人[7]利用氯化锂(LiCl)和碳酸锂(Li2CO3)作为锂源,在700℃烧结制得了粒径约为25μm的尖晶石型LiMn2O4。Lu等人[8]利用KCl作为熔盐制得了具有疏松结构的LiNi0.5Mn1.5O4高电压正极材料。
3.溶胶凝胶法
溶胶凝胶法利用化学手段让锂离子和过渡金属离子均匀分布在凝胶中,在较低温度下热处理即可制得锰系尖晶石正极材料。Liu等人[9]通过溶胶凝胶法合成了锰酸锂和碳纳米管复合正极材料,大大降低了锰酸锂的合成温度。首先配置锰酸锂前躯体溶液和多层碳纳米管悬浊液,再将二者同柠檬酸溶液混合,制得溶胶后干燥,在250℃煅烧制得LiMn2O4。配制溶液时加入非离子表面活性剂桥联碳纳米管和金属离子。在制得的活性物质中形成了碳纳米管导电网络,改善了正极材料的电化学性能。Fang等人[10]通过改良的溶胶凝胶法制得的LiNi0.5Mn1.5O4振实密度高达2.15g/cm3。
4.水热合成法
水热合成法是在处于临界或者超临界的水体系中进行的合成反应。Yue等人[11]用乙炔黑还原高锰酸钾,得到锰氧化物和碳的复合物质。然后将所得到的复合物质同LiOH进行水热反应,所制得的LiMn2O4活性物质中残余的碳大大提升了正极材料的电子电导。Wang等人[12]利用乙二醇辅助水热法制备了LiNi0.5Mn1.5O4高电压正极材料,乙二醇能够显著改善正极材料的颗粒分散性。
5.共沉淀法
利用草酸盐或碳酸盐同时沉淀过渡金属离子制得Ni-Mn前驱体,再同锂源煅烧可制得LiNi0.5Mn1.5O4正极材料。Zhu等人[13]使用草酸铵和碳酸铵混合物作为沉淀剂合成了化学计量比精确的LiNi0.5Mn1.5O4球形二次颗粒。Zhang等人[14]采用不同分子量PEG辅助共沉淀法合成LiNi0.5Mn1.5O4,其中PEG4000所对应的样品有着较纯的物相和均匀的粒径分布,表现出较好的电化学性能。
上述合成方法中,以固相法和共沉淀法作为产业化宏量制备的首选工艺。
五、锰基尖晶石正极材料的改性方法
影响锰基尖晶石正极材料电化学性能的特征因素是指Jahn-Teller效应、过渡金属离子排布有序度、过渡金属元素在电解液中的溶解等。离子掺杂和表面包覆等改性手段能够作用于这些特征因素,从而改善正极材料的电化学性能。
1.离子掺杂
如前文所述,Jahn-Teller效应是造成LiMn2O4循环性能恶化的重要因素。掺杂能够显著抑制该效应,增强尖晶石的晶体结构稳定性并在一定程度上减少Mn3+的溶解。具体地,离子掺杂可以分为阳离子掺杂、阴离子掺杂和阴阳离子复合掺杂。
2.阳离子掺杂
用化合价较低的金属阳离子如Ni2+取代Mn4+和Mn3+能够提升锰元素的平均化合价,使得晶体结构中Mn3+的量减少,从而抑制Jahn-Teller效应[15]。Yang等人[16]采用Al3+掺杂,观测在电解液中浸泡不同时间后锰酸锂正极材料晶粒保持原有形貌的能力。研究表明,Al3+掺杂能够明显提高晶格稳定性,抑制活性物质同电解溶液之间的边界反应。Thirunakaran等人[17]通过高温固相法制备了一系列的LiMoxMn2-xO4(x=0.01,0.05,0.10)样品,测试表明少量的Mo6+掺杂并不改变尖晶石的结构,但明显改善了材料的循环稳定性。虽然具有较高化合价的Mo6+取代Mn3+和Mn4+會导致尖晶石晶体结构中Mn3+比例增多,但更强的Mo-O键能起到稳定晶体结构的作用。Xu等人[18]采用溶胶凝胶法合成了二元阳离子掺杂的尖晶石锰酸锂正极材料LiCrxFexMn2-2xO4(x=0,0.05,0.1)。其中,LiCr0.05Fe0.05Mn1.9O4具有较好的电化学性能,虽然它的首次充放电比容量相对LiMn2O4略有下降,但是循环性能却明显改善。9 000次和10 000次循环后,LiCr0.05Fe0.05Mn1.9O4的容量保持率分别为71%和67%。
3.阴离子掺杂
用于锰基尖晶石正极材料掺杂的阴离子主要有F-和S2-,这些离子部分取代晶格中的O2-,能够稳定晶体结构,提升正极材料的循环性能。
4.阴阳离子复合掺杂
阴阳离子复合掺杂能够结合阳离子掺杂和阴离子掺杂的优点,更大限度地提升锰基正极材料的电化学性能。Manthiram等人[19]系统性地研究了阴阳离子复合掺杂尖晶石正极材料Li1.1Mn1.9-yMyO4-zFz(M=Ni,Al; 0≤y≤0.3,0≤z≤0.2),并采用XRD、SEM、DSC等測试手段对材料进行分析。结果表明,制备的材料均为尖晶石结构,F和Ni、Al的阴阳离子复合掺杂不仅增强了材料的热稳定性,而且提高了锂离子在尖晶石晶格中的脱嵌速率,正极材料的大电流放电能力和循环稳定性得到明显提高。
LiNi0.5Mn1.5O4的掺杂改性同样分为阳离子掺杂(Cu2+、Al3+、Ti4+和Nb5+)、阴离子掺杂(F-和S2-)和阴阳离子复合掺杂。掺杂对于LiNi0.5Mn1.5O4晶体结构的影响主要表现为过渡金属离子在八面体16d位置排布有序程度的改变,进而影响材料的电化学性能。最近有研究表明,P掺杂能够同时影响LiNi0.5Mn1.5O4材料的晶体结构和微观形貌。P掺杂向镍锰酸锂晶体结构中引入带正电的缺陷,使得Mn3+含量增多,提升了过渡金属离子在八面体16d位置排布的无序度。当掺杂量增加时,LiNi0.5-xP2xMn1.5-xO4(x=0、0.005、0.01和0.02)晶粒由规则八面体演变为截角八面体。晶粒表面(111)面逐渐减少,(100)面逐渐增多,加剧了SEI钝化膜的形成和过渡金属元素的溶解。LiNi0.480P0.04Mn1.480O4在0.1C倍率下的放电比容量高达142.7mAh/g,非常接近于材料的理论比容量(146.7mAh/g)。锂离子掺杂技术中,阴阳离子共产掺杂的效果最好。
5.表面包覆
锰基尖晶石正极材料同有机电解液之间的边界副反应是其容量衰减的关键原因,电池性能恶化在高温下或大倍率循环时尤为明显。表面修饰能够有效地减少电解液对正极材料的侵蚀作用,改善材料的循环性能和倍率性能。目前用于锰基尖晶石表面修饰改性的材料主要包括氧化物、聚合物和碳材料。
(1)氧化物包覆
氧化物是科学研究中用于锰基尖晶石表面修饰改性最常见的材料,可分为简单氧化物〔如三氧化二铝(Al2O3),氧化镁(MgO)和二氧化硅(SiO2)〕和复杂氧化物〔如磷酸铝(AlPO4)〕。Arumugam等人[20]在LiMn2O4晶粒表面包覆了不同质量分数的纳米SiO2。晶体结构和微观形貌分析表明SiO2包覆并未对LiMn2O4的晶型造成显著影响,SiO2包覆层的平均厚度约为50nm。电化学性能测试表明,SiO2包覆显著改善了LiMn2O4在室温和高温下循环性能。2.0%(质量分数)SiO2包覆的LiMn2O4正极材料在30℃和60℃的初始容量分别为126mAh/g和123mAh/g,容量保持率高达95.2%和91.1%。Lim等人[21]在利用液相法包覆LiMn2O4时,加入一定质量的聚乙烯吡咯烷酮(polyvinyl pyrrolidone简称PVP),实现了二氧化锆(ZrO2)对正极材料均匀的包覆。在水溶液中将PVP高分子链包裹在正极材料纳米颗粒上,这些高分子链可以将包覆材料前驱体原子缠绕其中,经过热处理后就可以获得比较均匀的包覆层。改变PVP的用量,可以控制ZrO2包覆层的厚度。Xiong等人[22]利用Al(NO3)3·9H2O作为包覆前驱体对LiMn2O4进行表面修饰,发现较高的热处理温度会使得附着在晶粒表面的Al2O3颗粒向锰基尖晶石晶格内部扩散。Al3+既以氧化物的形式包覆在正极材料颗粒表面抑制锰元素的溶解,又进入LiMn2O4的晶格中取代Mn抑制Jahn-Teller效应。
通常用于锰基尖晶石表面修饰改性的简单氧化物材料是电化学惰性的,它们在抑制锰元素溶解的同时,会阻碍到锂离子的传输,甚至引起LiMn2O4和LiNi0.5Mn1.5O4放电容量和倍率性能的恶化。Deng等人[23]采用一种常见的锂离子固态电解质锂镧锆氧(LLZO,Li7La3Zr2O12),对尖晶石LiMn2O4进行表面修饰。无论是四方相结构还是立方相结构,LLZO都有着较高的室温电导率(四方相:2.3×10-5S/ cm,立方相:10-3~10-4S/cm)。研究表明,锂镧锆氧作为包覆材料对尖晶石LiMn2O4进行表面修饰时能够提升材料的循环稳定性但不损害材料的放电容量和倍率性能。
此外,由于尖晶石锰酸锂基体稳定温度范围的限制(<900℃)以及包覆工艺的制约,很多包覆材料在正极材料晶粒表面并非以纯相存在,有些甚至是无定形态。Zhao等人[24]通过改变热处理温度来调控锂镧锆氧固态电解质在尖晶石晶粒表面的包覆形态。随着包覆温度的提升,包覆物质的结晶度和纯度逐渐升高,微观形貌也发生变化。当热处理温度为400℃时,LLZO在八面体晶体表面形成了比较松散的包覆层。温度为600℃时,LLZO包覆层更为均一致密。温度升高至800℃时,包覆层破裂,在晶粒表面形成均匀分布的岛状纳米颗粒。包覆物质在尖晶石晶粒表面的变化可以视为膜的生长和破裂过程。包覆温度较低时,自扩散较弱,易于形成均匀的包覆层;包覆温度较高时,自扩散较强,易于形成包覆颗粒。
LiNi0.5Mn1.5O4基本不存在Jahn-Teller效应,因而具有比LiMn2O4更好的常温循环性能。但是由于其工作电压(约4.7V)较高,在高温环境下或者大倍率充放电时电极材料同电解液的边界副反应更为剧烈,包覆改性对于镍锰酸锂正极材料意义重大。Li1.3Al0.3Ti1.7(PO4)3玻璃-陶瓷固态电解质表面修饰能够显著地改善LiNi0.5Mn1.5O4的高温性能[24]。结晶度更高、厚度更薄的Li1.3Al0.3Ti1.7(PO4)3包覆层拥有更为通畅和稳固的锂离子扩散通道,也能够更好地保护活性物质晶粒。
(2)聚合物包覆
Stroeve等人[25]在LiMn2O4晶粒表面包覆了一层聚合物(PDDA),提高了LiMn2O4在常温和高温下的热稳定性。当包覆30~50mM PDDA时,效果最好。他们认为LiMn2O4表面吸附一层聚合物抑制了表面反应,通过阻止Mn离子的溶解从而延长了锂离子电池的寿命,由此提高了电池的稳定性。Arbizzani等人[26]发现聚合物3-4-ethylenedioxythiophene (PEDOT)包覆尖晶石LiMn2O4適合做电极材料。PEDOT通过电化学方法包覆在颗粒表面,阻止LiMn2O4颗粒表面与电解液直接接触。由于PEDOT是一种电子导电聚合物,所以它兼有导电材料和胶粘剂的作用。但是,PEDOT包覆的LiMn2O4复合物的渗透率比较低,在合成过程中前驱体的形貌会影响到PEDOT作为导电剂的作用。
(3)碳包覆
Yue等人[11]以乙炔黑为碳添加剂,采用水热法合成了尖晶石LiMn2O4/C复合物正极材料。通过X射线衍射,扫描电镜和电化学性能测试对材料的微观形貌、晶体结构和电化学性能进行了分析。结果显示,碳包覆增加了材料的电导率,而且该材料复合结构中,LiMn2O4和C之间的接触比一般通过物理机械混合得到的LiMn2O4/C材料要好。电化学测试表明,LiMn2O4/C复合材料的初始容量是83mAh/g,在2A/g电流密度下循环200次后,容量仍能保持在初始容量的92%,具有优异的高倍率性和循环性。
锰酸锂正极材料的循环稳定性和倍率性能的提高必须采用表面包覆改性技术,其中以锂离子固态电解质的表面包覆效果最好。
六、尖晶石锰酸锂正极材料的产业化状况及前景展望
新能源革命是继工业革命之后的又一场关系到全人类前途和命运的重要技术革新,其发展速度远远超出我们的想象,并已经开始对人类社会的生活方式和发展模式产生深刻影响。在新能源革命的浪潮中,全球锂离子电池产业进入到高速发展通道,预计到2020年世界锂离子电池市场规模将超过2×108kWh。锂离子电池能否继续向大容量、长寿命、高功率和低成本发展,关键取决于锂离子电池正极材料。但目前我国锂离子电池正极材料市场,3C市场仍以钴酸锂和高容量三元正极材料2个体系为主。在动力电池领域,主要以磷酸铁锂为主,三元材料已开始引起大家的关注。但尖晶石锰酸锂几乎没有被主流市场所认识和接纳。目前市场上少量产业化的尖晶石锰酸锂主要以低端产品为主,仅仅是将电解二氧化锰和碳酸锂混合采用固相烧结简单的工艺而获得。高温性能和循环性能都十分差,仅仅是靠低价而勉强获得一点市场。目前的状况完全没有体现出尖晶石锰酸锂的优势和潜力。
清华大学赵世玺课题组对锰酸锂正极材料进行了深入系统的研究。锰基尖晶石(LiMn2O4和LiNi0.5Mn1.5O4)正极材料存在的主要理论问题和工艺问题都得到很好的解决,已没有难以逾越的技术难题阻碍该体系正极材料的产业化,目前完全可以进入大规模产业化应用阶段。采用固相法合成工艺,结合阴阳离子掺杂和固态电解质表面包覆技术,完全解决锰酸锂正极材料存在的Jahn-Teller和Mn离子溶解问题。尤其是在动力电池领域,尖晶石锰酸锂具有电压平台高、倍率性能好、安全性好的突出特点。虽然理论容量低于其他几个体系,电压平台高,和体积比能量高可以弥补其容量低的不足。锰基尖晶石正极材料存在的技术难题已被解决,已具备进入产业化阶段的条件。在未来,锰基尖晶石材料会是锂离子电池正极材料的主力军。
参考文献
[1] Xia Yongyao,Massaki Yoshio.An investigation of lithium ion insertion into spinel structureLi-Mn-O compounds[J]. Journal of the Electrochemical Society,1996,143(3):825-833.
[2] Chen Zhaoyong,Liu Xinquan,Gao Lizhen,et al.Electrochemical capacity fading in high temperatureof spinel LiMn2O4 and its improvement[J].Chinese Journal of Inorganic Chemistry,2001,17(3):325-330.
[3] Cabana J,Casas-Cabanas M,Omenya F O,et al.Composition-Structure Relationships in the Li-Ion Battery Electrode Material LiNi0.5Mn1.5O4[J].Chemistry of Materials,2012,24(15):2952-2964.
[4] Ding Yuanli,Xie Jian,Cao Gaoshao,et al.Single-Crystalline LiMn2O4 Nanotubes SynthesizedVia Template-Engaged Reaction as Cathodes for High-Power Lithium Ion Batteries[J].Advanced Functional Materials,2011,21(2):348-355.
[5] Hu Daoheng,Zhao Shixi,Deng Yufeng,et al.Synthesis and electrochemical performance of rod-like spinel LiMn2O4 coated by Li–Al–Si–O solid electrolyte[J].Journal of Materials Chemistry A.2013(1):14729-14735.
[6] Gao Zhigang,Sun Kai,Cong Lina,et al.High performance 5V LiNi0.5Mn1.5O4 spinel cathode materials synthesized by an improved solid-state method[J].Journal of Alloys and Compounds,2016(654):257-263.
[7] Helan M,Berchmans L J,Jose T P,et al.Molten salt synthesis of LiMn2O4 using chloride-carbonate melt[J].Materials Chemistry and Physics,2010,124(1):439 -442.
[8] Lu Xu,Lin Xiujing,Shang Yesheng,et al.Modified KCl Molten Salt Method Synthesis of SpinelLiNi0.5Mn1.5O4 with Loose Structure as Cathodes for Li-ion Batteries[J].International Journal of Electrochemical Science,2014,9(12):7253-7265.
[9] Liu Xianming,Huang Zhengdong,Oh Seiwoon,et al.Sol-gel synthesis of multiwalled carbon nanotube LiMn2O4 nanocomposites as cathode materials for Li-ion batteries[J].Journal of Power Sources,2010,195(13):4290-4296.
[10] Fang Junchuan,Xu Yuefeng,Xu Guiliang,et al.Fabrication of densely packed LiNi0.5Mn1.5O4 cathode material with excellent long-term cycleability for high-voltage lithium ion batteries[J].Journal of Power Sources,2016(304):15-23.
[11] Yue Hongjun,Huang Xingkang,Lv Dongping,et al.Hydrothermal synthesis of LiMn2O4/C compositeas a cathode for rechargeable lithium-ion battery with excellent rate capability[J].Electrochimica Acta,2009,54(23):5363-5367.
[12] Wang Li,Liu Guijuan,Wu Wei,et al.Synthesis of porous peanut-like LiNi0.5Mn1.5O4 cathode materials through an ethylene glycol-assisted hydrothermal method using urea as a precipitant[J].Journal of Materials Chemistry A,2015,3(38):1949 7-19506.
[13] Zhu Zhi, Zhang Ding,Yan Hui,et al.Precise preparation of high performance spherical hierarchical LiNi0.5Mn1.5O4 for 5 V lithium ion secondary batteries[J].Journal of Materials Chemistry A,2013,1(18):5492-5496.
[14] Zhang Xiaolong,Cheng Fangyi,Zhang Kai,et al.Facile polymer-assisted synthesis ofLiNi0.5Mn1.5O4 with a hierarchical micro-nano structure and high rate capability[J].Rsc Advances,2012,2(13):5669-5675.
[15] Capsoni D,Bini M,Chiodelli G,et al.Inhibition of Jahn-Teller cooperative distortion in LiMn2O4 spinel by Ga3+ doping[J].Journal of Physical Chemistry B,2002,06(30):7432-7438.
[16] Yang Yuan,Xie Chong,Riccardo Ruffo,et al.Single Nanorod Devices for Battery Diagnostics:A Case Study on LiMn2O4[J].Nano Letters,2009,9(12):4109-4114.
[17] Thirunakaran R,Ravikumar R,Vijayarani S,et al.Molybdenum doped spinel as cathode material for lithium rechargeable cells[J].Energy Conversion and Management, 2012,53(1):276-281.

