Beckman Coulter AU2700全自动生化仪的性能验证
杨伟明,王小中,刘静,吕娇凤
(南昌大学第二附属医院检验科,南昌330006)
Beckman Coulter AU2700全自动生化仪的性能验证
杨伟明,王小中,刘静,吕娇凤
(南昌大学第二附属医院检验科,南昌330006)
目的对在Beckman Coulter AU2700全自动生化分析仪部分检测项目丙氨酸氨基转移酶(ALT)、尿素(UREA)、总蛋白(TP)、氯(Cl-)的分析性能进行验证,保证检测结果的准确可靠。方法根据美国临床实验室标准化协会(CLSI)及其他相关文献对ALT、UREA、TP、Cl-的精密度、正确度、可报告范围、生物参考区间等分析性能进行验证。结果各项目批内精密度、日间精密度分别小于1/4 CLIA’88的允许总误差(1/4Tea)、1/3 CLIA’88的允许总误差(1/3Tea);正确度偏倚小于1/2 CLIA’88的允许总误差(1/2Tea);ALT、UREA、TP、Cl-线性实验相关系数2≥0.975,以上项目在厂家规定的检测范围内线性良好;生物参考区间验证结果均在设定的范围之内。结论Beckman Coulter AU2700全自动生化分析仪所验证项目性能符合要求,该检测系统能够满足临床应用。
全自动生化分析仪;检测系统;性能验证
全自动生化分析仪是临床检验中经常使用的重要仪器之一,通过对血液或体液的各种生化指标进行分析测定,为临床疾病的诊断、治疗提供可靠依据。然而,设备的检测系统性能是否符合要求,对我们的检验结果起着决定性作用。《医学实验室质量和能力认可准则》(ISO 15189:2012,IDT)和《医疗机构临床试验室管理方法》等也要求对全自动生化分析仪性能进行验证。本文对在Beckman Coulter AU2700全自动生化分析仪的检测项目丙氨酸氨基转移酶(ALT)、尿素(UREA)、总蛋白(TP)、氯(Cl-)的分析性能进行验证,评价是否达到要求、能否满足临床应用。现报道如下。
1 材料与方法
1.1 仪器及试剂
1.1.1 仪器Beckman Coulter AU2700全自动生化分析仪
1.1.2 试剂质控品由RANDOX公司提供,高值质控品(批号:765UE),中值质控品(批号:1005UN);ALT、UREA、TP、Cl-项目均使用原装配套试剂、校准品,由Beckman Coulter公司提供。
1.2 实验样本⑴精密度实验样本:2个水平RANDOX质控血清,根据需要分管冷冻保存。⑵有证的参考物质:ALT、UREA、TP、Cl-各一个水平,血清ALT和TP,证书编号分别为GBW(E)090593、GBW(E)090351,由北京市医疗器械检验所提供;血清UREA,证书编号为GBW09174a,由卫生部临床检验中心提供证公司提供;血清Cl-,证书编号为GBW09152,由中国计量科学研究院提供。⑶能力验证(PT)定值样品:国家卫计委临检中心2016年第二次PT样品,编号分别为201621、201622、201623、201624、201625。⑷分析测量范围(AMR)样本:收集接近于ALT、UREA、TP、Cl-项目试剂厂家提供的分析测量范围上限(高浓度H)和下限(低浓度L)的足够实验用量样本备用。⑸临床可报告范围(CRR)样本:选择ALT、UREA、TP、Cl-项目在AMR内的高值足够实验用量样本,根据需要用生理盐水稀释2倍、5倍、10倍不等备用。⑹生物参考区间验证样本:选择无溶血、脂血和黄疸的健康体检者的新鲜血清样品20份,男女各半。
1.3 方法
1.3.1 精密度验证批内精密度:选择高值与中值两个水平的质控血清作为评价样本,在较短的时间内及稳定的条件下连续重复测定20次,记录每次的测定结果并计算其均值(MEAN)、标准差(SD)和变异系数(CV)。日间精密度:每天做1次评价样品,累积20次结果[1],计算MEAN、SD和CV。以美国临床实验室修正法规(CLIA’88)规定的TEa(ALT、UREA、TP、Cl-的Tea分别是20%、9%、10%、5%)为依据,批内精密度<1/4TEa,日间精密度<1/ 3TEa,对精密度性能进行验证。
1.3.2 正确度验证参照中国合格评定国家认可委员会(CNAS)-CL38:2012《医学实验室质量和能力认可准则在临床化学检验领域的应用说明》[2]及有关参考文献[3]标准,对ALT、UREA、TP、Cl-项目进行正确度验证,按以下2种方法进行:⑴检测ALT、UREA、TP、Cl-项目有证的参考物质,每个项目重复测定3次,计算每个样品重复测量的均值与参考物质的靶值的相对偏倚;⑵检测2016年国家卫计委临检中心发放的EQA样品5份,每个样品重复测定3次,计算每个样品重复测量的均值与靶值的相对偏倚;⑶正确度的质量要求:ALT、UREA、TP、Cl-偏倚<1/2Tea(偏倚分别<10%、4.5%、5%、2.5%)判定正确度验证符合要求。
1.3.3 AMR验证按照参考文献[3],将ALT、UREA、TP、Cl-项目AMR验证低中值(L)和高值(H)样本,分别按照5H、4H+1L、3H+2L、2H+3L、1H+4L、5L的关系配置成6个浓度梯度,每个浓度的样本按顺序测定三次,计算均值。将预期值(x)与测定值(y)进行回归分析,得到直线回归方程y=bx+a。若b值在1±0.03范围,相关系数r2≥0.975,a和0无显著差异,接近于0,则可直接判断分析测量范围在实验已涉及浓度;如果上述任一条不满足条件,则舍去高值或中值组数据,再做回归统计分析,直至缩小分析范围或重做,判断符合要求。
1.3.4 CRR CRR上限通过最大稀释度试验来验证[4,5]。在AMR范围内取一份高浓度(已知值)的病人样本,用空白液或厂商推荐的稀释液和最大稀释度进行系列稀释,已知值的实验样品在检测系统上进行检测,每个浓度重复测定3次,获得的结果均值为实测均值。已知值除以稀释度为预期值,计算回收率=(实测均值/预期值)×100%和偏倚。判定标准:以110%≥回收率≥90%,且偏倚<1/2Tea,最大稀释度得到验证,AMR乘以最大稀释度即为CRR上限,结合AMR和临床需要确定日常工作该项目的最大稀释度及CRR。
1.3.5 生物参考区间验证参照行业标准[6],进行小样本验证,选择20例健康人员为实验对象,若参考区间按性别、年龄等分组,则每组至少20人,对项目的参考区间进行验证。判定标准:落在参考限外的测定值不超过2个标本(10%),则该参考区间可使用;若3个或3个以上测定值超出,则需重新筛选20人,重复上述操作,同样若不超过2个测定值超出该参考区间的则可以使用,参考区间验证通过。否则,应考虑是否需要建立自己的参考区间。
1.3.6 统计学分析用Excel 2003办公软件和SPSS 19.0软件进行数据处理及统计分析。

表1 ALT、UREA、TP、Cl-的批内精密度实验统计结果及性能判断
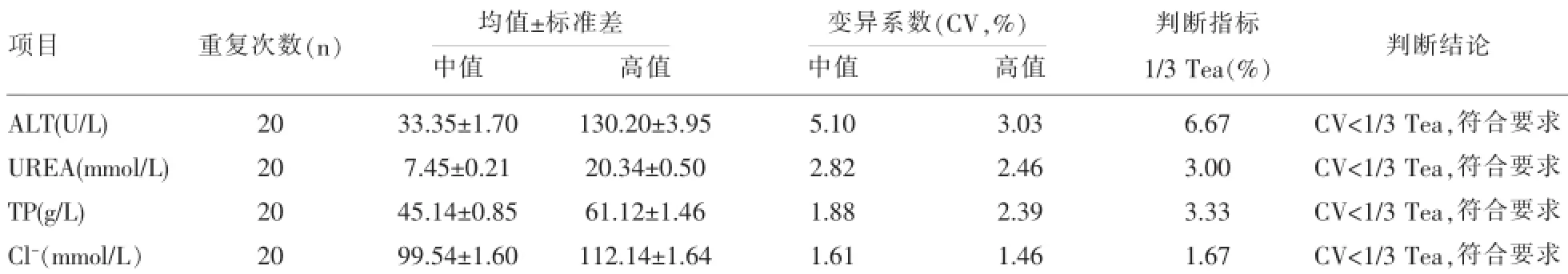
表2 ALT、UREA、TP、Cl-的日间精密度实验统计结果及性能判断
2 结果
2.1 精密度验证
2.1.1 批内精密度连续测定中、高2个浓度水平质控品,ALT、UREA、TP、Cl-的CV%均小于1/4Tea,符合要求,验证通过。结果见表1。
2.1.2 日间精密度测定中、高2个浓度水平质控品,每天1次,连续测20d,记录结果并进行统计分析,ALT、UREA、TP、Cl-的CV%均小于1/3Tea,各项目测定结果均符合要求,验证通过。结果见表2。
2.2 正确度验证
2.2.1 检测有证的参考物质ALT、UREA、TP、Cl-各项目的正确度验证结果显示偏倚均小于1/2Tea,符合要求,验证通过。结果见表3。
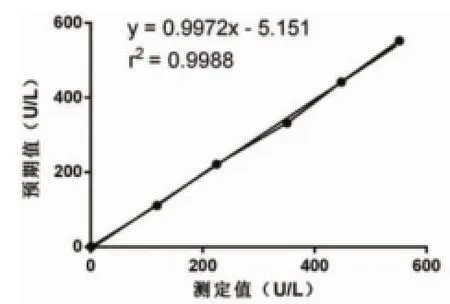
图1 ALT测定值与预期值散点图
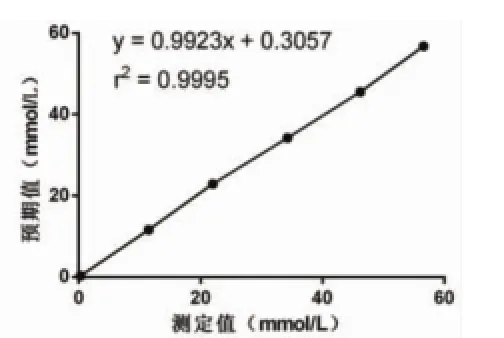
图2 UREA测定值与预期值散点图
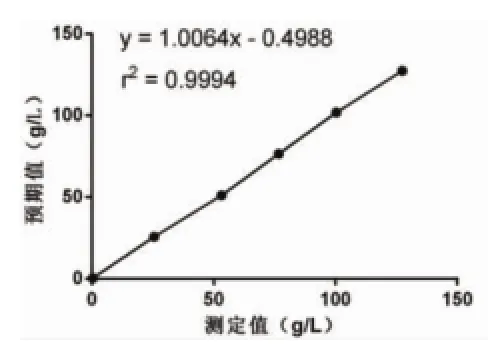
图3 TP测定值与预期值散点图
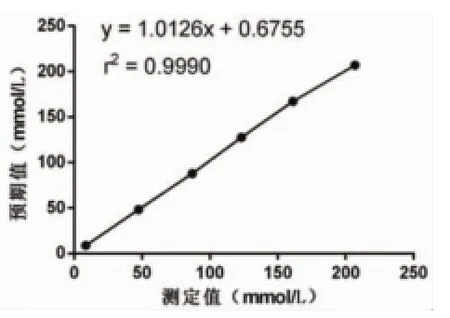
图4 Cl-测定值与预期值散点图
2.2.2 检测PT样品ALT、UREA、TP、Cl-各项目的正确度验证结果显示偏倚均小于1/2Tea,符合要求,验证通过。结果见表4。
2.3 分析测量范围ALT、UREA、TP、Cl-分别选择低浓度和高浓度样本各1份,分别按要求制备成6个实验样品,按实验方法测量,记录结果并绘制散点图(分别见图1~图4),所有实验点呈明显直线趋势,建立直线回归方程,r2≥0.975,斜率b均在0.97~1.03之间,接近于1,截距a与0均无显著性差异(P均>0.05),且6个测定值与预期值偏差均<±10%,ALT、UREA、TP、Cl-的分析测量范围验证通过,结果见表5。
2.4 CRR验证结果在AMR内取高值血清样本,进行不同比例稀释,检测结果用稀释回收率表示,实验结果见表6,回收率均在90%~110%之间,偏差均<1/2TEa,最大稀释度得到验证,结合AMR和临床需要确定日常工作该项目的最大稀释度及CRR。
2.5 生物参考区间每个项目选择不同年龄10名男性和10例女性共20例健康体检者体检测ALT、UREA、TP、Cl-,浓度分别为(7.50~40.00)U/L、(3.40~8.00)mmol/L、(67.50~78.10)g/L、(99.06~102.90)mmol/L,均落在需验证的的参考区间内。ALT、UREA、TP、Cl-参考区间分别为(5.00~40.00)U/L、(2.90~8.20)mmol/L、(60.00~83.00)g/L、(96.0~108.0)mmol/L得到验证,结果显示生物参考区间可以直接使用。
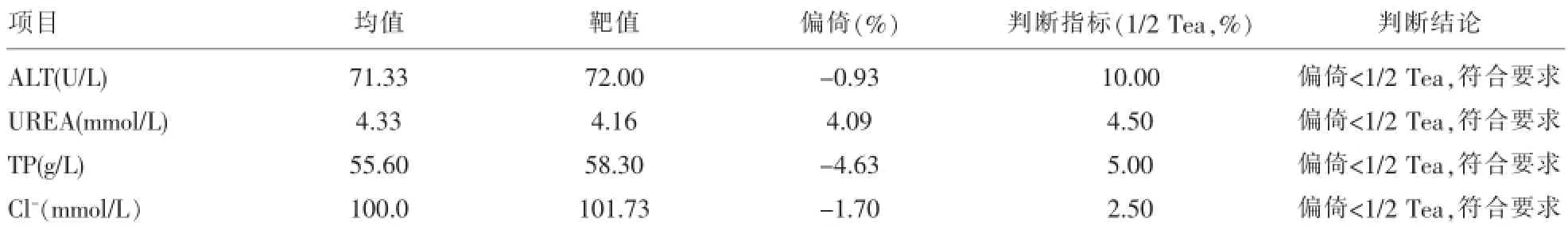
表3 有证参考物ALT、UREA、TP、TG、TBIL、Cl-的正确度实验统计结果及性能判断
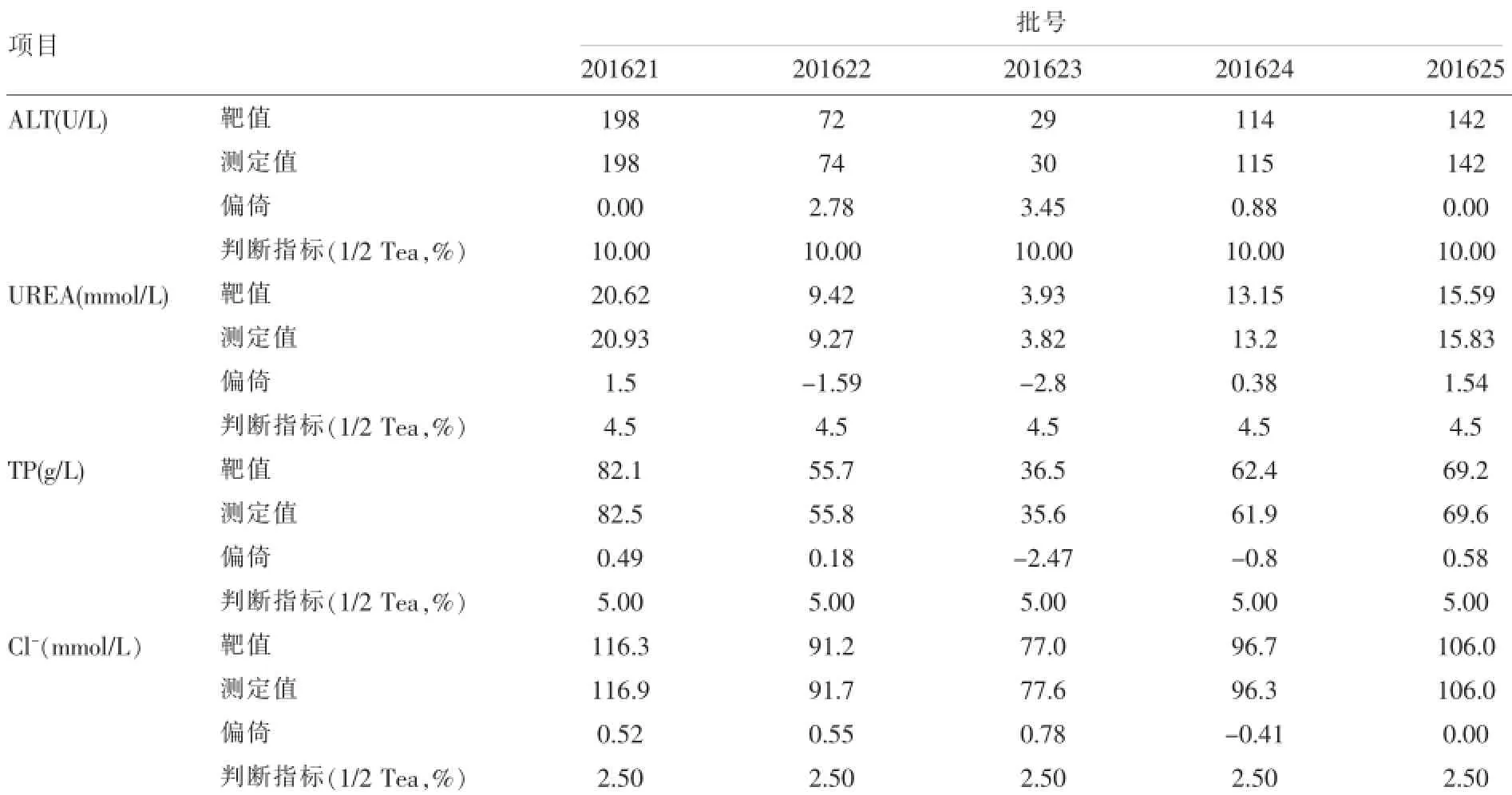
表4 PT样品ALT、UREA、TP、Cl-的正确度实验统计结果及性能判断
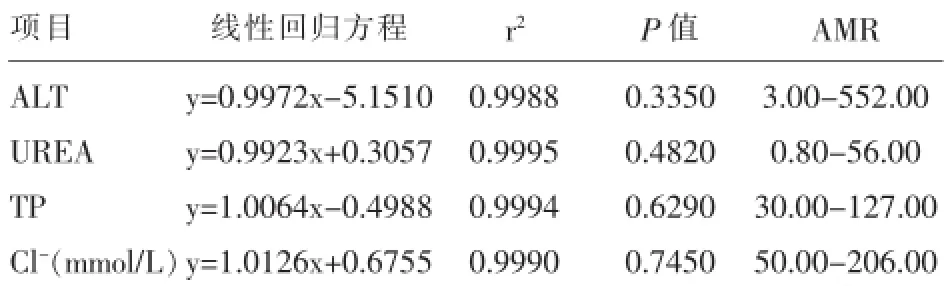
表5 ALT、UREA、TP、Cl-的AMR实验统计结果
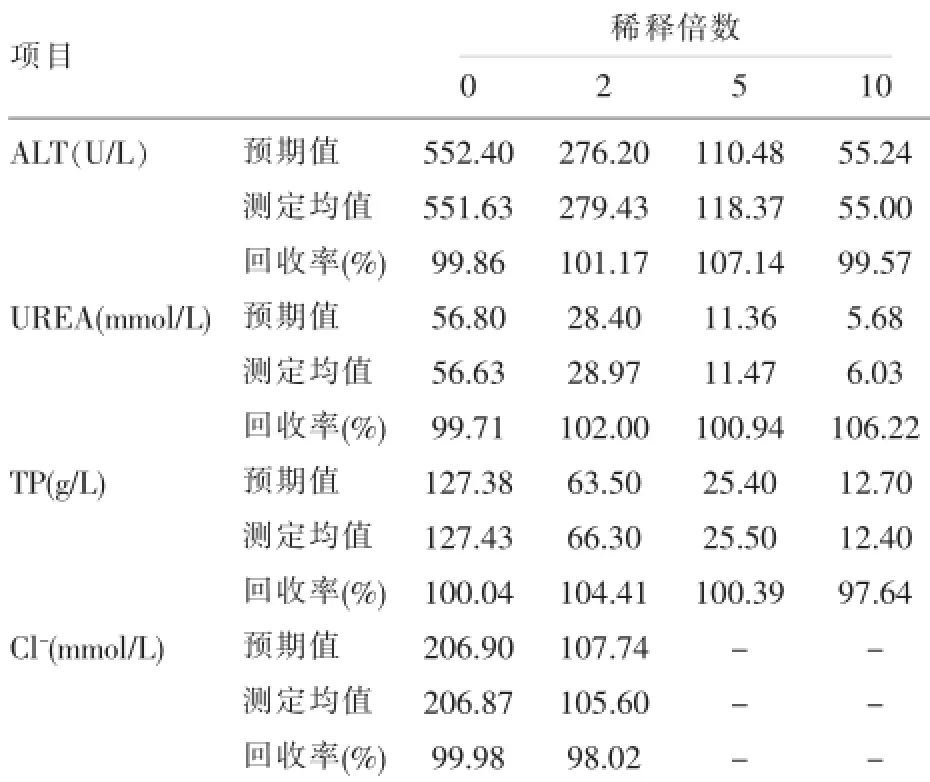
表6 ALT、UREA、TP、Cl-的稀释回收实验统计结果
3 讨论
精密度是指在规定条件下,对同一或类似被测对象重复测量所得示值或测定值间的一致程度,反映了系统的随机误差。临床上通常仅对标本作一次检测就发出报告,因此仪器的精密度性能非常重要,是评价检验方法、仪器或试剂盒分析性能的首要指标,同时也是保障检验结果准确的前提[7]。为了更好地检出不稳定的误差,美国NCCLS EP-5A文件,CLIA'88能力验证分析质量提出,当批内精密度小于1/4 CLIA'88,日间精密度小于1/3 CLIA'88时,可认为它的随机误差属于可接受的水平[8]。表1、表2结果表明,AU2700生化仪对4个检测项目的高中值的批内精密度为1.01%~2.96%和日间精密度为1.46%~5.10%,符合CLIA'88能力验证分析质量要求,表明其具有良好的精密度,满足性能评价要求。
正确度是指无穷次重复测量所得量值的平均值与一个参考量值间的一致程度[9,10],用“偏倚”表示,反映了检测系统的系统误差[11]。EP15-A3[12]建议临床实验室用定值参考物质进行正确度验证,这里的参考物质是一个广义的概念,包括了有证参考物质、大型能力比对或室间质评物质等,临床实验室对定值参考物质进行检测,若检测结果在允许误差或不确定度范围内则正确度得到验证。我国卫生行业标准[9]规定至少用2个测量浓度的定值参考物质进行试剂盒的正确度性能验证。参考EP15-A3和行业标准,我们分别使用了有证的参考物质和PT定值的5个样品共6个测量浓度进行正确度性能验证,浓度涵盖分析测量范围。使用有证参考物质进行正确度评价当然是首选的方法,但在实际工作中,由于购买有证的参考物质价格昂贵,尤其要购买多个浓度更是不易。可以利用5个PT/EQA样本的简易方法进行正确度验证[3],只要参加PT的实验室数量足够大,分析物冷冻保存条件下性能稳定,此方法不失为一种简便、经济、有效的方法。本研究表3、表4结果显示,AU2700生化仪对3个检测项目的偏倚均小于1/ 2Tea,说明正确度符合临床要求。
可报告范围包括AMR和CRR。AMR是指标本不经任何预处理,检验程序所能给出准确结果的范围[9]。有时临床上常出现超出AMR上限的结果,实验室需将标本稀释后重新测定,测定结乘以稀释倍数,发出检测报告,这就是临床可报告范围[13]。在本研究AMR实验中对系列浓度样本进行检测,并对预期值和测定值回归分析,r2均≥0.975,斜率b在0.97~1.03之间,接近于1,截距a与0无显著性差异(P均>0.05),计算每个样品的稀释回收率均在90%~110%,稀释偏差均≤1/2TEa,AU2700生化仪在厂家规定的检测范围内线性良好。在我们具体的临床工作中,不但要检测项目的AMR,也要结合临床实际考虑CRR,目的是为了分析各稀释浓度的线性关系,确定最高稀释倍数,从而确保为临床发出准确的检验报告,一般只是对于那些CRR大于AMR的检测项目才需要进行验证[14,15]。表7实验结果表明,所研究项目的稀释回收率均在90%~110%之间,偏差均<1/2TEa,最大稀释倍数得到验证,说明在一定范围内的标本稀释检测结果可靠,可满足临床要求。20例健康人血清浓度均在设定的参考区间范围内,可以认为所验证的参考区间适用于本实验室。
综上所述,本研究参考试剂厂家、CLSI文件以及国内关于定量检测分析系统性能验证的相关报道,评价了在Beckman coulter AU2700全自动生化分析仪上检测ALT、UREA、TP、Cl-的性能,基本与厂家声明的性能一致,检测系统的性能通过验证,能够满足临床需要,可以应用于日常临床检验工作。
[1]冯仁丰.临床检验质量管理技术基础.第2版.上海:上海科学技术文献出版社,2007:85-91.
[2]中国合格评定国家认可委员会.医学实验室质量和能力认可准则在临床化学检验领域的应用说明(CNAS-CL38)[S].2012-9-13.
[3]张秀明,阚丽娟.浅析定量检验程序分析性能验证实验方案设计[J].中华检验医学杂志,2015,38(6):428-430.
[4]李婷婷,宁芬,陆雅春,等.日立7600全自动生化分析仪检测系统性能验证[J].安徽医学,2013,34(11):1679-1682.
[5]Zhang XM,Wang WJ,Wen DM,et al.Analytical performances and heart failure research of the BNP and NT proBNP assays on the cobas e601 and ADVIA centaur[J].Clin Lab,2013,59:109-126.
[6]中华人民共和国卫生部.临床实验室检验项目参考区间的的制定(WS/T花402-2012)[S]:2012-12-24.
[7]吴宗勇,贾德强,李佳,等.自动生化分析仪的能力验证[J].临床和实验医学杂志,2011,10(7):524-525.
[8]陶亚,廖经忠,孙谦,等.Beckman Coulter AU 5821全自动生化分析仪性能评价[J].中国现代医学杂志,2014,24(29):91-97.
[9]王治国.临床检验质量控制技术[M].第2版.北京:人民卫生出版.2010:41-46.
[10]中华人民共和国卫生和计划生育委员会.临床实验室对商品定量试剂盒分析性能的验证(WS/T 420-2013)[S]:2013-07-16.
[11]医学实验室质量和能力认可准则:ISO 15189:2007[S].
[12]CLSI.User verification of precision and estimation of bias;approved guideline-third edition(EP15-A3)[s].2014.
[13]徐江霞,龚淑琪,万振华,等.新型乙肝定量PCR试剂检测性能验证[J].实验与检验医学,2016,34(2):149-151.
[14]寿爽,徐胜,吕洁,等.迈瑞BC-6900全自动血细胞分析仪血液模式的性能验证和评价[J].实验与检验医学,2015,33(3):310-316.
[15]陈丽娟,罗俐莺,魏权,等.尿液有形成分全自动分析仪(UF-1000i)性能评价[J].实验与检验医学,2015,33(4):435-475.
R446.11+2
A
1674-1129(2017)02-0222-04
10.3969/j.issn.1674-1129.2017.02.026
2016-10-19;
2016-12-25)
国家自然科学基金(81560033)
吕娇凤,主任技师,Email:2111014815@qq.com

