耐碳青霉烯类药物肺炎克雷伯菌耐药基因研究
周道平,陆伟桃
(广州市黄埔区红十字会医院检验科,广东广州510760)
耐碳青霉烯类药物肺炎克雷伯菌耐药基因研究
周道平,陆伟桃
(广州市黄埔区红十字会医院检验科,广东广州510760)
目的了解对碳青霉烯类药物耐药的肺炎克雷伯菌(CRKP)碳青霉烯酶基因的携带情况。方法收集本院2013年1月至2016年6月临床标本中分离的630株肺炎克雷伯菌,采用VITEK-2 Compact全自动微生物鉴定系统进行细菌鉴定和药敏检测以及改良Hodge试验筛选CRKP,采用聚合酶链反应(PCR)检测碳青霉烯酶基因,采用多位点序列分型(MLST)技术对CRPK进行分子遗传学分析。结果630株肺炎克雷伯菌中,61株对亚胺培南耐药,为CRKP,占9.7%,CRKP对多种临床常用抗菌药物均显著耐药,对替加环素具有良好的敏感性。PCR结果显示59株CRKP携带碳青霉烯酶基因,其中53株携带bla KPC-2型基因(89.8%),4株携带bla NDM-1型基因(6.8%),2株携带bla OXA-48型基因(3.4%)。MLST分型主要以ST11为主(49株,80.3%)。结论我院CRKP基因型主要为KPC-2型,另外有散在NDM-1和OXA-48型,MLST分型主要为ST11型。
肺炎克雷伯菌;抗药性细菌;碳青霉烯酶;多位点测序分型
肺炎克雷伯菌(Klebsiella pneumoniae)是一种常见的主要寄生于人体上呼吸道和肠道中的革兰阴性杆菌,长期大量使用抗生素或人体免疫力下降时可引起呼吸、消化以及泌尿系统等多部位感染[1],是医院内感染重要的条件致病菌,同时也是临床上比较常见的耐药菌[2,3]。由于超广谱β-内酰胺酶(ESBLs)等耐药机制的介导,肺炎克雷伯菌对常用的青霉素类以及头孢菌素类等β-内酰胺类药物的耐药率较高[4],但对碳青霉烯类和β-内酰胺酶抑制剂复合制剂的耐药率相对较低[5]。但由于近几年来碳青霉烯类药物在临床上的广泛应用,并且编码碳青霉烯酶的基因位于可移动的基因元件上,致使耐碳青霉烯类药物的肺炎克雷伯菌(Carbapenem Resistant Klebsiella Pneumoniae,CRKP)的检出率逐渐上升以及发生医院内感染的局部暴发流行[6-8]。本研究应用多重PCR技术和多位点序列分型(multilocus sequence typing,MLST)技术对我院2013年1月至2016年6月分离的CRKP进行基因分型研究,为指导临床合理使用抗生素和院内感染控制提供科学依据。
1 材料与方法
1.1 菌株来源收集广州市黄埔区红十字会医院2013年1月至2016年6月临床分离的非重复肺炎克雷伯菌630株,筛选出碳青霉烯类药物不敏感(美罗培南或亚胺培南)肺炎克雷伯菌61株,其中31株分离自下呼吸道标本,16株分离自尿液标本,6株分离自血液标本,8株分离自其他无菌体液标本。菌株鉴定和药敏试验采用法国梅里埃公司的Vitek2-Compact全自动微生物鉴定仪,碳青霉烯酶表型确证使用CLSI推荐的改良Hodge试验。质控菌株大肠埃希菌ATCC 25922和肺炎克雷伯菌ATCC 700603、ATCC BAA 1705和ATCC BAAl706为本实验室保存。
1.2 药物敏感试验应用VITEK-2 Compact全自动微生物鉴定系统检测CRKP对阿米卡星、头孢曲松、头孢他啶、头孢吡肟、哌拉西林/舒巴坦、美罗培南、亚胺培南、厄他培南、复方磺胺甲唑、环丙沙星和左氧氟沙星等药物的敏感性,药物敏感性判定标准参照CLSI的折点判读标准[9]。应用E-test条法检测替加环素的敏感性,判断标准参照美国食品药品监督管理局(FDA)文件标准。
1.3 细菌总DNA的提取采用煮沸法提取细菌总DNA,方法为挑取对数生长期菌落3~5个,混悬于100μl超纯水中,煮沸10min,15400g离心2min,上清使用分光光度计测量DNA含量,并分装-20℃冰箱保存备用。
1.4 碳青霉烯酶基因bla KPC、bla IMP、bla VIM、bla NDM-1和bla OXA-48检测根据参考文献[10]设计并合成PCR引物,引物序列见表1。PCR扩增条件为:95℃5min;95℃45s,60℃45s,72℃1min,共35个循环;72℃8min。扩增产物送Invitrogen公司进行测序,测序结果在GenBank数据库进行比对查询(www.ncbi.nlm.nih.gov/blast/)并确定基因类型。

表1 耐碳青霉烯类药物肺炎克雷伯菌PCR扩增引物序列
1.5 MLST分析通过对gapA、infB、mdh、pgi、rpoB、pheE和tonB 7个管家基因进行PCR和测序,对所有CRKP进行MLST分析。引物合成和反应条件参照MLST数据库(http://bigsdb.web.pasteur.fr),即94℃2min,94℃20s,50℃1min,72℃30s,35个循环;72℃5min。测序结果提交至MLST数据库(http://www.pasteur.fr/recherche/genopole/ PF8/mlst/Kpneumoniae.html)进行序列比对以确定菌株的序列型(Sequence Type,ST)。
2 结果
2.1 CRKP药物敏感性检测结果本次分离的61株CRKP对阿米卡星、头孢曲松、头孢他啶、头孢吡肟、哌拉西林/舒巴坦、美罗培南、亚胺培南、厄他培南、复方磺胺甲噁唑、环丙沙星和左氧氟沙星的耐药率分别为93.4%(57/61)、98.4%(60/61)、96.7% (59/61)、98.4%(60/61)、98.4%(60/61)、100.0%(61/ 61)、100.0%(61/61)、100.0%(61/61)、14.8%(9/61)、96.7%(59/61)和95.1%(58/61),未检出对替加环素耐药菌株。
2.2 碳青霉烯酶基因检测结果对61株CRKP进行碳青霉烯酶基因扩增和测序后,结果与GenBank数据库进行并对,结果显示有59株CRKP携带有碳青霉烯酶基因,其中53株携带bla KPC-2型基因,占89.8%(53/59);4株携带bla NDM-1型基因,占6.8%(4/59);2株携带bla OXA-48型基因,占3.4%(2/59);未检测到编码VIM和IMP酶的基因,基因扩增结果见图1。
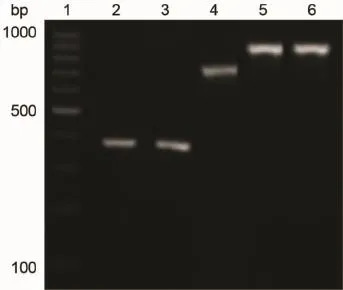
图1 CRKP碳青霉烯酶基因扩增结果
2.3 MLST分析结果将7个管家基因的基因测序结果与数据库比对结果显示,61株CRKP中最常见的型别为ST11型,有49株,占80.3%,其次为ST101型(3株)、ST15型(3株)、ST437型(2株),ST17、ST709、ST147、ST2068型各1株。53株携带bla KPC-2基因的菌株中46株为ST11型,2株ST101型,2株ST15型,ST437、ST17型和ST709型各1株。
3 讨论
肺炎克雷伯菌是临床分离和医院内获得性感染非常重要的条件致病菌之一,其可引起下呼吸道感染、尿路感染、败血症、肝脓肿等。碳青霉烯类抗菌药物是治疗肺炎克雷伯菌感染的有效药物,但2015年CHINET对国内主要地区20所医院细菌耐药性监测显示肠杆菌科细菌中耐碳青霉烯类药物主要以肺炎克雷伯菌为主,并且肺炎克雷伯菌对碳青霉烯类药物的耐药率在2005年至2015年的10年间呈快速上升趋势,从最开始的3%上升至2015年的15%左右[11],使临床的抗感染治疗面临巨大挑战。
本次分离的CRKP具有多重耐药的特点,对青霉素类、头孢菌素类以及β内酰胺类药物的耐药率非常高,几乎全部耐药,对喹诺酮类和氨基糖苷类药物也具有较高的耐药率,但对磺胺类抗菌药物耐药率较低,对替加环素无耐药菌株,显示良好的敏感性。
肺炎克雷伯菌对碳青霉烯类药物产生耐药的最主要的机制是其产生碳青霉烯酶,主要的碳青霉烯酶包括A类、B类和D类。A类主要有KPC、SME、IMI、NMC和GES等类型,以KPC型最为常见。KPC酶可水解碳青霉烯酶类药物的β内酰胺环,于1997年在美国北卡罗来纳州被发现[12],并命名为KPC-1,随后在肺炎克雷伯菌中发现了11种KPC酶,国外以产KPC-3型酶的检出率较高,而在我国临床上以KPC-2型最为常见[13]。携带有KPC酶基因的肺炎克雷伯菌对亚胺培南和美罗培南高度耐药。B类又称金属β-内酰胺酶,主要有IMP、VIM和NDM-1等类型,可水解具有β-内酰胺环的多种抗生素,水解活性不被克拉维酸/舒巴坦等复合剂抑制,对氨曲南无水解活性。D类酶又称苯唑西林酶(OXA酶),在肺炎克雷伯菌中主要是OXA-48型[14],其对亚胺培南亲合力较高,但水解效能较低,不能水解氨曲南和广谱头孢菌素[15]。
结果显示,本院分离的61株CRKP中有59株携带碳青霉烯酶基因,检出率为96.7%,其中53株携带bla KPC-2型基因,占89.8%(53/59),提示本院CRKP以KPC-2型为主,与文献报道一致[16,17],同时提示,产KPC-2型碳青霉烯酶是肺炎克雷伯菌对碳青霉烯类药物耐药的最主要原因。本研究同时有2株CRKP未检测出碳青霉烯酶基因,其对碳青霉烯类药物耐药的机制可能与高水平产AmpC酶,对碳青霉烯类药物的亲和力下降以及膜通透性改变或外排泵增强相关。本研究发现4株CRKP携带bla NDM-1基因,2株携带bla OXA-48基因,未检测到编码VIM和IMP酶的基因。
MLST技术是一种源于多位点酶电泳分型(MLEE)技术的,基于核酸序列测定的细菌分型方法,通过PCR扩增多个管家基因片段,测定其序列,分析菌株的变异。MLST分析结果可在不同的实验室间进行比较,实现了全球范围的数据交流。
研究显示,世界范围内流行的CRKP主要为ST11和ST258型,二者有较近的亲缘关系,仅tonB基因有差异[18,19]。我国以ST11型CRKP为主要流行株[18,20],本研究显示,本院分离的CRKP主要为ST11型,占80.3%,53株KPC-2型CRKP中有46株为ST11型,占88.5%,并未发现ST258型CRKP,与文献报道一致。
综上所述,我院CRKP基因型主要为KPC-2型,MLST分型主要为ST11型,产KPC-2型碳青霉烯酶是我院肺炎克雷伯菌对碳青霉烯酶类药物耐药的主要原因,因此,临床上需加强对CRKP的监测,并采取有效措施预防CRKP的感染。
[1]杨剑,刘剑荣,黄永建.细菌培养法与核酸(荧光PCR法)检测肺炎克雷伯菌的对比分析[J].实验与检验医学,2014,32(6):692-693,721.
[2]胡付品,朱德妹,汪复,等.2013年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2014,14(5):365-374.
[3]梁丽霞,岑丽莲,赖汉瑜,等.311株肺炎克雷伯菌感染分布及耐药分析[J].实验与检验医学,2016,34(3):375-376.
[4]杨剑,王小中.产超广谱β-内酰胺酶肺炎克雷伯菌的耐药情况分析[J].实验与检验医学,2016,4(2):229-230.
[5]Nordmann P.Carbapenemase-producing Enterobacteriaceae:overview of a major publichealth challenge[J].Med Mal Infect,2014,44(2):51-56.
[6]Wang X,Chen G,Wu X,et al.Increased prevalence of carbapenem resistant Enterobacteriaceae in hospital setting due to crossspecies transmission of the bla(NDM-1)element and clonal spread of progenitor resistant strains[J].Front Microbiol,2015,6 (595):1-8.
[7]World Health Organization.Antimicrobial resistance:global report on surveillance 2014[R].Geneva,Switzerland:WHO,2014.
[8]Hussein K,Raz-Pasteur A,Finkelstein R,et al.Impact of carbapenem resistance on the outcome of patients'hospital-acquired bacteraemia caused by Klebsiella pneumoniae[J].J Hosp Infect,2013,83(4):307-313.
[9]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility texting;twenty-fifth informational supplement.CLSI document M100-S25[S].Wayne,PA:CLSI,2015.
[10]Doyle D,Peirano G,Lascols C,et al.Laboratory detection of Enterobacteriaceae that produce carbapenemases[J].J Clin Microbiol,2012,50(12):3877-3880.
[11]胡付品,朱德妹,汪复,等.2015年CHINET细菌耐药性监测[J].中国感染与化疗杂志,2016,16(6):685-694.
[12]Yigit H,Queenan AM,Anderson GJ,et al.Novel carbapenem-hydrolyzing beta-lactamase,KPC-1,from a carbapenem-resistant strain of Klebsiella pneumoniae[J].Antimicrob Agents Chemother,2001,45(4):1151-1161.
[13]邵闯,薛建江.碳青霉烯类耐药肺炎克雷伯菌耐药机制的研究进展[J].现代医药卫生,2016,32(20):3150-3153.
[14]Nordmann P,Naas T,Poirel L.Global spread of carbapenemaseproducing Enterobacteriaceae[J].Emerg Infect Dis,2011,17(10):1791-1798.
[15]Vila J,Marti S,Sánchez-Céspedes J.Porins,efflux purnps and multidrug resistance in Acinetobacter baumannii[J].J Antimicrob Chenother,2007,59(6):1210-1215.
[16]刘萍,张坚磊,刘晔华,等.耐碳青霉烯类抗菌药物的肺炎克雷伯菌的基因分型研究[J].中华检验医学杂志,2016,39(9):701-704.
[17]吕继芳,郑焙文,张静,等.耐碳青霉烯类肺炎克雷伯菌分子流行病学和耐药基因分析[J].中国抗生素杂志,2016,41(5):356-361.
[18]Munoz-Price LS,Poirel L,Bonomo RA,et al.Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases[J].Lancet Infect Dis,2013,13(9):785-796.
[19]Chen L,Mathema B,Chavda K D,et al.Carbapenemaseproducing Klebsiella pneumoniae:molecular and genetic decoding[J].Trends Microbiol,2014,22(12):686-696.
[20]Qi Y,Wei Z,Ji S,et al.ST11,the dominant clone of KPCproducing Klebsiella pneumoniae in China[J].J Antimicrob Chemother,2011,66(2):307-312.
Study on carbapenem resistance genes and genotypes of carbapenem-resistant Klebsiella pneumoniae
ZHOU Daoping,LU Weitao.Clinical Laboratory,the Red Cross Hospital of Huangpu District in Guangzhou City,Guangdong Province,Guangzhou 510760,China.
Objective To investigate the carbapenem resistance genes and genotypes of carbapenem-resistant Klebsiella pneumoniae(CRKP)isolates.Methods Six hundred and thirty isolates of Klebsiella pneumoniae were isolated from various clinical specimens between January 2013 and June 2016 in our hospital.Identification and antimicrobial susceptibility testing for Klebsiella pneumoniae isolates were conducted by VITEK-2 Compact automatic microbiological assay system.Modified Hodges test was used for detecting carbapenemase-producing isolates.The carbapenemase-encoding genes among CRKP isolates were identified by PCR and sequencing.Multilocus sequence typing(MLST)was used for determining the sequence type of CRKP isolates.Results Among 630 Klebsiella pneumoniae isolates,61 were resistant to imipenem with high-level resistance to most of clinically oftenused antimicrobial agents.Carbapenemase-encoding genes were identified in 59 isolates of CRKP,among which 53(89.8%),4(6. 8%)and 2(3.4%)were found to carry blaKPC-2,bla NDM-1,and bla OXA-48.MLST results showed that ST11 was the most prevalent sequence type,accounting for 80.3%(49/61)of CRKP isolates.Conclusion In Guangzhou area,blaKPC-2 is the most prevalent carbapenemase gene and ST11 is the most prevalent sequence type among CRKP isolates.
Klebsiella pneumoniae;Antimicrobial resistance;Carbapenemase;Multilocus sequence typing
R446.5,Q939.92
A
1674-1129(2017)02-0212-03
10.3969/j.issn.1674-1129.2017.02.023
2017-01-19;
2017-03-17)
周道平,男,1973年生,学士学位,副主任技师,主要从事临床微生物及免疫诊断研究。

