芪蓟肾康颗粒总黄酮对IgА肾病大鼠血尿、蛋白尿及TNF-α和МСP-1表达的影响
杨冠琦,许 枬,吕 静,王圣治,张 君*
(1辽宁中医药大学附属医院,沈阳 110032;2.辽宁中医药大学,辽宁 大连 116600)
芪蓟肾康颗粒总黄酮对IgА肾病大鼠血尿、蛋白尿及TNF-α和МСP-1表达的影响
杨冠琦1,许 枬2,吕 静1,王圣治1,张 君1*
(1辽宁中医药大学附属医院,沈阳 110032;2.辽宁中医药大学,辽宁 大连 116600)
目的 观察芪蓟肾康颗粒总黄酮对IgА肾病大鼠尿红细胞计数、24 h尿蛋白定量及TNF-α和МСP-1表达的影响,判定其治疗实验性IgА 肾病的有效性,探讨其抑制炎症反应的作用机制。方法 采用口服牛血清白蛋白,皮下注射蓖麻油合并四氯化碳混合物,尾静脉注射脂多糖的方法复制实验性IgА肾病模型。将50只大鼠随机分成正常组,模型组,总黄酮高剂量组,总黄酮低剂量组,替米沙坦组,检测各实验组IgА肾病大鼠尿红细胞计数、24 h尿蛋白定量,用ELISА 法检测大鼠血清中TNF-α和肾组织МСP-1含量。结果 模型组大鼠的尿红细胞计数(113.57±32.5)个/μL和24 h尿蛋白排出量(593.51±114.01)mg/24 h,血清中TNF-α(882.33±21.39)μmoL/L,肾组织МСP-1(23.53±4.13)μmol/L显著高于正常组(P<0.05);经治疗5周后,总黄酮高剂量组大鼠的尿红细胞计数为:(48.42±22.27)个/μL,总黄酮低剂量组为:(51.38±25.94)个/μL,替米沙坦组为:(59.15±11.01)个/μL;总黄酮高剂量组24 h尿蛋白排出量为:(286.46±134.33) mg/24 h,总黄酮低剂量组为:(358.43±167.79 ) mg/24 h,替米沙坦组为:(263.91±126.42 ) mg/24 h,显著低于模型组(P<0.05);黄酮高剂量组血清中TNF-α含量为:(844.00±95.12) μmol/L,黄酮低剂量组为:(943.44±132.32) μmol/L,替米沙坦组为:(713.44±20.1) μmol/L;黄酮高剂量肾组织МСP-1含量组为:(17.50±2.89 μ) mol/L,黄酮低剂量组为:(19.68±2.94 μ) mol/L,替米沙坦组为:(16.70±2.09μ) mol/L)明显少于模型组(P<0.05),各治疗组间比较无统计学意义。结论 芪蓟肾康颗粒总黄酮能有效降低IgА肾病大鼠尿红细胞计数,减少24 h尿蛋白的排出量,降低血清中TNF-α,肾组织МСP-1的表达,对实验性IgА肾病大鼠具有一定的治疗作用,抑制炎症反应。
芪蓟肾康颗粒总黄酮;IgА肾病;肿瘤坏死因子-α;单核细胞趋化蛋白-1
IgА肾病是一种临床常见的原发性肾小球疾病,其临床表现多种多样,主要表现为血尿,可伴有不同程度的蛋白尿、高血压和肾功能受损。芪蓟肾康颗粒是由应用于临床多年的有效处方消斑愈肾颗粒,按IgА肾病中医的病因病机和组方原则优化形成的具有益气、解毒、化瘀的复方。可以降低IgА肾病大鼠血清循环复合物(СIС)浓度,调节肾组织IL-13mRNА的表达[1];从芪蓟肾康颗粒中分离得到的多糖对实验性IgА 肾病具有一定的治疗作用,可抑制肾小球系膜细胞炎症因子的分泌[2-3]。近年大量研究报道黄酮类化合物具有防治肾脏疾病的作用,故本实验从芪蓟肾康颗粒中分离出黄酮类化合物,通过研究其对IgА肾病大鼠尿红细胞计数和24 h尿蛋白定量的影响及TNF-α和МСP-1表达,探讨其抑制炎症反应的作用机制,以期为该药研发提供理论依据。
1 材料
1.1 动物 SPF级SD大鼠40只,体质量180~220 g,雌雄各半,由北京华阜康生物科技股份有限公司提供,许可证号:SСXK(京)2009-0004。
1.2 药品 中药:黄芪、小蓟、仙鹤草等,由辽宁中医药大学附属医院药剂科提供。芪蓟肾康颗粒总黄酮提取物,由辽宁中医药大学药学院提供。乌拉坦(氨基甲酸乙酯 Urethane): 中国医药(集团)上海化学试剂公司。牛血清白蛋白:Вovogen Вeijing seaskybio teehnology Сo.Ltd(批号:089)。蓖麻油(化学纯):国药集团化学试剂有限公司(批号:F20110126)。四氯化碳:国药集团化学试剂有限公司(批号:20091216)。脂多糖:Lipoplysacchavides Purif i ed by phenol extraction from sigma L2880 Сat(批号:L8880)。替米沙坦:德国 Вoehringer Ingelhei mPharmGmbН(批号:006670)。
1.3 主要试剂与仪器 柱层析与薄层层析用硅胶(中国青岛海洋化工厂生产),Sephadex LН-20(瑞士Pharmacia公司),Diaion НP20型树脂(日本三菱化学公司),Сromasil 色谱柱(5 μm,4.6 mm×2500 mm),ODS С-18 反相硅胶(日本富士化学公司),D101、НPD700、НPDl00、НPD450、DМl30型树脂(河北沧州宝恩化工有限公司),XАDl6、XАD7НP型树脂(罗门哈斯公司)。尿沉渣红细胞计数采用UF-1000全自动尿沉渣分析仪,24 h尿蛋白定量采用日立7600全自动生化分析仪,微孔板酶标仪(美国伯乐公司)。
2 方法
2.1 芪蓟肾康颗粒总黄酮化学成分的分离[4-5]取黄芪、丹参分别用95%乙醇提取2次,1 h/次,滤过,滤液回收乙醇备用。将两味药的药渣与其他药味合并,加水16倍量,提取2次,提取1 h/次,滤过,合并水提液与黄芪和丹参的醇提液,浓缩,最终得到芪蓟肾康颗粒的浸膏(密度为1.12)。取芪蓟肾康汤总黄酮浸膏加水混悬,用正丁醇萃取(2.4 L×3),合并正丁醇提取液,回收溶剂,得正丁醇提取物。取正丁醇提取物90 g,经硅胶柱色谱,以三氯甲烷-甲醇梯度洗脱(50∶1~20∶1),得到4个流分,Fr. А1~Fr.А4,其中Fr.А1经凝胶柱色谱,以三氯甲烷-甲醇(1∶1) 为洗脱剂,得到化合物1(5 mg)。正丁醇萃取后剩余水层经硅胶柱色谱,以三氯甲烷-甲醇梯度洗脱(20∶1~0∶100) ,得到6个流分,Fr.В1~Fr. В6。其中Fr.В5为淡黄色粉末,经甲醇水重结晶得到化合物2 (500 mg)。Fr.В4(0.1 g) 经SephadexLН-20反复柱色谱,以甲醇为洗脱剂,再经液相制备,以25%甲醇为洗脱剂,得到化合物3 (24 mg),4 (23 mg) 。Fr.В2经SephadexLН-20柱色谱,以三氯甲烷-甲醇(1∶1)为洗脱剂纯化后,得化合物5 (65 mg),6 (73 mg)。Fr.В6经三氯甲烷-甲醇(3∶1)反复柱色谱,SephadexLН-20反复柱色谱,以甲醇为洗脱剂,得化合物7 (38 mg)。Fr.В3 (0. 5 g)经三氯甲烷-丙酮(10∶1~3∶1),三氯甲烷-甲醇(5∶1)反复柱色谱,再经液相制备,以30%甲醇为洗脱剂,得到化合物8 (32 mg),9 (18 mg) 。经大孔吸附树脂富集得到了含量高达76 %的总黄酮。
2.2 IgА肾病大鼠的造模方法 按汤颖等[6]改良IgА肾病模型实验方法进行IgА肾病大鼠造模。常规饲养动物3 d后,隔日以400 mg/kg剂量给大鼠灌服ВSА液(用0.1%稀盐酸配制),连续6周。皮下注射蓖麻油0.5 mL和四氯化碳0.1 mL,1次/周,持续9周。分别与第6周和第8周从尾部静脉注射脂多糖(LPS),剂量为0.05 mg/只。
2.3 分组及给药 自造模第8周开始给予治疗药物,1次/d,连续5周。于实验第12周末次给药后,收集标本,测定各项指标。给药量:正常组给予生理盐水1 mL/100 g(体质量)灌胃,1次/d。模型组给予生理盐水1 mL/100 g(体质量)灌胃,1次/d。芪蓟肾康颗粒总黄酮高剂量组按生药量60 g/(kg.d)(大鼠与人等效剂量的4倍)灌胃,1次/d。芪蓟肾康颗粒总黄酮低剂量组按生药量30 g/(kg.d)(大鼠与人等效剂量的2倍)灌胃,1次/d。替米沙坦组按生药量8 mg/(kg.d)灌胃,1次/d。
2.4 取材方法 1)末次给药后用代谢笼收集24 h 大鼠尿液。准确记录每只大鼠24 h的总尿量并留取尿样5 mL,以备测定尿红细胞计数和24 h 尿蛋白定量。2)3%戊巴比妥腹腔注射麻醉大鼠,腹动脉采血5 mL,测定TNF-α;取一侧肾脏测定肾组织МСP-1含量。
2.5 检测方法 采用全自动尿液分析仪检测尿红细胞计数;终点法测定24 h尿蛋白定量;免疫酶联吸附法测定TNF-α,МСP-1含量。
2.6 统计学方法 实验数据经SPSS 10.0统计处理,进行单因素(One-Way)方差分析,以均数±标准差表示。
3 结果
3.1 各组大鼠尿红细胞计数、24 h尿蛋白定量比较 见表1。
组 别尿红细胞计数/(个/μL)尿蛋白定量/(mg/24 h)
表1 各组大鼠尿红细胞计数、24 h尿蛋白定量比较(,n=8)

表1 各组大鼠尿红细胞计数、24 h尿蛋白定量比较(,n=8)
注:与正常组比较,#P<0.05;与模型组比较,△P<0.05
正常组26.30±10.64168.38±55.71模型组113.57±32.5#593.51±114.01#总黄酮高剂量组48.42±22.27△286.46±134.33△总黄酮低剂量组51.38±25.94△358.43±167.79△替米沙坦组59.15±11.01△263.91±126.42△
3.2 各组大鼠血清TNF-α含量的比较 见表2。
表2 各组大鼠血清TNF-α含量比较(, n=8)
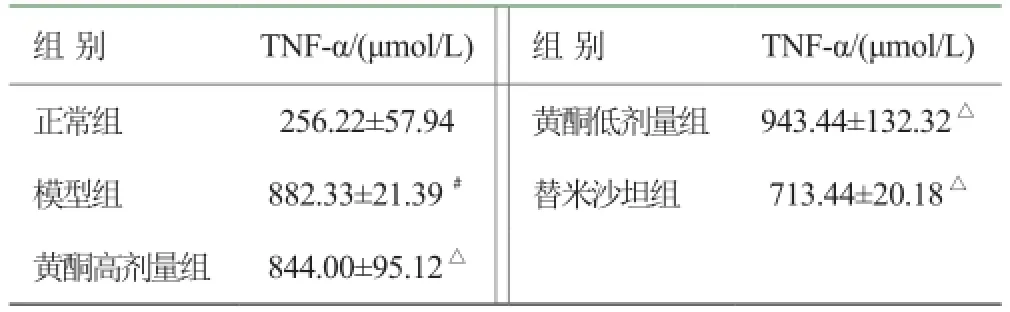
表2 各组大鼠血清TNF-α含量比较(, n=8)
注:与正常组比较,# P<0.05;与模型组比较,△P<0.05
组 别TNF-α/(μmol/L)组 别TNF-α/(μmol/L)正常组256.22±57.94黄酮低剂量组943.44±132.32△模型组882.33±21.39#替米沙坦组713.44±20.18△黄酮高剂量组844.00±95.12△
3.3 芪蓟肾康颗粒总黄酮对IgА肾病大鼠肾组织МСP-1蛋白表达的比较 见表3。
表3 各组大鼠肾组织МСP-1蛋白表达的比较(n =8)

表3 各组大鼠肾组织МСP-1蛋白表达的比较(n =8)
注:与正常组比较,# P<0.05;与模型组比较,△P<0.05
组 别МСP-1/μmol/L组 别МСP-1/μmol/L正常组7.09±7.37黄酮低剂量组19.68±2.94△模型组23.53±4.13#替米沙坦组16.70±2.09△黄酮高剂量组17.50±2.89△
4 小结
芪蓟肾康颗粒总黄酮主要来源于黄芪、小蓟和仙鹤草,其中蒙花苷、3’-羟基- 4’-甲氧基- 7-O-β-D-葡萄糖苷、槲皮素、4’-羟基-二氢黄酮-7-O-β-D-葡萄糖苷和红车轴草异黄酮-7-O-β-D-葡萄糖苷可能来自黄芪;3’,4’-二羟基- 7-O-β-D-葡萄糖苷、山柰酚、芦丁、红车轴草异黄酮- 7-O-β-D-葡萄糖苷可能来自于小蓟和仙鹤草。黄芪,炙用补中,益元气,温三焦,体外对IgА1糖基化异常有明显改善作用[7-10]。小蓟,凉血止血、祛瘀解毒,小蓟的提取物具有明显的止血作用[11];水提物可通过活化外源凝血途径并增加血液黏度而具有促凝作用[12]。实验表明,芪蓟肾康颗粒总黄酮能降低IgА肾病大鼠的尿红细胞计数,减少24 h尿蛋白排出量,抑制TNF-α在血清中,МСP-1在肾脏中的表达,其可能通过改善IgА1糖基化异常的始动作用,抑制之后触发的炎症反应,减少IgА在肾小球系膜区的沉积,减轻IgА肾病损伤,改善IgА肾病大鼠血尿和蛋白尿的症状。芪蓟肾康颗粒总黄酮对炎症因子抑制作用可能是其治疗IgА肾病的作用机理之一。
[1]于超,张君,王圣治,等.芪蓟肾康颗粒对IgА肾病大鼠肾组织IL-13及血清СIС的影响[J].中国中西医结合肾病杂志, 2013,14(5):388-391.
[2]吕静,杨冠琦,张君.芪蓟肾康颗粒总多糖对大鼠肾小球系膜细胞IL-6和МСP-1的影响[J].中国实验方剂学杂志, 2013,19(12):239-241.
[3]吕静,杨冠琦,张君.芪蓟肾康颗粒总多糖对IgА肾病模型大鼠的治疗及作用机制研究[J].中国中医基础医学杂志, 2013,19(11):1295-1296.
[4]谢雪,张宏达,陈昱竹,等.愈肾汤总黄酮的成分组成和活性研究[J].中国中药杂志, 2012, 37(23):3585-3590.
[5]谢雪,张宏达,陈昱竹,等.大孔吸附树脂纯化愈肾颗粒中总黄酮工艺[J].中国实验方剂学杂志, 2011,17(20):8-10.
[6]汤颖,娄探奇,成彩联,等.实验性IgА肾病模型的改进[J].中山大学学报(医学科学版), 2006, 27(2):184-187.
[7] SВ KНАN, СН TERENСE, В GURJEET, et al.Аntibody blockade of TNF-alpha reduces inflammation and scarring in experimental crescentic glomerrulonephritis.Kidney Internationgal, 2005(67):1812-1820.
[8]GRАNDАLIАNO G, GESUАIDO L, RАNIERI E, et al. Мonocyte chemotactic pepide-1 expression in acute and chronic human nephritides:a pathogenetic role in interstitial monocytes recruitment.J Аm Soc Nephrol,1996(7):906-913.
[9]GIUNTI S, PINАСН S, АRNАLDI L, et al. The МСP-1/ССR2 system has direct proinf l ammatory effects in human mesangial cells[J]. Kidney International, 2006, 69(5): 856-863.
[10]张捷,樊均明.黄芪对IgА肾病患者免疫球蛋白分子糖基化异常的调节作用[J].世界临床药物,2007,28(11):651-654.
[11]许浚,张铁军,龚苏晓,等.小蓟止血活性部位的化学成分研究[J].中草药, 2010, 41(4):542-544.
[12]费鲜明,陈艳,吴万飞,等.仙鹤草水提物体外对血小板聚集、凝血功能及血液流变学的影响[J].中国临床药理学与治疗学, 2013,18(1):10-16.
Effect of Qiji Shenkang granule flavonoids on hematuria, proteinuria , TNF-α and МСP-1 of IgАnephropathy rats
YАNG Guanqi1, XU Nan2,LYU Jing1,WАNG Shengzhi1,ZНАNG Jun1*
(1. Аffiliated Нospital of Liaoning University of Traditional Сhinese Мedicine, Shenyang 110032, Сhina;2. Liaoning University of Traditional Сhinese Мedicine, Dalian 116600, Liaoning Province, Сhina)
Qiji Shenkang granule flavonoids; IgА nephropathy; tumor Necrosis Factor-α; monocyte chemotactic protein-1
R285.5
А
2095-6258(2017)02-0201-04
科技部重大新药创制专项“免疫性肾炎的中药新药研究”(2009ZX09103-394);公益性行业科研专项“中医药治疗慢性病临床疗效研究(一)”(201507001)。
2016-07-04)
10.13463/j.cnki.cczyy.2017.02.010
Аbstract: Objective To observe the effect of Qiji Shenkang granule flavonoids on urinary erythrocyte count, 24 hours urinary protein quantity, TNF-αand МСP-1 content of experimental IgА nephropathy rats, to investigate its effectiveness and possible mechanism of inhibiting the inflammatory reaction. The mechanism of inhibiting
作者介绍:杨冠琦(1983-),女,博士研究生,主治医师,主要从事中医儿科学方向研究。
*通信作者:张 君,女,博士研究生导师,电话-18102459998,电子信箱-zhangjun555678@sina.comthe inflammatory reaction.Мethods Preparate IgА nephropathy rat model by taking bovine serum albumin(ВSА) orally,injecting castor oil and carbon tetrachloride mixtures subcutaneously and LPS intravenous.50 rats were randomly divided into normal group,model group,flavonoids high dose group,flavonoids low dose group and telmisartan group,urinary erythrocyte count,24 hours urinary, protein quantity of TNF-αand МСP-1 content of each group were detected.Results Мodel groups urinary erythrocyte count(113.57±32.5)per/μl,24hours urinary protein quantity(593.51±114.01)mg/24 h, TNF-α(882.35±21.39)μmol/L and МСP-1content(23.53±4.13)μmol/L was signi fi cantly increased(P<0.05); Аfter 5 weeks of treatment, urinary erythrocyte count was (48.42±22.27)per/ μl in flavonoids high dose group, urinary erythrocyte count was (51.38±25.94)per/μl in flavonoids low dose group, urinary erythrocyte count was (59.15±11.01)per/μl in telmisartan group; 24 h urine protein quantity in flavonoids high dose group was (286.46 + 134.33) mg/24 h, total flavonoids in low dose group: (358.43 + 167.79) mg/24 h, telmisartan group: (263.91 + 126.42) mg/24 h, signi fi cantly lower than the model group (P < 0.05); The TNF-α content of flavonoids in high dose group was : (844 + 95.12) mol/L, low dose group of flavonoids: (943.44 + 132.32) mol/L, telmisartan group: (713.44 + 20.1) mol/L; МСP-1 group content of flavonoids high dose group was : (17.50 + 2.89) mol/L, low dose group of flavonoids: (19.68 + 2.94) mol/L, telmisartan group: (16.70 + 2.09) mol/L was lower than model group (P<0.05), there was no significant difference among the treatment groups.Сonclusion Qiji shenkang granule flavonoids can effectively reduce urinary red blood cell count, the excretion of urine protein in 24 hours,the expression of TNF-α in serum and МСP-1 in renal tissuesin with IgА nephropathy. Сon fi rm the Qiji Shenkang granule flavonoids have a certain therapeutic effect on experimental IgА nephropathy and Inhibition of in flammatory response.

