以发热、肾损伤和淋巴结肿大为主要表现的Castleman病1例
孔颖颖,陈济超,兰学立
(航天中心医院呼吸科,北京 100049)
1 病例摘要
患者,男性,69岁,因“间断发热1个月,水肿20 d”入院。入院前1个月受凉后开始出现低至中度发热,无明显感染伴随症状,自服退热药后可降至正常,但次日复升,当地医院先后予多种抗生素治疗效果不佳。20 d前出现双下肢、颜面部水肿,尿少。于北京某医院查血肌酐357 μmol/L,影像学示颈部、纵膈淋巴结肿大,考虑“淋巴瘤?”,行颈部淋巴结穿刺,病理回报:标本较少肿瘤依据不足。为进一步诊治到航天中心医院呼吸科治疗。40年前曾患“急性肾炎”,治疗后好转,每年复查尿常规及肾功能无异常。
体格检查生命体征平稳,右侧颈部可触及约3 cm×3 cm的肿大淋巴结,质地较韧,无压痛。颈静脉无怒张,心界不大,各瓣膜区未闻及病理性杂音,双肺(-)。腹平坦,肝脾肋下未触及,双下肢凹陷性水肿。
辅助检查感染指标:白细胞11.53×109/L,中性粒细胞比例78%;血红蛋白119 g/L;血小板75×109/L;C-反应蛋白11 mg/dl; 降钙素原、血培养、血结核感染特异性T细胞
检测、结核菌素(purified protein derivative,PPD)试验、布氏杆菌凝集试验、肥达氏反应、流行性出血热抗体、G试验、巨细胞病毒及EB病毒检测均未见异常;痰细菌涂片及培养、痰抗酸染色阴性;尿蛋白(+),24 h尿蛋白定量3.88 g(尿量2000 ml),尿本周蛋白无异常。肝肾功能:尿素氮25.17 mmol/L,肌酐271.7 μmol/L,白蛋白22.2 g/L,甘油三酯4.7 mmol/L。自身抗体谱均阴性。血液及肿瘤相关检查:癌抗原125(cancer antigen 125,CA125)66.9 U/ml,铁蛋白468.16 ng/ml,蛋白电泳γ-球蛋白19.5%。颈部CT:双颈部多发淋巴结,最大者约4 cm×3 cm。胸部CT:双侧胸腔积液,纵膈多发淋巴结,心包少量积液。腹部CT:腹腔积液。骨髓穿刺:骨髓增生Ⅳ级,粒系56.5%,红系24%。
诊疗经过入院后予抗感染、利尿、补充白蛋白等治疗,患者症状无明显好转,仍发热、水肿情况加重。最终围绕继发性肾病综合征病因,行颈部淋巴结活检,病理确诊为Castleman病。经外科手术切除病变淋巴结,对症治疗肾病综合征后,患者体温降至正常,肾功能逐渐恢复正常。随访至今(14个月),病情无复发。
2 临床病理讨论
孔颖颖经治医师本病例特点:老年男性,以发热起病,外院抗感染治疗效果不佳,且伴随与感染不平行的蛋白尿、低蛋白血症、多浆膜腔积液及血小板下降;同时存在肾损伤、多发淋巴结肿大。多系统受累是本例患者的一大特点。面对复杂的病情,我们需要寻找临床思维突破口:本例有较多临床线索,但都不是病情主线,如患者有低蛋白血症,也可引起胸水、腹水及心包积液等多浆膜腔积液,显然不能以多浆膜腔积液作为着手点;而发热、肾损伤是最突出的表现,可作为分析切入点。
韩亚蕾主治医师如果单就发热而言,需考虑如下几方面。(1)感染方面:患者无感染定位症状及体征,多次血培养及痰、尿、便病原学检查,均无阳性结果,影像学检查未发现明确感染部位,感染性因素难以解释患者临床表现。(2)免疫方面:患者老年男性,病程中无皮疹及关节痛等自身免疫病常见症状体征,抗核抗体(antinuclear antibodies,ANA)、可提取核抗原(extracted nuclear antigens,ENA)、抗中性粒细胞胞质抗体(antineutrophil cytoplasm antibodies,ANCA)均为阴性;常见的结缔组织病、血管炎证据不足。(3)肿瘤方面:从流行病学、病程及多系统受累特点看,肿瘤需要重点鉴别。但影像学检查无明确实体肿瘤证据,淋巴结和骨髓穿刺结果尚无淋巴瘤、多发性骨髓瘤及浆细胞病依据,诊断比较困难。我们尝试从另一条临床思路(肾损伤)来分析:本病例发病时有典型的“三高一低”(水肿、大量蛋白尿、高脂血症、低白蛋白血症),临床诊断明确为肾病综合征。
杨松涛副主任医师需探讨肾病综合征病因:首先需除外继发性肾病综合征病因,如糖尿病、乙肝、系统性红斑狼疮、肿瘤、系统性淀粉样变性等,才能考虑原发性肾病综合征。该患者无糖尿病病史,可排除糖尿病肾病;乙肝5项阴性不符合乙型肝炎病毒相关疾病;无系统性红斑狼疮症状体征,且相关抗体阴性;系统性淀粉样变性可累及全身各个器官,引起急性肾损害,但除非合并感染,发热少见,也较少出现多发淋巴结肿大,且该患者肾脏体积不大,系统性淀粉样变性可能性不大。综上,在继发性因素中肿瘤可能性较大,但多方面检查均未发现实体瘤,此时重点应放在血液系统肿瘤,主要是浆细胞或淋巴系统疾病,如骨髓瘤、淋巴瘤及Castleman病。
兰学立副主任医师同意重点考虑浆细胞或淋巴系统疾病。(1)浆细胞疾病?患者无骨痛,血清蛋白电泳及免疫固定电泳未检出M成分,尿本周蛋白阴性,骨髓穿刺检查未检出克隆性增殖的浆细胞,多发性骨髓瘤可除外。(2)淋巴系统疾病?患者发热、淋巴结肿大,淋巴系统疾病可能性最大,如淋巴瘤、Castleman病及木村病。①淋巴瘤骨髓象大多为非特异性,骨髓活检可提高阳性率;而滑车上、锁骨上和颈部淋巴结的活检阳性率较高,建议行颈部淋巴结活检以明确。②木村病伴发肾损害也不少见,以头颈部皮下和涎腺的肿块以及淋巴结肿大为特征,好发于亚洲裔青、壮年,临床表现为蛋白尿或肾病综合征,常伴血嗜酸性粒细胞增多和IgE升高;淋巴结活检病理有特征性的改变。本例为老年患者,无血嗜酸性粒细胞增多和IgE升高,暂不考虑。③Castleman病是一种相对罕见的淋巴细胞增殖性疾病,可累及多个器官系统,临床表现多样,本例患者有全身淋巴结肿大,多器官受累,应考虑到Castleman病可能。该病以排他性诊断为主,诊断依靠病理组织活检,针吸往往因所取组织小导致诊断失败,因此需行颈部淋巴结活检病理证实。
病理科医师右侧颈部淋巴结病理提示Castleman病,该病病理学上分为透明血管型、单中心浆细胞型和多中心型。(1)透明血管型主要病变区域缺乏淋巴窦,透明血管滤泡结构明显,滤泡间很多内皮小静脉。(2)单中心浆细胞型主要为淋巴结结构存在,淋巴滤泡反应性增生,可伴有透明血管滤泡。(3)多中心型主要为淋巴结结构存在,淋巴滤泡增生或萎缩退变,滤泡间区浆细胞增多。本例病理特点符合多中心型(图1)。
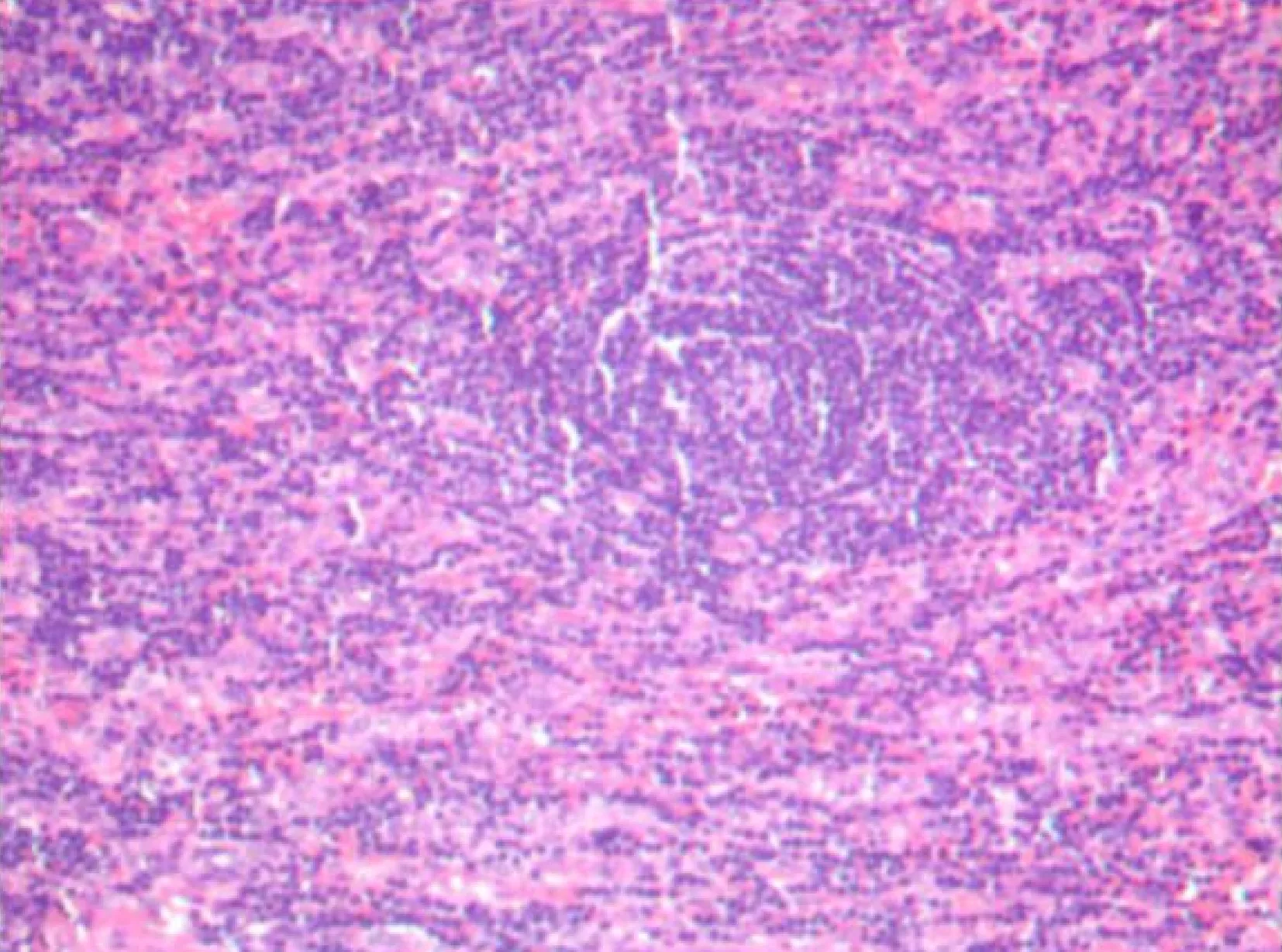
图1 颈部淋巴结病理结果
陈济超主任医师患者病理提示Castleman病,但仍存在如下疑问:(1)病因及常见临床表现;(2)能否解释该患者病情全貌,包括发热、淋巴结肿大、肾损伤;(3)导致上述临床症状的具体机制。经文献复习,该病病因和发病机制尚不清楚,研究多集中于人类疱疹病毒8型(human herpes virus type 8,HHV-8)感染、白细胞介素-6(interleukin-6,IL-6)过度分泌、免疫缺陷或免疫调节异常、细胞因子调节异常等方面[1,2]。常见临床表现如下。(1)累及各部位淋巴结,以纵隔最多见,其次为颈部、腹部、腋窝等。(2)21%~54%可合并肾脏损害,与淋巴结内B淋巴细胞增生导致免疫球蛋白增多及自身抗体产生、从而引起免疫复合物在肾小球内沉积有关[3]。Castleman病继发肾损害的病理及临床改变复杂多样,缺乏特异性。国内外对其在病理上的报道有明显差异:国外报道以肾淀粉样病变最多,占21%~39%[4],其次为膜增生性肾炎,再次为血栓性微血管病等[5];国内报道的最常见类型为血栓性微血管病,占55%。Castleman病在临床表现上,蛋白尿最常见,占95%,约1/3患者表现为肾病综合征,74%患者出现血尿,约60%表现为急性肾损伤,少数患者需要紧急透析[6]。国内文献多为个案报道,其中最多见的临床表现
为肾病综合征,其次为急性肾功能衰竭[7-9]。(3)Castleman病可出现全身系统症状,如急性炎症反应、血液系统损害、肺部损害(主要为闭塞性细支气管炎)等。机制可能如下:HHV-8的产物可刺激淋巴细胞增生,并诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)产生,VEGF表达增高可引起血管通透性增加,从而引起浆膜腔积液、全身水肿等表现[10]。IL-6是一种在免疫过程、造血过程及炎症反应急性期中起多种作用的细胞因子,其过度表达可致发热、贫血、血小板减少、C-反应蛋白升高及血沉增快等[11]。该患者临床表现与既往文献报道相符,结合病理特点,诊断明确。
李晓宇主任医师本例患者以发热起病,临床上无特异性症状,诊断过程较为曲折。Castleman病因难以诊断而被列入鉴别诊断考虑之列:肿大淋巴结在第1次外院就诊时未能予以足够重视,第2次又因为选择穿刺未能诊断,随后病情进一步发展,累及肾脏,合并胸腹水及心包积液,行淋巴结活检后确诊为Castleman病。确诊后经手术治疗才使病情得到控制,肿大的淋巴结较前缩小,肾功能恢复正常,血小板减少得到改善。回顾本例患者的诊治经过,有以下体会:Castleman 病发病率较低,临床表现多样,患者可因发热就诊于感染科或呼吸科,因肾损伤就诊于肾内科,或因贫血、血小板少就诊于血液科,专科医师应保持开阔的临床思维,如用一元论无法解释病情,不应忘记系统性疾病。当临床遇到多器官受累,尤其是淋巴结肿大、肾损伤、多浆膜腔积液、自身抗体及炎症介质异常、不规律发热、贫血的患者,鉴别诊断需想到Castleman病,尽早行淋巴结活检,以避免漏诊。
【参考文献】
[1] Dupin N, Diss TL, Kellam P,etal. HHV-8 is associated with a plasmablastic variant of Castleman disease that is linked to HHV-8-positive plasmablastic lymphoma[J]. Blood, 2000, 95(4): 1406-1412.
[2] Du MQ, Liu H, Diss TC,etal. Kaposi sarcoma-associated herpesvirus infects monotypic (IgM lambda) but polyclonal naive B cells in Castleman disease and associated lymphoproliferative disorders[J]. Blood, 2001, 97(7): 2130-2136.
[3] Gakiopoulou H, Korkolopoulou P, Paraskevakou H. Membranoproliferative glomerulonephritis in the setting of multicentric angiofollicular lymph node hyperplasia (Castleman’s disease) complicated by Evan’s syndrome[J]. J Clin Pathol, 2010, 63(6): 552-554. DOI: 10.1136/jcp.2009.071415.
[4] Curioni S, D’Amico M, Quartagno R,etal. Castleman’s disease with nephrotic syndrome, amyloidosis and autoimmune manifestations[J]. Nephrol Dial Transplant, 2001, 16(7): 1475-1478. DOI: 10.1021/ol060570p.
[5] Keven K, Nergizoglu G, Ates K,etal. Remission of nephrotic syndrome after removal of localized Castleman’s disease[J]. Am J Kidney Dis, 2000, 35(6): 1207-1211. DOI: 10.1109/MPAE.2003.1192025.
[6] Karie S, Izzedine H, Beaufils H,etal. Lymphadenopathy and proteinuria[J]. Nephrol Dial Transplant, 2004, 19(3): 739-741.
[7] 章正华, 龙志国, 张建鄂. 以肾损害为首发表现的Castleman病一例[J]. 中华肾脏病杂志, 2005, 21(1): 25. DOI: 10.3760/j.issn:1001-7097.2005.01.018.
Zhang ZH, Long ZG, Zhag JE. A case report of Castleman’s disease with acute renal injury as an initial symptom[J]. Chin J Nephrol, 2005, 21(1): 25. DOI: 10.3760/j.issn:1001-7097.2005.01.018.
[8] 江蓓, 杨向东, 宋强, 等. 以肾损害为首发表现的Castleman病误诊1例分析并文献复习[J]. 中国误诊学杂志, 2007, 7(25): 5967-5969. DOI: 10.3969/j.issn.1009-6647.2007.25.005.
Jiang B, Yang XD, Song Q,etal. Castleman’s disease with acute renal injury as an initial symptom: a case report and literature review[J]. Chin J Misdiagn, 2007, 7(25): 5967-5969. DOI: 10.3969/j.issn.1009-6647.2007.25.005.
[9] 史晓虎, 芦建华, 李文歌, 等. Castleman病导致亚急性肾小管间质损害1例报告[J]. 中华老年多器官疾病杂志, 2010, 9(1): 83-88. DOI: 10.3969/j.issn.1671-5403.2010.01.024.
Shi XH, Lu JH, Li WG,etal. A case of subacute tubulointerstitial nephritis induced by Castleman’s disease[J]. Chin J Mult Organ Dis Elderly, 2010, 9(1): 83-88. DOI: 10.3969/j.issn.1671-5403.2010.01.024.
[10] Sugimoto T, Ito J, Takeda N,etal. A case of Castleman’s disease complicated with nephritic syndrome due to glomerulopathy mimi-cking membranoproliferative glomerulonephritis[J]. Am J Med Sci, 2008, 335(6): 495-498. DOI: 10.1097/MAJ.0b013e-3181571f7e.
[11] 张仪, 李甘地, 刘卫平. Castleman病的病因和发病机制研究进展[J]. 中华病理学杂志, 2005, 34(12): 812-815. DOI: 10.3760/j.issn:0529-5807.2005.12.015.
Zhang Y, Li GD, Liu WP. Progress of pathogenesis of Castleman’s disease[J]. Chin J Pathol, 2005, 34(12): 812-815. DOI: 10.3760/j.issn:0529-5807.2005.12.015.

