Micro CT对骨髓间充质干细胞拮抗矽肺大鼠肺纤维化的效果评价
安国亮 李小丽 王 炎 连西濛 朱钟慧 郭彩霞 吴惠慧 田 琳
(首都医科大学公共卫生学院劳动卫生与环境卫生学系 首都医科大学环境毒理学北京市重点实验室,北京 100069)
·基础研究 ·
Micro CT对骨髓间充质干细胞拮抗矽肺大鼠肺纤维化的效果评价
安国亮 李小丽 王 炎 连西濛 朱钟慧 郭彩霞 吴惠慧 田 琳*
(首都医科大学公共卫生学院劳动卫生与环境卫生学系 首都医科大学环境毒理学北京市重点实验室,北京 100069)
目的 探讨Micro CT能否评价大鼠矽肺纤维化程度并反映骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)拮抗肺纤维化的效果。方法 Wistar雌性大鼠60只,采用数字表法随机分为对照组、石英组和BMSCs处理组,每组20只。石英组和BMSCs处理组气管内滴注石英混悬液(50 mg/mL)。染尘后,BMSCs处理组尾静脉注射BMSCs,其他组尾静脉注射0.9%(质量分数)氯化钠注射液。染尘后不同时间点进行大鼠肺部Micro CT平扫,取肺组织观察病理改变。结果 石英组与对照组相比,第7、15、30 d病理HE染色分别可见炎细胞浸润,散在的矽结节和矽结节的融合;Masson染色可见在每个时间点,石英组的胶原纤维量均高于对照组;CT分别可见肺门斑块状密度增高影,点状和片状高密度影。BMSCs处理组与石英组相比,第15、30 d病理和CT均显示矽肺不同程度减轻。结论 Micro CT能够评价15 d和30 d时矽肺纤维化程度并反映BMSCs对肺纤维化的拮抗作用。
Micro CT;矽肺;骨髓间充质干细胞
矽肺是由于长期吸入游离二氧化硅粉尘而引起的以肺组织弥漫性纤维化为主的全身性疾病[1],由于发病机制复杂,至今尚无有效的治疗方法。这使得人们亟需找到切实有效的方法,从而延缓、阻遏石英引起的肺组织纤维化。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一种来源于骨髓的具有多项分化潜能的成体干细胞[2],已有研究[3-5]表明,给予外源性BMSCs可减轻肝、肾、肺等多种器官的纤维化,Micro CT作为一种非损伤工具,可以动态观察同一动物不同时间肺组织的病理变化。本研究中本课题组观察BMSCs对石英致大鼠肺组织纤维化模型的影响,定期进行全肺CT扫描和矽肺的病理比较,探讨Micro CT能否反映矽肺大鼠肺纤维化程度和BMSCs拮抗纤维化的作用。
1 材料与方法
1.1 实验动物
SPF级Wistar雌性大鼠由首都医科大学实验动物部提供,实验动物许可证号:SCXK(京) 2012-0001,体质量200 g左右。
1.2 仪器和试剂
Micro CT[Inveon,西门子(中国)有限公司],二氧化碳培养箱(Thermo公司,美国),光学显微镜(Olympus公司,日本),荧光倒置相差显微镜(Olympus公司,日本),流式细胞仪(BD公司,美国);结晶型二氧化硅(Sigma公司,美国),磷酸盐缓冲液(Hyclone公司,美国),胎牛血清(MP公司,美国),α-MEM培养基(Hyclone公司,美国),胰蛋白酶、青链霉素(南京凯基生物科技发展有限公司),异氟烷(深圳市瑞沃德生命科技有限公司)。
1.3 方法
1.3.1 BMSCs分离、培养与鉴定
采用全骨髓贴壁法分离培养BMSCs。将冲洗出的骨髓细胞混悬液移至细胞培养皿中,置于37 ℃、5%(体积分数)二氧化碳培养箱内。通过换液逐渐去除未贴壁细胞。待细胞生长至80%至90%底面积后开始传代,传至第3代经流式鉴定CD抗原表达情况后,用于后续实验。
1.3.2 动物分组和处理
采用数字表法将60只雌性大鼠随机分为对照组、石英组和BMSCs处理组(简称BMSCs组),每组20只。采用气管滴注法建立动物模型,无水乙醚进行气体麻醉,石英组和BMSCs组一次性气管内滴注质量浓度为50 mg/mL的石英混悬液1 mL,对照组一次性气管内滴注等量0.9%(质量分数)氯化钠注射液。分别在24 h和96 h后,BMSCs组尾静脉注射含有2×106个BMSCs的细胞混悬液1 mL,对照组和石英组分别注射等量0.9%(质量分数)氯化钠注射液。于造模后7、15、30 d进行CT观察,而后股动脉放血处死大鼠,统一取肺组织做病理HE染色和Masson染色。
1.3.3 肺组织Micro CT观察
大鼠经异氟烷气体麻醉后,水平固定在Micro CT配套的动物支架上,保证肺部处在扫描范围内,分别在3个时间点(7、15、30 d)进行扫描。具体参数如下:扫描分辨率78 μm,曝光时间2 000 ms,电压80 kV,电流500 μA,扫描角度360°;图形分辨率78 μm,扫描时间25 min。扫描后用cobra软件进行三维重建,观察肺组织。
1.3.4 肺组织病理学观察
取每组大鼠左肺,经固定、浸蜡、包埋等过程,5μm连续切片,HE染色和Masson染色,光学显微镜下观察肺组织的病理学变化。
1.4 统计学方法

2 结果
2.1 BMSCs鉴定
原代BMSCs培养,细胞融合度在80%至90%时进行传代,传代后的细胞生长速度加快,形态为梭形或纺锤形,旋涡状生长,如图1 A(100×)和1 B(200×)。经流式鉴定,细胞CD90阳性率为93.3%,CD45 阳性率为6.8%。符合BMSCs表面标志物的特点,表明实验分离培养所获得的细胞为BMSCs,如图2、3。
2.2 肺组织病理学观察
在不同时间点,对照组肺泡结构完整,肺泡腔大小均匀,清晰可见,支气管上皮完好,黏膜光滑,无明显炎性渗出物。与对照组相比,石英组在7 d时,肺泡间隔增厚,肺泡腔内可见矽尘,大量的巨噬细胞,尘细胞,肺上皮细胞及少量的中性粒白细胞,形成巨噬细胞肺泡炎,胶原纤维的量增高(P<0.01)。15 d时,肺泡壁增厚,肺组织可见典型的细胞结节,肺泡腔内可见石英颗粒和炎性渗出,胶原纤维的量明显增多(P<0.01)。30 d时,可见细胞结节融合,周围的肺泡结构大部分破坏,残留肺泡代偿性扩张,肺泡壁增厚,淋巴细胞浸润,肺泡腔内有泡沫细胞及其崩解物,大量的胶原纤维聚集,形成广泛的纤维化(P<0.01)。与石英组相比,BMSCs组在第7天时肺泡间隔稍增厚,肺泡内有少量渗出,胶原纤维的量有所下降(P<0.05)。15 d时,可见结节内大量的巨噬细胞空泡化,成纤维细胞有所减少(P<0.01);30 d时,可见松散的细胞结节以及大量的泡沫细胞,肺纤维化程度有所减轻(P<0.01)。详见图4~6。
2.3 肺组织Micro CT观察
在不同时间点,对照组双侧肺实质密度均匀,肺纹理清晰,可见到支气管和血管所形成的纹理影,走行自然。石英组7 d时双肺肺门有斑块状密度增高影,出现直径<5 mm的微结节,边界清晰,部分可见融合,肺纹理不清晰;15 d时,Micro CT显示在7 d的基础上,肺内纹理模糊,肺门周围出现圆形或类圆形密度增高影;30 d时,Micro CT显示肺纹理不见,矽结节融合,出现片状高密度影,胸膜增厚,伴有部分淋巴结钙化。BMSCs处理组7 d时与石英组7 d时大体相同;15 d时,肺纹理不清晰,可见点状散在的高密度影;30 d时,可见网状高密度影,淋巴结钙化不明显,肺纹理相对可见,详见图7。

图2 PE CD45表面抗原流式细胞术检测结果
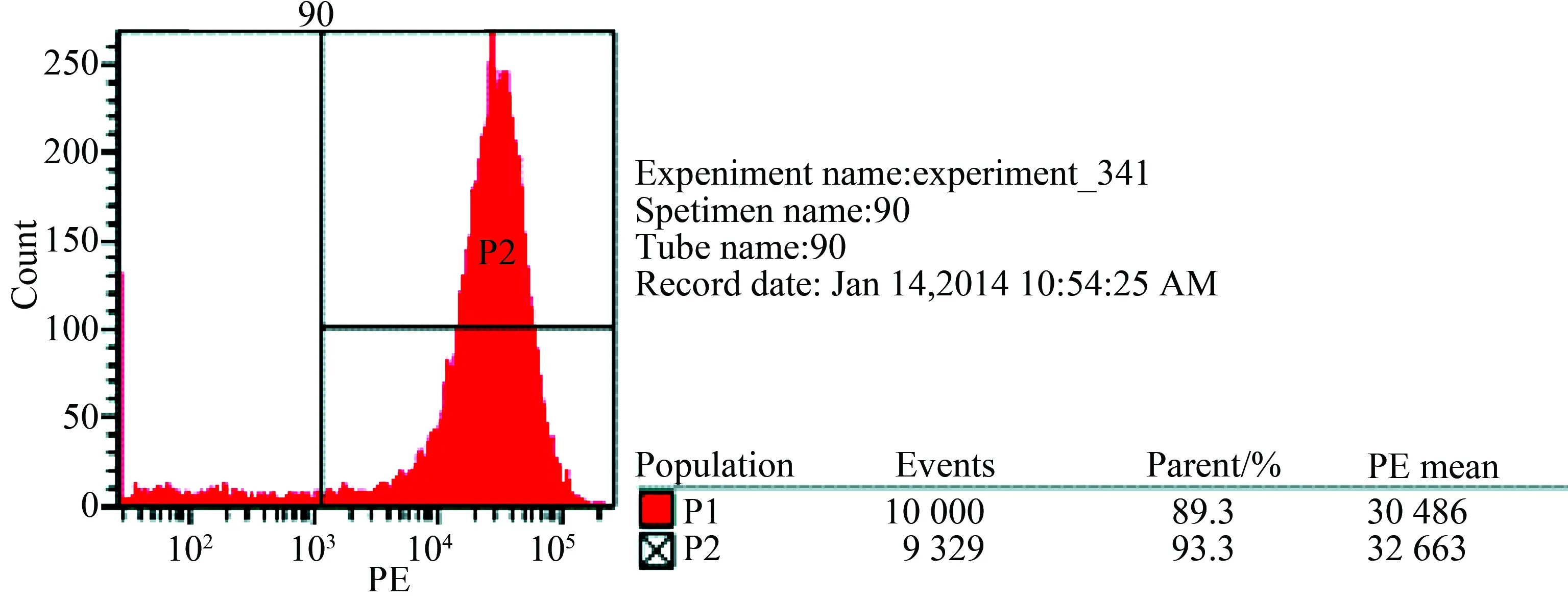
图3 PE CD90表面抗原流式细胞术检测结果

图4 各组不同时间点肺组织的形态学观察(HE染色)
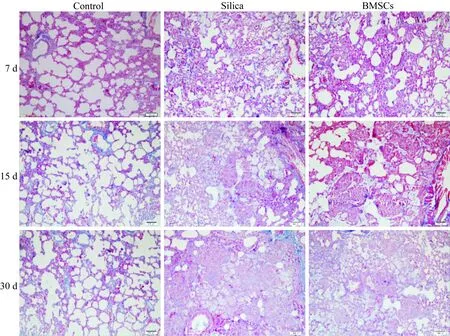
图5 各组不同时间点肺组织的形态学观察(Masson染色)
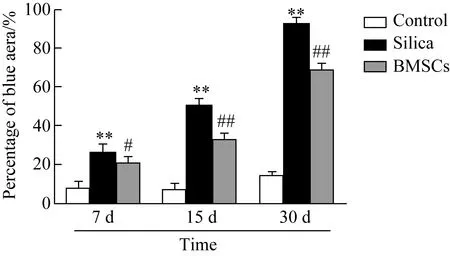
图6 Masson染色胶原纤维阳性所占百分比
3 讨论
矽肺是我国危害最严重的职业病,作业工人长期持续吸入游离二氧化硅粉尘后,在一系列炎性因子和纤维化因子的刺激下,肺内发生慢性炎性反应,成纤维细胞增生,进而发生肺组织纤维化[6]。近年来,矽肺的危害已得到全世界的公认,尤其该病呈进行性发展,一旦发生则很难治愈,严重影响病人身体健康和生活质量,同时给家庭和社会带来巨大的负担[7]。充分正确认识矽结节及纤维化的影像特征,包括CT影像学表现,可以做到实时动态监测,早发现、早诊断[8-9]。
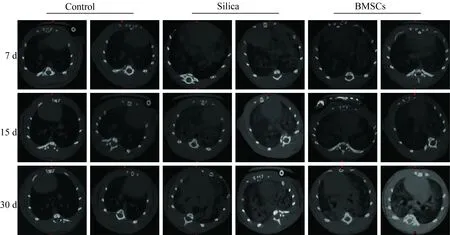
图7 各组不同时间肺组织点的Micro CT扫描结果
研究[10]表明,给予外源性BMSCs对急性肺损伤和慢性肺疾病有保护作用,BMSCs对于博来霉素、野百合碱和脂多糖引起的肺组织纤维化有一定治疗作用。进一步研究[11]显示将BMSCs移植到由博莱霉素诱导的肺纤维化大鼠模型中,微环境的损伤使BMSCs靶向性迁移到受损部位来修复受损的肺组织,本次研究探讨BMSCs是否对石英所致的大鼠肺纤维化有抑制作用。
尽管病理能够反映动物矽肺纤维化的程度,但不能实时动态观察完整的矽肺纤维化进展过程,Micro CT作为一种非损伤工具,可以动态观察同一动物不同时间肺组织的病理变化,使研究者能够更全面的掌握矽肺纤维化的动态过程以及药物拮抗肺纤维化的效果。此外,用Micro CT进行矽肺检查,也显示出在小阴影、大阴影上检出的优越性[12]。
本研究表明,从染尘后7 d到30 d,石英组的病理结果分别出现了炎性反应,矽肺结节和部分矽肺结节的融合,Masson染色的结果呈现出胶原纤维逐渐增高的趋势,与HE染色结果一致;Micro CT结果分别显示双肺肺门斑块状密度增高影,小圆形结节状高密度影和片状高密度影。提示Micro CT结果和病理结果一致,因此Micro CT可以活体实时动态评价矽肺纤维化程度。BMSCs组与石英组相比,7 d时,病理结果表明BMSCs能够减轻炎性反应,胶原纤维含量有所降低,而Micro CT结果没有显现。15 d和30 d时,病理HE染色结果分别显示,矽结节内巨噬细胞空泡化和松散的细胞结节,Masson染色结果也呈现出胶原纤维减少的趋势;Micro CT结果分别显示点状散在高密度影和网状高密度影。提示BMSCs减轻了石英所引起的肺组织纤维化,而Micro CT能够反映BMSCs拮抗大鼠矽肺纤维化的效果。
[1] Leung C C, Yu I T, Chen W. Silicosis [J]. Lancet, 2012, 379(9830):2008-2018.
[2] Wang X, Zhao W, Wang J, et al. Bone marrow stromal cells inhibit the activation of liver cirrhotic fat-storing cells via adrenomedullin secretion [J]. Dig Dis Sci, 2015, 60(5):1325-1334.
[3] Ali G, Masoud M S. Bone marrow cells ameliorate liver fibrosis and express albumin after transplantation in CCl4-induced fibrotic liver [J]. Saudi J Gastroenterol, 2012, 18(4):263-267.
[4] Hong L, Dai C. Effects of bone marrow mesenchymal stem cells on plasminogen activator inhibitor-1 and renal fibrosis in rats with diabetic nephropathy [J]. Arch Med Res, 2016, 47(2):71-77.
[5] Ni S, Wang D, Qiu X, et al. Bone marrow mesenchymal stem cells protect against bleomycin-induced pulmonary fibrosis in rat by activating Nrf2 signaling [J]. Int J Clin Exp Pathol, 2015, 8(7):7752-7761.
[6] Greenberg M I, Waksman J, Curtis J. Silicosis: a review [J]. Dis Mon, 2007, 53(53):394-416.
[7] 吴天文. CT在矽肺诊断中与X线的优势对比[J]. 中国医药指南, 2011, 9(14):24-25.
[8] 袁功玲, 李敏, 沈苏军,等. 矽肺病人36例的CT影像学分析[J]. 职业与健康, 2013, 29(13):1587-1589.
[9] 武粟, 唐洪渠,孔亮.煤工尘肺大阴影的CT表现及临床意义[J]. 中国煤炭工业医学杂志,2016 19(4) :555-557.
[10]Zhao M M, Cui J Z, Cui Y, et al. Therapeutic effect of exogenous bone marrow derived mesenchymal stem cell transplantation on silicosis via paracrine mechanisms in rats [J]. Mol Med Rep, 2013, 8(3):741-746.
[11]Huang K, Kang X, Wang X, et al. Conversion of bone marrow mesenchymal stem cells into type Ⅱ alveolar epithelial cells reduces pulmonary fibrosis by decreasing oxidative stress in rats [J]. Mol Med Re, 2015, 11(3):1685-1692.
[12]郝新民. 应用Meta分析CT与X线在尘肺病诊断的优势对比[D].杭州: 浙江大学, 2013.
编辑 孙超渊
Assessment of antagonistic effect of bone marrow mesenchymal stem cells on pulmonary fibrosis in silicosis rat model by Micro CT
An Guoliang,Li Xiaoli,Wang Yan,Lian Ximeng,Zhu Zhonghui,Guo Caixia,Wu Huihui,Tian Lin*
(DepartmentofOccupationalandEnvironmentalHealth,SchoolofPublicHealth,CapitalMedicalUniversity,BeijingKeyLaboratoryofEnvironmentalToxicology,CapitalMedicalUniversity,Beijing100069,China)
Objective To explore Micro CT is able to evaluate pulmonary fibrosis and reflect antagonistic effect of bone marrow mesenchymal stem cells (BMSCs) in silicosis rat model.Methods Sixty Wistar female rats were randomly divided into three groups,n=20. Silica group and BMSCs treated group rats were intratracheally given silica suspension (50 mg/mL).After silica instillation, BMSCs treated group rats were injected BMSCs by caudal vein. Other group rats were injected saline, Respectively, rat lung received computed tomography (CT) scan after silica instillation. The rat lung was fixed and stained for pathology observation after rats were sacrificed. Results Compared with the control group, at 7, 15, 30 day, silica group show that inflammatory cell infiltration, scattered silicon nodules and fused silicon nodules,respectively by pathological section HE staining.Masson staining shows that collagen fiber content was higher than those in the control group at each time point.And shadow of heighten patchy density in pulmonary hilar, punctuate with high density and high density patching shadows were observed by CT. Compared with the silica group,BMSCs treated group reveal that silicon nodules decreased pathologically and CT indicate that high density area was smaller at the 15, 30 day. Conclusion At the 15, 30 day, Micro CT is able to evaluate the degree of pulmonary fibrosis in silicosis and reflect antagonistic effect of BMSCs in silicosis rat model.
Micro CT; silicosis; bone marrow mesenchymal stem cells
国家自然科学基金(81472958)。This study was supported by National Natural Science Foundation of China(81472958).
时间:2017-04-13 20∶04
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.2004.050.html
10.3969/j.issn.1006-7795.2017.02.017]
R13
2016-09-23)
*Corresponding author, E-mail:tianlin@ccmu.edu.cn

