盐胁迫对扁豆光合生理特性的影响
田京江+井大炜+张红+王明友

摘要 以德州紫花扁豆品种为试材,研究了不同浓度的NaCl(0、2、4、6、8、10 mg/g)处理对扁豆根系活力和光合生理特性的影响。结果表明:扁豆根系活力在土壤含盐量为4 mg/g时达最高值,并显著高于其他处理;当土壤含盐量≥6 mg/g时,根系活力呈显著下降趋势。随着盐胁迫程度的增加,扁豆叶片的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性呈先升后降的趋势,而丙二醛(MDA)含量与相对电导率则呈显著升高趋势。同时,当土壤含盐量≤4 mg/g时,叶片的净光合速率、蒸腾速率、气孔导度和叶绿素含量较不含盐对照无显著性变化,而当含盐量≥6 mg/g时,对应的光合指标则显著下降,并在含盐量为10 mg/g时达最低值。综合分析认为,低浓度的盐胁迫(≤4 mg/g)能增强扁豆的根系活力,提高叶片抗氧化酶活性,使光合特性无明显下降趋势;而较高浓度的盐胁迫(>4 mg/g)则对扁豆产生显著的抑制作用。
关键词 扁豆;盐胁迫;根系活力;抗氧化酶;光合特性
中图分类号 S643.5;Q948.11 文献标识码 A 文章编号 1007-5739(2017)05-0072-02
土壤盐渍化是蔬菜栽培中经常遇到的一种自然逆境[1]。日常生产过程中由于不合理的耕作制度、施肥与灌溉等引起的次生盐渍化则进一步加剧了对蔬菜生产的危害[2-3]。有研究表明[4],盐胁迫易导致蔬菜作物细胞的渗透胁迫与离子失衡,阻碍作物生长进而造成农作物减产甚至死亡。随着人口的不断增长,其与耕地面积持续减少之间的矛盾越来越显著[5-7]。因此,探讨蔬菜在盐胁迫生境下的生长规律,对于指导蔬菜的高效栽培具有重要的理论和实践意义。
扁豆(Lablab purpureus(L.) Sweet),又名龙爪豆、眉豆、鹊豆等,是一种重要的豆科作物,起源于非洲、印度与东南亚,自古代就传入了中国,栽培历史悠久。扁豆营养丰富,味道鲜美,鲜荚中富含矿物质、维生素与植物蛋白,并有一定的药用价值[8]。在澳大利亚的热带与亚热带地区,扁豆是重要的一年生草料作物之一[9]。在亚洲南部与东南部及非洲地区,扁豆既能作为粮食还可当作蔬菜来食用[10]。在中国,扁豆主要收获嫩荚作为一种蔬菜,其经济价值高,应用前景广泛,栽培范围广阔,自西北到东北、自华北到华南都有大面积种植[11]。目前,我国扁豆生产状况存在品质低、产量低的问题。近年来,随着扁豆价格的不断攀升,市场需求日益扩大,扁豆生产在部分地区已形成了产业化、规模化[9]。据统计,目前全国大约有4 000 hm2扁豆地,年产量为15 万~20万t。许多学者针对扁豆开展了大量的研究工作,但主要集中于施肥措施[11]、密植栽培[12]和轮作栽培[13]等方面,而关于土壤盐胁迫方面的研究报道较少。为此,本试验以德州紫花扁豆为试材,研究了盐胁迫对其根系活力、叶片抗氧化酶活性及光合特性的影响,旨在为扁豆的耐盐性评价及高产优质生产提供理论依据。
1 材料与方法
1.1 试验概况
试验于2013年在德州学院生态与园林建筑学院的蔬菜温室中进行。供试扁豆品种为德州紫花,由德州学院生态与园林建筑学院提供。
1.2 试验设计
将扁豆种子播种于盆径30 cm、高35 cm的塑料盆中,每盆留2株。试验采用完全随机区组设计,按土壤相对含盐量(NaCl)设置5个处理,分别为0、2、4、6、8、10 mg/g,每个处理15盆,3次重复。浇盐在出苗后30 d进行,盆下放一盆垫,防止盐分流失;采用称重法控制土壤含水量,保证盆内土壤含水量始终保持在田间持水量的75%~80%。
1.3 测定项目与方法
在扁豆结荚期测定各项生理指标。根系活力采用TTC比色法测定;叶片过氧化氢酶(CAT)与超氧化物歧化酶(SOD)活性分别采用紫外吸收法与愈创木酚法测定;叶片丙二醛(MDA)含量的测定采用硫代巴比妥酸比色法;叶片相对电导率的测定采用电导仪法[14]。
在扁豆的结荚期,选择晴天于9:00—10:00采用美国生产的Li-6400便携式光合测定仪测定叶片的光合特性(净光合速率、蒸腾速率、气孔导度和胞间CO2浓度);同时采集叶片用乙醇-丙酮混合法提取叶片叶绿素,并计算叶绿素含量[14]。
1.4 数据处理
采用Microsoft Excel 2013进行数据统计与分析,使用DPS 7.05软件进行方差分析。
2 结果与分析
2.1 盐胁迫与根系活力
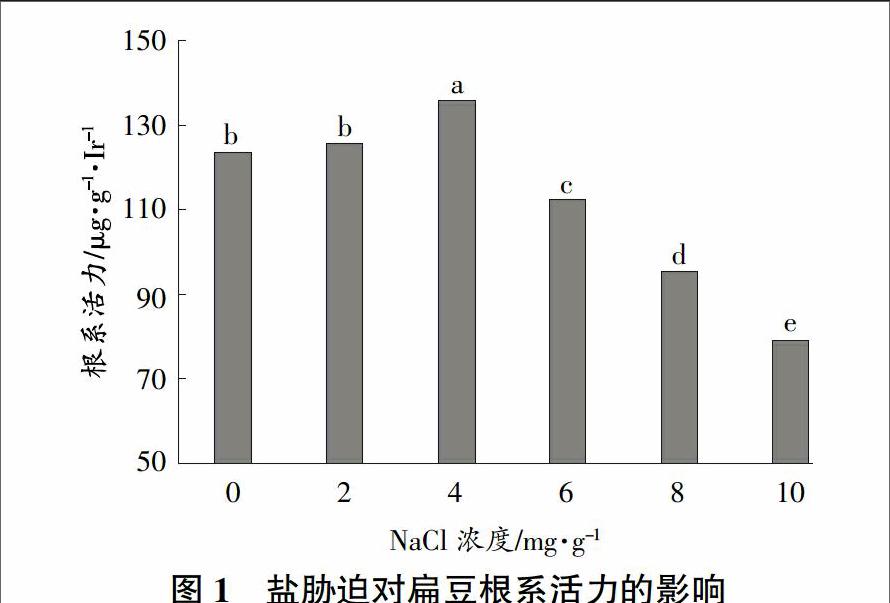
根系活力是反映根系吸收功能的重要指标之一,可指示根系新陈代谢的活动能力,根系特性与发育状况直接关系到扁豆对土壤养分、水分的吸收[15]。因此,根系活力的高低对扁豆植株的生长也具有一定的影响作用。由图1可以看出,在不同盐胁迫条件下,扁豆的根系活力发生了明显的变化。随着土壤含盐量的增加,扁豆根系活力呈现出先升高后下降的变化趋势。根系活力在土壤含盐量为4 mg/g时达到最高值,并显著高于其他处理,分别较0、2、6、8、10 mg/g处理提高10.25%、8.31%、21.26%、43.01%和72.09%。当土壤含盐量≥6 mg/g时,根系活力呈显著下降的趋势。由此可见,适当地增加土壤含盐量能够提高扁豆的根系活力,但当土壤含盐量过高时则会对作物造成一定伤害。
2.2 鹽胁迫与叶片抗保护酶活性、丙二醛含量和相对电导率
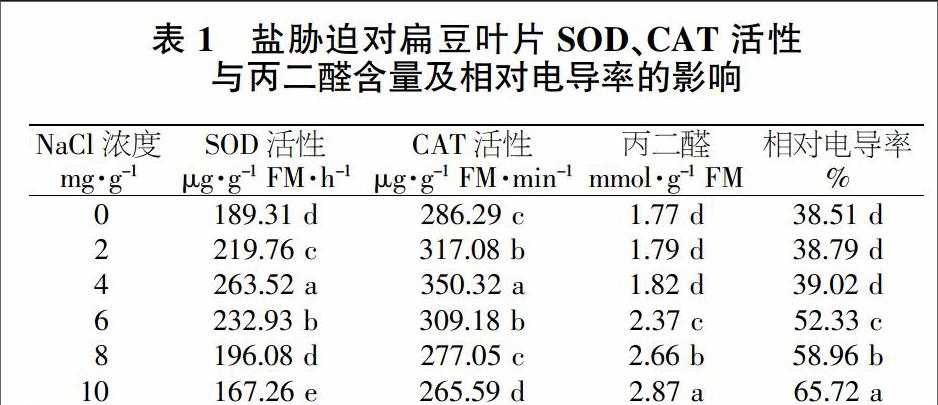
SOD与CAT是作物体内2种关键的抗氧化保护酶。由表1可以看出,扁豆叶片的SOD与CAT活性随着土壤含盐量的增加而呈先上升后下降的变化趋势。当土壤含盐量为4 mg/g时,SOD和CAT活性达最大值,并显著高于其他处理。当土壤含盐量>4 mg/g时,SOD和CAT活性则开始明显下降,并在土壤含盐量10 mg/g时达到最小值。当作物处于盐胁迫逆境时,组织细胞容易发生生理生化代谢紊乱,使膜系统遭到损害,主要是因为自由基的超负荷聚积所导致的;同时,易导致膜脂发生过氧化。由表1可知,扁豆叶片的丙二醛含量、相对电导率随土壤含盐量的增加而呈递增的变化趋势。当土壤含盐量为10 mg/g时达最高值,并与其他处理差异达显著水平。由此表明,随着盐胁迫程度的加大,扁豆叶片的抗氧化酶活性呈先升后降的趋势,而丙二醛含量和相对电导率则呈显著升高的趋势。
2.3 盐胁迫与叶片光合特性、叶绿素
由表2可以看出,0、2、4、6、8、10 mg/g土壤含鹽量处理的净光合速率分别达到21.96、19.72、19.55、14.63、12.27、9.58 μmol/(m2·s),其中土壤含盐量为2 mg/g和4 mg/g时的净光合速率与含盐量为0 mg/g时无显著性差异。当土壤含盐量≥6 mg/g时,净光合速率开始显著下降,而在含盐量为10 mg/g时最低,并显著低于其他处理。蒸腾速率与净光合速率呈现出基本一致的变化规律。
由表2还可以看出,同含盐量为0 mg/g相比,土壤含盐量为2 mg/g和4 mg/g时的叶片气孔导度变化较小,而含盐量>4 mg/g时则开始明显降低。说明随着土壤含盐量的增加,扁豆叶片的气孔导度所受的抑制作用越来越大。此外,在含盐量为0~4 mg/g时,叶片胞间CO2浓度变化不明显,当含盐量>4 mg/g时则显著升高,并在含盐量10 mg/g时达最高值,且显著高于其他处理。
叶绿素含量是作物光合特性的重要量度,能够直接影响碳水化合物的合成,它是反映叶片质量的主要指标之一[16]。方差分析显示,在土壤含盐量0~4 mg/g时,扁豆叶片的叶绿素含量变化不明显;当土壤含盐量>4 mg/g时,叶绿素含量显著下降,且随着土壤含盐量的进一步增加,叶绿素含量的下降幅度越来越大。综合分析认为,低浓度的盐胁迫(≤4 mg/g)对扁豆叶片光合特性的影响较小,但较高浓度的盐胁迫(>4 mg/g)则对扁豆产生抑制作用,且土壤含盐量越高,抑制作用越大。
3 结论与讨论
前人研究表明[17],土壤中盐分过多易导致水势的降低,给植物造成一种水逆境,这与冻害或干旱对植物的影响基本相当。本试验结果表明,在低盐胁迫(2~4 mg/g)条件下,扁豆的根系活力并未受到抑制作用,并在土壤含盐量为4 mg/g时达到最高值;而在较高浓度的盐胁迫(≥6 mg/g)条件下,扁豆的根系活力则受到了显著的抑制作用。这与刘爱荣等[18]对麦冬的研究结果相似。
当植物处在盐胁迫逆境环境下易导致活性氧在细胞内大量积聚。活性氧能使膜脂质发生过氧化,进而损伤细胞膜,而作物能够通过增加或激活抗氧化保护酶来防御活性氧物质对细胞造成的伤害[19]。相关研究认为[20],作物SOD、CAT活性随盐胁迫程度的增加或胁迫时间的延长,呈上升或先升后降的变化趋势。本试验结果表明,SOD与CAT活性随着盐胁迫程度的加大表现出先升高后下降的变化趋势,这说明较低程度的盐胁迫能激发扁豆体内保护酶系统的活性做出保护性反应,而较高浓度的盐胁迫则超出了扁豆的耐受阈值,产生了显著的抑制作用。
作物盐胁迫期间,细胞或组织的MDA含量和相对电导率可以反映细胞膜的稳定性[21]。本研究表明,在低盐胁迫下,扁豆叶片的MDA含量、相对电导率与不含盐对照相比无显著性差异,而较高浓度的盐胁迫条件则使MDA含量与相对电导率呈显著递增趋势。这说明较高浓度的盐胁迫对扁豆的细胞膜伤害较大,已经超出其耐受限度,使作物代谢紊乱发生膜脂过氧化,质膜遭到损害,大量离子外渗,导致MDA积累较多[22]。此外,本试验还表明,在低盐胁迫环境下,与不含盐对照相比,扁豆叶片的净光合速率、蒸腾速率、气孔导度、胞间CO2浓度和叶绿素含量均差异不显著;而在较高浓度盐胁迫环境下,胞间CO2浓度呈明显升高趋势,而其他光合特性指标显著下降,这表明较高浓度盐胁迫导致净光合速率的降低主要是由非气孔限制因素引起的。
4 参考文献
[1] 赫兰保,徐永清,李凤兰,等.盐胁迫对鲁梅克斯杂交酸模种子萌发及幼苗生理特性的影响[J].草业科学,2015,32(3):400-405.
[2] 武冲,尹燕雷,陶吉寒,等.盐胁迫对低温预处理石榴种子萌发及幼苗
生理生化的影响[J].西北植物学报,2015,35(1):161-167.
[3] 赵春.黄河三角洲野生大豆种子和幼苗对盐胁迫的响应[J].大豆科学,2015,34(1):71-74.
[4] 江绪文,李贺勤,王建华.盐胁迫下黄芩种子萌发及幼苗对外源抗坏血酸的生理响应[J].植物生理学报,2015,51(2):166-170.
[5] 李晓荣,姚世响,陈莎莎,等.藜异型性种子后代植株盐响应生理机制[J].生态学报,2015,35(24):8139-8147.
[6] MOSHIUR R,MOSHARROF H,PARVEZ A,et al.Plant Density Influence on Yield and Nutritional Quality of Soybean Seed[J].Asian Journal of Plant Sciences,2011,10(2):125-132.
[7] 井大炜,邢尚军,刘方春,等.保水剂-尿素凝胶对侧柏裸根苗细根生长和氮素利用率的影响[J].应用生态学报,2016,27(4):1046-1052.
[8] 丁国强,吴寒冰.彭镇青扁豆大棚高密度栽培技术[J].长江蔬菜,2009(11):21-22.
[9] 郑卓杰.中国食用豆类学[M].北京:中国农业出版社,1997.
[10] 袁娟,刘浔雯,武天龙.青扁豆—菜用豌豆套作丰产栽培技术[J].蔬菜,2009(9):18-19.
[11] 王云,黄双,王伏英,等.不同施肥水平对3个扁豆品种生长发育及前期产量的影响[J].安徽农业科学,2007,35(21) :6513-6515.
[12] 胡燕琳,姚陆铭,徐永平,等.扁豆密植栽培技术研究[J].中国农学通报,2012,28(1):264-268.
[13] 袁娟,陈程.扁豆、水稻轮作栽培措施对产量的影响[J].上海农业科技,2013(6):144-145.
[14] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[15] 井大炜,邢尚军,刘方春,等.保水剂施用方式对侧柏根际微生态环境的影响[J].农业机械学报,2016,47(5):146-154.
[16] 林桂玉,杨天慧,刘永光.外源ABA对盐胁迫下番茄种子萌发及生物发光的影响[J].北方园艺,2015(9):32-35.
[17] 阿依努尔·阿布拉,谢文磊,王泽,等.四种盐分胁迫对梭梭种子萌发及活力的影响[J].新疆农业科学,2015,52(11):2059-2064.
[18] 刘爱荣,张远兵,张雪平,等.麦冬生长及相关生理代谢对NaCl胁迫的响应[J].草地学报,2016,24(1):93-100.
[19] 井大炜,王明友,张红,等.鸡粪对芸豆土壤有机碳氧化稳定性与碳库管理指数的影响[J].农业机械学报,2016,47(8):192-200.
[20] 王鹏,马玲玲,陈雨,等.盐胁迫对油葵种子萌发及内源激素含量的影响[J].北方园艺,2015(3):12-15.
[21] 刘贵河,郭郁频,任永霞,等.PEG胁迫下5种牧草饲料作物种子萌发期的抗旱性研究[J].种子,2013,32(11):15-19.
[22] 庄华蓉.单盐和混合盐胁迫对沙冬青种子萌发的影响[J].节水灌溉,2015(2):15-20.

