小肠结肠炎耶尔森菌在达乌尔黄鼠鼠疫疫源地分布及特征研究
董 丽,于慧霞,陈彩玉,王立新,王化彬,景怀琦,王 鑫
小肠结肠炎耶尔森菌在达乌尔黄鼠鼠疫疫源地分布及特征研究
董 丽1,于慧霞1,陈彩玉1,王立新1,王化彬1,景怀琦2,王 鑫2
目的 了解小肠结肠炎耶尔森菌在达乌尔黄鼠鼠疫疫源地动物中的种间带菌分布情况及其特征,为我国小肠结肠炎耶尔森菌的研究提供科学的参考数据。方法 在达乌尔黄鼠鼠疫疫源地内选择牧区、半农半牧区和农区3个不同生态环境,分别采集鼠类、家畜家禽动物的粪便、舌根、咽拭子及肠道内容物等样本,进行小肠结肠炎耶尔森菌的分离、鉴定和毒力基因检测。结果 共检测各类样本3 260份,检出小肠结肠炎耶尔森菌65株,总检出率为1.99%;猪的带菌率最高,其携带O∶3/3、O∶5/1A、O∶4/4 3个血清生物型;其中O∶3/3型致病性菌株携带ail、ystA、yadA、VirF、rfbc毒力基因;且在牧区、半农半牧区、农区的样本均可检出阳性菌,以农区最高, 检出率为9.95%。结论 小肠结肠炎耶尔森菌在内蒙古达乌尔黄鼠鼠疫疫源地中分布较广,以农区为重;猪是致病性小肠结肠炎耶尔森菌的主要携带者。
达乌尔黄鼠鼠疫疫源地;小肠结肠炎耶尔森菌;病原特征;分布
小肠结肠炎耶尔森菌(Yersiniaenterocolitica)属于肠杆菌科,耶尔森菌属(Yersinia)。该菌中某些菌株对人和动物有很强的致病性,是当前国际社会广泛关注的食源性致病菌之一[1]。人感染后能引起严重的肠道疾患,甚至累及肝、肺、关节等器官,严重者可引起败血症导致死亡,有个别患者的临床表现(如关节疾病)极容易与布鲁氏菌杆菌病混淆。同时该菌属的致病性菌包括鼠疫耶尔森菌、假结核耶尔森菌和小肠结肠炎耶尔森菌,它们携带的毒力质粒PYV具有同源性,耶尔森菌仅限于初次感染,即动物被3种耶尔森菌属中的任何一种感染,就会对另外两种产生一定的免疫力,表明这3种近缘菌存在交叉免疫。
内蒙古赤峰市是达乌尔黄鼠鼠疫历史疫区,也是布鲁氏菌病自然疫源地,因小肠结肠炎与鼠疫杆菌有较近的亲缘关系,且可与布鲁氏菌产生非特异性免疫反应。目前,小肠结肠炎耶尔森菌在该地区的分布情况及病原特征未见报道。为了填补这项空白该研究旨在阐明小肠结肠炎耶尔森菌在该地区的分布和病原特征,为该病的预防控制提供参考依据。
1 材料与方法
1.1 调查区概况 内蒙古达乌尔黄鼠鼠疫疫源地内的赤峰市位于东经116°21′-120°58′,北纬41°17′-45°24′之间,总面积90 275 km2,人口460万,是多民族集聚的地区。按动物地理区划属古北界、蒙新区、东部草原亚区;自然气候属中温带半干旱大陆性季风气候区,大部分地区年平均气温为0~7 ℃,年降雨量在300~500 mm。为玄武岩丘陵半干旱草原地带,草原内植物主要以大针茅、羊草为代表的禾本科的多种植物。该地区鼠疫的主要贮存宿主为达乌尔黄鼠,故称达乌尔黄鼠鼠疫疫源地,是我国历史悠久的鼠疫监测点,目前本市辖12个旗(县区),有11个旗(县区)已达到了国家稳定控制鼠疫的标准水平,仅阿鲁科尔沁旗近十余年动物间鼠疫疫情仍然活跃。
1.2 调查点选择 赤峰市北部多为牧区,中部为半农半牧区,南部多为农区。根据本市地理位置的条件,为使本次调查具有代表性和科学性,本次在牧区、半农半牧区和农区各抽样选择一个调查点,进行动物样本的采集。
1.3 样本采集 在各调查点随机采集鼠类和家禽家畜等标本。对鼠疫疫区内获得的鼠类样本首先进行鼠疫杆菌检验,排除鼠疫杆菌的可能。采集动物的样本主要包括新鲜粪便、舌根、肠道内容物和咽拭子,采集的样本装在盛有改良磷酸盐缓冲液的离心管(按1∶10混合)中,并置于4 ℃条件下冷增菌20 d。从2009-2013年共采集各类宿主动物样本3 260份,其中达乌尔黄鼠1 515份,小家鼠193份,黑线仓鼠、长爪沙土鼠、三趾、五趾跳鼠等42份;猪粪771份,猪咽拭子217份,牛、驴、马、羊、鸡、鹅等家畜家禽522份。
1.4 试剂来源 耶尔森菌麦康凯选择性培养基购自美国BD公司,API-20E试条购自法国梅里埃生物公司,分型血清O∶3、O∶8、O∶9单克隆抗体由中国疾病预防控制中心传染病预防控制所提供,O∶4、O∶5血清型分型血清购自日本生研株式会社,生物分型试剂购自丹麦ROSCO公司。耶尔森增菌液PBS、改良克氏双糖琼脂、半固体琼脂均购自北京陆桥生物科技有限公司。尿素培基购自日本荣研化学株式会社。聚合酶链反应PCR所有试剂均购自上海生物工程有限公司。
1.5 菌株分离培养和鉴定 常规操作参考小肠结肠炎耶尔森菌书中的介绍[2]。在生物安全柜中接种增菌样品于耶尔森选择性培基平板,25 ℃培养48 h;选择形态可疑菌落接种于改良克氏双糖琼脂培养基中,在25 ℃条件下培养24 h;改良克氏双糖斜面;黄/黄、不产H2S的菌落接种于尿素培基,在25 ℃条件下培养3 h,将分解尿素的菌株分别接种于两管半固体培养基,分别在25 ℃和37 ℃条件下培养24 h;取25 ℃培养有动力且37 ℃培养无动力的疑似菌株,进行革兰氏染色;对革兰氏染色为阴性的杆菌或球杆菌进行AP1-20E系统生化鉴定,最后确定为小肠结肠炎耶尔森菌株。血清分型采用玻片法,生物型鉴定采用小肠结肠炎耶尔森菌生物分型指标[2]。
1.6 毒力基因检测 常规PCR操作方法,并参照文献[3]设计引物,引物由生物工程(上海)股份有限公司合成,所用引物序列见表1。PCR反应体系中,模板1 μL,Premix 10 μL,上、下游引物各0.5 μL(20 μmol),纯水定容至20 μL,PCR反应扩增条件为:94 ℃, 5 min,94 ℃,15 s,54 ℃,30 s,72 ℃,30 s,25个循环,最后72 ℃ 10 min。
表1 PCR扩增引物序列
Tab.1 Primers used in PCR amplification

引物引物序列(5'-3')产物大小/bpailForwardTAATGTGTACGCTGCGAG351ReverseGACGTCTTACTTGCACTGystAForwardATCGACACCAATAACCGCTGAG79ReverseCCAATCACTACTGACTTCGGCTystBForwardGTACATTAGGCCAAGAGACG146ReverseGCAACATACCTCACAACACCyadAForwardCTTCAGATACTGGTGTCGCTGT849ReverseATGCCTGACTAGAGCGATATCCvirFForwardGGCAGAACAGCAGTCAGACATA561ReverseGGTGAGCATAGAGAATACGTCGrfbcForwardCGCATCTGGGACACTAATTCG405ReverseCCACGAATTCCATCAAAACCA
2 结 果
2.1 菌株分离鉴定结果 从3 260份样本中分离培养共检出小肠结肠炎耶尔森菌65株,阳性检出率为1.99%。血清学、生物化学分析,所获65株小肠结肠炎耶尔森菌,包含了O∶3,O∶5,O∶4 3个血清型和3、4、1A三个生物型。其中O∶3/3血清生物型菌株占64.62%(42/65),O∶5/1A血清生物型菌株占33.84%(22/65),O∶4/4血清生物型菌株占1.54%(1/65)。结果见表2、表3。
2.2 菌株分布情况 3种不同的生境均可检出小肠结肠炎耶尔森菌,其中牧区17株,检出率为0.69%,半农半收区检出7株,检出率为1.84%;农区检出41株,检出率为9.95%。呈现牧区、半农半牧区、农区的检菌率依次升高的趋势,且不同生境的检菌率差异有统计学意义(χ2=155.05P<0.005)。猪的带菌率最高,为6.28%(62/988)。在牧区、半农半牧区、农区3个不同环境的菌株O∶3/3血清生物型分别占各检出菌株的5.88%(1/17)、28.57%(2/7)和95.12%(39/41)。
2.3 毒力基因检测结果 对65株小肠结肠炎耶尔森菌进行毒力基因检测,在65株菌中共检测了6种毒力基因,其中22株中检出了ystB基因,42株菌种检出了ail、ystA、yadA、virF、rfbc基因,1株菌检出ail、ystA、rfbc基因。详见表3。
表2 达乌尔黄鼠鼠疫疫源地小肠结肠炎耶尔森菌宿主动物检菌情况
Tab.2 Detection ofY.enterocoliticain animal hosts inCitellucsdauricusplague focuses
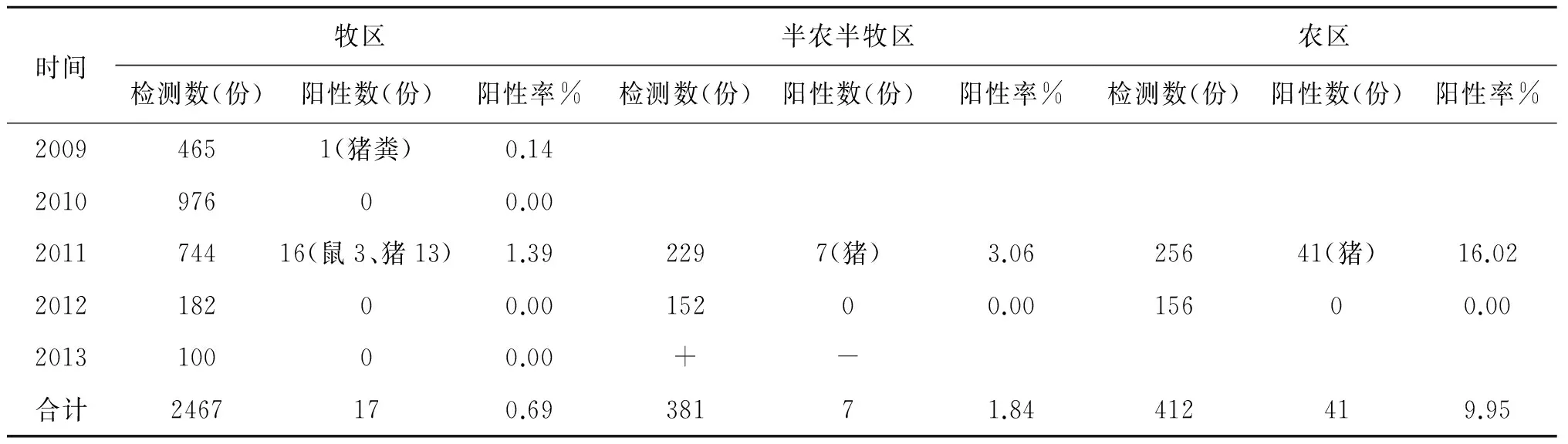
时间牧区半农半牧区农区检测数(份)阳性数(份)阳性率%检测数(份)阳性数(份)阳性率%检测数(份)阳性数(份)阳性率%20094651(猪粪)0.14201097600.00201174416(鼠3、猪13)1.392297(猪)3.0625641(猪)16.02201218200.0015200.0015600.00201310000.00+-合计2467170.6938171.84412419.95
总检出率:1.99%(65/3 260,3 260=2 467+381+412) χ2=155.05>10.60,P<0.005
表3 黄鼠鼠疫疫源地动物中小肠结肠炎耶尔森菌分型及毒力测定结果
Tab.3 Classification ofY.entorocaliticaand detection of toxicity genes inCitellusdauricusplague focuses
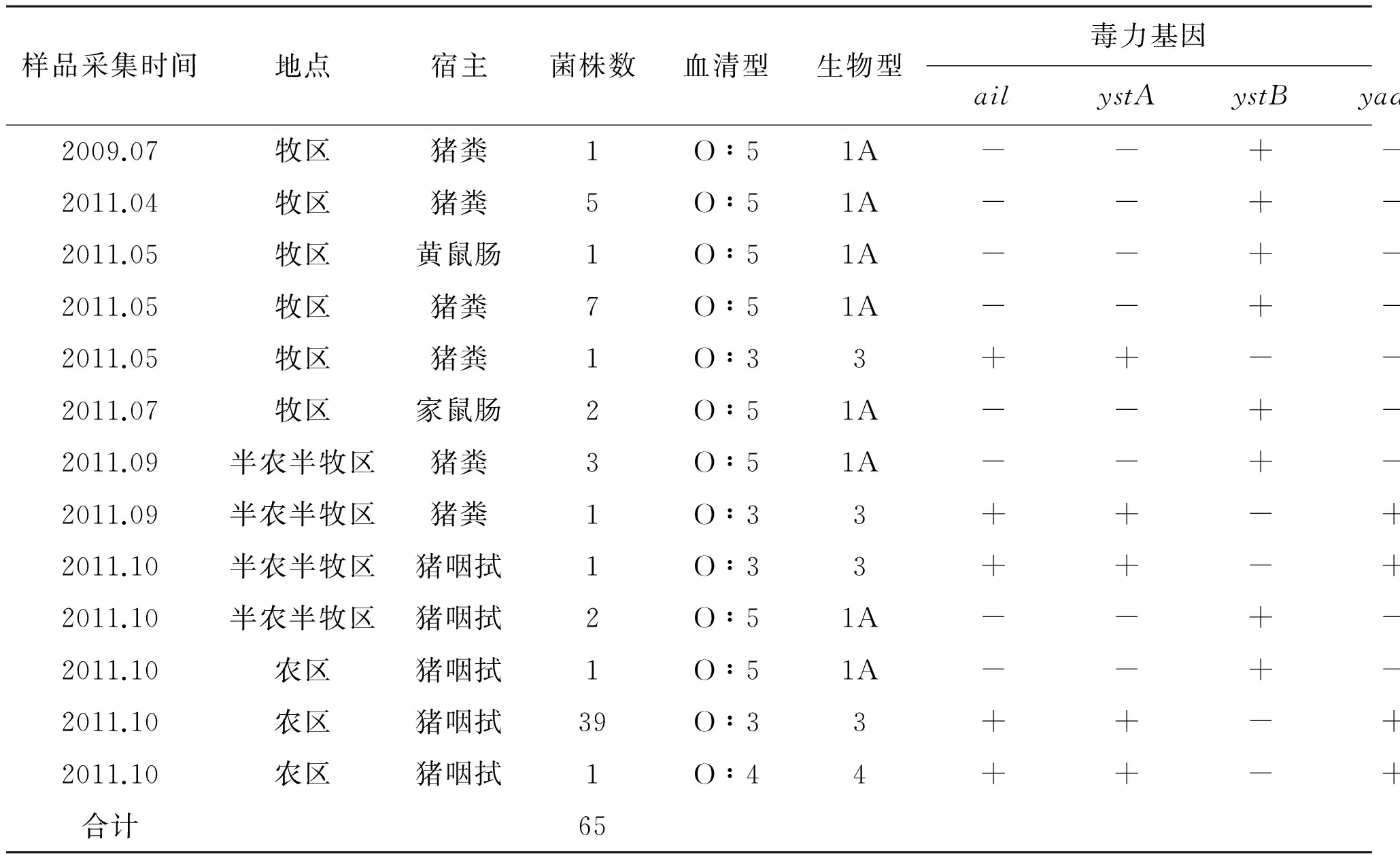
样品采集时间地点宿主菌株数血清型生物型毒力基因ailystAystByadAvirFrfbc2009.07牧区猪粪1O∶51A--+---2011.04牧区猪粪5O∶51A--+---2011.05牧区黄鼠肠1O∶51A--+---2011.05牧区猪粪7O∶51A--+---2011.05牧区猪粪1O∶33++---+2011.07牧区家鼠肠2O∶51A--+---2011.09半农半牧区猪粪3O∶51A--+---2011.09半农半牧区猪粪1O∶33++-+++2011.10半农半牧区猪咽拭1O∶33++-+++2011.10半农半牧区猪咽拭2O∶51A--+---2011.10农区猪咽拭1O∶51A--+---2011.10农区猪咽拭39O∶33++-+++2011.10农区猪咽拭1O∶44++-+++合计65
※致病性菌株占42/65×100%=64.6%
3 讨 论
通过对该地区小肠结肠炎耶尔森菌的分布及病原特征检测结果分析,共在3种不同生境采集的3 260份样本中获得小肠结肠炎耶尔森菌65株,总检出率为1.99%。证实了内蒙古达乌尔黄鼠鼠疫疫源地内小肠结肠炎耶尔森菌的存在,但检出率较低。65株小肠结肠炎耶尔森菌62株分离自猪粪样本,表明猪是小肠结肠炎耶尔森菌的主要贮存宿主,这一结果与先前报道一致[4]。65株小肠结肠炎耶尔森菌均分离自2011年,该结果可能是由采样质量偏差或其他原因,导致究其原因有待进一步调查证实。本次调查结果显示小肠结肠炎耶尔森菌在农区、半农半牧区、牧区均有分布。在农区、半农半牧区、牧区的检出率依次为9.95%,1.84%、0.69%,以农区最高。因为猪是该地区小肠结肠炎耶尔森菌的主要宿主,其结果一方面可能与3种不同环境牲猪饲养数量的多少以及饲养方式有关,另一方面可能与小肠结肠炎耶尔森菌的地域性分布有一定关系[5]。
本次对65株菌的病原特征分析显示,该疫源地内的小肠结肠炎耶尔森菌共有O∶3/3、O∶5/1A、O∶4/4三个血清生物型。O∶3/3血清生物型菌株,是我国已确定的对人有很强致病性菌株,它携带了ail,ystA,yadA,virF,rfbc等毒力基因[6-9];由该菌株引发的人间疾病暴发,国内外不乏相关报道[7,10]。调查结果提示当地人群应当对该病引起重视,谨防致病性小肠结肠炎耶尔森菌感染,造成暴发流行。本次调查在农区的猪体中还发现了O∶4/4血清生物型小肠结肠炎耶尔森菌,经鉴定它携带了ail,ystA,yadA,virF,rfbc毒力基因,与其相关的分布情况及致病性等问题有待进一步调查研究。
由于布鲁氏菌杆菌病与致病性小肠结肠炎耶尔森菌存在交叉免疫,所以在布鲁氏菌杆菌病的诊断检验中应采用多种检验方法,提高检验准确性,避免误诊。本次调查未发现O∶9血清型小肠结肠炎耶尔森菌,但赤峰市与辽宁省相毗邻,而同属于达乌尔黄鼠鼠疫疫源地的辽宁省某地区曾因O∶9血清型致病性小肠结肠炎耶尔森菌感染引起该病流行,应强化监测。
本试验共检测了1 500余只达乌尔黄鼠的舌根和肠内容物,仅在靠近村庄的黄鼠体中检到一株O∶5/1A血清生物型非致病性小肠结肠炎耶尔森菌,可能除黄鼠自身带菌外,不排除该菌株可能来自猪的交叉感染。在疫源地内鼠疫主要贮存宿主体内未检出致病性小肠结肠炎耶尔森菌,应进一步加大达乌尔黄鼠感染小肠结肠炎耶尔森菌的监测力度,同时开展血清学调查,从而佐证致病性耶尔森菌仅限于初次感染的观点,为该地区的小肠结肠炎耶尔森菌引起的疾病防控提供依据。
[1] Thoerner P,Bin Kingombe C, Bogli-Stuber K, et al. PCR detection of virulence genes inYersiniaenterocoliticaand yersinia pseudotuberculosis and investigation of virulence gene distribution [J], Appl Environ Microbiol,2003,69:1810-1816.
[2] Jing H Q,Yersiniaenterocolitica[M].Beijing:People′s Medical Publishing House,2004.
景怀琦.小肠结肠炎耶尔森菌 [M]. 北京:人民卫生出版社,2004.
[3] Wang X,Qiu Hy,Jin D,et al.0∶8 serdtypeYersiniaenterocolicastrain in China[J]. Internat J Food Microbiol,2008 125:259-266.
[4] Fredriksson-Ahomaa, Stolle MA, Stephan R. Prevalence of pathogenicYersiniaenterocoliticain pigs slaughtered at a swiss abattoir[J]. Internat J Food Microbiol , 2007, 119:207-212.
[5] Xu JJ,Yang JC,Wang X,et al.A survey of contamination withYersiniaenterocoliticain humam and animal in Xuzhou city,2004[J].Chin J Heal Lab Technol,2005,15(11):358-359.(in Chinese)
许静静,杨晋川,王鑫,等.徐州市2004年小肠结肠炎耶尔森菌人及动物带菌情况调查报告[J].中国卫生检验杂志,2005,15(11):358-359.
[6] Jing HQ,Li JY,Xiao YC,et al.Detection and investigation of virulence factor forYersiniaenterocoliticaserotype O∶3 and O∶9 [J].Chin J Vector Biol and Control,2004,15(4):317-319. (in Chinese)
景怀琦,李继耀,肖玉春,等.O∶3和O∶9小肠结肠炎耶尔森菌主要毒力基因分布调查[J].中国媒介生物学及控制杂志,2004,15(4):317-319.
[7] Sun DB,Jin RH,Pang WY,et al.The first discovery ofYersiniaenterocoliticadisease outbreak in our country(China) [J].Chin J Zoonoses,1987,3(5):2-4. (in Chinese)
孙殿斌,靳荣华,庞炜英,等.我国首次发生小肠结肠炎耶尔森氏菌病暴发流行[J].中国人兽共患病杂志,1987,3(5):2-4.
[8] Xiao YC,Liang JR,et al.Investigation on distribution ofYersiniaenterocoliticain different animalhosts[J].Chin J Zoonoses,2012,28(5):418-420. (in Chinese)
肖玉春,梁俊荣,古文鹏,等.不同动物宿主小肠结肠炎耶尔森氏菌分离及结果分析[J].中国人兽共患病学报,2012,28(5):418-420.
[9] Xiao YC,Wang X,Qiu HY,et al.Study of biotyping for pathogenicY.enterocoliticastrains in China.2010,26(7):651-653. (in Chinese)
肖玉春,王鑫,邱海燕,等.中国致病性小肠结肠炎耶尔森氏菌生物分型研究[J].中国人兽共患病学报,2010,26(7):651-653.
[10] Bottone EJ.Yersiniaenterocolitica: the charisma continues[J]. Clin Microbiol Rev, 1997,10:257-276.
Pathogenic characteristic and distribution ofYersiniaenterocoliticainCitellusdauricusplague focuses,Inner Mongolia
DONG Li1,YU Hui-xia1,CHEN Cai-yu1,WANG Li-xin1,WANG Hua-bin1,JING Huai-qi2,WANG Xin2
(ChifengCenterforDiseaseControlandPrevention,Chifeng024000,China)
In order to investigate the distribution ofYersiniaenterocoliticainCitellusdauricusplague focuses in Inner Mongolia,three different ecological environ/ments were chosen as the sampling area.Feces,tongue roots throat swabs,and intestinal contents of rodent,livestock,and poultry were separately collected,and differentY.enterocoliticastrains were isolated,and identified.PCR analysis was conducted to detect the toxicity genes ofY.enterocolitica.Statiscal analysis was performed by chi-square test.Of the 3 260 samples,65Y.enterocoliticastrains were isolated and the overall detection rate was 1.99%.To include O∶3/3,O∶5/1A,O∶4/4 serum biological type,the pathogenic strain of serotype O∶3 and biological typt 3 carryinq toxicity genes ail,ystA,VirF yadA and rfbc was isolated from pigs inCitellusdauricusplague focuses, Inner Mongolia are the major carrier of pathogenicY.enterocoliticadistributed in three different ecological environment,and distributed mainly in agricultural area.
Citellusdauricusplague focuses;Yersiniaenterocolitica;pathogenic character istics;distribution Supported by the National Science and Technology Major Project (No.2009-2012ZX10004-201) Corresponding author:Wang Hua-bin,Email:wanghuabin00@163.com
10.3969/j.issn.1002-2694.2017.03.012
王化彬,Email:wanghuabin00@163.com
1.内蒙古自治区赤峰市疾病预防控制中心,赤峰 024000; 2.中国疾病预防控制中心传染病预防控制所,北京 102206
R379
A
1002-2694(2017)03-0256-04
2016-04-21 编辑:梁小洁
国家科技重大专项课题(No.2009-2012ZX10004-201)

