扁桃斑鸠菊无性快繁及栽培产业化技术
王华宇+陈乃明+杨利平+梁刚++蔡林
摘要:建立了扁桃斑鸠菊的组培快繁技术体系,并进行了扦插育苗和造林技术研究,初步完成了种苗的规模化生产和示范林建设。研究结果表明,外植体表面消毒以75%乙醇预处理10 s,再用0.1%氯化汞浸泡8 min效果最好;继代培养的最适宜培养基为MS+6-BA 0.2 mg/L+IBA 0.05 mg/L,增殖系数可达到4.0;最适宜的生根培养基为 1/2MS+IBA 0.1 mg/L,生根率可达100%;将生根后的植株进行移栽,在轻基质(泥炭 ∶[KG-*3]珍珠岩=2 ∶[KG-*3]1)和黄心土中成活率均可达90%以上;其插穗在轻基质中扦插成活率为86.7%。造林1年后,成活率达到96%以上,平均株高可达2.9 m,适应性强,易于实现产业化。
关键词:扁桃斑鸠菊;无性快繁;栽培
中图分类号:S317文献标志码:A
文章编号:1002-1302(2017)05-0033-04
扁桃斑鸠菊(Vernonia amygdalina Del.),别称桃叶斑鸠菊、神奇叶、苦树、南非树等,为菊科斑鸠菊属植物,原产于非洲。扁桃斑鸠菊可以长成大树,栽培状态下多被修剪为灌木或篱笆,高2~5 m,喜光,宜在潮湿环境中生长,也耐干旱,适应所有土壤类型。扁桃斑鸠菊叶子可以安全食用,在尼日利亚等地被当作一种蔬菜。其叶片具有独特的气味和苦涩感,因而常被称为苦叶[1-3],可作为杀菌剂或啤酒花的替代品[4]。在西部非洲,扁桃斑鸠菊的叶子提取物被用作药物,用于治疗疟疾、蠕虫感染、厌食和妇科疾病治疗,有研究认为,其叶可以安全食用[5]。此外,Howard等通过扁桃斑鸠菊的提取物作用于乳腺癌细胞试验,认为Vernonia amygdalina是较好的纯天然抗肿瘤制剂[6]。目前,已从扁桃斑鸠菊中分离出5类共32种化合物,其主要活性成分有皂苷、生物碱、萜类、类固醇、香豆素类等,具有多种药用价值,其中包括确切的抗肿瘤作用值得在肿瘤治疗中应用[1]。
目前,已知菊科斑鸠菊属植物约1 000多种,我国已发现该属植物约30种,主要分布于西南至东南、台湾、新疆等地区[7]。扁桃斑鸠菊在东南亚及中国台湾等地民间应用较多,而中国大陆则相对比较陌生,近年来,两广地区陆续引进种植。关于扁桃斑鸠菊的生物学特征及繁育方面报道甚少,而选择优良种源和单株,通过植物组织培养、扦插等无性快繁技术,可以保证母本的优良性状,实现新品种快速开发。尤其是植物组培快繁技术,有利于种苗快速繁殖和种质资源保存,也为更深层次的开发研究提供了技术平台。本研究通过构建组培快繁技术体系和扦插繁殖技术研究,初步实现了扁桃斑鸠菊种苗的规模化生产,并进行了造林技术研究和示范林营建,为扁桃斑鸠菊的标准化生产和推广应用提供了参考依据。
1材料与方法
1.1材料
材料来源为广西钦州市林业科学研究所试验苗圃栽培的扁桃斑鸠菊。选取生长健壮、无病虫害的优良植株,剪取木质化程度较轻的当年生嫩枝为外植体。
1.2试验方法
1.2.1外植体消毒
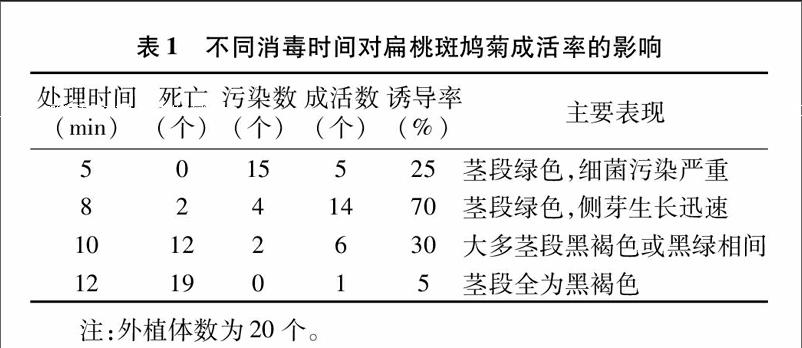
将采回的茎段截成长1.2~1.5 cm的带节小段,剪去叶片,只保留叶柄基部长约0.5 cm,流水冲洗20 min备用。在超净工作台上,用75%乙醇浸泡10 s,0.1%氯化汞振蕩消毒5~12 min,再用无菌水冲洗5次洗去残留药液,用无菌滤纸吸干水分后,切去茎段两端和叶柄上部少许,长度保留约0.2 cm,接种于诱导培养基上。氯化汞消毒时间设定为5、8、10、12 min,每种处理20个外植体,筛选出最佳灭菌时间。
1.2.2培养基配方设计
诱导培养基为MS+6-BA 0.5 mg/L+NAA 0.05 mg/L。继代培养时,以MS为基本培养基,添加6-BA(0.1~0.5 mg/L)、NAA(0.00~0.05 mg/L)或IBA(0.00~0.05 mg/L)等不同激素浓度组合进行培养。生根培养时,以1/2MS为基本培养基(仅大量元素减半),添加不同浓度的NAA(0.00~0.15 mg/L)或IBA(0.00~0.15 mg/L)进行培养。
1.2.3组织培养条件
除特别说明外,上述培养基均添加3.0%蔗糖和0.6%琼脂粉,高压灭菌前pH值调整至6.0。培养室培养温度为(23±2)℃,继代培养光照时间12 h/d,光照强度1 500~2 500 lx;生根培养光照时间16 h/d,光照强度 1 500~2 500 lx。
1.2.4组织培养过程
将消毒完成后的外植体接种于诱导培养基中,定期观察记录消毒结果,记录内容包括消毒外植体数、消毒时间过长造成的外植体死亡数、外植体霉菌细菌污染数、外植体成活数和侧芽的生长情况。3周后将记录结果进行统计,取各组的平均值作为结果。
[JZ]诱导率=(出芽外植体数/接种数)×100%。
继代和生根均用手术刀和镊子进行操作。待无菌芽生长至2~3 cm时,转入继代培养基进行培养,培养周期为21 d。在相同培养基中连续培养2个周期,待增殖苗生长稳定后,观察芽的生长情况。每种处理为150个接种芽,随机抽取30个接种芽,统计增殖系数,筛选最适宜的增殖培养基。增殖率=(增殖株数/接种数)×100%;芽增殖系数=增殖芽数/出芽株数。
取带有2~3个节的试管苗顶端转入生根培养基进行培养,截取长度约3 cm,每种处理为150株。生根培养2周后,随机抽取30株组培苗,统计植株高度、叶色、生根率、平均生根数等生长指标,筛选最佳的生根培养基。生根率=(生根株数/接种数)×100%;平均生根数=生根数量/接种株数。
1.2.5不同栽培基质对扁桃斑鸠菊移栽苗生长的影响
将完成生根阶段的试管苗,洗干净基部培养基,分别种植于轻基质(泥炭 ∶[KG-*3]珍珠岩=2 ∶[KG-*3]1)和黄心土中。分别移栽500株,3周后统计移栽成活率。成活率=(成活株数/移栽株数)×100%。
1.2.6不同基质对扁桃斑鸠菊扦插的影响
扦插试验采用容器(黑色育苗袋)扦插。选取长10~30 cm的2~3年生健壮枝条为插穗,扦插前均在200 mg/L NAA溶液中浸泡 30 min(液面浸没插穗下部1/4~1/3)。扦插基质选用黄心土和轻基质(泥炭 ∶[KG-*3]珍珠岩=2 ∶[KG-*3]1,体积比)2种基质,装袋后均用0.5%的KMnO4溶液喷洒消毒。
1.2.7不同栽植方式对扁桃斑鸠菊造林苗生长的影响
扁桃斑鸠菊造林地选择钦州市林业科学研究所试验林地,年均气温约22 ℃,坡度10°~35°,土质微酸性,光照充足,林地通风良好。造林选用容器苗造林,造林面积1 hm2,行距 1.5 m,株距1.5 m。扁桃斑鸠菊容器苗造林5个月后,于2015年5月选择其中立地条件相似的幼苗200株,进行截顶处理,截顶高度为距地面25~30 cm,截顶后截面用蜡密封处理。2015年12月,分别统计不同栽植方式的成活率、株高、分枝数、抗性、单株叶片鲜质量等生长指标。成活率=(成活株数/200株)×100%;单株叶片鲜质量采取随机抽取30株,全部摘除叶片后立即称质量,取其平均值。
2结果与分析
2.1无菌材料获得
在诱导培养基中,会在外植体的表面或茎段基部出现愈伤组织,但大多呈现水渍状且质地疏松,很难诱导出芽,而侧芽则易于诱导且生长迅速(图1-A)。初代培养3周时,侧芽可高达3~4 cm,具3张以上叶片(图1-B),转入增殖培养基进行继代培养。
2.2扁桃斑鸠菊的继代培养
扁桃斑鸠菊生长迅速,培养3周即可进行下一次继代,超过4周易出现黄叶和小芽死亡的情况,影响增殖效率。培养中发现扁桃斑鸠菊对植物激素的种类和浓度比较敏感,从表2可以看出,当6-BA浓度达到0.3 mg/L时容易出现玻璃化现象,当浓度达到0.5 mg/L时,玻璃化现象尤为严重,且基部水渍状愈伤组织较多;6-BA浓度为0.1 mg/L时,植株生长细弱,节间长,基部分枝少,影响增殖效率和种苗质量。当 6-BA 浓度为0.2 mg/L时,植株生长健壮(图1-C),6-BA与IBA配合使用时,试管苗的生长状况最佳。因此选用 MS+6-BA 0.2 mg/L+IBA 0.05 mg/L为扁桃斑鸠菊继代的最适宜培养基。
2.3扁桃斑鸠菊的生根诱导
扁桃斑鸠菊生根培养2周时,观察统计各组培养基的试验效果。统计生根数量时,长度达到0.5 cm的肉质根方可计入生根数。从表3可以看出,以1/2MS为基本培养基附加浓度0.05~0.15 mg/L的NAA或IBA均可取得较高的生根率,且平均生根数量都在5条以上,说明扁桃斑鸠菊的生根诱导较为容易。但采用NAA诱导时,虽然已经降低了基本培养基中无机盐的用量,但仍会出现不同程度的愈伤组织和玻璃化现象,不利于试管苗的移栽。采用IBA诱导生根时,以1/2MS+IBA 0.1 mg/L诱导生根的效果最好,根系最为发达,小苗的长势最好,最适合后期移栽。
[HTK]2.4不同栽培基质对扁桃斑鸠菊移栽苗生长的影响[HT]
3结论与讨论
目前,斑鸠菊属植物的研究重点主要集中在抗肿瘤活性、对免疫系统影响、皮肤病治疗和抗感染等药理学方面,尤以新疆阿克苏地区的中药材——驱虫斑鸠菊的研究为多。关于该属植物生物学特性、亲缘关系、繁殖方法等方面研究较少,如何加强相关基础研究,构建现代生物技术研究平台,对加速推进该属植物的产业开发尤为重要。
扁桃斑鸠菊生长迅速,继代苗的培养周期仅为3周,但容易出现玻璃化现象,继代初期,参照胡石开等驱虫斑鸠菊的组培技术[8],试验培养基MS+6-BA 1.0 mg/L+NAA 0.5 mg/L,试管苗玻璃化严重,且大多不可逆转。后经反复试验,设定培养基MS+6-BA 0.2 mg/L+IBA 0.05 mg/L,光照强度为1 500~2 500 lx时扁桃斑鸠菊增殖系数达到4.0,且小苗生长健壮。
组培生根环节中发现,当添加生根诱导激素NAA浓度超过0.05 mg/L时组培苗即易出现玻璃化现象,而添加IBA浓度达到0.15 mg/L时尚未出现玻璃化,在金叶苔草的组培育苗过程中也曾发现类似的现象[9]。说明虽然NAA、IBA都是诱导组培苗生根的最常用植物生长调节剂,但对特定植物诱导生根的效果有时差别明显,这可能与其作用机制有关。王喆之等在研究槐树试管苗生根时,就不同生长素种类对诱导的不定根来源、形态方面进行了专门研究,研究结果表明,IBA、NAA对不定根发生、生长都有促进作用,但IBA诱导的不定根细而长,生长快,且不定根直接来源于茎,而NAA诱导的根短而粗,且不定根表面常重新愈伤化,不利于试管苗成活[10]。
扁桃斑鸠菊的移栽苗在黄心土、轻基质中成活率均可达到90%以上,其插穗在2种基质中扦插成活率分别达到 84.7%、86.7%,说明扁桃斑鸠菊适应性强,对土壤要求不严
格。选择轻基质还是黄心土进行育苗,需要结合生产规模、运输距离等因素进行成本核算和风险分析。小规模经营时,扦插繁殖具有取材方便、设施要求不高的优势,但由于插穗的粗细、老嫩程度、内源激素含量等因素影响,扦插苗的萌芽、生根和生长情况一致性较差,不适合标准化生产。
扁桃斑鸠菊、适应性强,造林后生长迅速,1年生造林苗高度可达2.9 m。其叶片是食用和药用的主要部位,試验不同栽培管理技术对叶片生物量的影响具有现实意义。造林苗生长初期截顶处理后,较留顶苗而言,株高矮化,分枝数增加,叶色浓绿,节间缩短,抗风能力增强,平均单株叶片生物量较大,便于进行林地管理和叶片采收。本研究尚未针对最佳截顶时机进行对比筛选,以及在植株达到 2 m 以上高度时是否应进行二次截顶或去枝促萌处理以达到叶片高产,这些都需要进一步深入研究。扁桃斑鸠菊的销售体系尚未成熟,推广种植尚存在较大风险,亟需加强其药效研究和市场宣传,进一步发掘其应有的价值。
参考文献:
[1][ZK(#]杨早. 南非叶化学成分及药理作用研究进展[J]. 南京中医药大学学报,2013,29(4):397-400.
[2]Grubben G,Debton O A. Vegetables plant resources of tropical Africa:2[M]. Wageningen:Backhuys Publishers,2004:543-546.
[3]江燕. 抗癌植物扁桃斑鸠菊化学成分的研究[D]. 南宁:广西大学,2010.
[4]孙东方. 扁桃斑鸠菊甲醇提取物对高粱糖化及酿造特性的影响[J]. 酿酒,1998(1):66-68.
[5]Ibrahim N D,Abdurahman E M,Ibrahim G. Elemental analysis of the leaves of Vernonia amygdalina and its biological evaluation in rats[J]. Nigerian Journal of Natural Products and Medicine,2001,5(1):13-16.
[6]Howard C,Stevens J,Izevbigie E,et al. Time and dose-dependent modulation of phase 1 and phase 2 gene expression in response to treatment of MCF-7 cells with a natural anti-cancer agent[J]. Cellular and Molecular Biology,2003,49(7):1057-1065.
[7]孙力,巴玉兰,于鲁海,等. 斑鸠菊属植物药理活性研究进展[J]. 新疆中医药,2009,27(6):82-85.
[8]胡石开,王晓军,郝秀英,等. 驱虫斑鸠菊的组织培养与快速繁殖[J]. 植物生理学通讯,2008,44(2):310.
[9]王华宇,何贵整,陈乃明,等. 金叶苔草标准化繁育技术研究[J]. 上海农业学报,2013,29(4):64-67.[ZK)]
[10][ZK(#]王喆之,胡正海. IAA,IBA,NAA和2,4-D對槐树试管苗生根的影响[J]. 陕西师范大学学报(自然科学版),1997,25(2):57-59.

