不同基因型烟草的细胞毒性与致突变性分析
张永健,魏克强,杨进文
(1.山西大学生命科学学院,山西太原030006;2.山西农业大学农学院,山西太谷030801)
不同基因型烟草的细胞毒性与致突变性分析
张永健1,魏克强1,杨进文2
(1.山西大学生命科学学院,山西太原030006;2.山西农业大学农学院,山西太谷030801)
为了解不同基因型烟草的毒理学效应,分别采用中性红试验和Ames试验分析比较3个远缘杂交品系GZY-4,GZY-6,GZY-9和1个主栽烤烟品种NDY-1的烟雾提取物(CSE)对中国仓鼠卵巢细胞(CHO)和鼠伤寒沙门氏菌组氨酸缺陷型菌株的细胞毒性与致突变性。结果显示,与NDY-1相比,GZY-4,GZY-6和GZY-9诱导的CHO存活率较高,其中,GZY-4和GZY-6的EC50显著增大(P<0.05),4个材料的细胞毒性大小依次为NDY-1>GZY-9>GZY-6>GZY-4。CSE加S9后的致突变性明显高于不加S9的致突变性;与NDY-1相比,GZY-4和GZY-9均降低了CSE的移码突变和碱基置换能力,但GZY-6降低致突变的作用尤为显著(P<0.05);不同杂交品系的CSE致突变性也存在一定的差异。通过远缘杂交技术对烟草进行遗传改良,对提高烟草的安全性与可用性具有重要的意义。
烟草;烟雾提取物;细胞毒性;致突变性
烟草(N.tobacum)是重要的经济作物,然而,吸烟有害健康,世界烟草业正面临着巨大的挑战。长期以来,世界各国致力于研制“低毒少害,相对安全”的卷烟制品[1]。研究表明,烟草通过燃烧、裂解、蒸馏、冷凝等一系列复杂的物理化学过程,形成的烟雾气溶胶含有4 800余种化学成分,其中,既有提供香气、吃味和生理作用的物质,也有产生杂气、刺激的物质,还有苯并芘、亚硝胺、烟碱等有害的物质[2-4]。烟草化学成分的形成与生态环境、品种类型、栽培技术等多种因素密切相关[5-6]。不同基因型烟草品种的化学成分存在较大的差异,直接影响了卷烟制品的安全性和可用性,培育低毒少害的品种已成为当前我国烟草育种的主攻方向[7-8]。
烟草化学成分的差异会导致释放的烟雾产生不同的毒理学效应[9]。目前,国内外对卷烟制品的毒理学研究,通常采用国际烟草科学研究合作中心(CORESTA)推荐的体外毒性测试方法,即以哺乳动物细胞系细胞毒性分析(中性红试验)和细菌诱变分析(Ames试验)来评价烟气部分化学成分(主流烟气粒相凝集物)的相对毒性[10]。比较不同基因型烟草的体外毒性对优良品种的选育具有重要的指导意义。
本研究以GZY-4,GZY-6和GZY-9等3个远缘杂交品系为材料,以主栽烤烟品种NDY-1为对照,分析其烟雾提取物(CSE)的细胞毒性与致突变性,旨在为烟草品种的遗传改良提供参考依据。
1 材料和方法
1.1 材料
GZY-4,GZY-6和GZY-9为烟草远缘杂交品系,NDY-1为烟草栽培品种[11],均由山西农业大学烟草育种研究室提供,测试所用的单料烟由山西昆明烟草有限责任公司卷制;中国仓鼠卵巢细胞(CHO),购自上海通派生物科技有限公司;鼠伤寒沙门氏菌组氨酸营养缺陷型标准菌株TA97,TA98,TA100和TA102,由中国检验检疫研究院提供;健康、清洁级SD雄性大鼠,购自军事医学科学院实验动物中心。
1.2 试剂
RPMI 1640培养基(HyClone);胎牛血清(Hyclone)。胰蛋白酶(TransGen);二氨基芴、敌克松(Sigma)。二甲基亚砜、中性红染料、多氯联苯等均为国产分析纯。
1.3 仪器
多功能酶标仪(Spectra Max M5,美国);倒置显微镜(Olympus BX 51,日本);二氧化碳培养箱(Galaxy 170S,上海创奕);超净工作台(VS-840-1,上海博迅);水浴振荡器(HZS-H,哈尔滨东联);微量振荡器(MH-2,上海博迅);高速冷冻离心机(KDC-140HR,安徽中科中佳);高速匀浆机(S10,宁波新芝)。
1.4 方法
1.4.1 香烟烟雾提取物(CSE)的制备 其按照陆叶珍[12]、李威[13]的方法进行。先将卷烟样品置于温度22℃、湿度60%的培养箱中水分平衡48 h;然后采用溶液吸收法制备CSE:将香烟与2支串联的吸收管相接,管内各装5 mL DMSO和5 mL磷酸盐缓冲液(PBS),抽吸装置为50 mL注射器;一次燃烧1支烟,每次抽吸2 s,35 mL抽吸容积,抽吸间隔为58 s,采集过程中应没有烟雾泄露;重复采集10支烟制备成1.0支/mL的CSE溶液,0.22 μm微孔滤膜过滤除菌,-80℃保存备用。
1.4.2 中性红细胞毒性试验 中性红细胞毒性试验参考SHIN等[14]的方法进行。调节CHO细胞浓度为5×104个/mL,接种于96孔细胞培养板中,每孔200 μL,置于37℃,5%CO2培养箱中孵育24 h后,去除细胞培养液,加入200 μL含不同浓度CSE的培养液(0×10-3,2.0×10-3,2.5×10-3,3.3×10-3,4.0×10-3,5.0×10-3支/mL),同时设置相应的空白对照组,每组设置4个复孔,孵育(22±2)h后,倒置显微镜下观察CHO的细胞形态。弃去培养液,每孔加入中性红RPMI 1640无血清培养液(50 μg/mL)200 μL,继续培养3 h。培养结束后,去除中性红溶液,每孔加入1%的甲醛溶液200 μL,固定1 min。去除固定液,每孔加入150 μL中性红萃取液(V蒸馏水∶V乙醇∶V乙酸=49∶50∶1,现配),置于微量振荡器上振荡10 min,采用酶标仪测量540 nm处的吸光度值。

式中,X表示细胞存活率,ODn,ODc,ODo分别为样品、细胞对照、空白的多孔平均吸光度值。
1.4.3 细菌诱变分析(Ames)试验 参考GB 15193.4—2003《鼠伤寒沙门氏菌/哺乳动物微粒体酶试验》[15]的方法进行。
1.4.3.1 大鼠肝微粒体酶S9诱导及制备 多氯联苯(PCB)溶于玉米油(质量浓度为200 mg/mL),按500 mg/kg给大鼠腹腔注射,5 d后颈椎脱臼处死。无菌条件下取出肝脏,用冰冷的0.15 mol/L氯化钾溶液冲洗干净,称质量,每克肝加0.1 mol/L的氯化钾溶液3 mL,用高速匀浆机制成肝匀浆,在4℃高速离心机上以9 000 r/min离心10 min,吸出上清液即为S9原液,临用时按照1∶9的比例配制成10%的S9混合液。
1.4.3.2 平板掺入法检测 在加(+)S9或不加(-)S9活化系统下,用生物学鉴定合格的菌株(TA97,TA98,TA100和TA102)检测CSE的致突变性。将提取的CSE原液分别稀释0倍、2倍、4倍、8倍、16倍作为测试剂量组;二氨基芴、敌克松作阳性对照物;用DMSO和PBS缓冲液1∶1混合液作阴性对照物;每组设置3个重复。分别取2 mL保温的顶层培养基于无菌试管中,依次加入0.1 mL测试菌株,混匀;加入不同浓度的CSE 0.1 mL(需活化时加0.5 mL S9混合液),迅速混合后倒入底层培养基上,平铺固化后于37℃培养48 h,统计细菌突变菌落数。
1.5 数据统计
采用SPSS 16.0统计软件分析处理,数据以均值±标准差表示;各组间比较采用单因素方差分析(P<0.05为差异显著)。利用线性回归计算EC50。
2 结果与分析
2.1 不同烟草CSE对CHO细胞毒性的影响
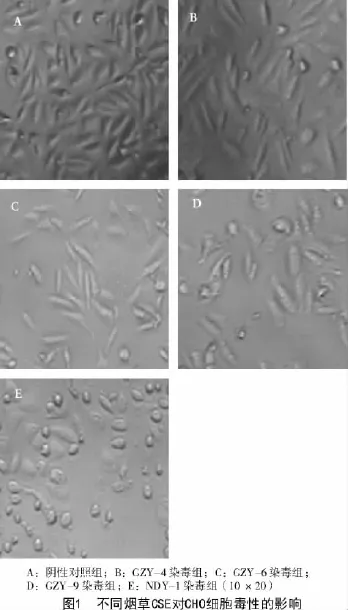
各测试组的CHO形态学观察显示,对照组细胞以短梭形为主,边界清晰可见,排列整齐,细胞大小均匀,相邻细胞间连接较为紧密,贴壁良好,细胞生长旺盛(图1-A);而CSE染毒组细胞出现死亡、数量较少,细胞群体呈无序的生长状态。GZY-4,GZY-6染毒组细胞形态多为长梭形,有部分细胞变为圆形,细胞排列分散,细胞膜不清晰(图1-B,1-C);GZY-9和NDY-1染毒组细胞形态大多数变为圆形,细胞边界模糊,胞体扁平且宽大,并且NDY-1组出现大量的细胞死亡(图1-D,1-E)。
从图2可以看出,4种烟草的CSE对CHO的细胞毒性具有明显的剂量-效应关系,随着CSE浓度的增加,各组的细胞存活率均逐渐降低;但与NDY-1相比,各测试组同浓度的CSE呈现出较高的细胞存活率,其大小依次为GZY-4>GZY-6> GZY-9>NDY-1。
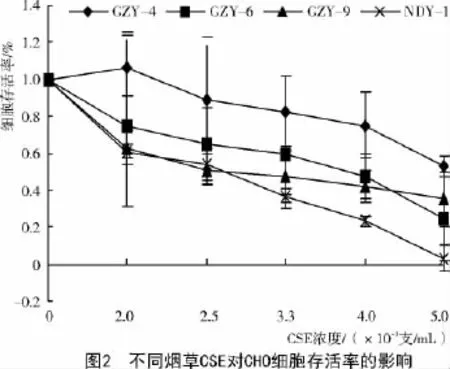
比较4种烟草CSE的EC50值(半最大效应浓度,即50%细胞产生毒性效应的测试样品浓度)显示(表1),NDY-1的细胞毒性显著高于GZY-4和GZY-6(P<0.05),GZY-9与NDY-1的EC50差异不显著(P>0.05),CSE对CHO溶酶体膜的损伤程度依次为NDY-1>GZY-9>GZY-6>GZY-4,这与图2的分析结果一致。

表1 不同烟草CSE对CHO细胞EC50值的影响
2.2 不同烟草CSE对S.typhimurium (his-)菌株致突变性的影响
Ames分析显示,与-S9相比,+S9有助于CSE样品中某些物质的活化,从而提高其致突变性。无论是-S9还是+S9,NDY-1对TA97和TA98的致突变性最大;各组CSE的移码突变能力表现为:与NDY-1相比,GZY-4,GZY-6对TA97,TA98菌株的回复突变数呈现出降低的趋势;虽然GZY-9也降低了对TA97的回复突变数,但对TA98的回复突变数基本一致;GZY-4,GZY-6和 GZY-9对TA100的碱基置换突变力较NDY-1显著降低,降低程度依次为GZY6>GZY-4>GZY-9;3种CSE对TA102的致突变性也较NDY-1明显降低。初步表明,CSE对鼠伤寒沙门氏菌组氨酸营养缺陷型菌株的致突变性大小呈现出NDY-1>GZY-9>GZY-4>GZY-6的趋势(图3)。

3 讨论
中性红是一种弱阳离子染料,极易被正常细胞摄取并在溶酶体内聚集。当细胞受到毒物作用,导致细胞膜和溶酶体膜发生损伤时,细胞的中性红摄入能力会下降,可以间接反映细胞的存活情况,因此,中性红试验被广泛地用于香烟烟雾的生物学活性检测[16]。CHO细胞是加拿大卫生部推荐用于评估香烟烟雾细胞毒性的细胞系,对香烟烟雾提取物(CSE)的敏感度适中,测试结果比较稳定[17]。香烟烟雾中含有大量的自由基,能引起细胞膜中不饱和脂肪酸的脂质过氧化反应,生成对细胞具有毒性作用的过氧化物,直接影响膜结构,以致膜通透性增大,使溶酶体等细胞器膜肿胀、溶解及破坏,导致细胞的广泛性损伤。本研究结果显示,高浓度的CSE能够引起细胞存活率显著降低,而且不同基因型烟草的细胞毒性存在一定的差异,这与BOMBICK等[18]的研究结果一致。4种烟草的细胞毒性大小依次为NDY-1>GZY-9>GZY-6>GZY-4。GZY-4,GZY-6和GZY-9与NDY-1相比,半最大效应浓度(EC50)分别增加了148.0%,45.9%和8.9%,表明GZY-4和GZY-6能显著降低对CHO溶酶体膜的损伤(P<0.05);GZY-9也降低了其对CHO的细胞毒性,但与NDY-1相比,毒性差异不显著(P>0.05)。
Ames试验以组氨酸营养缺陷型鼠伤寒沙门氏菌为标准菌株,TA97,TA98用于检测能发生移码突变的诱变剂,TA100用于检测引起碱基对置换的诱变剂,TA102能检测出其他测试菌株不能检出或极少检出的某些诱变剂。当无组氨酸的培养基中有致突变物存在时,该菌株能回复突变为野生型,在无组氨酸的培养基中生长;香烟烟雾中的NNK、焦油等致癌物,具有较强的致突变作用,故可以根据菌落的回复突变数来衡量香烟烟雾的基因毒性[9,19-20]。本研究结果显示,CSE加S9后的致突变活性均明显高于不加S9的致突变活性,这与PREFONTAINE等[21]的研究结果一致;GZY-4,GZY6和GZY-9较NDY-1对TA97的致突变性降低,而GZY-9对TA98的回复突变性无显著影响;GZY-4,GZY-6和GZY-9也能显著降低对TA100的致突变活性;在+S9的情况下,GZY-4,GZY6和GZY-9对TA102的致突变性较NDY-1降低,这可能与各基因型烟草的化学成分差异有关[9]。
综上所述,对烟草品种进行遗传改良,能够降低烟草制品的相对毒性。烟草燃烧后,固有化学成分的差异会造成释放的香烟烟雾化学成分在组成和含量上发生变化,最终导致不同的毒理学效应[22],培育优良品种可能是提高烟草安全性与可用性的有效措施之一。
[1]夭建华,陈辉敏,方力,等.国内外卷烟危害性评价方法现状和发展趋势[J].烟草科技,2007(1):51-54.59.
[2]BAKER R R.Smoke generation inside a burning cigarette:Modifying combustion to develop cigarettes that may be less hazardous to health[J].Progress in Energy and Combustion Science,2006,32(4):373-385.
[3]赵晓丹,史宏志,钱华,等.不同类型烟草常规化学成分与中性致香物质含量分析[J].华北农学报,2012,27(3):234-238.
[4]HOFFMANN D,ILSE HOFFMANN A,ELBAYOUMY K.The Less harmful cigarette:A controversial issue.A tribute to Ernst L.wynder [J].Chemical Research in Toxicology,2001,14(7):767-790.
[5]刘政,胡亚杰,韦建玉,等.GAP在我国烟草中的发展、影响及对策[J].天津农业科学,2012,18(4):65-68.
[6]李彦平,丁燕芳,孙焕,等.我国烟草育种现状及思考[J].河南农业科学,2010,39(9):148-150.
[7]汪耀富,高华军,刘国顺,等.不同基因型烤烟叶片致香物质含量的对比分析[J].中国农学通报,2005,21(5):117-120.
[8]冀浩,刘永强,周立非,等.不同烤烟品种在云南景东的适应性研究[J].内蒙古农业科技,2011(6):31-33.
[9]曹易懿,栾洋,郑赛晶,等.烤烟和白肋烟的致突变作用和细胞毒性的对比研究[J].职业与健康,2012,28(16):1937-1940.
[10]CROOKS I,SCOTT K,DALRYMPLE A,et al.The combination of two novel tobacco blends and filter technologies to reduce the in vitro,genotoxicity and cytotoxicity of prototype cigarettes[J].Regulatory Toxicology and Pharmacology,2015,71(3):507-514.
[11]魏治中.烟草远缘杂交育种[M].北京:中国农业科技出版社,2008.
[12]陆叶珍.卷烟烟气冷凝物加S9与不加S9细胞-遗传毒性体外试验的比较研究[D].杭州:浙江大学,2010.
[13]李威.香烟导致A549细胞遗传物质损伤的实验研究 [D].武汉:武汉科技大学,2012.
[14]SHIN H J,SOHN H O,HAN J H,et al.Effect of cigarette filters on the chemical composition and in vitro,biological activity ofcigarette mainstreamsmoke[J].Food&Chemical Toxicology,2009,47(1):192-197.
[15]中国国家标准化管理委员会.GB 15193.4—2003鼠伤寒沙门氏菌/哺乳动物微粒体酶试验 [S].北京:中国标准出版社,2003:34-44.
[16]唐萍,米其利,倪红梅,等.CHO细胞中性红试验参数研究[J].云南大学学报(自然科学版),2010(Z1):139-141.
[17] LI X,PENG B,NIE C,et al.Evaluation of the cytotoxicity of cigarette smoke total particulate matter using three in vitro assays and two types of cells[J].Toxicology Mechanisms and Methods,2013,23(4):240-246.
[18]BOMBICK D W,PUTNAMK,DOOLITTLE D J.Comparative Cytotoxicity Studies of Smoke Condensates from Different Types of Cigarettes and Tobaccos[J].Toxicology in Vitro,1998,12(3):241-249.
[19]VANHELDENYG,KEIJER J,HEIL S G,et al.Beta-carotene affects oxidative stress-related DNA damage in lung epithelial cells and in ferret lung[J].Carcinogenesis,2009,30(12):2070-2076.
[20]COMBES R,SCOTT K,DILLON D,et al.The effect of a novel tobacco process on the in vitro,cytotoxicity and genotoxicity of cigarette smoke particulate matter[J].Toxicology in Vitro,2012,26(6):1022-1029.
[21]PREFONTAINE D,MORIN A,JUMARIE C,et al.In vitro bioactivity of combustion products from 12 tobacco constituents[J].Food &Chemical Toxicology,2006,44(5):7242-7381.
[22]耿召良,张婕,葛永辉,等.烤烟主流烟气内源有害成分与烟叶化学成分相关性[J].应用生态学报,2015,26(5):1447-1453.
In vitro Analysis on Cytotoxicity and Mutagenicity of Different Genotypes Tobacco
ZHANGYongjian1,WEI Keqiang1,YANGJinwen2
(1.College ofLife Science,Shanxi University,Taiyuan 030006,China;2.College ofAgronomy,Shanxi Agricultural University,Taigu 030801,China)
To analyze the toxic effects of different genotypes tobacco,including GZY-4,GZY-6,GZY-9 and NDY-1,the neutral red assay and Ames test were used to assess the cytotoxicity and mutagenicity oftheir cigarette smoke extract(CSE).The results showed that the Chinese hamster ovary(CHO)viability of GZY-4,GZY-6 and NDY-9 was higher than that of NDY-1.Compared with NDY-1, the EC50of GZY-4 and GZY-6 was significantly increased(P<0.05).The sequence of the various cytotoxic ability was as follows: NDY-1>GZY-9>GZY-6>GZY-4.S9activation could amplify the mutagenicity response to the Salmonella typhimurium(his-)strains,which were treated by CSE.Compared with NDY-1,the two CSE samples(GZY-4 and GZY-9)could decrease the ability of frameshift mutation and base substitution.Especially,the mutagenic properties of GZY-6 was significantly decreased(P<0.05).These results suggested that it was an important meaning to enhance the safety and availability oftobacco by the genetic improvement.
tobacco;CSE;cytotoxicity;mutagenicity
S572
A
1002-2481(2017)03-0374-05
10.3969/j.issn.1002-2481.2017.03.14
2016-10-31
国家烟草专卖局重点科技项目(110199901005);山西省回国留学人员科研资助项目(2013-024)
张永健(1991-),男,山西孝义人,在读硕士,研究方向:动物分子细胞生物学。魏克强为通信作者。

