面向水产病原菌微流控检测的磁控分离方法*
郭建江,张荣标,杨 宁
(1.江苏大学电气与信息工程学院,江苏 镇江 212013;2.常州工学院电气与光电工程学院,江苏 常州 213002)
面向水产病原菌微流控检测的磁控分离方法*
郭建江1,2,张荣标1*,杨 宁1
(1.江苏大学电气与信息工程学院,江苏 镇江 212013;2.常州工学院电气与光电工程学院,江苏 常州 213002)
水产养殖环境中病原菌是导致水产养殖病害的主要原因,针对传统方法存在耗时长、试剂成本高、目标菌难分离及自动化程度低等缺点,开展了面向水产病原菌微流控检测的磁控分离方法的研究。设计了磁控捕获及分离等功能的专用磁场控制器,构建了基于微流控芯片的磁控分离实验平台,优化选择了磁极电流、磁控频率及捕获时间等参数,并以大肠杆菌E.coliO157:H7为例对磁控分离捕获率进行了实验验证,研究结果表明,磁控分离法捕获率可达到92%以上,与被动分离捕获方式相比,不仅捕获率提高30%,而且分离操作灵活可控,自动化水平较高,实现了水产病原菌的高效分离,也为后续水产养殖病害快速检测与预警提供保障。
水产病原菌检测;微流控芯片;磁控分离;捕获率
目前水产养殖中由于病原菌(如嗜水气单胞菌、大肠杆菌等)导致的水产病害常常会造成水产养殖业巨大的经济损失,因此如何实现水产病原菌(简称病原菌)快速检测与预警是保证水产品质量的关键[1-2]。基于微流控芯片的病原菌检测技术以其检测灵敏度高、检测速度快、试剂量小及易于集成化和自动化等优点已成为目前病原菌快速检测的研究热点[3-4]。
水产养殖多采用集约化模式,导致水环境成分复杂多样,如何将病原菌目标菌从样本中快速分离对提高后续微流控检测精度尤为关键,常规的病原菌微分离法有被动式分离[5]、介电电泳法[6]、光学分离等[7]。免疫磁分离法是采用表面偶联菌抗体的免疫磁珠(简称磁珠)与病原目标菌发生特异性免疫反应形成菌/磁珠复合物来捕获目标菌,并通过外磁场作用富集和分离细菌。与上述其他分离法相比,磁分离法具有靶向捕获率高,操作简单、速度快及易于保持目标菌活性等优点,利于提高后续检测精度和速度[8]。Forbes等[9]对在外磁场作用下的T型微通道中免疫磁珠的磁控分离运动进行了理论分析和数值模拟,分析了流场、磁场和浓度场对磁珠分离效率的影响。Munir等[10]在内嵌间歇电磁场控制下的微通道内模拟仿真了纳米磁珠捕获和分选生物分子的过程,并与被动式分选相比较,提高了分选效率。Tania Smistrup K等[11]模拟设计了一种可变磁场结构的磁珠捕获生物分子的微流控装置,该装置随不同对象可调整磁场特性取得最佳的捕获分选效率。Debarun Das等[12]采用外置磁场结合内嵌电泳结合驱动的方式模拟仿真免疫磁珠捕获细胞和病原菌的过程,相比单一驱动方式,捕获率大大提高。国内上海交通大学的吴信宇[13]等采用多物理场耦合分析法,利用磁场与流场的协同作用对比研究直通、L型和T型等3种通道提高微通道磁泳分离效率的方法。大连理工的严小冲[14]采用流场与磁场耦合分析法数值仿真了不同流速下磁珠在永磁体吸附下运动轨迹。
上述文献模拟仿真研究了不同芯片结构下的微流控微纳粒子磁分离方法,但对微流磁控分离病原菌等生物分子的机理还需进一步的实验研究与验证。本文提出一种基于微流控检测的水产病原菌磁控分离方法,以常见的水产病原菌大肠杆菌E.coliO157:H7(简称大肠杆菌)为例对该方法进行分析和实验验证。
1 病原菌微流控磁控分离机理[14-15]
由麦克斯韦全电流定律
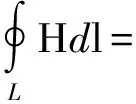
(1)
式中:H为磁场强度,L为积分闭合回路,I为电磁线圈电流。
由式(1)可知,磁控分离所设计的磁场发生器采用电磁驱动方式时,磁场的磁场强度与电磁线圈的驱动电流成正比。
在病原菌磁控分离过程中,磁珠一方面受到外磁场施加的磁场作用力,另一方面受到样本流体对磁珠的粘滞阻力。其中外磁场对单个磁珠施加磁场作用力为:
Fm=μ0χeffVP(H·)H
(2)
式中:μ0为真空磁导率,Vp为磁珠体积,χeff为磁珠有效磁化系数。
由式(1)和式(2)可知,当其他参数不变时,外磁场对磁珠的作用力与磁场强度成正比,即与线圈驱动电流成正比。样本流体对单个磁珠的粘滞阻力为:
Fd=-6πηrP(vf-vP)
(3)
式中:η为流体粘度,rp为磁珠半径,vf为流体速度,vp为磁珠速度。
由牛顿第二定律:
(4)
式中:mp为磁珠质量,Fg为单个磁珠受到的重力和浮力之和。
由于磁珠微小,Fg远小于磁场力和粘滞阻力因而可以忽略,且在微尺度下磁珠的速度变化率近似为0,因此
Fm+Fd=0
(5)
即磁场对磁珠的磁力与流体对磁珠的粘滞阻力相平衡。对样本流体而言,磁珠对流体的搅动力Fj等于Fd也等于Fm,即磁珠对病原菌的捕获与分离受磁场力Fm影响。
由层流不可压缩流体Navier-Stokes方程为:
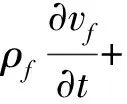
(6)
式中:ρf为流体密度,P为压强,c为磁珠浓度,δ(f)为随磁场频率f变化的周期函数。
由式(6)可知磁珠对病原菌的捕获与分离程度受磁场频率和磁场力的控制。
定义病原菌磁控捕获率CE(Capture Efficiency)(以下简称捕获率)
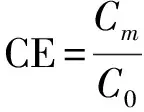
(7)
式中:Cm为磁控分离后细菌浓度,C0为细菌初始浓度。
采用捕获率来定量评价微流控磁控分离系统的性能优劣。
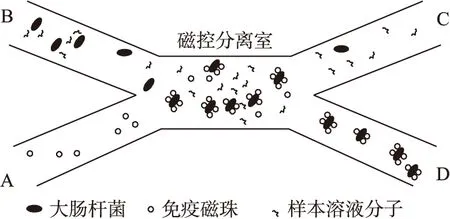
图1 磁控分离芯片模型图
2 实验平台与实验方法
2.1 微流控芯片设计
如图1所示,所设计的微流控芯片包括磁控分离室以及进出样口等结构,具备样品进样、磁控混合、磁控捕获及分离目标菌等功能。芯片以聚二甲基硅氧烷(PDMS)为基材,在PDMS上刻画出微纳通道并粘合在玻璃基片上。芯片微管道体积为6.8×10-3mL。A和B分别为免疫磁珠和大肠杆菌样本进样口,C为清洗杂质流出口,D为磁控分离后的检测输出口。磁控分离室用于磁珠与细菌在外磁场力作用下充分混合并发生免疫反应,完成细菌的捕获与分离。磁控分离是基于磁珠的磁致运动实现细菌的富集和分离,因此磁控特性的优劣影响磁控分离的效果以及后续的检测精度。
2.2 病原菌微流控磁控分离实验平台
图2是磁控分离整体实验平台。微流控芯片放置于磁场控制器中心-Z轴铁芯端子上,微量注射器连接于注射泵(0.098 μm/步,CVs的流量精度<1%),通过芯片通道A、B将病原菌样本和免疫磁珠溶液(粒径180 nm,浓度10 mg/mL)注入微流控芯片。芯片A、B通道通过注射泵启停动作来控制注入磁珠与细菌样本的流量,通道C、D通过聚四氟乙烯导管夹控制分离后的流体通断,通道C接清洗杂质采集试管,通道D接磁控分离后的样本采集试管。

1.注射泵;2.微量注射器;3.微流控芯片;4.磁场控制器;5.直流稳流电源;6.电源控制板;7.清洗液采集试管图2 磁控分离实验平台照片
磁场发生器由X-Y-Z轴6个铁芯线圈驱动产生正负6个方向的平行磁场,每个方向的磁场在磁控分离室中心处的磁感应强度可在0~65 mT范围内调控,直流稳流电源(YB3205,0-5A)可通过单片机电源控制板控制磁场控制器各个方向的磁极线圈供电,调节改变X-Y-Z轴磁场力和磁控频率控制病原菌磁控分离效率。
2.3 实验方法
病虫害防治是冬枣幼果期的一项重要管理内容。病害主要防治炭疽病、斑点落叶病、锈病等,虫害主要防治盲蝽蟓、红蜘蛛、桃小食心虫等。
通常水产养殖集约养殖水环境中单位体积中病原菌含量较低,因此需采用滤膜(<0.45 μm)真空泵富集并定量冲洗稀释后得到病原菌检测样本。常用的标准检测方法为平板计数法。即取定量样本分布于特异性显色培养基上,并将其放入恒温振荡培养箱(37 ℃,200 r/min)中48 h增菌培养,之后根据显色菌落计数方法得检测样本病原菌浓度。
本实验方法将大肠杆菌作为目标病原菌,志贺氏菌和金黄色葡萄球菌为捕获干扰菌,所用采用菌种由江苏大学食品工程学院实验室提供。将三类菌种分别用磷酸盐缓冲液(PBS)调配成病原菌溶液,梯度稀释后采用平板计数法测得3种细菌的系列浓度标准样本。为验证磁控分离效果,将大肠杆菌、志贺氏菌和金黄色葡萄球菌三类病原菌样本按照1∶4∶5比例调配成水产养殖病原菌合成样本。
驱动磁场发生器X-Y平面的4个磁极循环间歇通断给芯片的磁控分离室施加平行磁场,实现样本与磁珠进行磁控混合并发生免疫反应生成磁珠/细菌复合物(如图1所示),定时磁控分离后,启动Z向磁极将磁珠/细菌复合物吸附在分离室下部,将B口换成PBS缓冲液注射冲洗分离室,然后停止Z向磁极释放磁珠/细菌复合物实现病原菌从样本中分离,取D口输出试管样本进行平板菌落计数,获得该磁控分离条件下病原菌浓度与初始病原菌浓度的比例关系由式(7)计算病原菌磁控捕获率。
实验首先测定优化磁控分离系统主要参数及其条件,而后依据最优检测条件对系列浓度的病原目标菌样本进行磁控捕获率检测与验证,并与被动式混合分离方法进行比较,验证与评价该磁控分离系统性能好坏。
3 结果与讨论
3.1 主要参数测定与优化
由上述磁控分离机理可知,病原菌微流控磁控分离系统中的磁控电流、磁控频率及捕获时间等参数直接影响分离的效率。因此本实验取病原菌合成样本(1 mL,大肠杆菌浓度2.6×103CFU/mL)与磁珠溶液(1 mL)由注射泵驱动微量注射器同时注入微流控芯片,并分别测定不同参数下的系统磁控捕获率,从而确定最佳检测效果下的系统参数与条件。
3.1.1 磁控电流
如图3所示,实验结果显示当磁控电流小于3 A时,检测样本的磁控捕获率呈线性上升,但大于3 A后无明显改变,表明磁场对磁珠控制达到饱和,此时磁珠受到的磁控力最大,对细菌的捕获效率最佳。因此可确定系统最佳磁控电流为3 A。
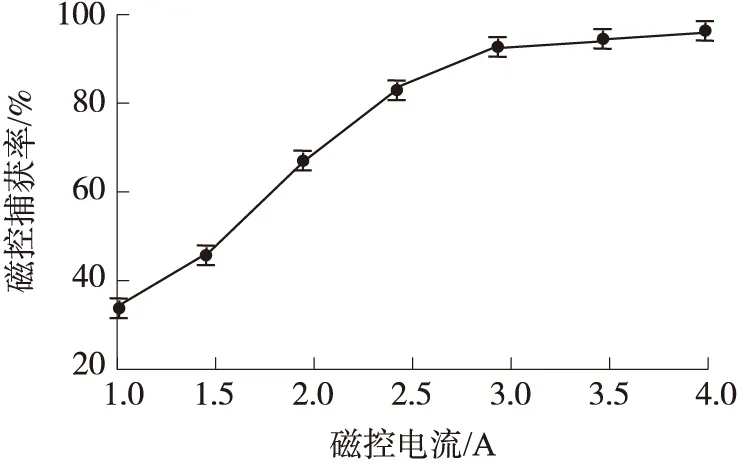
图3 磁控捕获率随磁控电流的变化
3.1.2 磁控频率
由式(6)可知,磁场变化频率影响样本流体的流动,即影响磁珠与病原菌的免疫反应,从而影响到磁控捕获率,当磁控频率过低时,磁场力的扰动过慢,磁控捕获率不高,捕获率随着磁场力频率的增加而增加。但当频率过高时,磁珠受到液体粘滞阻力作用而滞后于磁场力的扰动,同时,磁珠受到变化过快的磁场力而不能得到充分的释放,因而磁场随着磁场力频率的进一步增加反而会导致磁控捕获率下降。
实验中采用0.5Hz~6Hz等范围的7种不同磁控频率参数对检测样本进行磁控捕获率检测,结果如图4所示,小于4Hz时,磁控捕获率呈类似线性增加,直到大于4Hz时捕获率开始明显下降,说明此时病原菌磁控捕获率最大,因此可确定系统最佳磁控频率为4Hz。

图4 磁控捕获率随磁控频率的变化
3.1.3 目标菌磁控捕获时间
在微芯片通道中磁珠捕获目标菌发生免疫反应时间直接影响磁控捕获率的高低。时间过短会造成免疫反应不充分导致捕获不完全;时间过长会由于磁珠频繁碰撞导致部分反应复合物的磁珠与菌分解引起捕获率误差。因此在上述优化磁控电流和频率的条件下,实验分别取1min~7min的捕获时间进行系统捕获率检测。如图5所示,当捕获时间等于5min时,捕获率达到最大,而且超过5min后捕获率有下降趋势,因此结果表明此时磁控捕获率误差最小。
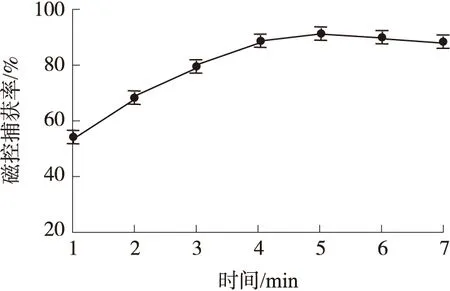
图5 磁控捕获率随目标菌捕获时间的变化
3.2 系统性能分析
采用上述实验测定的系统最优参数针对不同浓度的目标检测样本进行磁控分离效果分析。取以定量大肠杆菌作为目标菌(1mL浓度为3×108CFU/mL)样本施加不同浓度的2种干扰菌充分混合并梯度稀释后,生成不同浓度的7种目标菌检测样本,与定量磁珠溶液(1mL)同时注入微流控芯片,采用最佳参数条件磁控分离检测,将不同条件下磁控捕获率与样本中目标菌浓度作定量关系。如图6所示。结果表明样本目标菌浓度在3×102CFU/mL~3×108CFU/mL范围内,磁珠对目标菌的捕获效率均在92%以上,当目标菌浓度大于3×106CFU/mL时,系统磁控捕获率低于90%,因此本文提出磁控分离方法对高浓度(106CFU/mL)和低浓度(102CFU/mL)的细菌都具有较高的捕获效率。
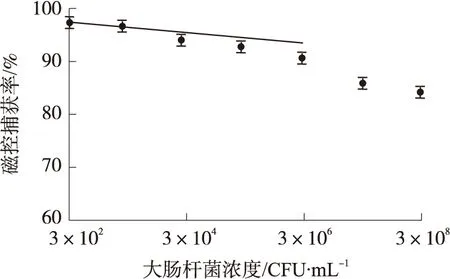
图6 不同浓度大肠杆菌样本的磁控捕获率
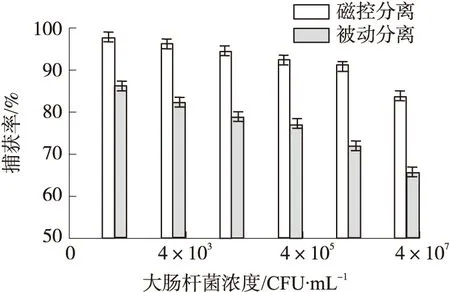
图7 不同分离方式病原菌捕获率比较
为进一步验证分析所提出的磁控分离系统的性能,取6组系列梯度浓度(4×102CFU/mL~4×107CFU/mL)范围内的大肠杆菌样本,施加干扰菌后注入系统进行磁控分离捕获率检测验证,并采用文献[16]中微流控芯片进行病原菌被动分离比较分析。图7为2种方法进行大肠杆菌捕获率所得的比较柱状图。从图7可以看出,本文提出的磁控分离方法与被动分离法相比,目标菌捕获率提高约为30%,实现了水产病原菌高效分离,有利于提高后续病原菌检测精度和检测效率。
4 结论
在自行研制的三维可控磁场作用下将水产养殖病原菌的磁控混合、捕获及分离等功能集成于一体创建了微流控磁控分离系统,并测定与优化了系统的磁控电流、磁控频率等主要条件参数,与被动式捕获分离方式相比,捕获率提高了30%,且提高了病原菌分离自动化水平,实现了水产致病菌的快速高效分离,为后续病原菌高精度检测打下基础,所提出的方法为水产养殖病害快速检测与预警提供了应用前景。
[1] Adams A,Thompson K D. Development of Diagnostics for Aquaculture:Challenges and Opportunities[J]. Aquaculture Research,2011,42(s1):93-102.
[2] 吴淑勤,王亚军. 我国水产养殖病害控制技术现状与发展趋势[J]. 中国水产,2010(8):9-10.
[3] Hol F J H,Dekker C. Zooming in to See the Bigger Picture:Microfluidic and Nanofabrication Tools to Study Bacteria[J]. Science,2014,346(6208):1251821.
[4] Foudeh A M,Didar T F,Veres T,et al. Microfluidic Designs and Techniques Using Lab-on-a-Chip Devices for Pathogen Detection for Point-of-Care Diagnostics[J]. Lab on a Chip,2012,12(18):3249-3266.
[5] Huang L R. Continuous Particle Separation Through Deterministic Lateral Displacement[J]. Science,2004,304:987-990.
[6] 方明,樊磊,曾一笑,等. 集成阵列叉指电极介电泳芯片粒子分离[J]. 微纳电子技术,2016,53(7):461-466.
[7] 耿照新,邢冰冰. 微纳流体样品片上分离技术[J]. 中国科学:信息科学,2014,44(2):177-198.
[8] Van Reenen A,de Jong A M,den Toonder J M J,et al. Integrated Lab-on-Chip Biosensing Systems Based on Magnetic Particle Actuation—A Comprehensive Review[J]. Lab on a Chip,2014,14(12):1966-1986.
[9] Forbes T P,Munson M S,Forry S P. Theoretical Analysis of a Magnetophoresis-Diffusion T-Sensor Immunoassay[J]. Lab on a Chip,2013,13(19):3935-3944.
[10] Munir A,Zhu Z,Wang J,et al. FEM Analysis of Magnetic Agitation for Tagging Biomolecules with Magnetic Nanoparticles in a Microfluidic System[J]. Sensors and Actuators B:Chemical,2014,197:1-12.
[11] Smistrup K,Bu M,Wolff A,et al. Theoretical Analysis of a New,Efficient Microfluidic Magnetic Bead Separator Based on Magnetic Structures on Multiple Length Scales[J]. Microfluidics and Nanofluidics,2008,4(6):565-573.
[12] Das D,Al-Rjoub M F,Banerjee R K. Enhanced Capture of Magnetic Microbeads Using Combination of Reduced Magnetic Field Strength and Sequentially Switched Electroosmotic Flow—A Numerical Study[J]. Journal of Biomechanical Engineering,2015,137(5):051008.
[13] 吴信宇. 磁动力微流控芯片内磁珠动力学行为及其强化混合与分离机理研究[D]. 上海交通大学,2012.
[14] 严小冲. 微流控芯片中磁珠吸附机制研究[D]. 大连理工大学,2013.
[15] Yang R J,Hou H H,Wang Y N,et al. Micro-Magnetofluidics in Microfluidic Systems:A Review[J]. Sensors and Actuators B:Chemical,2016,224:1-15.
[16] 郭建江,张荣标,杨宁,等. 基于微流控芯片的圆褐固氮菌浓度快速检测方法[J]. 农业机械学报,2015,46(1):155-159.

郭建江(1970-),湖北襄阳人,江苏大学在读博士,现为常州工学院教授,研究方向为微流控检测技术在农业自动化中的应用;

张荣标(1957-),江苏南通人,现为江苏大学电气信息工程学院教授,博士生导师,研究方向为计算机智能检测技术,474820848@qq.com。
Magnetic Isolating Method for Aquaculture Pathogens Detection System*
GUOJianjiang1,2,ZHANGRongbiao1*,YANGNing1
(1.School of Electrical and Information Engineering,Jiangsu University,Zhenjiang Jiangsu 212013,China;2.School of Electrical and Photoelectronic Engineering,Changzhou Institute of Technology,Changzhou Jiangsu 213002,China)
Pathogenic bacteria in aquatic environment is the major cause of aquaculture diseases. However conventional methods require a long time and a great amount of cost for other reagents,and suffer from difficult isolation and lower automation. A magnetic isolating method for aquaculture pathogens detection system was proposed. A dedicated magnetic controller with magnetic capture and isolation was designed,and the magnetic isolation experiment platform based on microfluidic chip was built up. The optimum magnetic pole current,switching frequency and capture time of the platform were determined,and illustrated by the case ofEscherichiacoliO157:H7 the performance of the method was experimentally verified. The research results showed that the capture efficiency of magnetic isolating method reached as high as 92%. And compared with passive isolation by barriers,the capture efficiency increased by 30%,and the separating operation was flexible and controllable with higher automation,which realized pathogens efficient separation and benefitted rapid detection and early warning on aquaculture disease.
aquaculture pathogens detection;microfluidic chip;magnetic isolation;capture efficiency
项目来源:中国博士后科学基金资助项目(2014M560404);江苏省农业自主创新计划项目(CX(14)2092);江苏省普通高校研究生科研创新计划资助项目(CXLX12_0662);常州市科技支撑计划(社会发展)项目(CE20155054);国家自然科学基金项目(61673195);国家级大学生创新训练项目(201611055004)
2016-08-11 修改日期:2016-11-07
S943
A
1004-1699(2017)03-0373-05
C:2575;3120
10.3969/j.issn.1004-1699.2017.03.007

