应用于神经通路研究的微机电系统探针与低功耗低噪声单集成芯片系统
孙建辉 蔡新霞 刘军涛 王春兴 李登旺 陈泽源 程传福 汪金辉 胡冬梅
摘要针对神经内海马区谷氨酸化学递质与神经电生理信号的并行双模检测需要,设计了8通道电化学递质与电生理双模并行检测传感芯片微系统,系统组件包括:基于SOI(Silicononinsulator)工艺衬底制备的微机电系统MEMS(Microelectromechanicalsystem)神经信息检测探针、低噪声颅内神经电小信号放大器、低功耗中速SAR(Successiveapproximationregister)ADC(Analog/DigitalConverter)模/数转换器、精简低能耗OOK(OnOffKeying)/FSK(FrequencyShiftKeying)调制射频发射器。本微型神经信息传感芯片系统具有体积小、抗干扰、化学递质与电生理信号并行检测、灵敏性好、线性度高等特点。对电生理裸探针的4个电生理位点表面沉积铂黑,电极阻抗优化为35.0kΩ;通过酶固定技术在谷氨酸检测位点上纳米定向修饰酶复膜结构(PtmPDGluOx)以形成具有特异选择性的生物识别点,实现神经化学递质谷氨酸的检测;在6~35μmol/L谷氨酸浓度范围内线性度是0.97,单位面积灵敏度是0.0069pA/(μmol/L),电流响应误差<3.0pA,表明此探针可以实现特异选择功能。同时,基于数模混合180nm的ASIC(Applicationspecificintegratedcircuit)芯片制造工艺(SmicRF180nm1Poly6M)制造的神经电生理传感后端信息调理单芯片,其内部关键测试指标:微弱小信号低噪系电压放大器(等效输入噪声电压≤0.7μVrms,增益>70dB,电源/共模抑制比>100dB等)、SARADC(有效量化位数是12bits,功耗1.2mW,最大转换速率1Msps,信噪比为60.9dB)、ASK/FSK调制的射频发射器(功放PA4~5dBm,输出功率满足10m辐射距离)。此微型神经信息感知处理芯片集成检测系统,可为海马区神经通路的研究提供便携、普适性的无线可穿戴设备。
关键词神经通路;神经植入探针;传感后单集成芯片;微型生物可穿戴设备
1引言
谷氨酸(Glutamate,Glu)是神经内关键的兴奋性神经递质之一,其代谢与大神经认知、记忆、运动、神经元可塑性等功能相关[1]。神经信息传导具有神经电生理和神经递质两种方式。对神经内谷氨酸和神经电生理并行检测有利于全面研究神经系统功能。目前,针对谷氨酸和电生理信号的文献报道都是利用单模手段,而在体双模检测报道很少。如2015年Kanamori结合EEG电极和微透析的双模检测法,在体研究大鼠神经内谷氨酸浓度增加的现象[2]。2014年Tani等[3]在神经片中分离出海马CA3区和皮层的谷氨酸能神经突触,通过的功能特别依赖于谷氨酸信号转运,因此熟悉海马生理结构,并从神经电生理、谷氨酸递质传导等方面分析海马区的神经传导通路,是海马区相关神经疾病研究的重要方法。他们采用膜片钳记录电刺激后的离子通道信号,并使用荧光共振能量转移技术测量谷氨酸释放。不论基于神经调控进行病理、药理研究,还是研究某特定神经区神经回路的作用机制,在体实时获得相关神经区电生理和谷氨酸化学递质信号的双模并行变化具有重要意义[4]。谷氨酸与相关化合物通过延长兴奋性突触传递作用导致神经元破坏,引发兴奋性毒性,从而引发癫痫、神经创伤、神经缺血等急性神经元损伤。通常情况下,释放到突触间隙的谷氨酸浓度可达1mmol/L,时间维持10
3s,在突触间隙的谷氨酸长期累积,引起谷氨酸受体受到过分刺激,从而导致神经元损害甚至死亡。海马(Hippocampus)是脊椎动物(包括人类)大脑神经的重要组成,在记忆形成和空间感知中具有非常关键的地位。海马区结构和功能的改变与癫痫、阿尔茨海默病、精神分裂症等神经疾病关系密切,是病理研究的重要神经区之一[5]。长期增强效应作为神经可塑性重要形式即在海马区被第一次发现[6]。海马区神经电信号分类和特征分析在神经疾病研究中具有重要意义,而海马区的功能特别依赖于谷氨酸信号转运,因此熟悉海马生理结构,并从神经电生理、谷氨酸递质传导等方面分析海马区的神经传导通路,是海马区相关神经疾病研究的重要方法。
本研究运用纳米材料修饰技术、微纳加工制造技术、酶生物传感技术、神经调控技术,设计了一款双模(电生理电位与谷氨酸化学递质)并行检测的植入式、8通道神经信息检测器件,并进行在体测试研究。同时,神经器件检测的动作电压信号被后续后端电路进行放大、滤波、去噪、模拟到数字信号转换、功耗优化、并且电路模块高度集成,图1为本研究设计的神经信号处理传感芯片系统整体,并且该微型可穿戴系统[7]可以移植到手机及其它便携生物信号检测终端。
2SOIMEMS谷氨酸检测神经植入传感器和信号处理集成单芯片制备
2.1MEMS植入神经探针制备
本实验采用SOI自停止技术形成硅基底,SOI硅片中间二氧化硅氧化层可作为背面基底湿法腐蚀的自停止层。MEMS神经信息传感探针基于三层光刻工艺,利用了3块掩膜版,如图2所示,探针关键制备流程:(1)为了使硅基底与微电极阵列之间完全绝缘,热氧化制备硅底绝缘层(图2A);(2)利用第一块掩膜版光刻显影将图形转移到光刻胶上,在其上溅射Ti层后溅射Pt薄膜层,增强粘附性,再剥离光刻胶层与多余的Ti/Pt薄膜层,留下记录位点、导线和焊盘的金属导电层图形,以形成金属导电层(图2B);(3)采用等离子化学气相沉积(PECVD)方法沉积氮化硅(Si3N4)绝缘层,利用第二块掩膜版进行光刻显影,对氮化硅进行等离子刻蚀,暴露出电极及焊盘,保留引线表面覆盖的绝缘层,以形成氮化硅绝缘层(图2C);(4)利用第三块掩膜版进行光刻显影,通过深刻蚀形成硅针基底外形;通过湿法腐蚀去除SOI底层硅,使硅针以外的二氧化硅薄层下脱落,形成微电极阵列针体(图2D)。电极针体通过压焊工艺与尾端接口电路进行焊接封装,形成完整的微电极阵列芯片。MEMS传感探针整体,后端正方形焊盘通过压焊连接到外部接口电路,与斩波放大接口电路进行匹配集成(图3A为传感探针的后端尾端焊盘),而尖端则修饰纳米材料酶敏感膜为传感探针的尖端检测位点部分(图3B为2个同样的Pt铂探针),以形成特异选择性的生物识别点。该MEMS探针芯片在硅针基底上集成了电化学微电极阵列、电生理微电极阵列、引线、焊盘以及氮化硅绝缘层。其中,硅探针1(以棱形分布着通道1,2,3和4,为电生理信号检测通道)淀积铂黑纳米材料,用于电生理信号检测;而硅探针2(以棱形排部着通道1,2,3和4,为电化学信号检测通道)则修饰PtmPDGluOx固定敏感复膜,用于神经化学递质信号检测。电生理和电化学位点距离尽量近,便于检测微米范围内同一脑区微環境的电生理/电化学信息。为了防止互相干扰,电极之间距离不能太近。探针前端可植入部分长8mm,探针体宽90μm,相邻探针1与2的间隔是180μm,4个圆形检测位点为一组,分布在每个硅探针尖端,圆形位点直径12μm,形成具有高时空分辨率、生理与化学递质信息互不干扰的微米级检测精度的神经信息检测双探针。
2.2神经电生理检测位点铂纳米颗粒
为了提高微弱神经信号的检测灵敏度,在MEMS探针表面修饰纳米材料,其纳米结构能够有效增大比表面积[8],以加快表面的电子转运,提高电流响应灵敏度。电化学铂沉积使用阴极沉积机制,在基体电极上直接外延生长纳米铂颗粒层,铂黑的电沉积镀液使用H2PtCl4,再加少量硝酸铅、醋酸铅,铅离子均匀化铂镀层晶粒,同时减少析出的氢的数量,提高了沉积电流效率。通过改变沉积电压及时间,可以形成多种不同形貌的电极表面。沉积电位电位过小不会发生氧化还原反应,电位过大则会引起颗粒簇集问题;沉积时间会影响铂黑层的致密均匀性与厚度,沉积具体操作为:将45mmol/L氯铂酸和4.0mmol/L醋酸铅溶液按体积比1〖KG-3∶〖KG-51配制成电解液,取15mL备用。实验采用两电极体系,将需要电镀的4个位点与电化学工作站工作电极相连,电生理检测的铂丝电极与工作站的对电极(与参比电极短接)相连。将铂丝电极和电极尖端浸入电解液中,在
.1V恒电位下沉积1min,电镀结束后,用去离子水洗掉电极表面的残留离子,即得到疏松的铂黑颗粒薄层。在1kHz处,对修饰后的微电极表面进行电化学阻抗扫描,修饰后的电极阻抗约为34.0kΩ,比未修饰纳米材料的裸电极阻抗下降了一个数量级。图4A为探针修饰铂黑纳米后的表面扫描电子显微镜(Scanningelectronmicroscope,SEM)照片,图4B为化学递质探针尖端表面的铂黑形貌,显示出明显的黑色颗粒层。
2.3电化学检测位点选择性酶膜修饰
制备的MEMS铂探针电极表面固定的谷氨酸氧化酶(LGlutamateoxidase,GluOx)可氧化为谷氨酸,生成氨、H2O2和α酮戊二酸,通过间接测量H2O2发生氧化还原反应的产生电流,再进行电流与谷氨酸浓度的换算,即可得到谷氨酸浓度变化曲线。如图5所示,本研究使用交联法酶固定技术,并加入牛血清蛋白BSA惰性蛋白质作为基质,以防止酶分子交联过程中因密度过大可能导致酶活性中心不能接近底物问题。
在谷氨酸检测位点上固定PtmPDGluOx复膜结构,其中沉积的间苯二胺(1,3Phenylenediamine,mPD)层可与酶层形成有效大分子过滤抗干扰层,阻止尺寸比较大的分子(抗坏血酸AA、多巴胺DA、3/4二羟基苯乙酸DOPAC)通过,而小分子(H2O2等)则可以穿过,膜层接触电极表面发生反应,生成牢固的复膜结构,即形成有效的谷氨酸神经化学递质识别位点。修饰好的电极在室温固化后,形成的酶层稳固性极佳,用水进行冲洗不会脱落。通过对3个电化学位点进行谷氨酸标准溶液标定,在PBS缓冲液中,+0.7V电位作用下,神经化学递质检测电极mPDGluOx微电极对6~35μmol/L不同浓度谷氨酸进行标定,结果显示线性度为0.98,单位面积灵敏度为0.0069pA/μmol,电流响应误差低于3.0pA,线性相关系数(R)为0.97;如图6A所示,mPDGluOx微电极响应电流随谷氨酸浓度的增加而增大;如图6B所示,谷氨酸在电极表面氧化电流与浓度呈线性关系,灵敏度为24.6pA/(μmol/L)。证明设计的电化学检测探针可以实现特异性选择功能。实验结果表明,微电极位点一致性良好、电化学性能可靠,化学递质检测硅针2上以棱形分布着通道5,6,7和8,可用于化学递质谷氨酸的检测。
2.4MEMS传感后端信号处理集成单芯片制备
如图7所示,神经电生理传感后端信号处理集成单芯片包括:带宽/增益可调的低噪声神经电(动作/局部场电位)微弱信号斩波稳定放大器、SARADC与ASK/FSK调制的射频发射器。传感后端的小信号放大器进行前端传感器感知的微弱神经电生理信号的放大与直流失调/低频闪烁噪声的抑制,然后送到低功耗中速SARADC模块进行模拟到数字信号的转换,最终SARADC输出的数字信号被数字编码器模块进行无线信道传输编码并打包成帧,然后帧码流对射频电路物理层进行基于ISM(Industrialscientificmedical)2.4GHz波段的射频上频谱调制,最终经过天线辐射到远处接收基站。芯片能耗进行了降低优化,以提高设备续航时间。本研究设计的传感后端数模混合信号调理单芯片,具有神经电传感后端处理的普适应用价值,构建了可穿戴场合应用的微型神经信号采集与无线传输设备。该模块可以集成到生物智能检测手持终端设备,以构建智慧神经电传感检测设备。
2.4.1神经电生理信号的斩波稳定放大使用调制/解调斩波去噪技术[9],开发了具有普适应用价值的神经电生理电压信号斩波小信号放大电路。斩波稳定电路利用纹波抑制环路消除位于单级放大器输出端的纹波电压,以避免纹波电压导致后续电路的饱和问题[10]。斩波电路使用正反馈环路技术以提高输入阻抗,提高后端斩波放大器与传感器的分压比,并且负反馈环路用于稳定中频增益。斩波放大器主体核后级联的基于采样/保持原理的部分用于消除由于非理想的MOS开关引起的毛刺噪声,并且斩波放大系统的增益/带宽可以用数字方式进行调整。斩波放大电路基于功耗节省效率提高的电流复用单级放大主体核,并且放大主体单级核增益足够大,有利于抑制后续电路噪声[11]。设计的斩波放大电路,配合双模并行SOIMEMS神经信息检测器件,进行了放大电路关键指标的测试:等效输入噪声电压≤0.7μVrms(rootmeansquare)、数字可调增益范围71~82dB(4200~11200倍)、功耗是8.0μW/单通道、共模抑制比>110dB、电源抑制比>100dB等。
2.4.2SARADC模/数转换SARADC电路采用多级放大器级联自动归零去噪声、锁存去回踢噪声、最高位MSB电容拆分、电容阵列失配消除等技术,研发了一款转换速度适中的SARADC核,其关键参数是:等效量化位数(Effectivenumberofbits,ENOB)为12bits,当最大转换速度为1Msps时,芯片功耗为1.2mW,最大转换速度为1Msps,信噪比SNR为60.9dB、无杂散动态范围(Spuriousnoisefreedynamicrange,SFDR)為73.7dB。SARADC使用了深N阱工艺,并且SAR数字控制部分进行单独隔离,防止数字抖动对模拟部分的干扰。最后,对流片后的ADC模块进行测试。结果表明,SARADC可完成放大后模拟神经电压的数字转换。
2.4.3ASK/FSK调制的射频发射利用直接上变频的ASK/FSK调制的射频电路结构,主要模块包括基于锁相环的频率综合器(Phaselockedloopfrequencysynthesizer,PLLFS)与E类的功率放大器(Etypepoweramplifier,PA)。设计的神经电可穿戴设备的感知节点需要布置在人体头部表面,需要使用电池供电;考虑系统复杂度与硬件成本,低功耗、高速率、高集成度是射频电路设计的目标。VCO(Voltagecontroloscillator)通过频率控制字进行频带的选择;此外,分频字进行分频器分频比的控制。PAE的输出功率通过功率控制字进行PAE输出幅度的控制,具有频谱纯净、易于集成、功耗低等特点。FSK调制通过关断锁相环内的开环VCO电容阵列,VCO的变容管电容随着控制电压改变而改变,进而改变输出信号的频率与相位。VCO通过增加电容阵列的数目来扩大VCO的调频范围,从而避免控制电压控制变容器引起的非线性问题。
2.4.4集成后的传感芯片系统、与商用设备&旧系统的对比本研究研发的神经电生理(动作/场电位)信号采集传感后端IC芯片与前端神经电生理探针匹配后集成,具有很小的体积,可以构建微型可穿戴神经检测设备[12]。与商用的Cerebus公司多通道神经电生理信号记录系统进行比较,此多通道神经电检测仪器对电生理信号检测的准确度为95%。由于本电路模块高度集成化,可用于构建神经信息可穿戴微型终端,并且芯片内部对数字逻辑部分进行基于单独隔离环的保护,以及利用深N阱工艺,以降低电路内部噪声。此传感芯片系统体积大大减小,具有便携可穿戴实际应用价值。
3实验部分
3.1实验动物、仪器与试剂
实验动物:健康野生型小鼠;实验试剂:0.9%生理盐水(石家庄四药公司),0.7%烏拉坦(国药集团化学试剂有限公司);实验仪器:脑立体定位仪,液压微推进器,BSA124S型电子天平(德国赛多利斯公司);MWD20型超纯水器(美诚公司,中国);数据分析软件:OfflineSorter动作电位分类软件(PlexonInC.美国)、NeuroExplorer神经信息分析软件(NexTechnologies,美国)。
3.2实验方法
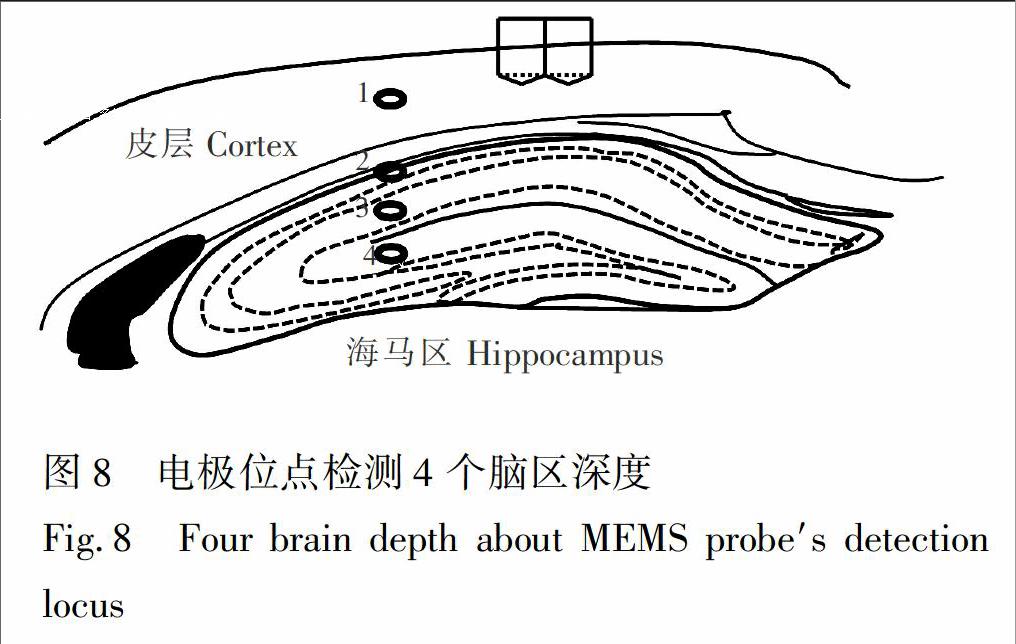
对麻醉小鼠进行0.75%戊巴比妥钠腹腔注射,去掉头皮后在小鼠颅骨上开1.5mm×1.5mm窗口,并挑破电极进入处的硬神经膜。电极植入时通过大神经皮层进入海马区域,水平定位是(ML:2.01mm,AP:2.04mm)。将微电极阵列垂直固定在微推进器上,通过液压推进器以1.1μm/s的速度缓慢匀速推进微电极,分别到达3个植入深度后暂停120s,等待电流稳定后继续匀速推进。整个实验过程中电极尖端垂直行程为2.2mm,并停留记录在4个不同深度处,包含皮层到海马区不同深度的神经区结构。采用Ag|AgCl丝植入到小鼠神经皮层作为电化学参比电极(AP:2.0mm,ML:
2.01mm,DV:
.01mm)。MEA上的一个电化学位点连接Gamry电化学工作站,采用计时电流法检测神经内化学递质谷氨酸,施加恒电位+0.70V,采样频率为2Hz(采样间隔为0.50s)。
4结果与讨论
4.1皮层至海马区谷氨酸浓度变化
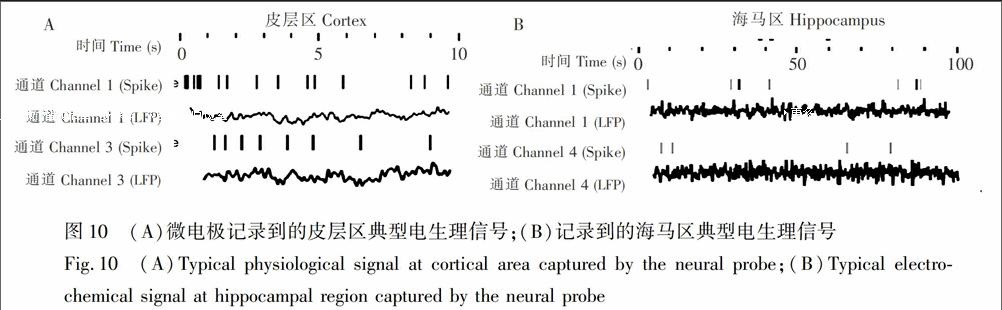
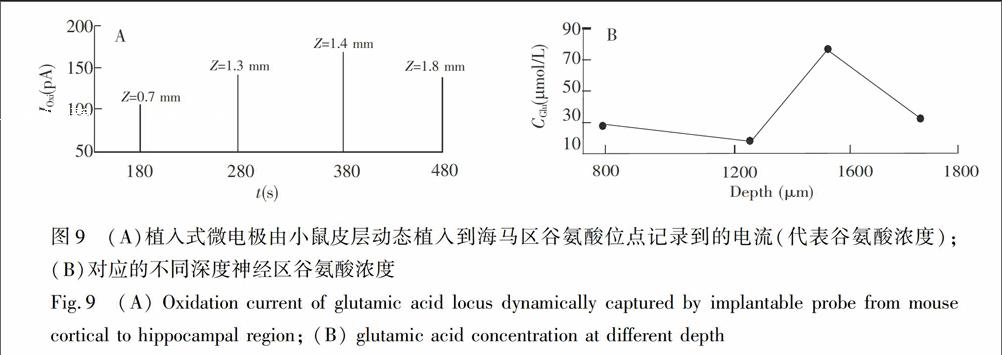
本实验电极覆盖皮层到海马区不同脑区深度的4个停留记录位置如图8所示。电极由皮层植入海马区过程中,使用计时电流法实时记录电流变化[13],并从立体定位仪上读取植入深度Z(图8)。
在植入初期,电极在皮层表面Z=0.20mm处停留足够长时间(90s),直至电流稳定在约15.19pA。图9A显示400s内电极由皮层(Z=0.70mm)植入到海马区(Z=1.80mm)过程中的电流变化,电极在每个标定深度处停留约40s,并在下降过程中保持匀速。植入过程中电流曲线出现两个明显的浓度台阶,说明谷氨酸在不同神经区分布的自然浓度差异。图9B显示4个不同深度神经区对应的谷氨酸浓度
变化趋势。为了减小计时电流法中非法拉第电流的影响,取Z=0.20mm处最后10s的扫描电流均值为神经颅内‘0′谷氨酸浓度对应的基底电流,电极稳定在某一具体深度后,计算氧化电流均值与该基底电流的差值,通过标定曲线灵敏度换算为该深度神经区的谷氨酸浓度。深度1对应神经区位于视觉皮层,谷氨酸浓度分别为(35.50±0.03)μmol/L、(37.80±0.27)μmol/L。深度3对应神经区位于海马CA1区,谷氨酸浓度分别为(84.50±0.31)μmol/L。深度4处的浓度谷值分别对应皮层与CA1区、CA1区与齿状回交接处的神经区。
4.2皮层至海马区电生理信号分析
利用OfflineSorter软件聚类分析记录到的神经动作电位(Spikes),得到单神经元的放电序列。图10A显示了神经皮层区和海马区典型通道1和3记录到的电生理信号。4个通道在皮层区记录到5种典型Spike,第3通道同时检测到两种不同类型的动作电位;而4个通道在海马区记录到3种典型Spike,其中第4通道同时检测到两种不同的动作电位。记录到的皮层区动作电位发放频率均值为2.10~10.67spikes/s,远大于海马区动作电位发放频率均值0.03~0.15spikes/s。目前,传统微透析法检测的海马区谷氨酸浓度为110~200μmol/L,略高于此微探针电极测量结果。神经电生理实验表明,该微电极上的多测量点可同时记录神经元不同层次的场电位[14],并很好地记录单个神经元的胞外神经动作Spike电位。微电极记录的皮层动作电位波形种类、发放频率均大于海马区细胞发放水平,说明皮层细胞活跃性和通讯复杂度大于海马区。对海马区的神经电生理记录中,现有文献报道采用膜片钳记录到的海马神经元自发放电主要分为5种类型,分别为不规则发放型、单波规则发放型、紧张发放型、阵发排放型及周期排放型[15],图10B为通道1记录到的同一种放电波形具有锥体细胞的簇状放电特性。
5结论
针对在体神经信息检测的实际需求,使用SOI衬底的MEMS技术制备了一种双通道植入式神经信息检测8通道微电极阵列芯片。此芯片在硅针基底上集成了铂金电化学微电极、电生理微电极、焊盘与引线等。采用纳米修饰、酶固定技术分别进行电生理位点、谷氨酸检测位点定向修饰。铂黑修饰后电生理检测位点阻抗比裸电极下降了一个数量级;谷氨酸位点在标准谷氨酸溶液内的线性度与单位面积灵敏度、反应时间、选择性均满足要求。基于研发的微电极阵列芯片对皮层至海马区的神经电生理与谷氨酸在体双模检测,实时测量到从皮层至海马区的谷氨酸动态释放和神经动作Spike发放,验证了植入式微电极阵列可实现谷氨酸递质、动作电位和场电位的并行在体检测,可为皮层到海马区神经通路的研究提供有效的MEMS植入神经传感探针。此外,基于传感后端处理芯片(斩波稳定神经电生理小信号放大、SARADC模数转换、编码器与射频发射)构建了一款低噪声低功耗的微型神经电生理信息可穿戴设备。
References
1MichaelAC,BorlandLM.UniversityofPittsburgh,Pennsylvania:CRCPress,2007
2KanamoriK.EpilepsyRes,2015,(11):32-46
3TaniH,DullaCG,FarzampourZ,TaylorWeinerA,HuguenardJR,ReimerRJ.Neuron,2014,81(4):888-900
4WEIWenJing,SONGYiLin,FANXinYi,ZHANGSong,WANGLi,XUShengWei,CAIXinXia.ChineseJ.Anal.Chem.,2015,43(7):983-988
蔚文静,宋轶琳,范心怡,张松,王力,徐声伟,蔡新霞.分析化学,2015,43(7):983-988
5AndersenP.OxfordUniversityPress,USA,2007
6BlissTVP,LmoT.J.Physiol.,1973,232(2):331-356
7LINNanSen,WANGLi,WANGMiXia,XUShengWei,YUWeiDong,CAIXinXia.ChineseJ.Anal.Chem.,2015,43(1):93-97
林楠森,王力,王蜜霞,徐声伟,禹卫东,蔡新霞.分析化学,2015,43(1):93-97
8WeiWJ,SongYL,ShiWT,LinNS,JiangTJ,CaiXX.Biosens.Bioelectron.,2014,(55):66-71
9VanHN,KimS,KimH,KimJP,VanHC.IEEET.Biomed.Circ.Sys.,2012,6(6):552-561
10YooJ,YanL,ElDamakD,AltafMAB.IEEEJ.SolidStateCirc.,2013,48(1):S1214-228
11XuJW,FanQW,HuijsingJH,HoofCV.IEEEJ.SolidStateCirc.,2013,48(7):S11575-1584
12BonfantiA,CeravoloM,ZambraG,GusmeroliR,BorghiT,SpinelliAS,LacaitaAL.IEEEEuropeanSolidStateCircuitsConf.(ESSCIRC),2010:330-333
13JIANGTingJun,LIUChunXiu,SONGYiLin,XUShengWei,WEIWenJing,CAIXinXia.ChineseJ.Anal.Chem.,2014,42(8):1071-1076
蔣庭君,刘春秀,宋轶琳,徐声伟,蔚文静,蔡新霞.分析化学,2014,42(8):1071-1076
14MahmudM,TravalinD,BertoldoA,GirardiS,MaschiettoM,VassanelliS.J.Med.Biol.Engineer.,2012,32(6):397-404
15YANGRunSheng,PANShengWu,FANGYing,YANGShengChang.Biomed.Engineer.Res.,2009,(1):25-27
杨润生,潘盛武,方颖,杨盛昌.生物医学工程研究,2009,(1):25-27
AbstractA8channelneuralsignal′ssimultaneoustransducerdetectionmicrosystemwasdevelopedtoresearchtheneurallooplocatedatthebrainhippocampuszone.ThecomponentsofthesystemcontainedtheneuralprobemanufacturedwiththeMicroelectromechanicalsystems(MEMS)techniquebasedonsilicononinsulator(SOI)substrate,biologicallownoisechopperstabilizationamplifier,lownoiseandintermediatespeedSARADCconverter,reducedandlowpowerASK/FSKmodulationradiotransmitter.Themicrosystemwasapplicablewiththecharactersofsmallvolume,interferencesfree,neuralelectrophysiologyandneurotransmittersimultaneousdetection,highsensitivity,highlinearity,etc.Theelectroderesistancewasoptimizedto35.0kΩafterdepositingnanometerplatinumblackonthe4electrophysiologicalsitesonthePtelectrode.Withthemodificationenzymetechnique,nanomaterialenzymemembrane(PtmPDGluOx)wasdirectlyfixedontheglutamatedetectionlocusforselectivelydetectingspecialneuralneurotransmittermatter.Inaddition,theelectrochemistrymeasurementresultsindicatedthatthelinearrangeofglutamatewas6-35μmol/Lwithcorrelationcoefficientof0.97,thesensitivitywas0.0069pA/(μmol/L).Thecurrentresponseerrorwaslessthan3.0pA,whichshowedthattheneuralneedlesatisfieddifferentialselection.Also,thelogic/analogmixedsignal180nmApplicationspecificintegratedcircuit(ASIC)technique(SmicRF180nm1Poly6M)wasusedtomanufacturethetransducerbackenddisposingICchip,andthetestresultsprovidedsomekeyparameterssuchaschopperstabilizationamplifier(equivalentinputtingnoisevoltage≤0.7μVrms@1kHz,gainof71-82dB,CMRR/PSRR>100dB),SARADC(ENOBis12bits,powerconsumptionis1.2mWwhenmaxmiumconversionspeedis1Msps,signalnoiseratiois60.9dB,etc),andASK/FSKmodulationradiotransmitter(thePA′soutputtingpowerof4-5dBm,theradiationrangeof10meters).Themicroneuraltransducerintegratedsystemwasconvenientandwirelesswearablefortheresearchofbrainhippocampusregion.
KeywordsNeuralloop;Neuralimplantableneedle;Lownoiseandlowpowerintegrationsinglechip;Biologicalwearabledevice
(Received19December2016;accepted14February2017)
ThisworkwassupportedbytheNationalNaturalScienceFoundationofChina(Nos.61527815,31500800,61501426,61471342)andtheNationalBasicResearchProgramofChina(No.2014CB744600)

