环境水样及固相样品中全氟化合物分析方法研究进展
孙腾飞 向垒 陈雷 肖滔 莫测辉 李彦文 蔡全英 胡国成 贺德春
摘要全氟化合物(Perfluorinatedcompounds,PFCs)是一类持久性有机污染物,在环境中普遍检出,严重危害人体健康,已成为环境科学和毒理学研究的热点之一。PFCs含有较多同系物及同分异构体,且在环境中通常为痕量水平(ng/g或μg/L),迫切需要建立灵敏可靠的样品前处理和检测技术。国内外已针对环境样品基质中痕量PFCs的检测开展了大量研究,但有关复杂环境样品中PFCs前处理方法、分析方法、基质效应等方面的系统评述还相对较少。本文综述了环境样品(水、沉积物/污泥、土壤、植物)中PFCs的前处理方法、检测方法(尤其是同分异构体)及环境样品基质效应对其检测的影响,以期为相关研究提供参考。
关键词全氟化合物;环境样品;样品前处理;基质效应;同分异构体;评述
1引言
全氟化合物(Perfluorinatedcompounds,PFCs)是指化合物分子中与碳原子连接的氢原子全部被氟原子所取代的一类有机化合物,根据其所含官能团的不同,主要可分为全氟羧酸类化合物(Perfluoroalkylcarboxylicacids,PFCAs)、全氟磺酸类化合物(Perfluoroalkylsulfonicacids,PFSAs)、全氟调聚醇类化合物(Perfluorinatedtelomericalcoholcompounds,FTOHs)及全氟酰胺类化合物(Perfluorooctanesulfonamides,PFOSAs)[1~3]。由于具有较高的热稳定、化学稳定及表面活性等性质,PFCs被广泛用作聚合物、表面活性剂、润滑剂等,应用于工业、农业等领域[4,5],并随之持续大量地进入环境[6~9]。目前已在饮用水[10,11]、地表水[6,12,13]、地下水[11,14]、沉积物[6,15,16]、土壤[6,17]等各种环境介质中普遍检出PFCs。
PFCs含有大量化学键能较高的〖JG(C〖ZJYF〖JG)键,进入环境后很难被降解,其中PFCAs和PFSAs生物降解性能最差,特别是全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)在自然环境中几乎不发生降解[15,18,19],只有通过人工化学手段(如超声波辐照或紫外光催化氧化等)下才能被降解[18]。环境介质中的PFCs可发生迁移扩散,在远离排放点的边远地区甚至南北极地区都能检出[20]。同时PFCs可进入生物体内累积,并最终通过食物链或其它途径进入人体[15,21,22],在血液、母乳中普遍检出[15,23~25]。进入人体的PFCs,具有肝脏毒性、胚胎毒性、生殖毒性、神经毒性、内分泌干扰毒性,甚至致癌性等,严重威胁人类健康[26~28]。因此PFCs环境污染与人体健康问题已成为近年来环境科学和毒理学研究的国际前沿课题[15,29]。
PFCs含有较多同系物和支链异构体(仅PFOA和PFOS的异构体就达数十种),且其在环境中通常为痕量水平(ng/g或μg/L数量级),因此开展PFCs环境及其健康问题研究时,需要可靠灵敏的样品前处理和检测技术。目前国内外已针对环境样品中痕量PFCs的检测开展了大量研究\[7,30~34],但有关环境样品尤其是沉积物、土壤、植物等复杂环境样品中PFCs前处理、分析方法的系统评述,以及PFCs样品基质效应及其同分异构体检测方法的系统总结还相对较少。本文综述了环境水样和固相样品(沉积物/污泥、土壤、植物)中PFCs前处理方法、检测方法(尤其是同分异构体)以及基质效应对PFCs测定的影响,以期为PFCs环境及其健康问题的研究提供参考。
2样品前处理
2.1样品萃取
2.1.1水样萃取水样中PFCs的萃取主要采用固相萃取法(SPE),该方法具有萃取耗时短、有机溶剂使用少,且可同步进行萃取和净化的特点\[35,36]。常用的固相萃取柱主要包括弱离子交换柱(WAX)、亲水亲脂平衡柱(HLB)和碳18柱(C18)。其中WAX柱萃取效果最好,对PFCAs,PFSAs和FOSAs均有较高的萃取富集能力,而HLB柱只对长碳链的PFCAs和PFSAs具有较高萃取富集能力[37],C18柱则因其填料中含有一定量的PFCs填料(46pg/LPFOA和12pg/LPFOS)[38],对痕量PFCs测定有较大干扰,近年已较少应用。固相微萃取法(SPME)是在SPE法基础上发展起来的新型微萃取分离技术,具有萃取过程无需使用溶剂、回收率高等优点,但主要针对挥发或半挥发性有机物,因此采用该方法萃取PFCs时,需进行衍生化[20,39]。Monteleone等[40]以氯甲醇丙酯丙醇混合溶剂对水样中PFCAs进行衍生化,后在顶空模式下进行固相微萃取,萃取效果良好(回收率为84.4%~116.8%,RSD为0.4%~14.5%)。
2.1.2土壤样品萃取目前固相基质(土壤、植物、沉积物、污泥等)中PFCs的萃取主要采用超声萃取法(UAE),该方法具有萃取效率高、用时短、萃取设备容易获得的优点[41,43~45],潘媛媛等[45]以甲醇为萃取剂,以UAE法萃取土壤中PFCs获得理想回收率(81.5%~119.2%)。除了UAE法外,加速溶剂萃取(ASE)法也被用于固相基质中PFCs萃取,该方法是在高温、高压条件下萃取固体基质中有机污染物的方法,具有耗时短、自动化程度高、消耗有机溶剂少的特点。Wang等[42]以ASE法萃取土壤中PFCAs(C6~C12,C14)和PFSAs(C4,C6,C8)的回收率为71.2%~119.2%,RSD<10%。然而,由于设备成本相对较高,ASE法在普通实验室中难以应用。
2.1.3植物样品萃取与土壤相比,植物基质(色素、纤维素、糖类等)更为复杂,PFCs可通过氢键、疏水作用力及色散力等与这些基质成分吸附、络合,导致单一溶剂萃取效果较差[46]。因此,植物样品中PFCs需选用混合溶剂萃取。以二氯甲烷(醋酸铵甲醇(99〖KG-3∶〖KG-51,V/V))混合溶剂(50〖KG-3∶〖KG-550,V/V)超声萃取不同蔬菜(生菜、西红柿)各部位(根、茎、叶)PFCAs(C4~C10)和PFSAs(C4,C6~C8,C10)均获得良好结果(平均回收率为85%)[47]。乙腈/水及混合溶液也能有效萃取蔬菜(土豆、四季豆、生菜、菠菜)中的PFCAs(C4~C12)及PFSAs(C4,C6,C8,C10),其回收率为70%~105%,RSD为1%~21%[33]。PFCs在碱性条件下可解离为阴离子化合物,并与阳离子配对试剂四丁基硫酸氢氨(TBA)通過强静电作用形成疏水离子缔合物,该物质可通过较弱极性溶剂有效萃取。目前,以NaOH为解离剂,以TBA为离子配对剂,以甲基叔丁基醚(MTBE)为萃取剂,通过离子配对法进行超声萃取,已成为植物样品中PFCs萃取的重要方法[48~50]。Felizeter等[50]以该方法萃取不同蔬菜(生菜、西红柿、南瓜、卷心菜)中PFCAs(C4~C14)和PFSAs(C4、C6、C8)的回收率在70%~97%之间,PFCA(C4)回收率较低(48%)与基质残留成分对其检测有抑制作用及缺少适合内标化合物有关。
2.1.4污泥、沉积物样品萃取与植物样品不同,污泥、底泥的异质性程度较高,离子配对法不适用于这类基质。为测定这类基质中的PFCs,往往采用混合溶剂交替萃取[4]。文献\[4,43\]以1%乙酸及乙酸酸化甲醇(甲醇1%乙酸,90〖KG-3∶〖KG-510,V/V)交替超声萃取沉积物、活性污泥中13种PFCs,其回收率大多为70%~115%,个别化合物(PFTeA)回收率较低(41%),与该化合物碳链较长(C>10)。不易从固相萃取柱洗脱及残留基质成分的抑制效应有关。值得注意的是,由于PFCs在四氢呋喃(THF)水混合溶液中有较强的溶解和分配能力,因此以该混合溶液(THF〖KG-3∶〖KG-5水=75〖KG-3∶〖KG-525,V/V)为萃取剂,超声萃取河流沉积物(荷兰)、活性污泥(荷兰市政污泥)[44]及植物(菠菜、胡萝卜、橘子、苹果)[46]中PFCs均获得良好效果(回收率为88%~110%,RSD<10%)。表1列出了近年来有关环境样品(水、土壤、沉积物、污泥、植物)中PFCs的萃取和检测的方法。
2.2样品净化和基质效应
2.2.1样品净化水样中PFCs萃取后,通常可直接浓缩、进样。固体基质(土壤、植物、沉积物、污泥等)由于具有复杂的基质成分,PFCs萃取过程中,基质成分往往被同时萃取,这些残留成分会改变PFCs的离子化率,从而严重影响其分析定量,因此固体基质萃取后还需进行净化处理[4,43,45]。固相萃取(SPE)法是PFCs样品前处理过程中最为常用的净化方式,所用净化柱包括HLB柱、WAX柱、C8/季胺盐混合柱和硅酸镁载柱(Florisil柱)[33,35,43,48~51]。其中WAX柱对多数PFCs均具有良好净化效果,被广泛应用于土壤[4,52]、植物[46]和沉积物[44,52]样品的净化。
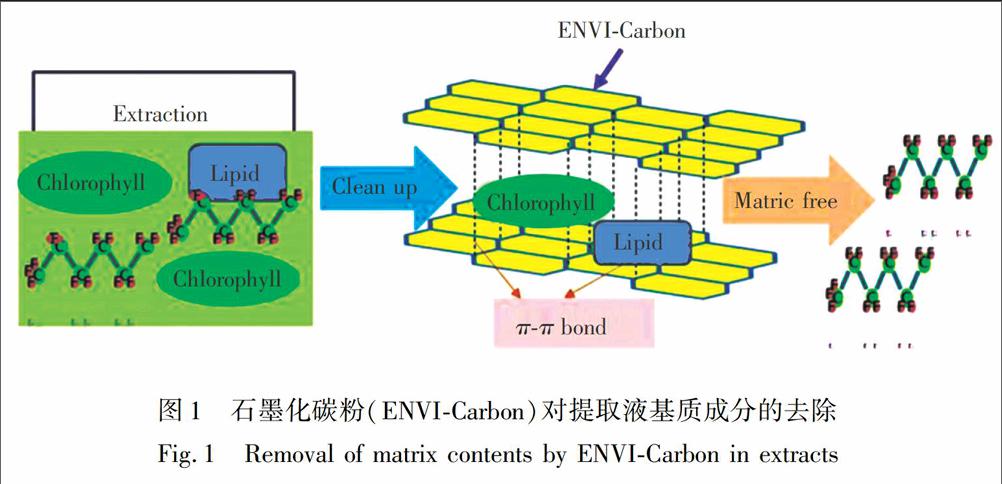
2.2.2基质效应及其评价经过固相萃取柱净化后,大部分样品基质成分被去除,但残留的基质成分(如叶绿素、纤维素、脂质等)会造成基质效应,即残留基质成分改变目标化合物离子化效率,导致其测定时分析信号增强或减弱的现象[41,55]。基质效应程度可用目标化合物基质信号强度与其溶剂信号强度之比(Smatrix/Ssolvent)或基质标线与其溶剂标线斜率之比(Kmatrix/Ksolvent)评价,通常认为,当Smatrix/Ssolvent或Kmatrix/Ksolvent<0.9时为抑制效应,当Smatrix/Ssolvent或Kmatrix/Ksolvent>1.1时为增强效应,当0.9 2.2.3植物样品基质效应基质效应的程度与植物样品种类、部位及PFCs化合物性质等因素有关。卷心菜根、茎、叶残留基质成分对PFCAs(C4、C5、C10~C12)及PFSA(C8)测定有抑制效应(Kmatrix/Ksolvent为0.19~0.90),而其根、茎残留基质成分对PFCAs(C8)及PFSA(C6)测定有增强效应(Kmatrix/Ksolventt为1.11~1.12)[50];南瓜根、叶基质残留成分均对PFCAs(C4~C12)及PFSA(C8)有抑制效应(Kmatrix/Ksolventt为0.19~0.89),而其茎残留基质成分对PFSA(C6)测定有增强效应(Kmatrix/Ksolvent为1.11)[50];西红柿叶、果实残留基质成分对PFCAs(C4、C8、C10~C12)测定均有抑制效应(Kmatrix/Ksolvent为0.34~0.84),除此之外其根、茎残留基质成分对PFCAs(C4)也有抑制效应[50]。本研究组最近的研究显示,总溶解性糖是影响作物可食部分(胡萝卜、生菜、南瓜和大米)中全氟己磺酸PFSA(C6)测定的主要基质成分[56]。 2.2.4土壤样品基质效应与植物样品相比,有关土壤残留基质成分对PFCs检测基质效应的报道较少,Li等[4]研究显示,土壤残留基质可对PFCAs(C2、C4)检测信号造成抑制效应,而对PFCAs(C10、C11)检测信号造成增强效应,其Smatrix/Ssolvent或Kmatrix/Ksolventt在0.85~1.41之间。 2.2.5污泥、沉积物样品基质效应污泥、沉积物等样品基质成分变异度较高,其对PFCs的基质效应受样品来源影响较大[4,43]。Li等[4]发现黄埔江干流采样点沉积物残留基质成分对PFCAs(C2~C13)的测定主要表现为抑制效应(Kmatrix/Ksolventt为0.73~0.87),而其支流(苏州河)采样点沉积物残留基质成分则主要表现为增强效应(Kmatrix/Ksolventt为1.10~1.35);还发现初沉池污泥及化学(混凝等)污泥残留基质成分对PFCAs(C2~C13)测定的基质效应相对较小(Kmatrix/Ksolvent为0.84~1.03),而曝气池活性污泥残留基质成分则可表现出明显的抑制或增强效应(Kmatrix/Ksolvent为0.66~0.99或1.06~1.37)。值得注意的是,曝气池活性污泥的抑制效应主要发生于较短碳链PFCAs(C2~C6),而增强效应则主要发生于较长碳链PFCAs(C10~C13),说明碳链长度也与基质效应大小有关,并显著影响污泥等样品中PFCs的检测。 2.2.6基质效应控制石墨碳粉(ENVICarb粉)具有空间层状结构,其π电子可有效吸附、去除具有芳环或杂环结构的残留基质成分(如叶绿素等),但却难以与具有高电负性氟原子的PFCs相互作用[45,48]。石墨碳粉净化基质成分的过程绘制示意图见图1。为减少或控制PFCs测定过程中的基质效应,一些研究在样品(蔬菜、土壤)萃取液经过固相萃取净化后,还进一步采用石墨碳粉进行净化[45,48,57]。经石墨碳粉净化后,植物、土壤样品残留基质成分对PFCs的基质效应明显降低,降低幅度可达30%~50%[57]。为进一步减少基质效应的干扰,提高分析方法的稳定性和重现性,在测定环境样品PFCs时,通常采用基质标线进行内标法定量[56],其中短碳链PFCAs(C6~C9)、长碳链PFCAs(C10~C14)以及PFSAs(C6~C8)可分别以碳同位素标记的MPFOA(13C4PFOA)、MPFDA(13C2PFDA)、MPOS(13C4PFOS)作为内标化合物。需要说明的是,样品的基质效应与其前处理及检测方法密切相关。因此,选择恰当的前处理和检测方法是有效减少或去除基质效应的前提。研究人员发现PFCs检测过程中,大气压化学电离源(APCI)对基质效应的敏感程度顯著低于电喷雾离子源(ESI),因此以前者代替后者可有效减少样品残留基质成分产生的基质效应[32,58,59]。Takino等[58]采用APCI测定河水样品中PFCs时,基质效应可忽略(Smatrix/Ssolventt为0.958~0.997)。目前有关环境样品PFCs检测基质效应问题的研究已引起研究者的重视,很多研究评估了样品测定过程中基质效应的大小程度,并通过基质标线内标法控制基质效应,但有关基质效应的主要影响因素、作用机理等方面还需深入研究,以期获得低基质效应甚至无基质效应的高效分析方法。
3仪器分析
3.1高效液相色谱串联质谱(HPLCMS/MS)法测定直链PFCs
由于不同质量分析器的优势不同,且串联质谱分析器(MS/MS)的选择性和灵敏度显著高于单级质谱分析器(MS)[20],因此,目前普遍采用高效液相色谱串联质谱仪(HPLCMS/MS)测定环境样品中的痕量PFCs,其中以高效液相色谱串联三重四极杆质谱仪HPLCMS/MS(QqQ)和高效液相色谱串联四极杆线性离子阱质谱仪HPLCMS/MS(QTrap)应用最广[36,43,47]。采用HPLCMS/MS(QqQ)测定环境样品中PFCs的检出限可达pg/L或pg/g数量级,其中水样、土壤、沉积物/污泥及蔬菜样品PFCs的检出限分别为12~73pg/L[36]、10~100pg/g[45]、10pg/g[44]及1~30pg/g[46]。QTrap分析器对PFCs具有较高的选择性,但灵敏度较QqQ分析器略低。以HPLCMS/MS(QTrap)检测水样、土壤、沉积物/污泥及蔬菜样品中PFCs的检出限分别为15~472pg/L[52]、30~300pg/g\[45]、41~246pg/g[43]及1~1500pg/g[47,49]。与QqQ和QTrap相比,四极杆飞行时间质谱(QTOF)分析器分析范围和分辨率较高,可给出PFCs的精确分子量(精确至小数点后4位),并可对非目标分析物定性分析,但其线性范围较窄、灵敏度较低且分析成本较高,目前多用于PFCs结构鉴定,在常规实验室或日常定量检测中使用相对有限。最近的研究显示,高效色相色谱串联QTOF分析器及高分辨检测器(HRMS)后,其测定土豆、四季豆、生菜等蔬菜中PFCs的检出限可达pg/g级(1.8~20pg/g)[33]。考虑到QTOF分析器的高选择性,相信未来其将逐渐成为复杂环境基质样品中痕量PFCs测定的重要工具。
另外,近年出现的超高效液相色谱技术(UPLCMS/MS)和毛细管液相色谱质谱联用技术(CLCMS/MS)也可显著提高复杂环境基质样品中痕量PFCs的分析能力。Yoo[54]和Onghena等[60]以UPLCMS/MS和CLCMS/MS分别测定河水样品中PFCs,其回收率与传统HPLCMS/MS相当,但灵敏度提高数倍甚至上百倍。另有研究以UPLCMS/MS测定蔬菜中PFCs的检出限可达pg/g(0.3~3.3pg/g),且分析速度较传统HPLCMS/MS提高数倍[48]。
3.2气相色谱串联质谱(GCMS)法测定直链PFCs
GCMS法可直接测定具有挥发性的PFCs(如FOSAs和FTOHs等),测定时通常采用正化学电离(PCI)或大气化学电离(APCI)作为离子源。Ellington等[61]以PCI为离子源,采用GCMS测定土壤中FTOHs(6〖KG-3∶〖KG-52~14〖KG-3∶〖KG-52FTOHs,8〖KG-3∶〖KG-51~17〖KG-3∶〖KG-51FTOHs,7MeFTOH和9MeFTOH)的检出限为1.6~8.3pg/g;以同样条件测定植物(牛毛草、大麦、早熟禾及狗牙草)中FTOHs(6〖KG-3∶〖KG-52~14〖KG-3∶〖KG-52FTOHs)的检出限为0.1~0.35ng/g(dw)[54]。另有研究表明,以APCI为离子源,采用GCMS/MS(QTrap)测定水样中FTOHs(4〖KG-3∶〖KG-52~10〖KG-3∶〖KG-52)和FOSAs(NMeFOSA,NEtFOSA,NMeFOSE及NEtFOSE)的检出限为1~5ng/L[51]。
与PFOSAs和FTOHs不同,由于PFCAs和PFSAs较难挥发,采用GCMS法测定二者时通常需进行衍生化,衍生化的方法包括烷基化、酰胺化或硅烷化[53,62]。其中常用的衍生剂包括碘甲烷、重氮甲烷和三氟化硼甲醇等(烷基化剂),2,4二氟苯胺、3,4二氯苯胺等(酰胺化剂)及三甲基氯硅烷和N,O双三甲基硅基乙酰胺(硅烷化剂)等。前人以2,4二氟苯胺进行酰胺化衍生,测定水样中PFCAs(C2~C9)的检出限为0.5ng/g[64],而以三氟化硼甲醇烷基化衍生,测定沉积物中PFCAs(C7~C10)的检出限为0.5~0.8ng/g[62]。然而,由于衍生过程较为复杂且部分衍生化产物不稳定性,GCMS在检测非挥发性PFCs方面的应用相对较少[59,65]。
3.3PFCs同分异构体的测定
除直链产物外,PFCs生产过程中(尤其是电氟化法)会产生较多的同分异构体,包括支链异构体(单甲基和二甲基异构体)和对映异构体等[63]。由于存在结构方面的差异,PFCs不同同分异构体间的生物富集效应、毒性效应等也存在明显差异,例如PFOS支链异构体(1~5m,isoPFOS)在胎盘的转移速率大于其直链异构体(nPFOS),从而导致支链PFOS优先进入婴儿体内,而直链异构体在母体比例较高[66]。因此準确测定环境中不同PFCs同分异构体的含量及组成分布对于全面、客观评估该类化合物的环境和健康效应以及其源解析等方面有重要意义。
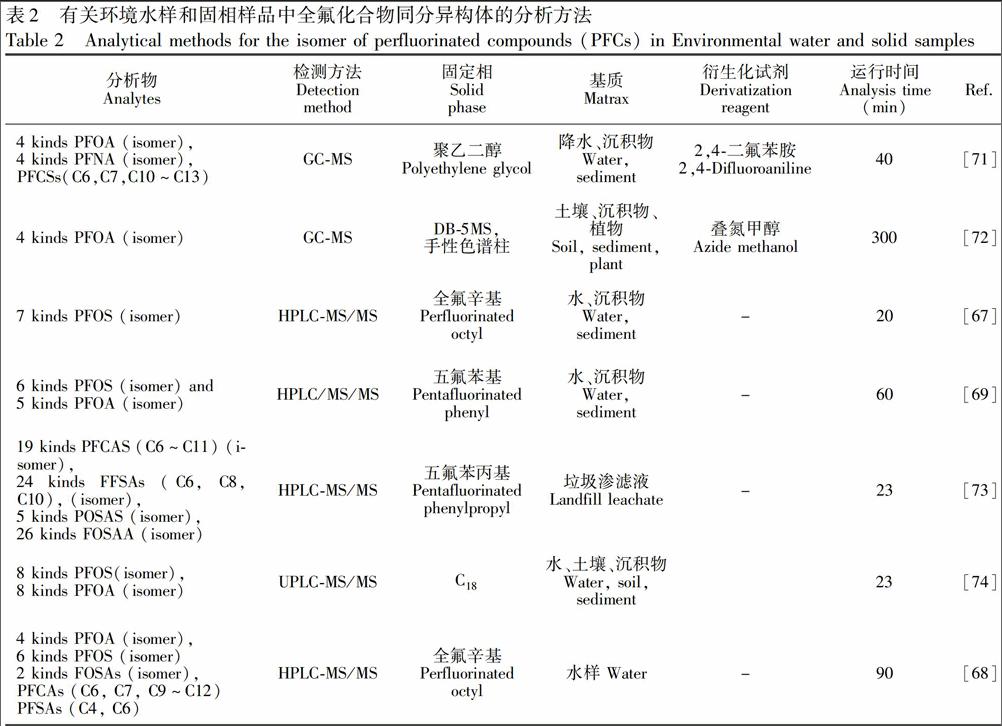
PFCs同分异构体也主要采用HPLCMS/MS法和GCMS法测定,但在分析条件、分析时间等方面与直链PFCs分析存在差异。为了提高对PFCs同分异构体的分离度,采用HPLCMS/MS法测定时,常采用与目标PFCs具有亲和作用的固定相(五氟苯基、全氟辛基或五氟苯丙基等)反相色谱柱(表2)。Houde等[67]以全氟辛基反相色谱柱,通过HPLCMS/MS测定了水及沉积物中多种PFOS同分异构体(6~7种),分析时间为20min。Chen等[68]则通过LCMS/MS,以全氟辛基反相色谱柱同时分离测定了〖CM(44水样中4种PFOA同分异构体及6种PFOS同分异构体、2种FOSA同分异构体及8种直链PFCs,但分〖CM)
析时间长达90min。最近,牛夏梦等[69]利用五氟苯基反相色谱柱,通过HPLCMS/MS同时测定了水及沉积物中PFOS(6种)和PFOA(5种)的同分异构体,方法回收率为90.8%~127%(水样)、74%~124%(沉积物),检出限分别为0.05~1.1ng/L和0.025~0.56ng/g,分析时间达60min。值得注意的是,PFCs同分异构体取代基的数目和位置可显著改变其疏水性,从而影响其在反相色谱柱中的分离。一般而言,取代基数目越多,PFCs疏水性越弱,反之亦然。因此,支链PFCs出峰通常快于直链PFCs,且其分支位点越多,出峰越快(图2)[70]。
〖CM(172熔融核色谱柱技术的应用显著提高了〖CM)
HPLCMS/MS法对PFCs同分异构体的测定效率。Benskin等[73]利用五氟苯丙基反相熔融核色谱柱,在23min内同时分离测定了垃圾渗滤液中19种PFCAs(C6~C11)\,24种PFSAs(C6,C8,C10)\,5种FOSA和26种FOSAAS的同分异构体。UPLC技术也可进一步提高LCMS/MS测定PFCs同分异构体的能力。Krrman等[74]利用UPLCMS/MS,以C18反相色谱柱,在23min内测定了环境样品(水、土壤和沉积物)中8种PFOA同分异构体及8种PFOS同分异构体。
由于气相色谱毛细管柱分离能力较强,可有效分离PFCs同分异构体,因此GCMS法也是环境样品中PFCs同分异构体测定的重要方法。deSilva等[71]以2,4二氟苯胺为衍生化剂,并以聚乙二醇为填料的强极性色谱柱,通过GCMS测定了降水及沉积物中4种PFOA同分异构体及其他6种直链全氟羧酸化合物PFCAs(C6,C7,C10~C13)。最近,Naile等[72]以叠氮甲醇为衍生剂,以DB5MS(30m)和手性色谱柱(BGB172,30m)串联,通过GCMS测定了土壤、沉积物、植物中4种PFOA异构体,但该方法分析间较长,部分样品仅色谱分离时间就长达300min以上。
与普通直链PFCs同系物分析方法相比,目前PFCs同分异构体分析方法还存在灵敏度低、稳定性差、可检测同分异构体化合物少(主要为PFOA和PFOS异构体)、可检测环境样品基质范围较窄等问题,未来尚需开发灵敏度高、稳定性好及应用范围广的新技术。
4结论与展望
全氟化合物是一类新型持久性有机污染物,在环境中普遍检出,其对环境污染与人体健康的威助已成为全球关注的热点问题。灵敏可靠的样品分析技术是研究这一问题的前提。目前,已针对复杂环境样品基质(沉积物/底泥、土壤以及植物等)中痕量PFCs的分析开展了大量研究,建立了高效、成熟、灵敏的环境样品PFCs前处理方法和检测技术,并探讨了样品基质效应对PFCs分析的影响和控制方法,但有关基质效应的主要影响因素、形成机理等方面还需要进一步研究,以获得高效测定复杂的环境基质样品中PFCs的低基质效应或无基质效应的分析方法。另一方面,与普通直链PFCs同系物相比,现有PFCs同分异构体分析方法存在灵敏度低、稳定性差、耗时长、应用范围窄等诸多问题。这些问题的研究和解决有助于进一步建立复杂环境样品中高效、灵敏、稳定的PFCs及其同分异构体分析方法,客观评价PFCs在环境中的污染特征、污染来源、环境行为、毒性效应、品种差异、健康风险及其影响因素等,这将成为今后PFCs分析技术领域研究的热点和趋势。
References
1DingG,WouterseM,BaerselmanR,PeijnenburgWJ.Arch.Environ.Con.Toxicol.,2012,62(1):49-55
2TheobaldN,CaliebeC,GerwinskiW,HuhnerfussH,LepomP.Environ.Sci.Pollut.Res.Int.,2012,19(2):313-324
3ArsenaultG,ChittimB,McAleesA,McCrindleR,RiddellN,YeoB.Chemosphere,2008,70(4):616-625
4LiF,ZhangC,QuY,ChenJ,ChenL,LiuY,ZhouQ.Sci.Total.Environ.,2010,408(3):617-623
5SepulvadoJG,BlaineAC,HundalLS,HigginsCP.Environ.Sci.Technol.,2011,45(19):8106-8112
6WangYW,FuJJ,WangT,LiangY,PanYY,CaiYQ,JiangGB.Environ.Sci.Technol.,2010,44(21):8062-8067
7ZareitalabadP,SiemensJ,HamerM,AmelungW.Chemosphere,2013,91(6):725-732
8ZhengH,LiJL,LiHH,HuGC,LiHS.J.Food.Sci,2014,79(6):1123-1129
9PanCG,ZhaoJL,LiuYS,ZhangQQ,ChenZF,LaiHJ,PengFJ,LiuSS,YingGG.Ecotoxicol.Environ.Safe,2014,107(7):192-199
10PostGB,CohnPD,CooperKR.Environ.Res.,2012,116(5):93-117
11EschauzierC,RaatKJ,StuyfzandPJ,deVoogtP.Sci.Total.Environ.,2013,458460(5):477-485
12YAOYao,DENGJieWei,YANGYunYun,FANGLing,ZHOUHaiYun,LIUHongTao,WANGXiaoWei,LUANTianGang.ChineseJ.Anal.Chem.,2015,43(7):1053-1057
姚瑤,邓洁薇,杨运云,方玲,周海云,刘洪涛,王晓玮,栾天罡.分析化学,2015,43(7):1053-1057
13LuZ,SongL,ZhaoZ,MaY,WangJ,YangH,MaH,CaiM,CodlingG,EbinghausR,XieZ,GiesyJP.Chemosphere,2015,119(9):820-827
14YaoY,ZhuH,LiB,HuH,ZhangT,YamazakiE,TaniyasuS,YamashitaN,SunH.Ecotoxicol.Environ.Safe,2014,108(8):318-328
15SHIYaLi,PANYuanYuan,WANGJieMing,CAIYaQi.Prog.Chem.,2009,21(2/3):369-376
史亚利,潘媛媛,王杰明,蔡亚歧.化学进展,2009,21(2/3):369-376
16ZhengH,HuG,XuZ,LiH,ZhangL,ZhengJ,ChenL,HeDB.Environ.Contam.Toxicol.,2015,94(4):503-510
17HUGuoCheng,ZHENGHai,ZHANGLiJuan,XUZhengCheng,CHENLaiGuo,HEDeChun,LIHuaShou.J.Environ.SciChina,2013,33(S1):37-42
胡國成,郑海,张丽娟,许振成,陈来国,贺德春,黎华寿.中国环境科学,2013,33(S1):37-42
18LiuJ,MejiaAvendanoS.Environ.Int.,2013,61(10):98-114
19StahlT,RiebeRA,FalkS,FailingK,BrunnH.J.Agric.Food.Chem.,2013,61(8):1784-1793
20SHIYaLi,CAIYaQi.Prog.Chem.,2014,26(4):665-681
史亚利,蔡亚岐.化学进展,2014,26(4):665-681
21NoorlanderCW,vanLeeuwenSP,teBiesebeekJD,MengelersMJ,ZeilmakerMJ.J.Agric.Food.Chem.,2011,59(13):7496-7505
22MüllerCE,DeSilvaAO,SmallJ,WilliamsonM,WangX,MorrisA,KatzS,GambergM,MuirDC.Environ.Sci.Technol.,2011,45(20):8665-8673
23BarbarossaA,MasettiR,GazzottiT,ZamaD,AstolfiA,VeyrandB,PessionA,PagliucaG.Environ.Int.,2013,51(11):27-30
24AntignacJP,VeyrandB,KadarH,MarchandP,OlekoA,LeBizecB,VandentorrenS.Chemosphere,2013,91(6):802-808
25KarrmanA,DomingoJL,LlebariaX,NadalM,BigasE,vanBavelB,LindstromG.Environ.Sci.Pollut.Res.Int.,2010,17(3):750-758
26PerezF,LlorcaM,KockSchulmeyerM,SkrbicB,OliveiraLS,daBoitMartinelloK,AlDhabiNA,AnticI,FarreM,BarceloD.Environ.Res.,2014,135(10):181-189
27CornelisC,D'HollanderW,RoosensL,CovaciA,SmoldersR,vandenHeuvelR,GovartsE,vanCampenhoutK,ReyndersH,BervoetsL.Chemosphere,2012,86(3):308-314
28QuBC,ZhaoHX,ZhouJT.Chemosphere,2010,79(5):555-560
29WangT,WangYT,LiaoCY,CaiYQ,JiangGB.Environ.Sci.Technol.,2009,43(14):5171-5175
30ClarkeBO,SmithSR.Environ.Int.,2011,37(1):226-247
31WangP,WangT,GiesyJP,LuY.Chemosphere,2013,91(6):751-757
32ValsecchiS,RusconiM,PoleselloS.Anal.Bioanal.Chem.,2013,405(1):143-157
33UllahS,AlsbergT,VestergrenR,BergerU.Anal.Bioanal.Chem.,2012,404(8):2193-2201
34YUYuCheng,XUDunMing,LUOChao,ZHOUYu,PENGTao,YUEZhenFeng.J.FoodSafeQual.,2014,(8):2550-2559
余宇成,徐敦明,罗超,周昱,彭涛,岳振峰.食品安全质量检测学报,2014,(8):2550-2559
35GonzálezBarreiroC,MartínezCarballoE,SitkaA,ScharfS,GansO.Anal.Bioanal.Chem.,2006,386(78):2123-2132
36BooneJS,GuanB,VigoC,BooneT,ByrneC,FerrarioJ.J.Chromatogr.A,2014,1345(4):68-77
37WANGChao,LYUYiBing,CHENHaiJun,TANLi,TENGEnJiang.ChineseJournalofChromatography,2014,32(9):919-925
王超,吕怡兵,陈海君,谭丽,滕恩江.色谱,2014,32(9):919-925
38YamashitaN,KannanK,TaniyasuS,HoriiY,OkazawaT,PetrickG,GamoT.Environ.Sci.Technol.,2004,38(21):5522-5528
39LiXJ,GanPS,PengRF,HuangC,YuH.J.Chromatogr.Sci.,2010,48(3):183-187
40MonteleoneM,NaccaratoA,SindonaG,TagarelliA.J.Chromatogr.A,2012,1251(6):160-168
41LiYW,ZhanXJ,XiangL,DengZS,HuangBH,WenHF,SunTF,CaiQY,LiH,MoCH.J.Agric.FoodChem.,2014,62(49):11831-11839
42WANGYi,KONGDeYang,SHANZhengJun,TANLiChao.Environ.Chem.,2012,31(1):113-119
王懿,孔德洋,單正军,谭丽超.环境化学,2012,31(1):113-119
43HigginsCP,FieldJA,CriddleCS,LuthyRG.Environ.Sci.Technol.,2005,39(11):3946-3956
44EsparzaX,MoyanoE,deBoerJ,GalceranMT,vanLeeuwenSP.Talanta,2011,86(9):329-336
45PANYuanYuan,SHIYaLi,CAIYaQi.Environ.Chem.,2010,29(3):519-523
潘媛媛,史亚利,蔡亚岐.环境化学,2010,29(3):519-523
46BallesterosGómezA,RubioS,vanLeeuwenS.J.Chromatogr.A,2010,1217(38):5913-5921
47BlaineAC,RichCD,HundalLS,LauC,MillsMA,HarrisKM,HigginsCP.Environ.Sci.Technol.,2013,47(24):14062-14069
48VestergrenR,UllahS,CousinsIT,BergerU.J.Chromatogr.A,2012,1237(3):64-71
49FelizeterS,McLachlanMS,deVoogtP.Environ.Sci.Technol.,2012,46(21):11735-11743
50FelizeterS,McLachlanMS,DeVoogtP.J.Agric.Food.Chem.,2014,62(15):3334-3342
51PortolesT,RosalesLE,SanchoJV,SantosFJ,MoyanolE.J.Chromatogr.A,2015,1413(9):107-116
52LIUQing,HEDeChun,XUZhenCheng,LIJie,ZHANGSuKun,PANLang.EnvionmentalMonitoringinChina,2014,30(4):134-139
刘庆,贺德春,许振成,李杰,张素坤,潘浪.中国环境监测,2014,30(4):134-139
53SHANGuoQiang,SUNHuaiHua,HOUZheng,ZHULingYan.Prog.Chem.,2012,24(10):2019-2027
单国强,孙怀华,侯征,祝凌燕.化学进展,2012,24(10):2019-2027
54YooH,WashingtonJW,JenkinsTM,EllingtonJJ.Environ.Sci.Technol.,2011,45(19):7985-7990
55XiangL,WangXK,LiYW,HuangXP,WuXL,ZhaoHM,LiH,CaiQY,MoCH.J.Agric.FoodChem.,2015,63(30):6689-6697
56XiangL,SunTF,ChenLei,XiaoT,CaiQY,LiH,HeDC,MongMH,LiYW,MoCH.FoodAnal.Method,2017(acceptedDOI:10.1007/s1216101708074)
57PowleyCR,GeorgeSW,RyanTW,BuckRC.Anal.Chem.,2005,77(19):6353-6358
58TakinoM,DaishimaS,NakaharaT.Rapid.Commun.Mass.Spectrom.,2003,17(5):383-390
59JahnkeA,BergerU.J.Chromatogr.A,2009,1216(3):410-421
60OnghenaM,MolinerMartinezY,PicóY,CampínsFalcóP,BarcelóD.J.Chromatogr.A,2012,1244(5):88-97
61EllingtonJJ,WashingtonJW,EvansJJ,JenkinsTM,HafnerSC,NeillMP.J.Chromatogr.A,2009,1216(28):5347-5354
62AlzagaR,SalgadoPetinalC,JoverE,BayonaJ.J.Chromatogr.Sci.,2005,1083(1):1-6
63BenskinJP,AhrensL,MuirDC,ScottBF,SpencerC,RosenbergB,TomyG,KylinH,LohmannR,MartinJW.Environ.Sci.Technol.,2011,46(2):677-685
64ScottBF,MoodyCA,SpencerC,SmallJM,MuirDC,MaburySA.Environ.Sci.Technol.,2006,40(20):6405-6410
65TrojanowiczM,KocM.Microchim.Acta,2013,180(1112):957-971
66BeesoonS,WebsterGM,ShoeibM,HarnerT,BenskinJP,WartinJW.Environ.Health.Persp.,2011,119(11):1659-1664
67HoudeM,CzubG,SmallJM,BackusS,WangX,AlaeeM,MuirDC.Environ.Sci.Technol.,2008,42(24):9397-9403
68ChenXW,ZhuLY,PanXY,FangSH,ZhangYF,YangLP.WaterRes.,2015,80(5):235-244
69NIUXiaMeng,SHIYaLi,ZHANGChunHui,CAIYaQi.Environ.Chem.,2015,34(8):1453-1459
牛夏夢,史亚利,张春晖,蔡亚岐.环境化学,2015,34(8):1453-1459
70LangloisI,OehmeM.Rapid.Commun.Mass.Spectrom.,2006,20(5):844-850
71deSilvaAO,MuirDC,MaburySA.Environ.Toxicol.Chem.,2009,28(9):1801-1814
72NaileJE,GarrisonAW,AvantsJK,WashingtonJW.Chemosphere,2016,144(11):1722-1728
73BenskinJP,IkonomouMG,WoudnehMB,CosgroveJR.J.Chromatogr.A,2012(5),1247:165-170
74KrrmanA,ElghDalgrenK,LafossasC,MskelandT.Environ.Chem.,2011,8(4):372-380
AbstractPerfluorinatedcompounds(PFCs),agroupofpersistentorganicpollutants,havebeenwidelydetectedinenvironmentalmediaandposedgreatthreattohumanhealth.TheresearchesonenvironmentalpollutionandhealthconcernofPFCsarethehotspotareas.BecausePFCscontainlotsofhomologsandisomerswhicharedetectedattracelevels(ng/gorμg/L)inenvironment,advancedandreliableanalyticalmethodsfordeterminationofPFCsinenvironmentareurgentlyneeded.Atpresent,studiesonanalyticalmethodsoftracePFCsinenvironmentalsampleshavebeenwidelycarriedoutinChinaandabroad.However,systematicreviewonthesamplepretreatment,analyticalmethod,andmatrixeffectofPFCsdeterminationincomplexenvironmentalmatrixesisrelativelyscarce.Therefore,thispaperreviewsthepretreatmentmethods,martixeffects,anddetectiontechniques(especaillyisomers)ofPFCsinenvironmentsamples(water,sediment/sluge,soilandplant).WehopethatthisreviewmayprovidevaluablereferencefortheenviromentalresearchesonPFCs.
KeywordsPerfluorinatedcompound;Environmentalsample;Samplepretreatment;Matrixeffects;Isomers;Review
(Received10November2016;accepted12February2017)
ThisworkwassupportedbytheNationalNaturalScienceFoundationofChina(Nos.41573093,U1501233).

