基于银/铂纳米模拟酶表面修饰的铜离子比色检测方法研究
吴亮亮 钱志娟 谢正军 张莹莹 彭池方
摘要 通过对银/铂纳米簇(Ag/Pt NCs)的表面修饰调控其催化活性,建立了一种高灵敏的比色法检测Cu2+。巯基丙酸能够抑制Ag/Pt NCs的催化活性,而巯基丙酸与Cu2+作用后,将导致上述抑制作用减弱。2基于上述原理,通过测量Ag/Pt NCs 催化TMBH2O2反应产生的显色信号,可以实现Cu2+的比色檢测。本方法检测Cu2+的线性范围为10~100 nmol/L,检出限(3σ)为5.0 nmol/L。将本方法应用于实际水样中Cu2+的检测,结果表明,本方法具有操作简单、成本低、灵敏度高、特异性好等优点。
关键词 银铂纳米簇; 比色检测; 巯基丙酸; 铜离子
1引 言
铜作为人体必须的微量元素,在人体生命活动及器官运行中发挥重要作用[1]。但是过量的铜会对人体产生潜在的毒性,也会对环境造成严重污染[2]。Cu2+在人体内过度累积可能会参与活性氧物质的生成,从而导致神经退行性疾病的发生; 同时,癌症、糖尿病、心血管疾病及动脉硬化、肝硬化肝腹水等也与Cu2+有关[3]。目前,常用的Cu2+检测方法包括原子发射光谱法(AES)[4]、原子吸收光谱法(AAS)[5]、电感耦合等离子质谱法(ICPMS)[6]及电化学分析法[7]。这些方法虽然灵敏度高,特异性好,但都存在不同的缺点,如耗时较长、仪器昂贵、需要专业操作人员、不便携带等,不利于实际应用。 因此,开发简单方便、成本低、灵敏度高、特异性好的Cu2+检测方法具有重要的应用价值。
近年来,基于纳米材料的比色传感方法的发展为研究者开发重金属离子的检测方法提供了新思路。相对于电化学方法[8]及荧光技术[9,10]而言,基于紫外光谱检测及裸眼可见的比色方法更加简单易行,受到研究者青睐。 Deng等 \[11]利用经过热处理的裸金纳米颗粒, 建立了一种快速检测Cu2+的比色检测方法; Hua等[12]利用化学反应诱导金纳米粒子聚集, 建立了一种比色检测水中Cu2+的方法。上述方法主要是通过调控纳米颗粒表面电荷, 诱导纳米粒子表面等离子共振吸收峰的变化实现检测,具有简单易行的优点,但由于许多样品基质中含有高浓度的离子,可能带来应用上的干扰。
研究表明,一些金属纳米粒子,如Fe3O4NPs\, PtNCs\, Co3O4NPs等,具有类似天然酶的活性,被称为“纳米模拟酶”[13]。通过修饰这些纳米模拟酶的表面组分,可调控其催化活性[14]。利用这一特性,研究者构建了一些灵敏的比色方法,检测物包括重金属[15,16]、三聚氰胺[17]及L半胱氨酸[18]。在这些模拟酶中,铂杂化纳米材料凭借其较高的催化活性, 已被广泛应用于生物传感器。如Lin等[18]通过将铂纳米材料与氧化石墨烯结合, 实现了对半胱氨酸的快速检测; Gao等[19]利用Au@PtNHs实现了扩增比色免疫分析。Zheng等[20]发现银铂杂合纳米簇(Ag/Pt NCs)相对于单一组份纳米簇而言,具有更高的催化活性。本课题组也利用Ag/Pt NCs的高催化活性,基于半胱氨酸和Hg2+对其催化活性的抑制作用,构建了高灵敏的比色检测方法[21,22]。
有文献报道,含巯基化合物如L半胱氨酸,能够通过巯基与铂纳米颗粒表面结合,形成〖JG(Pt〖ZJYS〖JG)键,抑制铂纳米模拟酶的催化活性[23,24]。另外,Cu2+可以催化巯基化合物的氧化形成二硫键[25]。基于上述两种作用,本研究利用巯基丙酸(MPA)抑制DNA银铂纳米簇(Ag/Pt NCs)的催化活性; 同时利用Cu2+与MPA反应,调控MPA对Ag/Pt NCs催化活性的抑制作用,实现了Cu2+的比色检测。本方法具有操作简单、成本低、特异性强、灵敏度高等优点。
〖HS1*5/62实验部分
2.1仪器与试剂
Multiskan MK3 酶标仪(美国 Thermo 公司); QL901 漩涡混匀器(江苏海门其林医用仪器厂); VS100C恒温混匀仪(无锡沃信仪器有限公司); UV2802pcs紫外分光光度计(优尼柯公司); JEOL2100透射电镜(日本电子株式会式); EMXplus10/12电子自旋共振波谱仪(德国布鲁克科技有限公司)。
AgNO3(美国Sigma公司,纯度99%); 四氯铂酸钾(玛雅试剂); 巯基丙酸(MPA)、四甲基联苯胺(TMB)、NaBH4(阿拉丁试剂); ssDNA(生工生物工程上海股份有限公司); 金属离子溶液(Hg2+, Mn2+, Sr2+, Zn2+, Fe3+, Co2+, Cr2+, Ag+, Ni2+, Cd2+, Al3+, Ba2+和Pb2+均为1 μg/mL,国家有色金属及电子材料分析测试中心); 实验用水为Millipore超纯水(18.2 MΩ cm); 其余试剂均为分析纯。
2.2Ag/Pt NCs的合成
参照文献\[21\]的方法合成Ag/Pt NCs,利用氧化还原法合成平均粒径为4 nm的Ag/Pt NCs:将50 μL 150 μmol/L AgNO3溶液及120 μL 125 μmol/L K2PtCL4溶液与300 μL 2 μmol/L ssDNA溶液(以10 mmol/L, pH 7.4的磷酸盐缓冲液稀释)振荡混匀,4℃避光反应30 min后,加40 μL 5 mmol/L NaBH4 溶液(冰水稀释),快速混匀,然后置于恒温振荡器上, 37℃,1500 r/min孵育3 h, 得到平均粒径为4 nm的2 μmol/L Ag/Pt NCs溶液,于4℃ 避光保存,一个月内活性不会发生明显变化。
2.3Cu2+ 的检测
用10 mmol/L Tris缓冲盐(pH 6.0), 稀释巯基丙酸溶液至20 μmol/L。将10 μL MPA溶液和90 μL系列浓度的Cu2+溶液(0~200 nmol/L) 依次加入到微孔板中,充分混合,于室温孵育20 min; 将制备的Ag/Pt NCs溶液稀释4倍,取10 μL 加入上述混合溶液中,充分混合,于室温孵育15 min; 最终向孵育好的混合溶液中依次加入30 μL柠檬酸缓冲溶液(0.01 mol/L,pH 4.0)、40 μL TMB溶液(3 mmol/L)、20 μL H2O2溶液(1 mol/L),振荡混合均匀,反应15 min, 测定652 nm处的吸光值,以吸光值对Cu2+的浓度绘制校正曲线。
2.4样品加标回收实验
采集本实验室的自来水、湖水及河水作为样品, 样品分别经0.22 μm微孔滤膜过滤。参照2.3节的方法测量, 并与石墨炉原子吸收光度法(GFAAS)测定结果比较。
3结果与讨论
3.1Ag/Pt NCs的表征
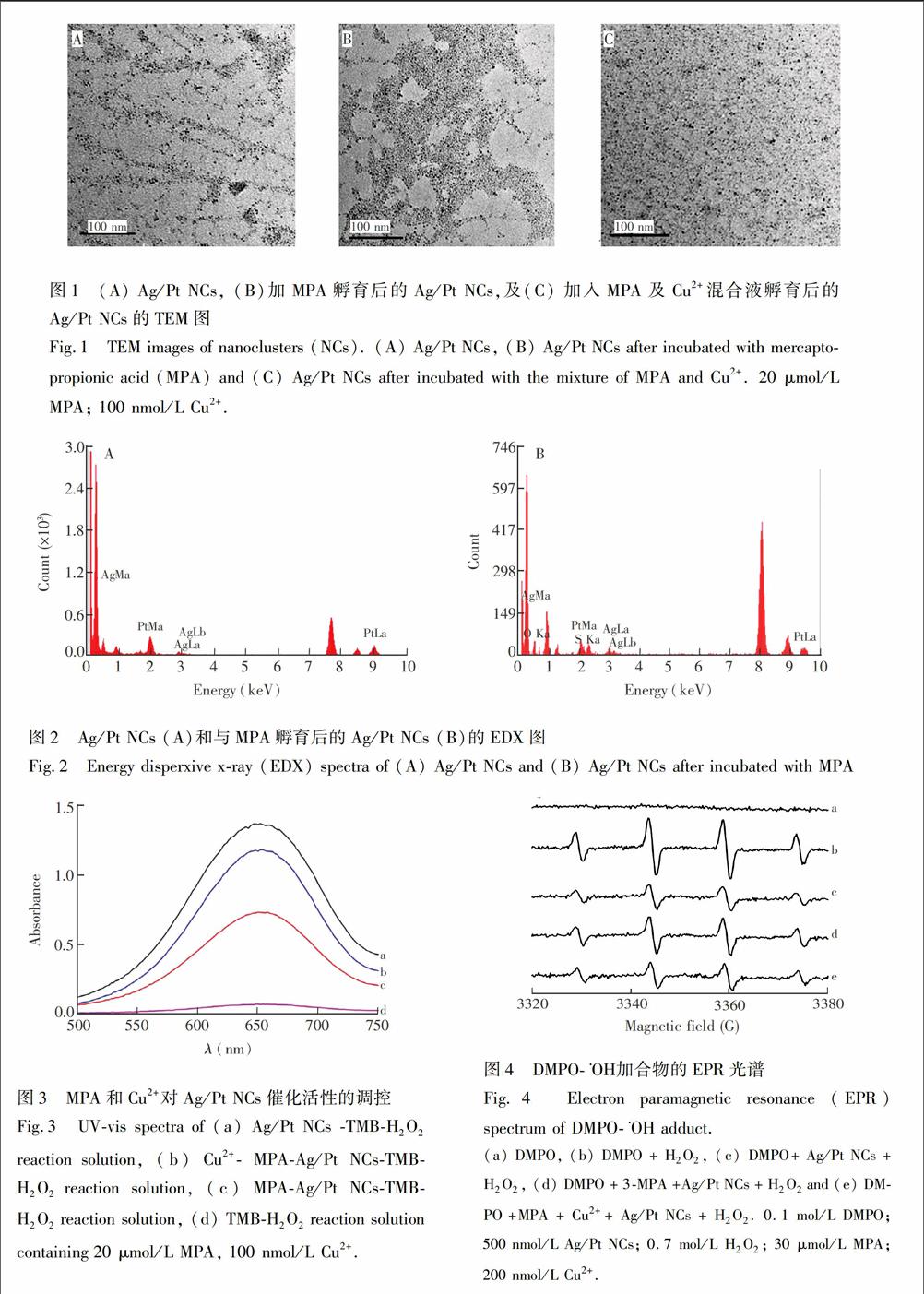
3.1.1透射電镜(TEM)和X射线电子能谱(EDX)表征透射电镜图如图1所示, Ag/Pt NCs的粒径约为5 nm(图1A); 向Ag/Pt NCs溶液中加入MPA后,Ag/Pt NCs呈现一定程度的聚集(图1B); 加入Cu2+和MPA的混合液时, Ag/Pt NCs并没有明显变化(图1C)。以上结果表明,Cu2+与MPA发生了反应,导致MPA对Ag/Pt NCs的结合作用减弱。由EDX谱图(图2)也可以发现,当向Ag/Pt NCs溶液中加入MPA后,Ag/Pt NCs表面出现S元素,说明MPA结合在Ag/Pt NCs表面。
3.1.2吸收光谱分析由吸收光谱(图3)可见,Ag/Pt NCs能催化TMBH2O2氧化还原反应,在652 nm处产生较强的吸收峰(曲线a),这说明Ag/Pt NCs具有过氧化物酶活性。然而,当与MPA孵育后,Ag/Pt NCs催化TMBH2O2时的吸收峰强度显著下降(曲线c)。当与MPA和Cu2+的混合液孵育后,上述催化反应的吸收峰的强度显著回升(曲线b)。上述结果说明,MPA作用于Ag/Pt NCs, 使其酶活性降低,而Cu2+与MPA发生了反应,降低了MPA对Ag/Pt NCs的模拟酶活性的抑制。
3.1.3电子顺磁共振(EPR)表征电子顺磁共振分析表明(图4),DMPO能够捕获H2O2经紫外灯照射产生的·〖KG-3OH,形成DMPO·〖KG-3OH,产生较强的EPR信号(曲线b)。Ag/Pt NCs与DMPO竞争结合·〖KG-3OH[16],导致DMPO·〖KG-3OH的信号变弱(曲线c)。当Ag/Pt NCs与MPA作用后,再与DMPO竞争·〖KG-3OH时, EPR信
而MPA与Cu2+反应后,再与Ag/Pt NCs孵育,将使得结合在Ag/Pt NCs表面的MPA减少,从而减弱了上述抑制作用,因此, EPR图谱上显现出较弱的DMPO·〖KG-3OH信号(曲线e)。
3.2Ag/Pt NCs比色检测Cu2+反应条件的影响
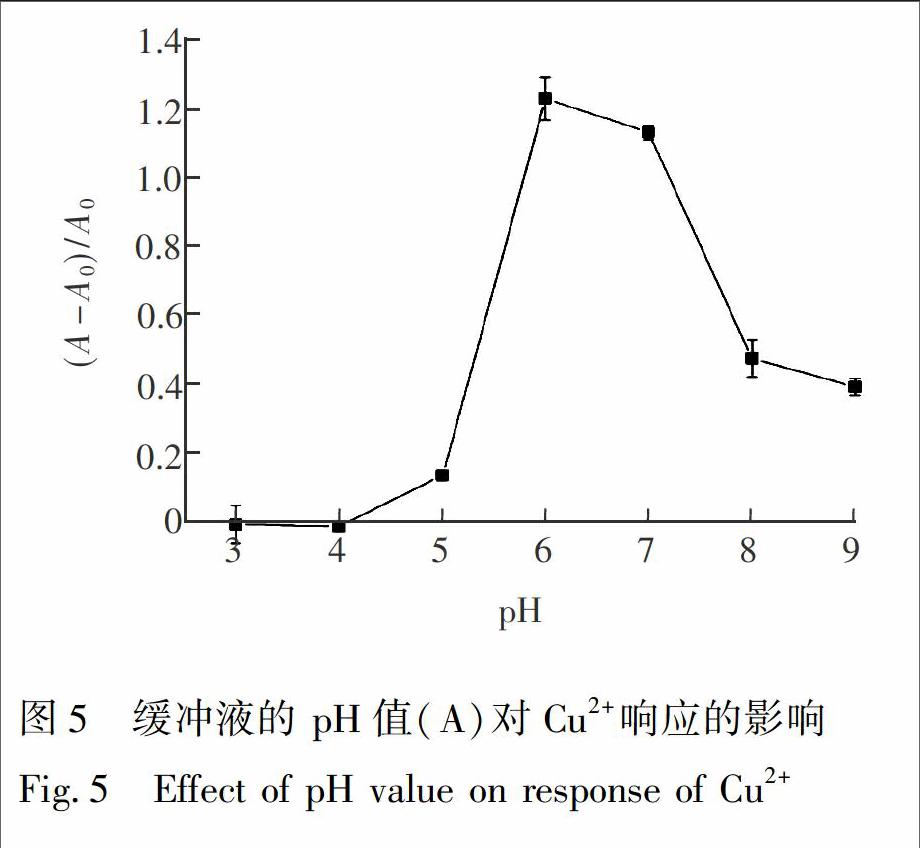
3.2.1缓冲溶液的pH值和盐浓度的影响考察缓冲液pH值分别为3.0, 4.0, 5.0, 6.0, 7.0, 8.0和9.0时对Cu2+的分析响应的影响。 结果表明(图5),当缓冲溶液的pH=6.0时,100 nmol/L Cu2+产生的吸光度差比值((A0-A)/A0)最大,因此,后续实验选用pH=6.0的缓冲溶液。
将浓度分别为1.0, 5.0, 10, 50和100 mmol/L的Tris缓冲溶液用于上述反应对Cu2+的响应分析。 结果表明,当缓冲溶液浓度低于10 mmol/L时, Cu2+产生的吸光度差比值变化较大,高于10 mmol/L时, 吸光度差比值明显下降。故选择10 mmol/L Tris缓冲溶液用于Cu2+检测。
3.2.2MPA浓度的影响考察浓度分别为1.0, 5.0, 10, 20和50 μmol/L的MPA溶液对Cu2+的响应2的影响。结果表明,当MPA溶液的浓度为20 μmol/L时,100 nmol/L Cu2+产生吸光度差比值明显高于其它浓度。故选用20 μmol/L MPA用于Cu2+检测。
3.2.3孵育时间的影响将100 nmol/L Cu2+与MPA分别孵育10, 20, 30, 40, 50和60 min。结果表明,当100 nmol/L Cu2+与MPA孵育10 min时,即可产生较高的吸光度差比值。孵育时间延长到20 min时,
所得吸光度差比值仅略有升高。孵育30~60 min,所得吸光度差比值缓慢下降。故选择将Cu2+与MPA孵育10 min用于Cu2+检测。
3.3Cu2+检测的标准曲线
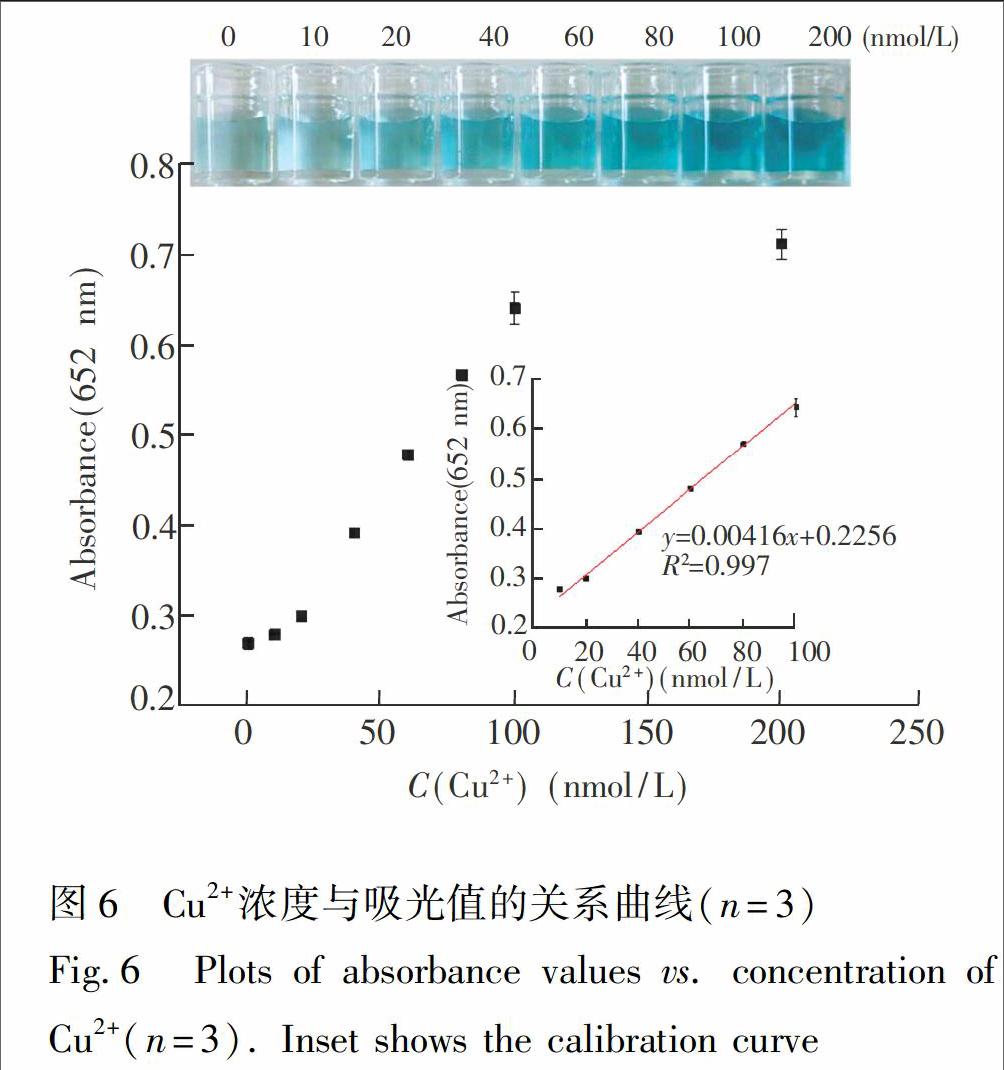
在上述优化反应条件下,应用Ag/Pt NCs检测Cu2+,以Cu2+
浓度作为横坐标,以吸光值作为纵坐标,绘制标准曲线。如图6所示,Cu2+浓度在10~100 nmol/L范围内与吸光值呈良好的线性关系(R2=0.997), 方法的检出限为5.0 nmol/L (3σ)。 与其它纳米比色检测方法相比,本方法在灵敏度和特异性方面具有优势(及表1)。
3.4特异性分析
选择常见金属离子Hg2+, Mn2+, Sr2+, Zn2+, Fe3+, Co2+, Cr2+, Ag+, Ni2+, Cd2+, Al3+, Ba2+和Pb2+, 考察本方法检测Cu2+的特异性。
上述金属离子的浓度均为10 μmol/L时,对本方法检测Cu2+(100 nmol/L)的影响如图7所示,高浓度的其它金属离子(10 μmol/L)与低浓度的Cu2+(100 nmol/L)相比,响应显著更低。因此,将Ag/Pt NCs模拟酶应用于Cu2+比色检测具有良好的特异性。
3.5样品加标回收实验
取实验室自来水、蠡湖湖水(无锡)及河水(校内),分别经0.22 μm滤膜过滤,采用上述比色方法检测(平行3次),结果表明,上述样品中Cu2+浓度分别为(29.6±1.1) nmol/L,(48.5±1.6) nmol/L和(76.4±3.7) nmol/L。同时,采用石墨炉原子吸收光度法(GFAAS)检测上述样品(n=3),其中Cu2+的浓度分别为(30.6±0.5) nmol/L,(47.0±0.6) nmol/L和(78.5 ±2.2) nmol/L。本方法与GFAAS测试结果的偏差小于5%。
上述结果表明,本方法检测Cu2+具有操作简单、灵敏度高、特异性好、成本低等优点,有望应用于环境和食品等领域中的Cu2+的检测。
References
1Wang S S, Wang X K, Zhang Z Y, Chen L X. Colloid Surf. A, 2015, 468: 333-338
2Zhang M, Ye B C. Analyst, 2011, 136(24): 5139-5142
3Valko M, Jomova K, Rhodes C J, Kuc〖KG-2ˇa K, Musílek K. Arch. Toxicol., 2016, 90(1): 1-37
4Amberger M A, Barth P, Frster O, Broekaert J A C. Microchim. Acta, 2011, 172(3): 261-267
5Qing Z, Mao Z, Qing T, He X, Zou Z, He D. Anal. Chem., 2014, 86(22): 11263-11268
6Djedjibegovic J, Larssen T, Skrbo A, Marjanovic〖KG-2ˇ A, Sober M. Food Chem., 2012, 131(2): 469-476
7Kopylovich M N, Mahmudov K T, Pombeiro A J L. J. Hazard. Mater., 2011, 186(23): 1154-1162
8Qiu S, Gao S, Zhu X, Lin Z, Qiu B, Chen G. Analyst, 2011, 136(8): 1580-1585
9Qiao Y, Zheng X. Analyst, 2015, 140(24): 8186-8193
10WANG JiaJia, LIAN Man, XIONG Jie, LI ZaiJun. Chinese J. Anal. Chem., 2016, 44(3): 367-376
王佳佳, 連 曼, 熊 杰, 李在均. 分析化学, 2016, 44(3): 367-376
11Deng H H, Li G W, Liu A L, Chen W, Lin X H, Xia X H. Microchim. Acta, 2014, 181(9): 911-916
12Hua C, Zhang W H, De Almeida S R M, Ciampi S, Gloria D, Liu G. Analyst, 2012, 137(1): 82-86
13Sener G, Uzun L, Denizli A. Anal. Chem., 2014, 86(1): 514-520
14Lien C W, Chen Y C, Chang H T, Huang C C. Nanoscale, 2013, 5(17): 8227-8234
15Long Y J, Li Y F, Liu Y, Zheng J J, Tang J, Huang C Z. Chem. Commun., 2011, 47(43): 11939-11941
16Lien C W, Tseng Y T, Huang C C, Chang H T. Anal. Chem., 2014, 86(4): 2065-2072
17Ni P, Dai H, Wang Y, Sun Y, Shi Y, Hu J, Li Z. Biosens. Bioelectron., 2014, 60: 286-291
18Lin X Q, Deng H H, Wu G W, Peng H P, Liu A L, Lin X H. Analyst, 2015, 140(15): 5251-5256
19Gao Z, Xu M, Lu M, Chen G, Tang D. Biosens. Bioelectron., 2015, 70: 194-201
20Zheng C, Zheng A X, Liu B, Zhang X L, He Y, Li J, Yang H H, Chen G N. Chem. Commun., 2014, 50(86): 13103-13106
21Wu L L, Wang L Y, Xie Z J, Xue F, Peng C F. RSC Adv., 2016, 6(79): 75384-75389
22Wu L L, Wang L Y, Xie Z J, Pan N, Peng C F. Sens. Actuator B, 2016, 235: 110-116
23Bernardi F, Traverse A, Olivi L, Alves MCM, Morais J. J. Phys. Chem. C, 2011, 115(25): 12243-12249
24Fei S, Chen J, Yao S, Deng G, He D, Kuang Y. Anal. Biochem., 2005, 339(1): 29-35
25Pecci L, Montefoschi G, Musci G, Cavallini D. Amino Acids, 1997, 13(3): 355-367
26Tharmaraj V, Yang J. Analyst, 2014, 139(23): 6304-6309
27Liu R, Chen Z, Wang S, Qu C, Chen L, Wang Z. Talanta, 2013, 112: 37-42
28Yuan X, Chen Y. Analyst, 2012, 137(19): 4516-4523
29Mehta V N, Kumar M A, Kailasa S K. Indust. Engineer. Chem. Res., 2013, 52(12): 4414-4420
30Ma Y R, Niu H Y, Zhang X L, Cai Y Q. Chem. Commun., 2011, 47(47): 12643-12645
31Shen Q, Li W, Tang S, Hu Y, Nie Z, Huang Y, Yao S. Biosens. Bioelectron., 2013, 41: 663-668
AbstractA sensitive colorimetric method for the detection of copper ions (Cu2+) was developed based on the surface modification of silver/platinum nanoclusters (Ag/Pt NCs) and regulation of peroxidaselike activity. It was found that 3mercaptopropionic acid (MPA) could inhibit the catalytic ability of Ag/Pt NCs; however, it lost the inhibition toward catalytic ability of Ag/Pt NCs after oxidized by oxygen through the catalysis of Cu2+. On the basis of this, a colorimetric method was developed for the detection of Cu2+ through measuring the colorimetric signal variation of the TMBH2O2 reaction. This method exhibited high sensitivity and selectivity toward Cu2+ over a panel of other metal ions. The linear range was 10-100 nmol/L and the detection limit was 5.0 nmol/L (3σ). The above method was also applied to detect real water samples and spiked samples, and the results demonstrated that this method was simple with low cost.
KeywordsSilver/platinum nanoclusters; Colorimetric detection; 3Mercaptopropionic acid; Copper ions
(Received 21 September 2016; accepted 21 November 2016)
This work was supported by the National Natural Science Foundation of China (No.31371767) and the Key Projects in the National Science & Technology Pillar Program during the Twelfth Fiveyear Plan Period (No.2015BAD17B02).

