持续糖监测系统在兔低血糖模型中的应用评估
郑 一, 王 楠
(民航总医院重症医学科,北京 100123)
研究报告
持续糖监测系统在兔低血糖模型中的应用评估
郑 一, 王 楠
(民航总医院重症医学科,北京 100123)
目的 建立兔低血糖模型,并评估皮下持续糖监测系统(CGMS)在低血糖监测时的准确性和及时性。方法 选用雌性新西兰大耳白兔16只,随机分为4组,每组4只。对照组为持续静脉注射生理盐水,实验组动物持续静脉注射胰岛素,根据剂量不同分为胰岛素0.1 U/(kg·h)组(RI=0.1 U组)、胰岛素0.2 U/(kg·h)组(RI=0.2 U组)和胰岛素0.4 U/(kg·h)组(RI=0.4 U组)。试验期间实施监测CGMS 240 min,间隔30 min采集耳缘静脉血,由手持血糖测定仪监测血糖(BG监测值)。结果 研究期间共获得CGMS监测数据1296个,与CGMS时间匹配的BG监测数据136个。应用胰岛素后BG和CGMS均明显降低, RI=0.1U组BG和CGMS降低速度分别为每分钟0.016和0.017 mmol/L; RI=0.2U组分别为每分钟0.04和0.027 mmol/L;RI=0.4 U组分别为每分钟0.049和0.032 mmol/L。按照BG监测值是否低于4.4 mmol/L将BG-CGMS配对数据分为低血糖和正常血糖两类。低血糖时BG-CGMS的平均偏差为0.55 mmol/L(上下限:-0.98~2.08 mmol/L),绝对差值百分率(RAD)为40.2%±45.2%;正常血糖时的BG-CGMS平均偏差为-0.19 mmol/L(上下限:-1.38~1.00 mmol/L),RAD为5.8%±5.3%。误差栅格分析(EGA)显示A区占比为93.4%,B区为0.7%,D区为5.9%,且D区均分布于BG低CGMS高的区域。结论 本研究结果提示,当血糖降低速度增快时,CGMS出现明显的滞后现象,当血糖降低至4.4 mmol/L以下时,CGMS存在高估血糖的危险。CGMS临床应用时应充分考虑这种危险。
持续糖监测系统;低血糖;胰岛素
血糖控制是危重症医学研究的热点问题之一,实时准确的血糖监测具有重要的临床意义[1, 2]。持续糖监测系统(continuous glucose monitoring system, CGMS)是一种以葡萄糖氧化酶电极测定皮下组织间液的糖浓度来反应患者血糖变化的技术,特点是可床旁实施,且为持续监测[3]。我们前期研究发现,皮下CGMS在ICU患者血糖监测中有一定的应用价值[4],但是研究群体并未包括低血糖患者。由于低血糖在ICU患者中的发生率较低,很难通过临床试验验证CGMS在监测低血糖时的准确性。因此本研究通过静脉持续注射胰岛素的方法建立兔低血糖模型,并将CGMS用于监测血糖下降过程中的实时变化,目的在于明确CGMS在监测血糖快速降低时的敏感性和准确性,为CGMS的进一步临床应用提供基本数据资料。
1 材料和方法
1.1 材料
实验动物:雌性新西兰大耳白兔【SCXK(京)2013-0004】,9~12月龄,体重为2.2~4.0 kg,由医院中心动物实验室负责喂养。本研究方案经首都医科大学附属北京天坛医院伦理委员会批准后实施。实验研究环境条件符合中国国家标准《实验动物环境及设施》(GB14925-2010)对屏障动物实验设施的有关标准,动物饲养管理和动物实验操作符合《北京市实验动物管理条例》等法规的要求【SYXK(京)2013-0009】。
1.2 方法
1.2.1 CGMS监测
应用国产雷兰动态血糖监测系统(CGMS)监测系统(圣美迪诺医疗科技有限公司,浙江)进行皮下组织间液糖浓度监测。该系统包括一次性传感器(针形电极)、显示器和数据下载软件三部分。动物备皮后,于两侧肩胛骨之间以2%盐酸利多卡因(山东华鲁制药有限公司,H37023472)局部浸润注射麻醉,做一3 cm长皮肤切口,钝性分离皮下组织,将CGMS监测电极植入,缝合皮肤,加压包扎固定。CGMS采用葡萄糖氧化酶法测定皮下组织间液糖浓度,每11.25 s采集一次数据,3 min刷新一次(16个数据的平均值),显示于显示器。葡萄糖浓度的测定范围为1.7~25.0 mmol/L。CGMS电极读取的是皮下组织间液的电流强度,电极植入后需经3 h的极化期。取兔耳缘静脉血标本,应用手持式POC快速血糖仪(美国强生医疗器械有限公司生产,SureStep,SN:CNDSQN84)测定血糖(BG)浓度,输入CGMS监测仪进行校正后,CGMS监测正式开始读取数据。CGMS电极使用期限为72 h,本实验电极使用时间均在有限期内。研究期间,实验人员每30 min查看电极植入情况,包括是否存在出血、过敏、感染和电极脱落等情况。CGMS监测仪自动检测电极工作状态,当出现电极不稳定时报警提示,表现为电流持续低于30 mA或检测曲线中断。当出现以上情况时拔除电极,终止实验,并废除该例实验数据。
1.2.2 兔低血糖模型的建立
应用胰岛素(江苏万邦生化医药有限公司,批号:国药H1089001)静脉持续注射的方法建立兔低血糖模型。将26 G一次性静脉留置套管(美国BD公司生产,Intima 2012/3151074)置入兔耳缘静脉,并妥善固定。生理盐水稀释胰岛素至不同浓度,按公斤体重匀速静脉泵入(德国贝朗公司生产注射器泵:Perfusor Compact S)。每30 min取对侧耳缘静脉血标本,手持式POC快速血糖仪测定BG浓度。当POC血糖浓度降低至2.1 mmol/L时,停止胰岛素泵入,更换为同等容量的生理盐水,维持液体输入量组间同等。
1.2.3 研究分组
将16只兔随机分为4组,每组4只:对照组为生理盐水静脉持续注射(无胰岛素),10 mL/h;胰岛素静脉持续注射剂量为0.1 U/(kg·h)(RI=0.1 U组);胰岛素静脉持续注射剂量为0.2 U/(kg·h)(RI=0.2 U组);胰岛素静脉持续注射剂量为0.4 U/(kg·h)(RI=0.4 U组)。
1.2.4 试验流程及数据采集
CGMS电极植入,完成极化期并进行首次血糖校正后开始试验。采集耳缘静脉血标本,应用手持式POC快速血糖仪测定BG浓度,记录CGMS监测仪显示的时间,并开始生理盐水(对照组)或胰岛素(试验组)静脉持续注射。之后每30 min测定一次耳缘静脉BG浓度,直到试验药物开始注射后240 min。当CGMS监测的糖浓度变化较前一个时间点超过10%时,增加一次耳缘静脉BG浓度测定。每次采集耳缘静脉血标本时,均记录CGMS监测仪显示的时间。试验结束后将CGMS数据下载至电脑,生成MS Excel文件,并将耳缘静脉BG测定值按照CGMS记录时间进行对照。
1.3 统计学处理
应用SPSS 17.0统计软件包统计学分析,数据以均数±标准差表示,不同时间点和不同试验组别CGMS和BG监测值间比较采用重复测量的方差分析。一致性检验采用Bland-Altman分析,应用Matlab R2011a软件(Mathworks中国分公司)进行Clarke误差栅格分析(EGA),P< 0.05为差异有显著性。
2 结果
2.1 实验动物基本情况
平均胰岛素注射时间在不同胰岛素剂量组间存在显著性差异(表1),0.4 U和0.2 U组的胰岛素注射时间明显低于0.1 U剂量组。胰岛素剂量为0.2 U和0.4 U组均有实验动物抽搐发生,表现为全身抖动、四肢反常伸直和头部后仰。胰岛素剂量为0.2 U组为2只动物,分别在胰岛素注射后126 min和129 min发生。0.4 U组所有动物均发生抽搐,分别在胰岛素注射后114 min、123 min、132 min和153 min发生。抽搐发生后,实验动物血管收缩,无法采集耳缘静脉血液标本。
2.2 CGMS和BG监测值随时间的变化趋势
表2显示了不同时间点CGMS、BG以及两者间差值在不同时间点的数据。对照组:CGMS在不同时点间的差异有显著性(P=0.021),240 min时的CGMS监测值显著低于30 min和90 min时;BG监测值(P=0.076)和CGMS-BG差值(P=0.901)在不同时点间差异无显著性。RI=0.1组:CGMS和BG监测值在不同时点间的差异有显著性(P< 0.001),随着胰岛素的应用,CGMS和BG监测值均明显降低;CGMS-BG差值在不同时点间差异无显著性(P=0.701)。RI=0.2组:CGMS和BG监测值在不同时点间的差异有显著性(P< 0.001),随着胰岛素的应用CGMS和BG监测值均明显降低;CGMS-BG差值在不同时点间差异无显著性(P=0.231)。RI=0.4组:CGMS和BG监测值在不同时点间的差异有显著性(P< 0.001),随着胰岛素的应用CGMS和BG均明显降低;CGMS-BG差值在不同时点间的差异有显著性(P=0.024),胰岛素应用90min后的CGMS-BG差值明显高于之前的水平。
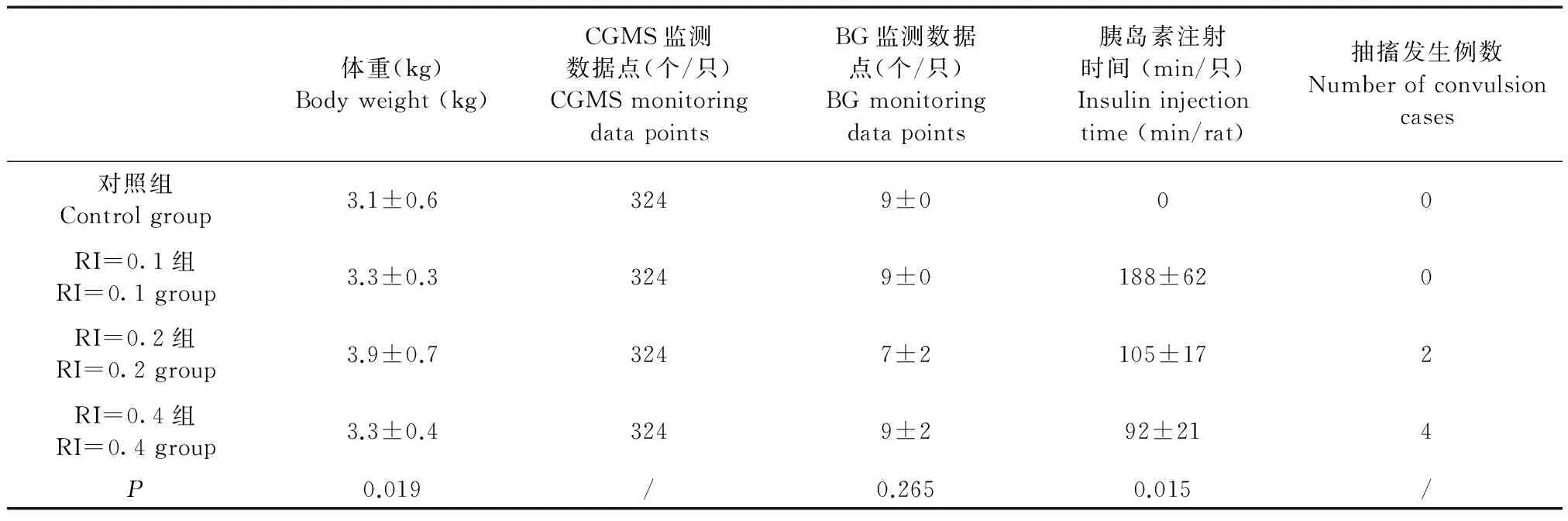
表1 实验动物基本情况(n=4)
对于相同时点不同组别间的差异,CGMS监测值在胰岛素开始注射时即刻和持续注射30 min时差异无显著性(P分别为0.848和0.413),持续注射60 min后的所有时点3个胰岛素剂量组的CGMS监测值均低于对照组(P值在0.002至< 0.001之间)。BG监测值显示了相似的特点,在胰岛素开始注射时即刻和持续注射30 min时差异无显著性(P分别为0.338和0.064),持续注射60 min后的所有时点3个胰岛素剂量组的BG监测值均低于对照组(P值均< 0.001),胰岛素注射90至150 min期间,BG水平均表现为(RI=0.2组和RI=0.4组)高于(RI=0.1组)高于对照组。由于数据缺失,180 min之后BG监测值差异未进行两两比较。不同胰岛素剂量组别的CGMS-BG差值,仅在胰岛素注射后120 min时间点差异有显著性(P=0.028),RI=0.2组和RI=0.4组高于RI=0.1组和对照组。
2.3 不同BG下降速度时的CGMS滞后时间
如表3所示,胰岛素剂量为0.1 U/(kg·h)时,CGMS发现低血糖的时间略有提前。而当胰岛素剂量增加到0.2~0.4 U/(kg·h)时,CGMS在发现BG降低至4.4 mmol/L的时间滞后6~16 min,发现BG降低至2.1 mmol/L的时间滞后29~43 min。
2.4 Bland-Altman及EGA分析
Bland-Altman分析如图1,BG监测值低于4.4 mmol/L时,平均偏差为0.55 mmol/L,上下限为-0.98~2.08 mmol/L,AD为0.7 ± 0.6 mmol/L,RAD为40.2% ± 45.2%(RAD最高为209%)。当BG监测值高于4.4 mmol/L时,平均偏差为-0.19 mmol/L,上下限为-1.38~1.00 mmol/L,AD为0.4±0.3 mmol/L,RAD为5.8% ± 5.3%(RAD最高为20%)。图2显示了EGA分析,A区占比为93.4%,B区为0.7%,D区为5.9%。且D区均分布于BG低CGMS高的区域。
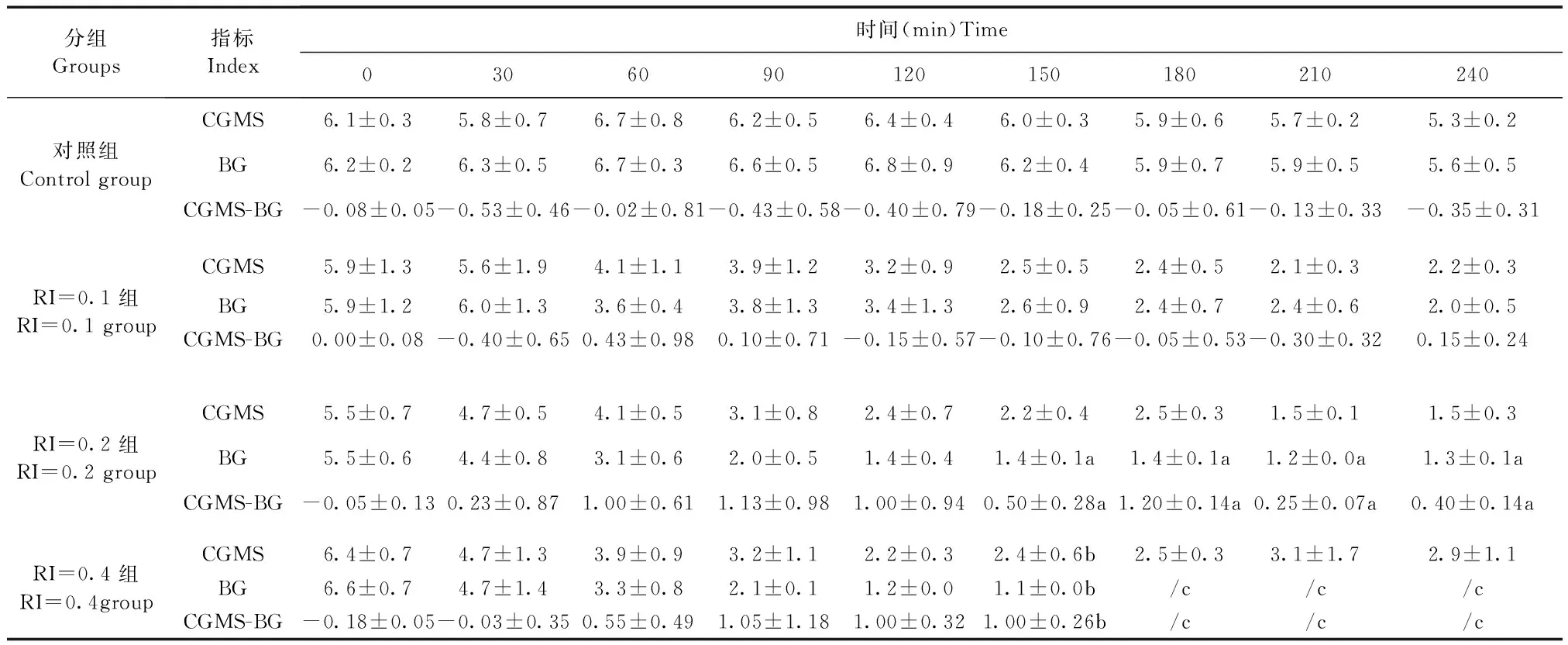
表2 不同时点持续糖监测(CGMS)、血糖(BG)及两者间的差值(n=4,CGMS-BG)
注:糖浓度单位为mmol/L。RI:胰岛素,剂量单位为U/kg/h;CGMS:持续糖监测系统;BG:血糖;CGMS-BG:两者间差值。a:n=2;b:n=3;c:癫痫、未采集血液标本。
Note. The unit of blood glucose concentration is mmol/L.The dosage unit of insulin is U/kg/h; CGMS: continuous glucose monitoring system;BG: blood glucose; CGMS-BG: Difference between them. a:n=2; b:n=3; c: Epilepsy, blood samples were not collected.

表3 不同BG下降速度时的CGMS滞后时间(n=4, min)
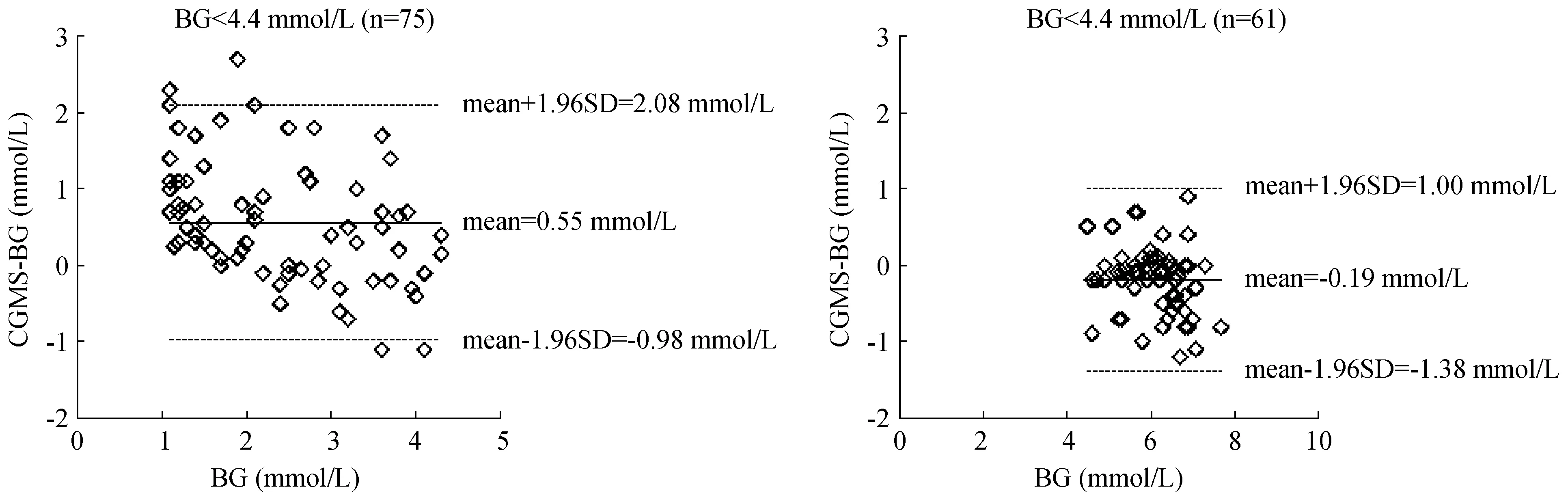
注:横坐标为耳缘静脉血糖测定值(BG),纵坐标为CGMS与BG间差值(CGMS-BG)。图中显示了平均偏差(mean)及其上下限。图1 Bland-Altman分析Note.The horizontal axis is the value of ear vein blood glucose (BG). The vertical axis is the difference between CGMS and BG (CGMS-BG). The figure shows the mean average deviation and its upper and lower limits.Fig.1 Bland-Altman analysis
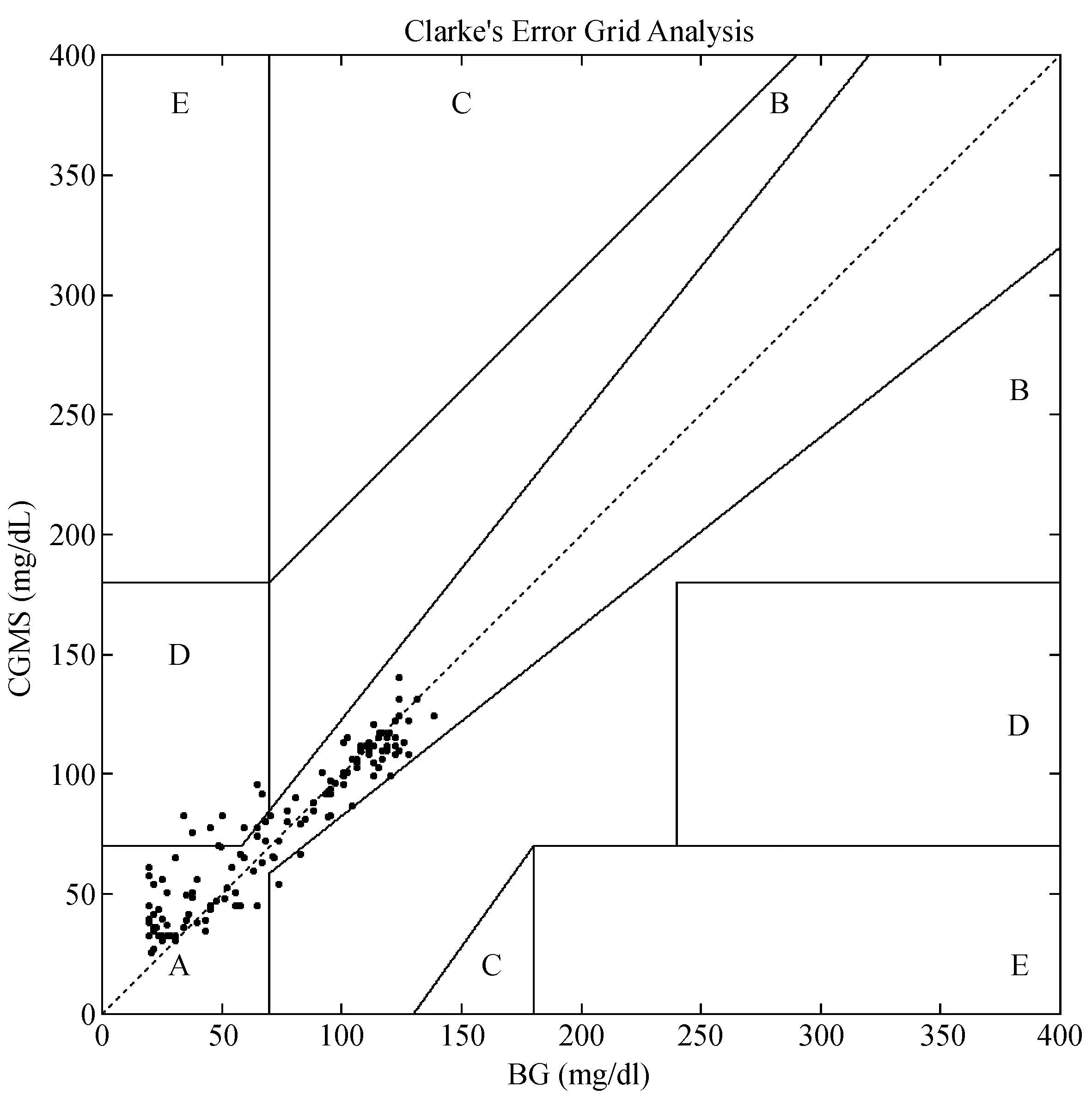
注:横坐标为BG监测值,纵坐标为CGMS监测值。图4 图EGA分析Note.The horizontal axis indicates BG monitoring values, and the vertical axis indicates CGMS monitoring values.Fig.4 EGA analysis
3 讨论
本研究以兔为试验对象,模拟了强化胰岛素治疗导致低血糖的临床过程,并验证了CGMS在监测低血糖时的准确性和及时性。研究结果提示,当血糖以较快速度降低时,CGMS出现明显的滞后现象。
近年来的研究发现,胰岛素控制血糖过程中的低血糖和血糖变异度也是导致不良转归的重要危险因素[5-7]。及时准确地发现低血糖事件也是CGMS的潜在应用前景之一,CGMS引入临床后,已经有一些研究验证了这项监测技术在ICU危重患者及妊娠期糖尿病中的准确性[3,8]。对于正常血糖和高血糖水平,按照国际标准化组织(ISO)的标准,即待检验技术与金标准(实验室检测)血糖绝对差值百分率(RAD)在20%以内,CGMS的准确性能够达到90%以上[9]。我们前期的研究也提示,当血糖在正常水平和高水平时,以实验室测定结果作为金标准,CGMS的RAD为14.4%,且每次校正后6 h内数据的RAD进一步降低至8.8%[4]。但是临床上低血糖的发生率较低,CGMS在低血糖水平中的准确性难以通过大样本的对照研究加以验证。Gómez等[10]通过将CGSM应用于33例接受胰岛素泵治疗的1型和2型糖尿病患者,共收集到2262对YSI-CGMS配对数据值,绝对差值的相对数的中位数(RAD)为20.1%,其中23%血糖水平低于75 mg/dL,64.9%的CBG值符合ISO血糖仪检测标准,Clarke误差栅格分析显示91.77%位于A区和B区(低血糖约为75.6%)。Jacobs等[11]的研究纳入了具有糖尿病史的ICU患者,仍然以指尖毛细血管血标本糖浓度为标准,在发生的12次低血糖事件中(血糖低于75 mg/dL),只有1次CGMS与血糖间相对差值小于5%,5次绝对差值小于15 mg/dL。Lee等[12]研究了CGMS在急诊室危重患者的应用,在CGMS监测的同时,每小时采集毛细血管血测定血糖,获得122个配对的数据,其中包括3次血糖低于70 mg/dL,RAD为47%。本研究以静脉血POC血糖值(BG)为标准,共获得136对配对数据。按照BG是否低于4.4 mmol/L区分为低血糖和正常血糖两个水平,发现低血糖时的平均偏差增高(0.55 mmol/L),偏差上下限增宽(-0.98~2.08 mmol/L),AD(0.7 mmol/L)和RAD(40.2%)增大。EGA分析显示,D区占比为5.9%,且均分布于BG低CGMS高的区域。这些结果提示,低血糖时CGMS存在高估血糖的趋势,这种监测结果将对患者构成十分严重的危险。
我们在研究中采用胰岛素持续静脉注射的方法模拟了临床胰岛素治疗的过程,目的是观察不同胰岛素注射速度是否造成不同的血糖降低速度,同时评价CGMS监测在发现低血糖时的及时性。到目前为止,CGMS在异常血糖动物模型中应用的相关资料较少。早期在研发CGMS监测电极的试验中采用了试验动物兔,静脉注射葡萄糖溶液造成高血糖,但是研究的主要目的在于明确葡萄糖氧化电极电流与不同血糖浓度的相关性[13]。Mori等[14]将CGMS应用于糖尿病狗模型,每天两次胰岛素静脉单次注射,比较了糖水平在日夜间的变异度。本研究采用0.1~0.4 U/(kg·h)胰岛素持续静脉注射,成功模拟出血糖逐渐降低的状态。当给予0.1 U/(kg·h)胰岛素时,POC测定的BG值和CGMS监测值在实施试验的240分钟呈现线性下降的趋势,BG和CGMS的下降速度几乎相同,分别为0.016和0.017 mmol/L/min。随着胰岛素剂量的增加,BG下降速度也加快,在0.2和0.4 U/(kg·h)组分别为0.04和0.049 mmol/L/min。更为重要的是,本研究发现当BG下降速度加快时,CGMS监测值出现明显的滞后现象。我们以BG等于4.4 mmol/L为低血糖界值,2.1 mmol/L为威胁生命的低血糖界值,根据回归方程,可以计算出CGMS相对于BG的滞后时间。胰岛素剂量为0.1 U/(kg·h)时,CGMS发现低血糖的时间略有提前。而当胰岛素剂量增加到0.2~0.4U/(kg·h)时,CGMS在发现BG降低至4.4 mmol/L的时间滞后6~16 min,发现BG降低至2.1 mmol/L的时间滞后29~43 min。
需要考虑的是,尽管本研究发现血糖以较快速度降低时CGMS出现明显的滞后现象,但是ICU患者多接受胰岛素持续静脉注射,应用CGMS作为低血糖预警,可能仍然有一定的临床意义。比如,临床实际操作中是否可以将CGMS低血糖报警限提高,当报警发生时观察CGMS变化趋势并进行其他血糖监测。2010年的一项随机对照研究将ICU患者的胰岛素剂量调整方法分为依照CGMS和传统单次血标本测定两组,虽然两组在平均血糖浓度和血糖控制在110 mg/dL的百分率无显著性差异,但发现CGMS组患者严重低血糖(血糖浓度低于40 mg/dL)发生率明显降低(1.6% vs 11.5%)[15]。王辰等[16]通过一项荟萃分析发现在危重症强化胰岛素治疗过程中,CGMS虽然在保持血糖于理想水平方面比较传统间断血糖监测(IGM)未见明显优势,但应用CGMS可明显减少低血糖事件的发生率。
总之,本研究建立了兔胰岛素持续静脉注射的低血糖模型,并验证了CGMS在低血糖监测时的准确性和及时性。研究结果提示,当血糖降低速度增快时,CGMS出现明显的滞后现象,当血糖降低至4.4 mmol/L以下时,CGMS存在高估血糖的危险。CGMS临床应用时应充分考虑这种危险,当出现血糖开始出现下降时,及时观察血糖变化趋势,并采用其他监测手段明确血糖实际水平。
[1] Sato J, Kanazawa A, Ikeda F, et al. Effect of treatment guidance using a retrospective continuous glucose monitoring system on glycaemic control in outpatients with type 2 diabetes mellitus: A randomized controlled trial [J]. J Int Med Res, 2016, 44(1): 109-121.
[2] Ma Z, Chen R, Liu Y, et al. Effect of liraglutide vs. NPH in combination with metformin on blood glucose fluctuations assessed using continuous glucose monitoring in patients with newly diagnosed type 2 diabetes [J]. Int J Clin Pharmacol Ther, 2015, 53(11): 933-939.
[3] Lane JE, Shivers JP, Zisser H. Continuous glucose monitors: current status and future developments [J]. Curr Opin Endocrinol Diabetes Obes 2013, 20: 106-111.
[4] Yue XY, Zheng Y, Cai YH, et al. Real-time continuous glucose monitoring shows high accuracy within 6 hours after sensor calibration: a prospective study [J]. Plos One 2013, 8: e60070.
[5] 史春虹,季阳阳,白然,等. 实时动态胰岛素泵与“双C”方案对血糖控制不佳的2型糖尿病患者的疗效对比[J]. 中华医学杂志, 2015, 95(24): 1930-1933.
[6] Dell’Aquila AM, Ellger B. Perioperative glycemic control: what is worth the effort ? Curr Opin Anaesthesiol, 2013, 26: 438-443.
[7] Yeoh E, Choudhary P, Nwokolo M, et al. Interventions that restore awareness of hypoglycemia in adults with type 1 diabetes: A systematic review and meta-analysis[J]. Diabetes Care, 2015, 38(8): 1592-1609.
[8] 宋依临,杨慧霞. 动态血糖监测和自我血糖监测在妊娠合并糖尿病患者血糖监测中的临床价值[J]. 中华妇产科杂志, 2014, 49(8): 579-583.
[9] Brunner R, Kitzberger R, Miehsler W, et al. Accuracy and reliability of a subcutaneous continuous glucose-monitoring system in critically ill patients [J]. Crit Care Med, 2011, 39: 659-664.
[10] Gomez A M, Marin S A, Munoz O M, et al. Numerical and clinical precision of continuous glucose monitoring in Colombian patients treated with insulin infusion pump with automated suspension in hypoglycemia[J]. Endocrinol Nutr, 2015, 62(10): 485-492.
[11] Jacobs B, Phan K, Bertheau L, et al. Continuous glucose monitoring system in a rural intensive care unit: a pilot study evaluating accuracy and acceptance [J]. J Diabetes Sci Technol 2010, 4: 636-644.
[12] Lee JH, Kim K, Jo YH, et al. Feasibility of continuous glucose monitoring in critically ill emergency department patients [J]. J Emerg Med, 2012, 43: 251-257.
[13] Johnson KW, Mastrototaro JJ, Howey DC, et al. In vivo evaluation of an electroenzymatic glucose sensor implanted in subcutaneous tissue [J]. Biosens Bioelectron, 1992, 7: 709-714.
[14] Mori A, Kurishima M, Oda H, et al. Comparison of glucose fluctuations between day- and night-time measured using a continuous glucose monitoring system in diabetic dogs [J]. J Vet Med Sci, 2013, 75: 113-117.
[15] Holzinger U, Miehsler W, Warszawska J, et al. Real-time continuous glucose monitoring in critically ill patients. A prospective randomized trial [J]. Diabetes Care, 2010, 33: 467-472.
[16] 王辰,朱宇清,帅学军. 实时动态血糖监测系统在危重症胰岛素强化治疗中作用的荟萃分析[J]. 中华急诊医学杂志, 2015, 24(3): 320-324.
Evaluation of the value of application of continuous glucose monitoring system in a rabbit model of hypoglycemia
ZHENG Yi,WANG Nan
(Department of ICU, Civil Aviation General Hospital, Beijing 100123, China)
Objective To establish a rabbit model of hypoglycemia and evaluate the accuracy and timeliness of hypoglycemia monitoring by continuous glucose monitoring system (CGMS). Methods Sixteen female New Zealand white rabbits were randomly divided into 4 groups, with 4 rabbits in each group. The rabbits in the control group were given intravenous infusion of saline. The animals in the experimental group were infused with insulin continuously, which were divided into 0.1 U/kg/h insulin group (RI=0.1 U group), 0.2 U/kg/h insulin (RI=0.2 U group) group and 0.4 U/kg/h insulin group (RI=0.4 U group) accordingly. During the experiment, CGMS was monitored for 240 min. Blood samples were collected at a 30-minute interval and the blood glucose level was measured by a hand glucose meter. Results A total of 1296 CGMS monitoring data were obtained during the study period, and 136 BG monitoring data matched with CGMS time were obtained. After the insulin administration, BG and CGMS were significantly decreased. The reduction rates of BG and CGMS were 0.016 and 0.017 mmol/L/min in the RI=0.1 U insulin group, 0.04 and 0.027 mmol/L/min in the RI=0.2U insulin group, and 0.049 and 0.032 mmol/L/min in the RI=0.4 U group. According to whether BG monitoring value was lower than 4.4 mmol/L, the BG-CGMS paring data were divided into hypoglycemia and normoglycemia. In hypoglycemia, the average deviation of BG-CGMS was 0.55 mmol/L (the upper and lower limits were -0.98 and 2.08 mmol/L, respectively) and the absolute difference percentage (RAD) was 40.2% ± 45.2%. The mean deviation of BG-CGMS in normal blood glucose was -0.19 mmol/L (upper and lower limits were -1.38 and 1.00 mmol/L, respectively) and 5.8% ± 5.3% in RAD. The error grid analysis (EGA) showed that the proportion of zone A was 93.4%, 0.7% in zone B, and 5.9% in zone D, and the zone D was distributed in area of low BG and high CGMS. Conclusions The results of this study indicate that CGMS has a significant hysteresis phenomenon when blood glucose is reduced rapidly. When the blood glucose levels fall below 4.4 mmol/L, CGMS may have a risk of overestimating blood glucose. Such risk should be fully considered during CGMS clinical application.
Continuous glucose monitoring system; Hypoglycemia; Insulin
郑一(1975)副主任医师,主要研究方向神经危重症,血糖监测。E-mail:jmqf04@163.com
R-33
A
1671-7856(2017) 03-0068-07
10.3969.j.issn.1671-7856. 2017.03.013
2016-08-25

