黄蜀葵花黄酮抗氧化性及对DNA氧化损伤的保护作用
黎 望 孙培冬 季晓彤 路 帅
(1. 江南大学食品胶体与生物技术教育部重点实验室,江苏 无锡 214122;2. 江南大学化学与材料工程学院,江苏 无锡 214122)
黄蜀葵花黄酮抗氧化性及对DNA氧化损伤的保护作用
黎 望1,2孙培冬1,2季晓彤1,2路 帅1,2
(1. 江南大学食品胶体与生物技术教育部重点实验室,江苏 无锡 214122;2. 江南大学化学与材料工程学院,江苏 无锡 214122)
采用石油醚、乙酸乙酯和正丁醇对黄蜀葵花乙醇提取物进行分级萃取,得到石油醚相、乙酸乙酯相、正丁醇相和水相4个不同极性成分。采用DPPH·清除、·OH清除和H2O2清除试验考察了其抗氧化活性,研究了正丁醇相对·OH 和H2O2诱导DNA氧化损伤的保护作用,并利用HPLC—MS对正丁醇中黄酮类物质进行了鉴定。结果表明:黄蜀葵花黄酮主要富集于乙酸乙酯相和正丁醇相;乙酸乙酯相对DPPH·的清除能力最好,IC50值为0.038 6 mg/mL,而正丁醇相对·OH和H2O2的清除能力较好,IC50值分别为0.225 0, 0.575 7 mg/mL;正丁醇相对·OH和H2O2诱导的DNA氧化损伤都有保护作用;正丁醇相中含有11种黄酮类化合物。
黄蜀葵花;黄酮;萃取相;抗氧化活性;DNA氧化损伤
自由基是人体生物反应中产生的一类代谢产物,正常情况下处于动态平衡,但由于大气污染、紫外线照射以及不良生活习惯等因素,常使人体内自由基过剩,从而引发DNA氧化损伤,导致衰老和各种疾病。大量研究[1-3]表明,黄酮类化合物具有较强的抗氧化作用,能够通过多种方式有效地清除自由基,从而预防、治疗疾病,减缓人体衰老等。而天然抗氧化剂的应用在食品、医药和化妆品行业日益凸显其优势。
黄蜀葵花为锦葵科秋葵属植物黄蜀葵的干燥花。黄蜀葵花含有黄酮类、还原糖类、鞣质、长链烃类化合物、多糖类化合物以及其他化学成分[4],其中黄酮类化合物为黄蜀葵花主要活性成分。研究表明黄蜀葵花黄酮具有降血糖[5]、改善肾纤维化[6]、保护心肌损伤[7]和促进血管新生[8]等生物活性,但有关黄蜀葵花黄酮对DNA氧化损伤的保护作用尚未见报道。
本研究拟利用不同极性溶剂对黄蜀葵花乙醇提取物进行分级萃取,得到不同极性部位,并通过清除DPPH·、·OH 和H2O2试验进行抗氧化活性筛选,对活性较好的部位进行·OH和H2O2诱导的DNA氧化损伤的研究,并对该组分的黄酮类物质进行鉴定,为黄蜀葵花黄酮的药用机理研究提供理论依据。
1 材料与方法
1.1 材料与试剂
黄蜀葵花:产地河南,购自亳州市芝春堂药材采购站;
芦丁标准品:纯度≥98%,上海源叶生物科技有限公司;
质粒pBR322 DNA:宝生物工程有限公司;
Goldview染料:上海宝曼生物科技有限公司;
DPPH(1,1-二苯基苦酰基苯肼):美国Sigma公司;
其他试剂:分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
电子天平:ME203E型,美国Mettler-Toledo公司;
超声波清洗仪:KH-100B型,昆山禾创超声仪器有限公司;
恒温水浴锅:HH-S2型,上海亚荣生化仪器厂;
旋转蒸发仪:RE-5203型,上海亚荣生化仪器厂;
循环水式真空泵:SHB-Ⅲ型,郑州长城科工贸有限公司;
双光束紫外可见分光光度计:U-1901型,北京普析通用仪器有限公司;
荧光分光光度计:Cary Esclipse型,美国Varian公司。
1.3 试验方法
1.3.1 黄蜀葵花黄酮样品的制备 称取黄蜀葵花粉末,用60%乙醇以1∶20(g/mL)的料液比在50 ℃下超声提取30 min,抽滤,将滤液减压浓缩得浸膏。将浸膏冷冻干燥得黄蜀葵花粗提物(ACF),再将其用适量水分散,依次用石油醚、乙酸乙酯、正丁醇进行少量多次的萃取,直至萃取相颜色较浅,将各相浓缩除尽溶剂后,干燥得到石油醚相(AFP)、乙酸乙酯相(AFE)、正丁醇相(AFB)和水相(AFW) 4部分萃取相固体,测各相得率及黄酮含量。将各萃取相均用水超声溶解,并配制成不同浓度样品备用。
(1)
式中:
Y——得率,%;
M1——各萃取相质量,g;
M0——粗提取物质量,g。
1.3.2 黄酮含量的测定 以芦丁为标准品,采用NaNO2—Al(NO3)3—NaOH法[9]得到标准曲线A=11.645 71C-0.003 04(R2=0.999 7)。将各萃取相配制成相应浓度,分别测定其吸光度,根据式(2)计算黄酮含量。
(2)
式中:
X——黄酮含量,mg/g;
C——稀释后样品溶液黄酮浓度,mg/mL;
N——稀释倍数;
V——体积,mL;
M——样品质量,g。
1.3.3 黄蜀葵花各萃取相对DPPH·清除能力测定 参考文献[10],在10 mL离心管中加入1 mL不同浓度的萃取相溶液和4 mL 0.04 mg/mL的DPPH溶液,混合均匀,室温下避光反应30 min,在520 nm处测定吸光度,以Vc为阳性对照。
(3)
式中:
S1——DPPH清除率,%;
A1——1 mL萃取相溶液+4 mL DPPH溶液的吸光度;
A2——1 mL萃取相溶液+4 mL乙醇的吸光度;
A0——1 mL H2O+4 mL DPPH溶液的吸光度。
1.3.4 黄蜀葵花各萃取相对·OH清除能力测定 参考文献[11],在10 mL离心管中依次加入1 mL 0.75 mmol/L邻二氮菲溶液、2 mL磷酸缓冲溶液(pH=7.4)、1 mL 0.75 mmol/L 的FeSO4溶液、1 mL不同浓度萃取相溶液,最后加入1 mL 0.01% H2O2,振荡摇匀,在37 ℃下水浴1 h,于510 nm处测吸光度,以Vc为阳性对照。
(4)
式中:
S2——·OH清除率,%;
A1——1 mL邻二氮菲+2 mL磷酸缓冲溶液+1 mL FeSO4+1 mL H2O+1 mL H2O2的吸光度;
A2——1 mL邻二氮菲+2 mL磷酸缓冲溶液+1 mL FeSO4+1 mL萃取相溶液+1 mL H2O2的吸光度;
A3——1 mL邻二氮菲+2 mL磷酸缓冲溶液+1 mL FeSO4+2 mL H2O的吸光度。
1.3.5 黄蜀葵花各萃取相对H2O2清除能力测定 参考文献[12],在10 mL离心管中加入40 mmol/L H2O2磷酸缓冲溶液(pH=7.4)0.5 mL,萃取相溶液0.5 mL,用PBS(pH=7.4)稀释到8 mL,混匀,静置反应15 min,在230 nm处测其吸光度。
(5)
式中:
S3——H2O2清除率,%;
A1——0.5 mL H2O2+0.5 mL萃取相溶液+7 mL PBS的吸光度;
A2——0.5 mL萃取相溶液+7.5 mL PBS的吸光度;
A0——0.5 mL H2O2+7.5 mL PBS的吸光度。
1.3.6 黄蜀葵花正丁醇相对·OH诱导DNA氧化损伤的保护作用 参考文献[13],在微量荧光比色皿中依次加入1 μL 100 ng/μL DNA、10 μL 0.1 mol/L (NH4)2Fe(SO4)2溶液、10 μL 0.17 mol/L的EDTA-2Na溶液、10 μL 0.015% H2O2溶液、10 μL 10 mg/mL VC溶液、10 μL AFB溶液、40 μL 1×TE缓冲溶液及0.5 μL Goldview染料,混匀后静置5 min,荧光测定条件为:狭缝Ex=5 nm,Em=10 nm,在激发波长486 nm下扫描500~700 nm范围内的荧光强度。
1.3.7 黄蜀葵花正丁醇相对H2O2诱导DNA氧化损伤的保护作用 参考文献[14],在微量荧光比色皿中依次加入1 μL DNA、1 μL 30% H2O2溶液,5 μL待测AFB溶液,95 μL 1×TE缓冲溶液以及0.5 μL Goldview溶液,混匀后放置10 min,再置于紫外灯下照射10 min,荧光测定条件同1.3.6。
1.3.8 黄蜀葵花正丁醇相的HPLC—MS解析 AFB用甲醇溶解,进行HPLC—MS分析。液相色谱条件:BEH C18柱(2.1 mm×100 mm,1.7 μm);流动相:乙腈—0.1%甲酸;梯度洗脱,流速:0.3 mL/min;柱温:45 ℃;进样量:5 μL;记录200~400 nm紫外光谱。质谱条件:负离子模式;检测范围(m/z):100~1 000;毛细管电压:3.5 kV;锥孔电压:30 V;离子源温度:100 ℃;脱溶剂温度:400.0 ℃;脱溶剂气流量:700 L/h;喷雾气流量:50 L/h;检测电压:1 800 V。
2 结果与分析
2.1 各萃取相得率及黄酮含量
由表1可知,经萃取后水相的得率达到67.39%,但黄酮含量仅仅是113.9 mg/g,而乙酸乙酯相和正丁醇相中的黄酮含量分别达到491.24,417.68 mg/g。

表1 不同极性部位得率及总黄酮含量Table 1 The yield and content of flavonoid in different phase
2.2 黄蜀葵花各萃取相对DPPH·的清除能力
由图1可知,各萃取相和VC清除DPPH·的能力随着质量浓度的增大而增强,且呈现量效关系。当质量浓度为0.18 mg/mL时,AFE 和AFB的清除率分别为95.233%,87.25%,而AFP和AFW对DPPH·的清除率低于50%。4个萃取相中AFE的清除能力最好,接近VC的清除能力。

图1 各萃取相对DPPH·的清除作用Figure 1 Scavenging effect of extracts on free radical DPPH·
2.3 黄蜀葵花各萃取相对·OH的清除能力
由图2可知,各萃取相对·OH的清除率随着质量浓度的增大而增强。AFB和AFE对·OH的清除能力高于AFP和AFW。当样品质量浓度达到0.4 mg/mL时,AFB和AFE对·OH的清除率均高于95%,AFW的清除率为56.33%,而AFP对·OH的清除率不足50%,表明 AFB和AFE有较强的清除·OH的能力。
2.4 黄蜀葵花各萃取相对H2O2的清除能力
由图3可知,在测定的质量浓度范围内,随着质量浓度的增大,各萃取相对H2O2的清除能力也增强。当质量浓度为1.0 mg/mL时,AFP和AFW的清除率比较低,而AFE和AFB的清除率接近90%,AFE和AFB的IC50值分别为0.628 5,0.575 7 mg/mL。
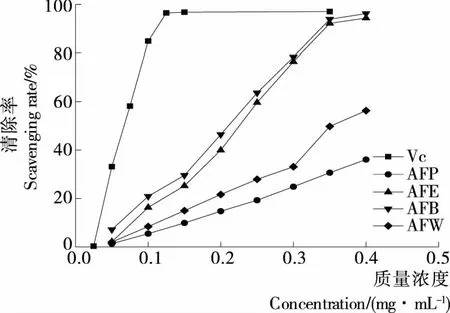
图2 各萃取相对·OH的清除作用Figure 2 Scavenging effect of extracts on free radical ·OH
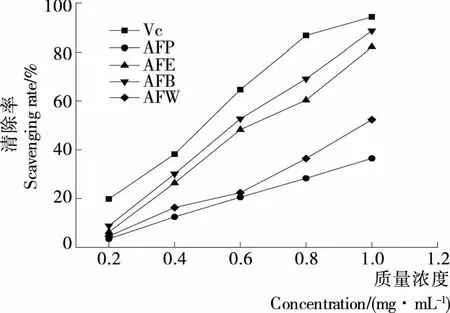
图3 各萃取相对H2O2的清除能力Figure 3 The scavenging activity of extracts on H2O2
2.5 AFB对·OH诱导的DNA氧化损伤的保护作用
由图4可知,Goldview-DNA在波长532 nm左右有最大发射光谱,在没有·OH氧化损伤DNA时,其荧光强度为258.836 8 a.u.;引入·OH后,DNA的双螺旋结构遭到破坏,影响DNA和染料Goldview之间的能量传递,导致体系荧光强度降低,此时荧光强度为61.324 7 a.u.。由图5可知,加入AFB溶液后,荧光强度增强,说明样品溶液的存在减弱了·OH对DNA 的氧化损伤程度。AFB浓度低于0.12 mg/mL时,随着样品溶液质量浓度的增加,其荧光强度增强,即对DNA氧化损伤的保护作用增强,当浓度超过0.12 mg/mL时,对DNA氧化损伤的保护作用随着AFB浓度的增加而减弱。出现此现象的原因是:质量浓度低时,AFB主要用于消除体系中·OH,从而抑制DNA的氧化损伤;而浓度过高时,AFB除了清除·OH,还能与DNA发生相互作用,削弱了体系的荧光强度。
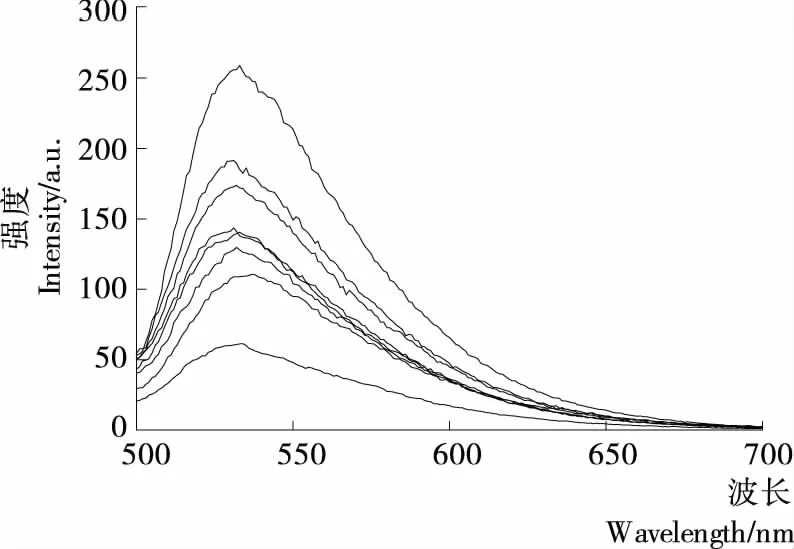
图4 AFB对·OH诱导的DNA氧化损伤的保护作用Figure 4 Protection of AFB on ·OH-induced oxidative DNA damage

图5 不同质量浓度时AFB体系的最大荧光强度Figure 5 The maximum fluorescence intensity of AFB system at different concentration
2.6 AFB对H2O2诱导DNA氧化损伤的抑制作用
由图6、7可知,在该试验条件下,Goldview-DNA在波长532 nm左右有最大发射光谱,没有H2O2氧化损伤DNA时,其荧光强度为278.10 a.u.;引入H2O2后,其荧光强度降至91.521 a.u.,表明H2O2的加入使DNA氧化损伤。加入AFB之后,体系的荧光强度也发生了变化。AFB质量浓度低于0.12 mg/mL,体系的荧光强度随着浓度的增加而增强;但浓度超过0.12 mg/mL后,体系的荧光强度就随浓度的增加而降低,但均大于仅被H2O2氧化损伤的荧光强度,即AFB对H2O2氧化损伤的DNA保护作用减弱,但对氧化损伤的DNA仍有保护作用,即AFB浓度在0.04~0.60 mg/mL时,对H2O2氧化损伤的DNA有保护作用。
2.7 AFB中黄酮类化合物结构鉴定
经过HPLC—MS分析,检测波长350 nm处的液相色谱图见图8,而相应的色谱峰对应的最大紫外吸收波长和质谱数据见表2,与相关的文献对照,推断鉴定出11个化合物。

图6 AFB对H2O2诱导的DNA氧化损伤的保护作用Figure 6 Protection of AFB on H2O2-induced oxidative DNA
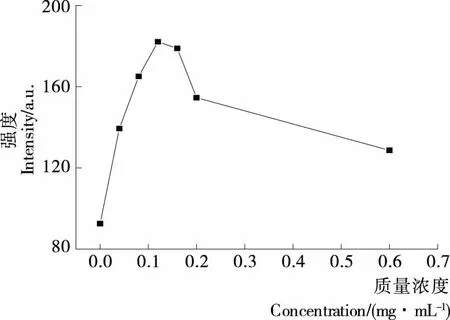
图7 不同质量浓度时AFB体系的最大荧光强度Figure 7 The maximum fluorescence intensity of AFB system at different concentration

图8 AFB在检测波长350 nm的色谱图Figure 8 Chromatogram of AFB at 350 nm
文献[15]表明,负离子模式下的黄酮苷类化合物有如下裂解规律:3’位糖苷主要丢失糖分子,只产生[苷元-H]-离子,不产生[苷元-2H]-离子;7位糖苷丢失糖分子,不仅产生[苷元-H]-,还能产生[苷元-2H]-离子,但后者强度明显低于前者;3位糖苷分别发生丢失糖分子和糖苷键均裂,同时产生[苷元-H]-和[苷元-2H]-离子,但后者强度高于前者。黄酮苷元为槲皮素的黄酮类化合物会产生m/z301或300离子;黄酮苷元为杨梅素和棉皮素的黄酮类化合物会产生317或316的离子,当同时有碎片离子峰195、167时为棉皮素。
表2中化合物1、5、6的分子离子峰都是m/z463,且都有碎片离子峰m/z301,300,表明苷元为槲皮素,而化合物5、6中m/z300的碎片峰强于m/z301的碎片峰,表明这两种化合物中糖苷为3取代[15],而化合物1则相反,表明糖苷为7取代,在根据各物质的出峰时间,参考文献[16],推测1、5、6依次为槲皮素-7-O-葡萄糖苷、异槲皮素、金丝桃苷。化合物2的分子离子峰为m/z493,且有碎片离子峰m/z317,表明苷元为杨梅素或槲皮素,同时有碎片m/z195和167,则苷元为棉皮素,参考文献[16],推测该化合物为棉皮苷。化合物3的[M-H]-为505,其分子量为506,碎片离子峰m/z463,301与文献[17]一致,推测为乙酰化金丝桃苷。化合物4、10、11分子离子峰都是m/z479,推测其分子量为480,都有碎片离子峰317,参考文献[16]推测其依次为杨梅素-3’-O-葡萄糖、杨梅素-3-O-葡萄糖、杨梅素-3-O-半乳糖。化合物7、8的分子离子峰为m/z609,且都有m/z301、300的碎片离子峰,参考文献[16],推测这两种物质分别为槲皮素3-O-半乳糖基鼠李糖、芦丁。化合物9的分子离子峰为m/z595,则分子量为596,由文献[16]可知,该化合物为槲皮素-3-O-葡萄糖基阿拉伯糖苷。

表2 HPLC分离化合物的质谱数据Table 2 Mass Spectrum data of compounds separated by HPLC
3 结论
黄蜀葵花粗提物经不同极性的溶剂萃取后,得到4个萃取相,黄酮富集于乙酸乙酯相和正丁醇相。抗氧化活性的研究表明乙酸乙酯相和正丁醇相的抗氧化性优于石油醚相和水相,这与两相中总黄酮含量存在量效关系。其中乙酸乙酯相对DPPH·的清除能力最佳,清除率最高达95.23%,IC50值为0.038 6 mg/mL;而正丁醇相对·OH和H2O2的清除能力最好,清除率最高分别为96.21%和88.62%,IC50值分别为0.225 0 mg/mL和0.575 7 mg/mL。选取正丁醇相进行DNA氧化损伤的研究,结果表明在0.04~0.60 mg/mL时,AFB对·OH和H2O2诱导的DNA氧化损伤都有保护作用,当质量浓度为0.12 mg/mL时,对DNA损伤的保护作用最强。通过HPLC—MS鉴定了正丁醇相中的11种黄酮类化合物。综上所述,黄蜀葵花黄酮具有较好的抗氧化活性,同时对DNA的氧化损伤也有较为显著的保护作用,且初步鉴定正丁醇相中的11种黄酮类化合物。本研究可为黄蜀葵花总黄酮在化妆品、食品和医药等领域的开发提供理论依据,但黄蜀葵花黄酮保护DNA氧化损伤的机理还有待进一步研究。
[1] 唐春红. 天然防腐剂与抗氧化剂[M]. 北京: 中国轻工业出版社, 2010: 182.
[2] 涂宗财, 傅志丰, 王辉, 等. 红薯叶不同溶剂提取物抗氧化性及活性成分鉴定[J]. 食品科学, 2015, 36(17): 1-6.
[3] 吴秋敏, 苏平, 刘芸. 黄酮的抗氧化性和促氧化性研究进展[J]. 食品工业科技, 2014, 35(24): 379-383.
[4] 周雷. 黄蜀葵花总黄酮研究进展[J]. 辽宁中医药大学学报, 2012, 14(6): 42-44.
[5] 陈刚. 黄蜀葵花的化学成分和降糖活性研究[D]. 北京: 中国人民解放军军事医学科学院, 2006: 43-47.
[6] 尹莲芳. 黄蜀葵花对肾病大鼠尿排泄的影响及其作用机制[J]. 河北医科大学学报, 2003, 24(6): 328-330.
[7] 范丽, 郭岩, 陈志武, 等. 黄蜀葵花总黄酮对小鼠急性心肌缺血缺氧损伤的保护作用[J]. 中国药房, 2005, 16(3): 176-178.
[8] 潘武, 蒋萌. 黄蜀葵花总黄酮对人脐静脉血管内皮细胞形成新生血管的影响[J]. 徐州医学院学报, 2010, 30(6): 359-361.
[9] 贾霖, 黄国清, 肖军霞. 金银花中黄酮类化合物的提取工艺[J]. 食品研究与开发, 2013, 34(9): 41-43.
[10] 王丹, 翟梅枝, 毛光瑞, 等. 核桃花粉提取物的抗氧化性研究[J]. 食品工业科技, 2014, 35(16): 137-139.
[11] 孙鲜明, 李小方, 邓瑞雪, 等. 流苏花总黄酮超声提取工艺及抗氧化活性研究[J]. 食品工业科技, 2015, 36(16): 266-272.
[12] 张溢, 孙培冬, 陈桂冰, 等. 芡实多糖的提取、抗氧化活性及对质粒DNA氧化损伤防护作用的研究[J]. 食品工业科技, 2015, 36(11): 122-126.
[13] 赵金莲, 曾佑伟, 李宽, 等. 荧光光谱法分析花茶对羟基自由基(·OH)诱导的DNA氧化损伤的保护作用[J]. 华南师范大学学报: 自然科学版, 2010(3): 92-97.
[14] YANG Xu, LV Yuan-ping. Purification, characterization, and DNA damage protection of active components from Tartary Buckwheat (Fagopyrumtataricum) hull[J]. Food Sci Biotechnol, 2015, 24(6): 1 959-1 966.
[15] 阿布拉江·克依木. 黄酮苷类天然产物的质谱分析方法研究[D]. 北京: 中国协和医科大学, 2006: 71.
[16] 池玉梅, 朱华云, 居羚, 等. 高效液相—四极杆飞行时间串联质谱分析黄蜀葵花中黄酮醇类化合物[J]. 分析化学, 2009, 37(2): 227-231.
[17] 吴桂梅. 罗布麻叶中黄酮类化合物的分离提取及抗氧化、抗抑郁活性的研究[D]. 长春: 长春师范学院, 2011: 38-39.
The antioxidant activities and protection on DNA oxidative damage of flavonoid from the flowers ofAbelmoschusmanihot
LI Wang1,2SUNPei-dong1,2JIXiao-tong1,2LUShuai1,2
(1.MinistryofEducation,SchoolofChemicalandMaterialEngineering,JiangnanUniversity,Wuxi,Jiangsu214122,China;2.TheKeyLaboratoryofFoodColloidsandBiotechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China)
The ethanol extracts of flowers fromAbelmoschusmanihotwas extracted by petroleum ether、ethyl acetate and n-butyl alcohol, and four different polar portions were obtained. The scavenging effect of different phases on DPPH·, ·OH and H2O2were studied to research the antioxidant activities of each phase. Moreover, the protection of n-butyl alcohol phase on DNA oxidative damage was also studied, and the flavonoids component was identified by HPLC-MS. The results showed that the ethyl acetate phase had the best scavenging effect on DPPH·, withIC50value 0.038 6 mg/mL. However, the n-butyl alcohol phase had scavenge ·OH and H2O2best, and theIC50values were 0.225 0 and 0.575 7 mg/mL, respectively. The n-butyl alcohol phase was proved to show protective effect in some degree on DNA oxidative damage., and totally 11 kinds of flavonoids were found in the n-butyl alcohol phase.
Abelmoschusmanihotflower; flavonoids; extracts; antioxidant activity; DNA oxidative damage
黎望,女,江南大学在读硕士研究生。
孙培冬(1967-),女,江南大学副教授,硕士。 E-mail: sunpeidong2004@126.com
2016—12—22
10.13652/j.issn.1003-5788.2017.02.029

