若尔盖湿地保护区黑颈鹤巢期及影响因子
蒋政权,李凤山,冉江洪,刘 伟,赵晨皓,张 波,李 华
1 四川大学生命科学学院生物资源与生态环境教育部重点实验室,成都 610064 2 广西师范大学历史文化与旅游学院,桂林 541004 3 国际鹤类基金会,美国威斯康辛巴拉布市 53913 4 四川若尔盖县湿地保护区管理局区,若尔盖 624500
若尔盖湿地保护区黑颈鹤巢期及影响因子
蒋政权1,2,李凤山3,冉江洪1,*,刘 伟1,赵晨皓1,张 波1,李 华4
1 四川大学生命科学学院生物资源与生态环境教育部重点实验室,成都 610064 2 广西师范大学历史文化与旅游学院,桂林 541004 3 国际鹤类基金会,美国威斯康辛巴拉布市 53913 4 四川若尔盖县湿地保护区管理局区,若尔盖 624500
对鸟类巢期的研究不仅可以丰富鸟类繁殖生物学资料,也可为理解和研究鸟类的生态适应与进化提供重要线索和依据。2013—2014年3月份至7月份,在若尔盖湿地保护区及周边对55对繁殖黑颈鹤的营巢时长进行了研究,调查结果显示:黑颈鹤的营巢时长在0.5—40 d之间,平均巢期为(6.7±9.3) d;在其营造的4种巢型中,巢期长短依次为:泥堆巢>草堆巢>草墩巢>岛地巢,且差异性极显著(P<0.001),巢期与巢型显著相关(r=0.728);在其营巢的3种巢址生境中,巢期长短依次为:湖泊生境>沼泽生境>河流生境,且差异性极显著(P<0.001),巢期与巢址生境显著相关(r=0.315);从不同营巢月份看,巢期长短依次为:4月份巢>5月份巢>6月份巢,且差异性极显著(P<0.01),巢期与筑巢月份显著相关(r=0.664);巢期与巢体积大小具有显著相关性(r=0.856),即营巢时间越长巢体积越大。黑颈鹤的营巢时间长短主要受营巢生境、月份和做巢类型的影响。
黑颈鹤;巢期;若尔盖湿地保护区;繁殖生物学;筑巢行为
筑巢是绝大部分鸟类成功繁殖的一个必需环节[1- 3],很多鸟类花费相当多地时间和能量用于筑巢活动[4-5],其筑巢所需的时间即称为巢期[2]。巢期是衡量鸟类繁殖投入的重要指标之一[6-7],巢期的长短也反映了鸟类繁殖行为对环境变化的适应性[8]。鸟类巢期时间的长短受多种因素的影响,包括巢的体积(大小)和类型[2],巢材获取的难易程度[5]、繁殖鸟的筑巢能力和经验[9]、筑巢的季节[10-11]、亲鸟的健康程度[12]及雌雄鸟的分工[13]等。对巢期的研究不仅有助于增加鸟类繁殖生物学的知识,也可为理解和研究鸟类的生态适应与进化提供重要线索和依据[14-17]。
黑颈鹤(Grusnigricollis)为国家一级重点保护物种,野生种群为10000—10200[18],被IUCN列为全球性易危物种(VU)(IUCN,2011),是唯一仅在青藏高原繁殖的鹤种。黑颈鹤通常一年只繁殖1窝[19],其繁殖区位于地域边远、气候严酷的高原,加之其筑巢于人畜不易接近的水域沼泽,对其繁殖生态的相关研究很少[20]。黑颈鹤可在多种湿地生境做巢、做巢的形式有多种、而且做巢产卵的时间差异较大[19,21-25]。黑颈鹤在严酷的高寒湿地中生活,繁殖时间相对较短,其在繁殖期的能量投入及分配决定其当年的繁殖成功率,对其巢期的研究可以了解其在繁殖期的能量分配和繁殖策略。
2013—2014年的3—7月份,在四川若尔盖湿地保护区及周边对黑颈鹤的营巢时间进行了研究,目的是了解:(1)黑颈鹤不同生境巢的巢期长短;(2)黑颈鹤不同巢型的巢期的长短;(3)不同月份做巢黑颈鹤的巢期;(4)黑颈鹤巢期与巢体积的关系。进而了解影响黑颈鹤巢期的主要因子,为探讨黑颈鹤的繁殖策略和适应性研究提供参考。
1 研究地点
研究地点位于四川省北部若尔盖湿地国家级自然保护区(以下简称若尔盖湿地保护区)及周边,地理坐标33°18′—34°01′ N,102°30′—103°06′ E。若尔盖湿地保护区建于1994年,面积约16.66万hm2,是中国面积最大的高寒泥炭沼泽湿地——若尔盖湿地的核心区域。整个若尔盖湿地有黑颈鹤2635只[26],而占其面积[26]8.3%的若尔盖湿地保护区有黑颈鹤893只[27],占三分之一。主要由于在保护黑颈鹤上的重要地位,若尔盖湿地保护区于2008年列入国际重要湿地名录。
若尔盖湿地保护区属黄河水系,西面离黄河30 km。区内的主要河流是黑河及其支流达水曲。黑河从东南至西北纵贯全区,向北注入黄河。达水曲贯穿区内的核心部分,哈丘湖、措拉坚、花湖、措丘湖等,主要湖泊及其周围的沼泽都集中在达水曲流域。由于地面平坦低洼,水流不畅,形成大面积沼泽,有的地段人、畜皆不能通行,但为黑颈鹤等水生动物特别是水禽提供了良好的栖息场所。
研究区域平均海拔3450 m,属典型的大陆性高原寒温带湿润季风气候,年平均气温0.6 ℃—1.2 ℃,1月平均气温-10.7 ℃,7月平均气温10.9 ℃,全年平均降水量为660—750 mm, 5—10月份为雨季,降水量占全年90%。研究地植被为亚高山灌丛、亚高山草甸、沼泽草甸和沼泽植被等4 种类型,其中沼泽植被主要为木里苔草(Carexmuliensis)、毛果苔草(C.lasiocarpa)、乌拉苔草(C.meyeriana)、水甜茅(Glyceriamaxima)、藏嵩草(Kobresiatibetica)、睡菜(Menyanthestrifolia)等优势种形成的植物群落,其盖度可达40%—90%[28]。
2 方法
2.1 野外调查方法
黑颈鹤每年3月中下旬从越冬地陆续迁回到若尔盖湿地保护区,繁殖黑颈鹤从3月底开始陆续结成繁殖对,4月初开始筑巢并以巢为中心形成繁殖领域,营巢、产卵到育雏的繁殖期间均在繁殖领域活动。在若尔盖湿地保护区,黑颈鹤的营巢期为4—6月份,其中,4月份为营巢旺季[19,27]。
在若尔盖湿地保护区,黑颈鹤可在湖泊、河流和沼泽等3种湿地生境做巢繁殖,其中,湖泊生境由于明水体面积大且水位较深,藏狐、狼、狗等巢捕食者和牛羊等牲畜均不能进入,巢被捕食或被践踏的风险最小[19,25];沼泽生境由于水位较浅且草垛子遍布,藏狐、狼、狗等巢捕食者和牛羊等牲畜均能进入,巢被捕食或被践踏的风险较大;河流生境处于二者之间。

图1 黑颈鹤的4种巢型Fig.1 Types of Black-necked Crane nests at Ruoergai
根据巢所处的位置和结构,将黑颈鹤的巢分为4种类型:岛地巢、草墩巢、泥堆巢、草堆巢(图1)。岛地巢、草墩巢、泥堆巢与王有辉等[22]的划分标准相同,属于地面巢;草堆巢是由黑颈鹤在湖泊中的挺水草丛中衔枯草堆积而成的一个用于产卵和孵化的繁殖场所,由于有巢周的挺水植物固定和阻挡,巢不会随水流漂移。草堆巢与王有辉等[22]的草丛巢的主要区别在于:草堆巢是直接筑在水体中,并可在水面上下浮动的漂浮巢,巢材全为枯草,巢体的厚度通常在40 cm以上,属于水面浮巢;而草丛巢为架设在积水沼泽草丛上或稍高地块的草丛中的巢,巢材由枯草、倒伏的植被、带泥块的草根等组成,巢的厚度通常在10 cm以下,属于地面巢。
根据蒋政权等[27]、窦亮等[29]的研究观察结果,确定黑颈鹤繁殖对的分布,并对繁殖对逐一编号。每天乘车对研究区内的繁殖对调查一遍。到达可观察繁殖对的区域后,选择制高点,用单筒望远镜观察其筑巢行为,记录:开始筑巢日期、持续天数、开始筑巢时间、每天筑巢时长。当黑颈鹤产下首枚卵并离巢后,进入湿地找到巢,现场记录巢的类型、大小(巢长、巢宽、巢高)和巢址生境特征。
2.2 数据处理与分析
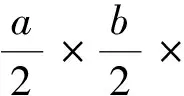
所有数据用SPSS19.0统计软件进行处理后进行单因素方差(one-way ANOVA)分析,如果结果具有显著性差异,对于2组以上的数据,再用Tukey HSD多重比较法进行两两比较,分析其差异性。用Spearman (T)相关系数r分析黑颈鹤巢期与巢的大小、巢型、筑巢生境及月份等的相关性。所有检验当P<0.05时视为差异显著,当P<0.01时视为差异极显著。
3 结果
黑颈鹤一般从7:00—9:00开始筑巢,每天筑巢4—6 h左右,筑巢时通常就近选取巢材,巢材以枯草、泥块或带泥的草本根茎为主,偶尔辅以人类丢弃的垃圾如塑料和纺织袋等对巢进行加固。黑颈鹤一般为雌雄共同进行筑巢,但有捕食者或牲畜、其它水鸟接近巢时,繁殖对通常会分出一只鹤驱逐入侵者,另一只鹤继续筑巢。
共记录到55个巢,其中草墩巢最多,为41个、岛地巢和泥堆巢均为5个、草堆巢4个。在3种营巢生境中,沼泽生境巢最多,为25个巢,湖泊与河流生境分别为17、13个巢。黑颈鹤巢期为(6.7±9.3) d(±SD),巢期最长的达40 d,巢期最短的只有0.5 d。
3.1 巢期与巢型的关系
在若尔盖湿地保护区黑颈鹤的4种巢型中,巢期长短依次为:泥堆巢>草堆巢>草墩巢>岛地巢(表1),其中泥堆巢的巢期最长,平均需要一个月的时间;岛地巢的巢期最短,平均不到一天。4类巢的巢期差异性极显著(P<0.001)。4类巢的巢期差异性的两两比较中,除岛地巢与草墩巢之间无显著性差异外(P=0.295),其它5组(岛地巢VS草堆巢、岛地巢VS泥堆巢、草堆巢VS草墩巢、草堆巢VS泥堆巢、草墩巢VS泥堆巢)比较结

表1 若尔盖黑颈鹤4种类型巢的巢期
果均表现为差异性极显著(P<0.001)。黑颈鹤的巢期与巢型的相关系数r=0.728(P<0.001),说明黑颈鹤的巢期与巢型显著相关。
3.2 巢期与巢址生境的关系
黑颈鹤的3种巢址生境中(所有巢型),湖泊生境的巢期最长,为(14.7±13.9)d(±SD,n=17);河流生境的巢期最短,为(3.0±1.7)d(±SD,n=13);沼泽生境居中,巢期为(3.2±1.3) d(±SD,n=25)。湖泊生境的巢期分别为河流生境、沼泽生境的4.9倍、4.6倍(表2)。3种生境巢的巢期差异性极显著(F=12.940;P<0.001)。在不同生境的两两比较中,湖泊生境与另2种生境(河流生境、沼泽生境)的巢期差异性极为显著(P<0.001),而河流生境与沼泽生境的巢期无明显差异(P=0.995)。黑颈鹤的巢期与做巢生境的相关系数r=0.315(P=0.019),说明在不区分巢型时,黑颈鹤的巢期与做巢生境显著相关。
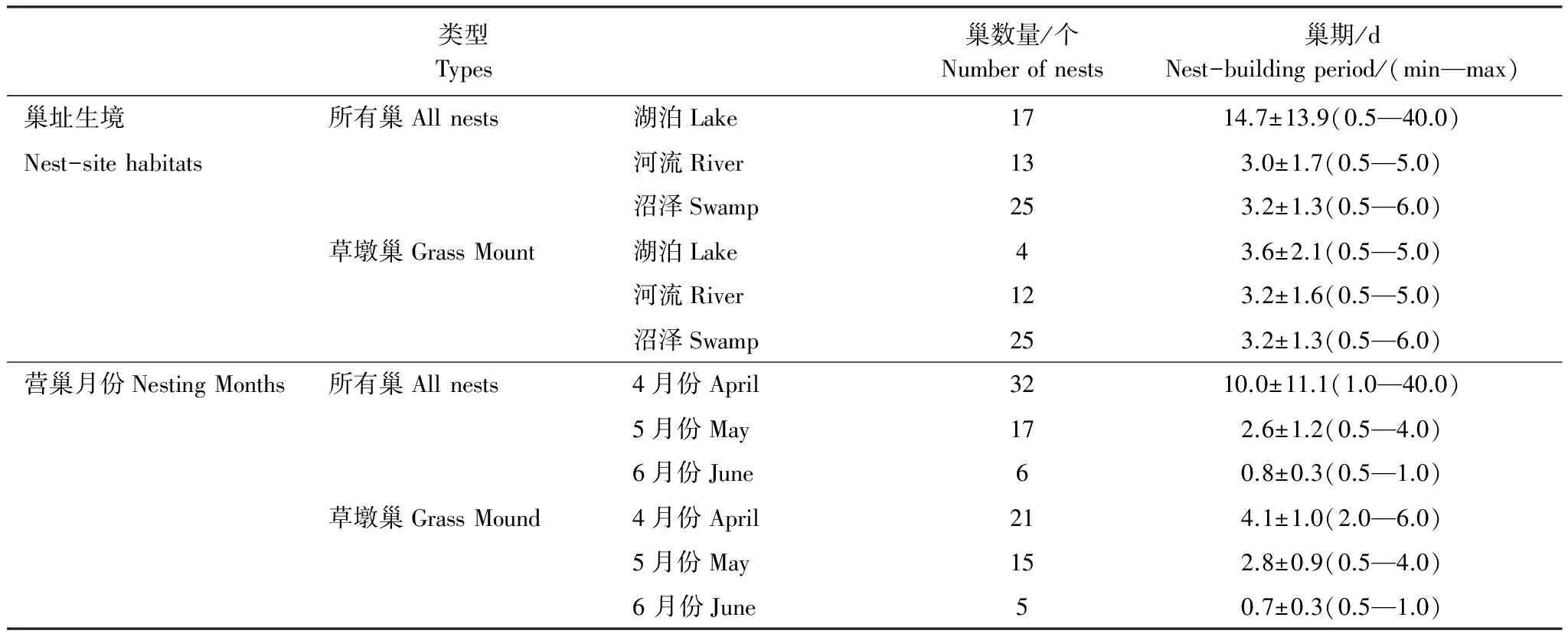
表2 若尔盖黑颈鹤不同生境和不同月份巢的巢期
在41个草墩巢中,湖泊生境的巢期最长,为(3.6±2.1)d(±SD,n=4);河流与沼泽两种生境的巢期相近,分别为(3.2±1.6)d(±SD,n=12)与(3.2±1.3) d(±SD,n=25)。3种生境草墩巢的巢期无显著性差异(F=0.155;P=0.857)。黑颈鹤草墩巢的巢期与做巢生境的相关系数r=0.083(P=0.608),说明黑颈鹤同一种巢型的巢期与做巢生境的相关性不显著。
3.3 巢期与筑巢月份的关系
在黑颈鹤的3个营巢月份中(所有巢型),4月巢的巢期最长,为(10.0±11.1) d(±SD,n=32);5月巢居中,巢期为(2.6±1.2) d(±SD,n=17);6月巢的巢期最短,为(0.8±0.3) d(±SD,n=6)(表2)。不同月份巢的巢期差异性极显著(F=5.133;P<0.01)。在不同月份巢的两两比较中,4月份巢与另2个月份(5月份、6月份)巢的巢期具有显著性差异(P<0.05),而5月份巢与6月份巢的巢期无的差异性不显著(P=0.908)。黑颈鹤的巢期与筑巢月份的相关系数r=0.664(P<0.001),说明黑颈鹤的巢期与筑巢月份显著相关。
黑颈鹤草墩巢的3个营巢月份中,4月份巢的巢期最长,为(4.1±1.0)d(±SD,n=21);5月份巢居中,巢期为(2.8±0.9)d(±SD,n=15);6月份巢的巢期最短,为(0.7±0.3) d(±SD,n=5)(表2)。不同月份草墩巢的巢期差异性极显著(F=32.088;P<0.001)。在不同月份巢的巢期差异性的两两比较中,3组(4月份巢 VS 5月份巢、4月份巢 VS 6月份巢、5月份巢 VS 6月份巢)比较均具有极显著的差异性(P<0.001)。黑颈鹤草墩巢的巢期与筑巢月份的相关系数r=0.733(P<0.001),说明黑颈鹤草墩巢(同一巢型)的巢期与筑巢月份显著相关。
3.4 巢期与巢体积的关系
监测到巢期的55个巢的巢体积为2261.9—719653.5 cm3,平均为(98531.4±140167.5) cm3(±SD);巢体积的个体差异性极大,体积最大的巢为最小的巢的318.2倍。体积最大的巢的巢期是体积最小巢的80倍。巢期与巢体积的相关系数r=0.856(P<0.001,n=55),说明黑颈鹤的巢期与巢体积显著正相关。
4 讨论
黑颈鹤的平均巢期为(6.7±9.3) d(±SD,n=55),要长于赤颈鹤(Grusantigoneantigone)2—3d的巢期[31],与苍鹭(ArdeacinereaLinnaeus)(7.6±1.1) d(±SD,n=5)[32]的巢期相当;比营洞巢为主的鹊鸲(Copsychussaularis)(13.7±3.6)d(±SD,n=5)[33]和栗喉蜂虎(Meropsphilippinus)(16.0±4.0) d(±SD,n=18)[34]的巢期更短,可能跟黑颈鹤的巢主要为简单堆积而成的地面巢,巢结构简单且雌雄共同参与筑巢有关。黑颈鹤的巢期幅度为0.5—40 d,与黑颈鸬鹚(Phalacrocoraxniger)10—14 d[35]、雀鹰(Accipiternisus)10—13 d[36]等巢期相比,黑颈鹤巢期的个体差异性更大,可能跟黑颈鹤的巢型更为丰富且不同巢型的巢体积和筑巢难度差异性较大相关。
Wysockietal.[10]的研究显示乌鸫(Turdusmerula)的巢期与巢大小正相关,越小的巢,巢期越短,反之亦然,因为更大的巢需要繁殖鸟花费更多地时间去收集和整理巢材,故建巢的时间(巢期)更长。黑颈鹤的巢期与巢体积(大小)显著正相关,越大的巢,其巢期也越长。
巢捕食对鸟类繁殖策略的形成起着一个决定性作用[37],在巢捕食威胁低的生境,鸟类往往采取增加当次繁殖投入的策略,将更多的时间用于筑巢[6];在巢捕食威胁高的生境,鸟类往往采取减少当次繁殖投入的策略(如更短的巢期),以便有更多的能量和时间用于再次筑巢[38-39]。Møller[40]与Hansell[41]的研究也表明鸟类巢期与繁殖生境的巢捕食威胁程度负相关,捕食威胁低的生境其巢期越长,反之亦然。黑颈鹤的3种巢址生境中,湖泊生境的巢捕食威胁程度要远远低于其它两种生境[19,25],湖泊生境的巢期明显长于河流生境和沼泽生境,且具有显著性差异。这也在一定程度上说明,湖泊生境鹤类受到天敌威胁较小,可以有更多的时间和能量用于筑巢。
鸟类在单次繁殖中为了最大程度地适应生境特征,亲鸟将资源和时间最佳地分配给繁殖的各个阶段,形成相应地繁殖策略[9-10]。Geupel和DeSante[42]的研究发现在高寒地区繁殖的鸟类,由于每年可用于繁殖的时间有限,为了确保各繁殖阶段均有足够的时间用于繁殖,其巢期的长短与繁殖鸟筑巢早晚相关,较早筑巢的繁殖鸟由于其拥有更长的繁殖周期,因此可以分配更多地时间用于筑巢阶段,故其巢期相对较长。本研究中黑颈鹤在3个筑巢月份的巢期长短依次为:4月份巢>5月份巢>6月份巢,不同月份巢之间存在显著性差异,并且巢期与筑巢早晚显著相关。黑颈鹤巢期的季节变化的主要原因有2个:首先,黑颈鹤采取了根据季节变化而调整筑巢类型的策略,在繁殖季节的早期(4月份),因为繁殖时间充裕,黑颈鹤更趋向于选择建巢期更长的泥堆巢和草堆巢,而在繁殖季节的晚期(6月份),黑颈鹤均选择巢期更短的草墩巢和岛地巢;其次,气温的季节变化导致对巢的保温功能的需求也相应变化,在若尔盖湿地保护区,4月份、5月份、6月份的月平均气温分别为-1.8℃、5.5℃、8.7℃[43],4月份至6月份期间随着气温的逐渐上升,黑颈鹤对巢的保温功能的要求也逐渐降低,其建的巢也相应地变薄变小,导致建巢工程量相应减少,故其巢期也相应变短。
张晓爱等[44]对高原雀形目鸟类筑巢特征的研究表明,鸟类的繁殖投入与它自身的能力相适应,一个阶段的投资增加,必然引起另一阶段投资减少,反之亦然。黑颈鹤在3种生境中筑巢时间的投入(即巢期)存在显著差异,湖泊生境的巢期显著长于另两种生境,哪么,湖泊生境黑颈鹤其它繁殖阶段(如孵化期的警戒行为或育雏期)的投入是否显著小于另两种生境是一个直得进一步研究的问题。
Mainwaring和Hartley[10]的研究发现雀类在营巢期用于筑巢的时间分配与用于觅食的时间分配之间处于一种平衡状态,当食物足够充分时,由于用于觅食的时间减少而用于筑巢活动的时间增加,即在一定程度上,巢期与食物的丰富程度成正相关。黑颈鹤的巢期长短与营巢期食物丰富程度之间的关系有待进一步研究。
管理建议:黑颈鹤筑巢期间对牲畜放牧尤为敏感,并且其巢期长,容易受影响。而目前若尔盖湿地保护区内部分区域在黑颈鹤做巢的最佳季节(4月份和5月份)仍在湿地放牧,导致本区域的黑颈鹤不得不推迟做巢时间,待牲畜放牧转移后才开始做巢繁殖,因此,建议若尔盖湿地保护区管理部门调整湿地的牲畜放牧时间,即在4—5月份期间,将有黑颈鹤做巢繁殖的湿地划为季节性禁牧区,以给黑颈鹤的做巢繁殖提供更好地繁殖生境。
致谢:感谢若尔盖湿地国家级自然保护区管理局、若尔盖花湖景区李奎经理及相关工作人员、参加野外调查的王彬、唐涛同学,感谢国际鹤类基金会的James Harris 先生和Elena Smirenski女士对写作的帮助。
[1] Mainwaring M C, Hartley I R, Lambrechts M M, Deeming D C. The design and function of birds’ nests. Ecology and Evolution, 2014, 4(20): 3909- 3928.
[2] 郑光美. 鸟类学(第2版). 北京: 北京师范大学出版社, 2012: 241- 255.
[3] Warning N, Benedict L. Paving the way: multifunctional nest architecture of the Rock Wren. The Auk, 2015, 132(1): 288- 299.
[4] Moreno J, Martínez J, Corral C, Lobato E, Merino S, Morales J, Martínez-De la Puente J, Tomás G. Nest construction rate and stress in female Pied FlycatchersFicedulahypoleuca. Acta Ornithologica, 2008, 43(1): 57- 64.
[5] Mainwaring M C, Hartley I R. The energetic costs of nest building in birds. Avian Biology Research, 2013, 6(1): 12- 17.
[7] Soler J J, Møller A P, Soler M. Nest building, sexual selection and parental investment. Evolutionary Ecology, 1998, 12(4): 427- 441.
[8] Berg M L, Beintema N H, Welbergen J A, Komdeur J. The functional significance of multiple nest-building in the Australian Reed WarblerAcrocephalusaustralis. Ibis, 2006, 148(3): 395- 404.
[9] Wysocki D, Jankowiak, Greo J L, Cichocka A, Sondej I, Michalska B. Factors affecting nest size in a population of BlackbirdsTurdusmerula. Bird Study, 2015, 62(2): 208- 216.
[10] Mainwaring M C, Hartley I R. Seasonal adjustments in nest cup lining in Blue TitsCyanistescaeruleus. Ardea, 2008, 96(2): 278- 282.
[11] Britt J, Deeming D C. First-egg date and air temperature affect nest construction in Blue TitsCyanistescaeruleusbut not in Great TitsParusmajor. Bird Study, 2011, 58(1): 78- 89.
[12] Tomás G, Merino S, Moreno J, Sanz J J, Morales J, García-Fraile S. Nest weight and female health in the Blue Tit (Cyanistescaeruleus). Auk, 2006, 123(4): 1013- 1021.
[13] 焦石, 姜云垒, 张立世, 李时, 王海涛, 高玮. 大山雀营巢期投入对繁殖功效的影响. 长春师范学院学报: 自然科学版, 2010, 29(2): 76- 79.
[14] Coleman R M, Gross M R, Sargent R C. Parental investment decision rules: a test in the bluegill sunfish. Behavioral Ecology and Sociobiology, 1985, 18(1): 59- 66.
[15] Rayadin Y, Saitoh T. Individual variation in nest size and nest site features of the bornean orangutans (Pongopygmaeus). American Journal of Primatology, 2009, 71(5): 393- 399.
[16] Moreno J, Lobato E, González-Braojos S, Ruiz-De Castaeda R. Nest construction costs affect nestling growth: a field experiment in a cavity-nesting passerine. Acta Ornithologica, 2010, 45(2): 139- 145.
[17] 王勇, 张正旺, 郑光美, 李建强, 徐基良, 马志军, Biancucci A L. 鸟类学研究: 过去二十年的回顾和对中国未来发展的建议. 生物多样性, 2012, 20(2): 119- 137.
[18] 李凤山. IUCN黑颈鹤保护行动计划. 动物学研究, 2014, 35(S1): 3- 9.
[19] 李筑眉, 李凤山. 黑颈鹤研究. 上海: 上海科技教育出版社, 2005: 28- 38.
[20] 马鸣, 李维东, 张会斌, 张翔, 袁国映, 陈莹, 袁磊, 丁鹏, 张宇, 程芸, 萨根古丽. 黑颈鹤在新疆罗布泊和昆仑山分布及种群状况. 动物学杂志, 2011, 46(3): 64- 68.
[21] 吕宗宝, 姚建初, 廖炎发. 黑颈鹤繁殖生态的观察. 动物学杂志, 1980, 15(1): 19- 24.
[22] 王有辉, 吴至康, 李筑眉, 李德浩, 周志军, 玛丽 安娜 比索普. 黑颈鹤巢、卵和雏鸟的观察. 贵州科学, 1989, 7(1): 50- 57.
[23] Dwyer N C, Bishop M A, Harkness J S, Zhong Z Y. Black-necked Cranes nesting in Tibet Autonomous Region, China // Proceedings of the 6th North American Crane Workshop. Regina, Saskatchewan, Canada, 1992, 6: 75- 80.
[24] Pfister O. The breeding ecology and conservation of the Black-necked Crane (Grusnigricollis) in Ladakh, India[D]. New Delhi: University of Hull, 1998: 1- 124.
[25] Wu H Q, Zha K, Zhang M, Yang X J. Nest site selection by black-necked craneGrusnigricollisin the Ruoergai Wetland, China. Bird Conservation International, 2009, 19(3): 277- 286.
[26] 刘强, 王凯, 李凤山, 孔德军, 杨晓君. 大若尔盖湿地黑颈鹤的数量和分布. 动物学研究, 2014, 35(S1): 134- 138.
[27] 蒋政权, 李凤山, 冉江洪, 张波, 王彬, 张曼, 李华. 四川若尔盖湿地国家级自然保护区黑颈鹤种群数量及繁殖. 动物学研究, 2014, 35(S1): 128- 133.
[28] 田应兵. 若尔盖高原湿地不同生境下植被类型及其分布规律. 长江大学学报: 自然版, 2005, 2(2): 1- 5.
[29] 窦亮, 李华, 李凤山, 张曼, 郑志荣, 冉江洪. 四川若尔盖湿地国家级自然保护区繁殖期黑颈鹤调查. 四川动物, 2013, 32(5): 770- 773.
[30] Vergara P, Gordo O, Aguirre J I. Nest size, nest building behaviour and breeding success in a species with nest reuse: the white storkCiconiaciconia. Annales Zoologici Fennici, 2010, 47(3): 184- 194.
[31] Mukherjee A, Soni V C, Borad C K, Parasharya B M. Nest and eggs of Sarus Crane (Grusantigoneantigonelinn.). Zoos’ Print Journal, 2000, 15(12): 375- 385.
[32] 高欣, 刘明玉. 苍鹭营巢习性的初步观察. 四川动物, 2002, 21(2): 96- 97.
[33] Bhatt D, Sethi V K, Kumar A, Singh A. Some notes on the breeding behaviour of the oriental magpie robin (Copsychussaularis) from Uttarakhand, India. Journal of Sustainability Science and Management, 2014, 9(1): 112- 119.
[34] 韩联宪, 程闯, 吴忠荣, 匡中帆. 栗喉蜂虎营巢行为与巢洞特征. 西南林业大学学报, 2012, 32(6): 73- 77.
[35] Joshi R P, Acharya C A, Senma R C. First record on breeding chronology of little cormorant,Phalacrocoraxnigerin Visnagar, north Gujarat. Asian Journal of Animal Science, 2010, 5(1): 17- 19.
[36] 田德雨, 杨潞潞, 张宝国, 徐珍萍. 山西省蟒河自然保护区雀鹰的繁殖. 山西林业科技, 2001, (3): 25- 26, 39- 39.
[37] Fontaine J J, Martin T E. Parent birds assess nest predation risk and adjust their reproductive strategies. Ecology Letters, 2006, 9(4): 428- 434.
[38] Slagsvold T. Clutch size variation of birds in relation to nest predation: on the cost of reproduction. Journal of Animal Ecology, 1984, 53(3): 945- 953.
[39] Martin T E. Avian life history evolution in relation to nest sites, nest predation, and food. Ecological Monographs, 1995, 65(1): 101- 127.
[40] Møller A P. Nest predation selects for small nest size in the blackbird. Oikos, 1990, 57(2): 237- 240.
[41] Hansell M H. Bird Nests and Construction Behaviour. Cambridge: Cambridge University Press, 2000.
[42] Geupel G R, DeSante D F. Incidence and determinants of double brooding in Wrentits. The Condor, 1990, 92(1): 67- 75.
[43] 彭林英, 曹金平, 张艳菲, 王金兰, 程新巧. 川西高原若尔盖旅游气候资源及旅游舒适期研究. 成都信息工程学院学报, 2010, 25(5): 536- 541.
[44] 张晓爱, 刘泽华, 赵亮, 王爱真, 雷富民. 青藏高原常见雀形目鸟类的筑巢特征. 动物学研究, 2006, 27(2): 113- 120.
Nest building duration and its contributing factors for black-necked cranes (Grusnigricollis) at Ruoergai, Sichuan, China
JIANG Zhengquan1,2, LI Fengshan3, RAN Jianghong1,*, LIU Wei1, ZHAO Chenhao1, ZHANG Bo1, LI Hua4
1CollegeofLifeSciences,SichuanUniversity,KeyLaboratoryofBio-resourcesandEco-environmentofMinistryofEducation,Chengdu610064,China2CollegeofHistory-CultureandTourism,GuangxiNormalUniversity,Guilin541004,China3InternationalCraneFoundation,Baraboo,Wisconsin53913,USA4SichuanRuoergaiNationalNatureReserve,Ruoergai624500,China
The black-necked craneGrusnigricollisis the only alpine crane species, and its distribution is restricted to the Tibetan-Qinghai Plateau and the adjacent high altitude areas of China, Bhutan, and India. With a world population of 10000—10200 birds, this species is classified as vulnerable under the IUCN Red List Categories. The Ruoergai wetland is situated at the headwaters of the Yellow River on the northeastern edge of the Tibetan Plateau in western China, and it is one of the largest wetlands in China. With over 2,000 cranes, the marsh is the most important breeding area for the black-necked crane in the world. The Ruoergai National Nature Reserve, a wetland site of international importance and accounting for only 8.3% of the Ruoergai wetland, hosts over 1/3 of the total black-necked cranes population breeding in the Ruoergai wetland. Nest building is a significant strategy for many bird species to secure breeding success, and many species spend considerable time and energy in nest building activities. For birds, nest building is one of the key indicators for parental investment during the breeding period, and the duration of nest building greatly reflects the birds’ adaptation to the environment. To enhance knowledge of the black-necked crane breeding biology, and better understand its ecological adaption and conservation strategy, we studied the behavior at the Ruoergai National Nature Reserve from March-July in 2013 and 2014. The specific objectives of this study were to determine the duration of nest building of this species and its relation to: (1) nest type; (2) starting date of nest building; (3) nest size; and (4) nesting habitat. All potentially nesting black-necked cranes pairs in the study area were located with field surveys and data from previous observations. We checked these pairs every day, accessing the site with field vehicles. Once arrived in an area where a pair of cranes was sighted, we watched from a distance with a spotting scope, and recorded the date, time, and nest building activity. Immediately after the hatching of crane chicks, we walked to the nest and recorded the nest type, size of the nest (length, width, and height), and nesting habitat. There were four types of nests: grass mound, natural island, dirt mound, and floating grass mound. Nesting habitats included lake, river, and shallow water marsh. A total of 55 nests of black-necked cranes were studied. From these 55, 41 were grass mounds, five were natural islands, five were dirt mounds, and four were floating grass mounds. Twenty-five nests were located in swampy habitats, 17 in lake habitats, and 13 near rivers. The cranes spent (6.7 ± 9.3) days on nest building, ranging from 0.5 to 40 days. From the four types of nests built or used by the cranes, nest building period was from longest to shortest: dirt mound > grass mound > floating grass mound > natural island. Nest building time and nest types correlated significantly (r=0.728). As for habitat type, nest building took the longest time in the lake habitat. Most nests were built in April, when cranes also spent more days building their nests, than in May and June. Finally, the larger the nest, the longer it took the cranes to build it.
black-necked crane; nest building duration; Ruoergai wetland Reserve; breeding biology; nesting behavior
国际鹤类基金会“若尔盖黑颈鹤繁殖生态及其环境因子关系研究”;广西高等学校立项科研项目(201204LX067)
2015- 09- 17;
日期:2016- 06- 14
10.5846/stxb201509171913
*通讯作者Corresponding author.E-mail: rjhong-01@163.com
蒋政权,李凤山,冉江洪,刘伟,赵晨皓,张波,李华.若尔盖湿地保护区黑颈鹤巢期及影响因子.生态学报,2017,37(3):1027- 1034.
Jiang Z Q, Li F S, Ran J H, Liu W, Zhao C H, Zhang B, Li H.Nest building duration and its contributing factors for black-necked cranes (Grusnigricollis) at Ruoergai, Sichuan, China.Acta Ecologica Sinica,2017,37(3):1027- 1034.

