降水变化对红松阔叶林土壤微生物功能多样性的影响
王楠楠, 韩冬雪, 孙 雪, 国 微, 马宏宇, 冯富娟,*
1 东北林业大学, 哈尔滨 150040 2 长白山科学研究院, 安图 133613
降水变化对红松阔叶林土壤微生物功能多样性的影响
王楠楠1, 韩冬雪1, 孙 雪1, 国 微2, 马宏宇2, 冯富娟1,*
1 东北林业大学, 哈尔滨 150040 2 长白山科学研究院, 安图 133613
红松阔叶林生态系统是中国东北地带性顶级植被,具有重要的生态学意义;长白山是研究温带森林对大气降水变化正负反馈的理想地带。以长白山红松阔叶林0—5cm、5—10cm表层土和红松根际土为研究对象,基于Biolog生态平板法,分析了不同降水量条件下土壤微生物功能多样性的变化规律及机制。结果表明,平均颜色变化率(Average well color development,AWCD)随培养时间的延长而增加,在培养初期的表现为降水减少30%样地>降水增加30%>对照样地,培养的末期,AWCD值的变化没有表现出明显的规律性。各降水量条件下根际土土壤微生物的AWCD值均高于表层土。Shannon多样性指数、Simpson优势度指数和McIntosh均匀度指数在不同降水量样地间均未表现出显著的差异,即降水量增减30%的情况下,未对红松林表层土和红松根际土的微生物功能多样性产生显著影响。土壤微生物利用率最高的碳源是氨基类,其次是碳水类和多聚类,其中氨基类和碳水类也是不同降水条件下微生物功能多样性表现出异质性的主要碳源。
碳源利用;Biolog;土壤微生物;功能多样性;土壤水分
在全球气候变化背景下,全球或局部地区的降水格局(包括降水量,降水强度及降水的季节分配)发生了改变。近50年来,东北地区降水量呈现减少的趋势,降水事件具有向极端化发展的倾向,降水分布更不均匀[1-2]。降雨的变化,特别是极端降雨会对森林生态系统的结构和功能产生重大影响[3]。土壤微生物作为森林生态系统中极为重要的组成部分,对植物的生长、生态系统中能量流动和物质循环等均起着重要作用,对保持森林土壤质量和生态系统稳定性等意义重大[4-5]。因此,土壤微生物群落特征对气候变化(如温度升高、降水格局变化等) 和各种扰动的响应和适应的探讨将是今后全球变化生态学研究的核心问题[6]。
土壤微生物多样性是评价微生物群落特征的重要内容,其中土壤微生物群落功能多样性是表达土壤微生物群落与生态功能的重要指标之一,可以评价土壤中微生物的生态特征和土壤的肥力特征,微生物功能多样性信息对于明确不同环境中微生物群落的作用具有重要意义[7]。土壤微生物多样性的研究手段众多,如聚合酶链式反应(polymerase chain reaction, PCR)、基因克隆文库分析法(gene cloning library,GCL) 、荧光原位杂交法(fluorescence in situ hybridization,FISH)、限制性酶切片段长度多态性分析法(restriction fragment length polymorphism, RFLP)、变性梯度凝胶电泳法(denaturing gradient gel electrophoresis, DGGE) 和温度梯度凝胶电泳法(thermal gradient gel electrophoresis, TGGE)等[8- 11],其中Biolog微平板技术,可以直接获得微生物功能多样性的信息,最大限度的保存了土壤微生物的代谢特点,目前广泛应用于估价土壤微生物群落代谢多样性和功能多样性的研究[12-13]。
以红松(Pinuskoraiensis)为建群种的红松阔叶林是我国东北地区最有代表性的地带性顶极植被,是我国温带针阔混交林带内最典型、最多样、最重要的森林生态系统,也是全球北方森林的组成部分。该区域气候寒冷、土壤潮湿、有岛状永久性冻土存在,属于全球气候变化敏感区域。长白山是研究温带森林对全球气候变化正负反馈的理想地带,具有显著的区域特性。本研究利用Biolog微平板技术,以长白山原始红松阔叶林表层土及红松根际土的土壤微生物为研究对象,比较了人工控制降水条件下土壤微生物的代谢特征的变化,旨在探讨降水变化对土壤微生物功能多样性的影响规律和机制,为进一步研究红松阔叶林生态系统中土壤微生物群落对全球气候变化大背景下降雨格局改变的响应规律提供理论依据和科学参考。
1 材料方法
1.1 研究区概况及样地设置
试验在中国科学院沈阳应用生态研究所长白山森林生态系统定位研究站内依托“国家重点基础研究发展计划”(973)项目建立的“原始阔叶红松林降水格局控制试验研究样地”内进行。样地坐标40°24′ N,128°28′ E,海拔736m,该区域为典型的温带大陆性山地气候。林地内优势种为红松,多种阔叶树与其混交,常见的为紫椴 (Tiliaamurensis)、水曲柳 (Fraxinusmandshurica)、枫桦(Betulacostata)等,此外混有少量的色木槭(Acermono)、蒙古栎(QuercusMongolica)、春榆(Ulmusdavidianavar.japonica)及白桦(Betulaplatyphylla)。红松平均株高16.70m,胸径23.45cm,林内郁闭度0.75。
该样地内设置9块50m×50m的样方,样方内通过截水板来控制降水量,共有3种控水模式,分别为截水板下降水增加30%、截水板下降水减少30%和无截水板对照,每个模式3个重复。降水量的控制,按照林面积的30%计算,即截水板拦截穿透雨的30%,树干径流量(小于18%)的影响被忽略。整个降水控制系统采用计算机控制,于2009年启动运行至今,样地概况见图1。该样地9月土壤主要理化性质见表1。

图1 样地内截水板设置 Fig.1 The rainout shelters in sample site
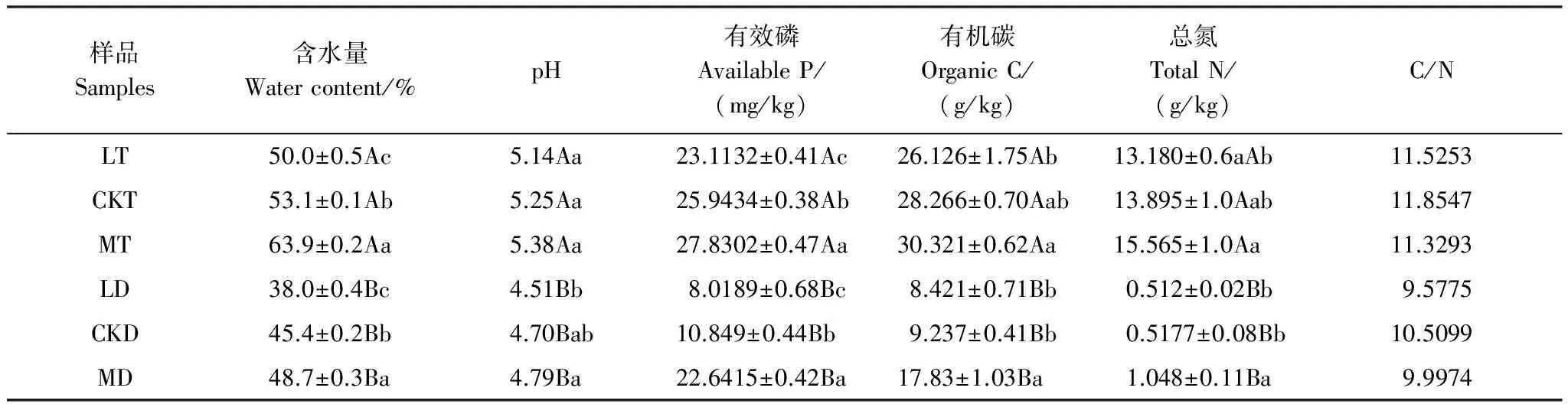
样品Samples含水量Watercontent/%pH有效磷AvailableP/(mg/kg)有机碳OrganicC/(g/kg)总氮TotalN/(g/kg)C/NLT50.0±0.5Ac5.14Aa23.1132±0.41Ac26.126±1.75Ab13.180±0.6aAb11.5253CKT53.1±0.1Ab5.25Aa25.9434±0.38Ab28.266±0.70Aab13.895±1.0Aab11.8547MT63.9±0.2Aa5.38Aa27.8302±0.47Aa30.321±0.62Aa15.565±1.0Aa11.3293LD38.0±0.4Bc4.51Bb8.0189±0.68Bc8.421±0.71Bb0.512±0.02Bb9.5775CKD45.4±0.2Bb4.70Bab10.849±0.44Bb9.237±0.41Bb0.5177±0.08Bb10.5099MD48.7±0.3Ba4.79Ba22.6415±0.42Ba17.83±1.03Ba1.048±0.11Ba9.9974
LT: 降水减少30% 0—5cm土层,Precipitation 30% decrease and 0—5cm layer;CKT: 对照样地的0—5cm土层,0—5 cm layer in control site;MT: 降水增加30% 0—5cm土层,Precipitation 30% increase and 0—5cm layer; LD: 降水减少30% 5—10 cm土层,Precipitation 30% decrease and 5—10 cm layer; CKD:对照样地的5—10 cm土层,5—10 cm layer in control site; MD:降水增加30% 5—10 cm土层,Precipitation 30% increase and 5—10 cm layer. 同列不同大写字母表示不同土层间差异显著(P<0. 05),不同小写字母表示不同降水量间差异显著(P<0. 05)
1.2 样品采集
取样工作于2014年9月进行,在每一样方内按S型布点作10个1m×1m的小样方,每个小样方内按自然土壤剖面取样法采集0—5cm和5—10cm表层土样,红松根际土样品采集时采用手工抖落法[14],采集后分别装于采集袋中,带回实验室。去除凋落物及土壤动物等杂质,过2mm筛后,将每个样方内的10个点充分混合组成1个混合样,立即进行biolog实验。
1.3 实验方法
Eco板接种液的制备采用Classen等的方法[15]。首先土壤样品在25℃的条件下活化24 h。取3 g新鲜土样放入盛有27 mL的0.85% NaCl溶液的三角瓶中,涡旋振荡1 min后,置于冰水浴中1 min,重复此操作3次。转入超净工作台中静置5min,吸取3 mL上清,加入27 mL NaCl溶液,混匀后再吸取3 mL上清,加入27 mL NaCl溶液。最终的稀释比例为1∶1 000。向Eco板的各孔中加入150mL的稀释液,将接种好的微孔板放入25℃的恒温培养箱中培养。用酶标仪(Sunrise Re-mote, TECAN)测定590、750nm下biolog微孔板的吸光度值,分别记录培养24、48、72、96、120、144、168、192 h和216 h的数值。
1.4 数据分析
微生物代谢活性用590 nm 下的值减去750 nm下的值表示, 孔的平均颜色变化率(AWCD) 计算方法如下[16]:
AWCD=∑(Ci-R)/n
式中,Ci为各反应孔在590nm与750nm吸光度值之差;R为Eco板对照孔的光密度值;n为Biolog生态板的碳源数目,该实验中值为31。Ci-R小于零的孔,计算中记为零。
通过Shannon多样性指数、Simpson优势度指数和McIntosh均匀度指数来表示表层土和根际土壤微生物群落代谢功能的多样性。计算公式如下:
Shannon多样性指数
H=-∑(Pi×lnPi)
Simpson优势度指数
D=1-∑(Pi)2
McIntosh均匀度指数
U=∑(Ci-R)2
式中,Pi=Ci-R/∑(Ci-R)。
数据处理分析应用Excel2013、SPSS(Version14.0forWindows)软件进行, 绘图应用Sigma-plot10.0 软件。
2 结果与分析
2.1 不同降水量条件下土壤微生物利用全部碳源的动力学特征
平均颜色变化率(AWCD) 是反映土壤微生物活性,即利用单一碳源能力的一个重要 指标[17-18]。计算9个样品利用31种碳源的AWCD值可知,随着培养时间的延长,微生物利用碳源的量呈逐渐增加趋势,且24h至96h增长快速,144h后这种增加逐渐缓慢(图1)。说明培养初期,土壤微生物经过短暂的环境适应后,利用碳源的能力逐渐提升,首先进入快速增长期,微生物代谢强度达到顶峰,随后逐渐达到稳定期。培养初期(48h),3种降水条件下AWCD值对空间位置的响应规律一致,均表现为根际土>0—5cm表层土>5—10cm表层土;同样,AWCD值对降水的响应规律也基本一致,即降水减少30%>降水增加30%>对照,但0—5cm表层土除外,表现为降水增加30%最高,降水减少30%最低。培养末期(168h),AWCD值在对照样地表现为0—5cm表层土>根际土>5—10cm表层土,其他两个样地均表现为根际土>0—5cm表层土>5—10cm表层土;不同空间位置的AWCD值对降水变化的响应规律差异较大,根际土表现为降水减少30%>降水增加30%>对照,0—5cm表层土表现为对照>降水增加30%>降水减少30%,5—10cm表层土表现为降水增加30%>对照>降水减少30%。整体来看,培养末期根际土土壤微生物的碳源利用能力高于表层土。

图2 不同降水量条件下9种土壤微生物的平均颜色变化率 Fig.2 The average well color devolopment of 9 kinds of soil microorganisms under different amount of precipitationLT: 降水减少30% 0—5cm土层,Precipitation 30% decrease and 0—5cm layer;CKT: 对照样地的0—5cm土层,0—5 cm layer in control site;MT: 降水增加30% 0—5cm土层,Precipitation 30% increase and 0—5cm layer; LD: 降水减少30% 5—10 cm土层 Precipitation 30% decrease and 5—10 cm layer; CKD:对照样地的5—10 cm 土层,5—10 cm layer in control site;MD:降水增加30% 5—10 cm土层,Precipitation 30% increase and 5—10 cm layer;LR:降水减少30% 红松根际土,Precipitation 30% decrease and Rhizosphere soil of Korean pine;CKR:对照样地的红松根际土,Rhizosphere soil of Korean pine in control site;MR:降水增加30%根际土,Precipitation 30% increase and Rhizosphere soil of Korean pine
2.2 不同降水量条件下土壤微生物多样性指数
Shannon指数可以表征土壤中微生物群落丰富度,Simpson指数常用来评估土壤中微生物群落优势度,McIntosh指数反映土壤中微生物群落均匀度[19]。土壤微生物经过168h培养后,分析其Shannon指数、McIntosh均匀度指数和Simpson优势度指数。结果表明,在降水增减30%条件下,Shannon指数和均匀度指数表现为根际土>0—5cm表层土>5—10cm表层土,在对照样地则表现为0—5cm表层土>根际土>5—10cm表层土;且在3块样地中,5—10cm土层与0—5cm土层、根际土的Shonnon指数差异均极显著(P<0.001),其他两个指数在不同空间位置上未达到显著水平。3个指数在不同降水条件差异均不显著。
2.3 不同降水量条件下土壤微生物对6大类碳源的利用强度
Biolog微孔板中的31种碳源可以根据官能团的不同分为6大类,分别为胺类、 氨基酸类、碳水类、羧酸类、酚酸类和多聚物。本研究中,土壤微生物对这6类碳源的利用率大小为氨基类>多聚类>碳水类>胺类>羧酸类>酚酸类(图2)。表明长白山红松阔叶林土壤微生物偏好的碳源类型是氨基类、碳水类和多聚类。
不同降水量条件下,6类碳源利用率存在差异:在降水减少30%样地,除胺类表现为0—5cm表层土>根际土>5—10cm表层土外,其余碳源的利用率均表现为根际土>0—5cm表层土>5—10cm表层土;对照样地中,除羧酸类表现为0—5cm表层土>5—10cm表层土>根际土,其余则表现为0—5cm表层土>根际土>5—10cm表层土;降水增加30%样地中,不同空间位置土壤微生物对六大类碳源的利用并没有表现出一致的规律。除羧酸类和胺类碳源外,其余4类碳源对降水变化的响应均达到显著水平。
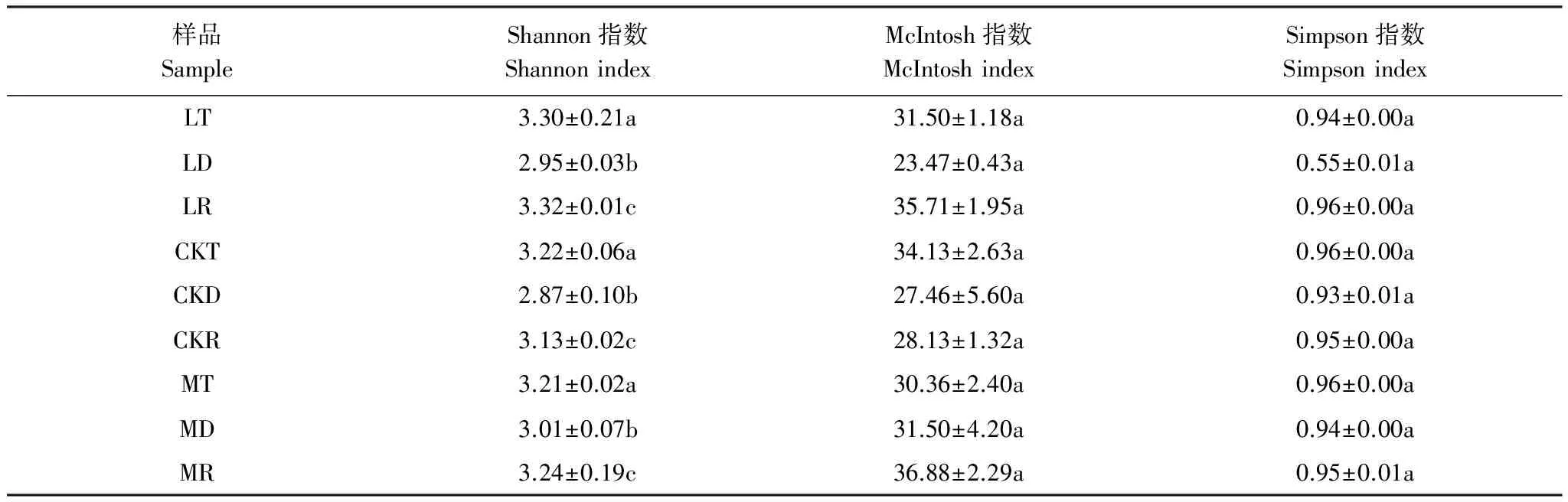
表2 不同降水量条件下的土壤微生物多样性指数(培养168h)
LR:降水减少30% 红松根际土,Precipitation 30% decrease and Rhizosphere soil of Korean pine;CKR:对照样地的红松根际土,Rhizosphere soil of Korean pine in control site;MR:降水增加30%根际土,Precipitation 30% increase and Rhizosphere soil of Korean pine;同列小写字母不同代表不同土壤样品间差异极显著(P<0.001)
不同空间位置上,这6类碳源对降水变化的响应规律也不一致。对根际土而言,降水的增加和减少均提高了6大类碳源的利用率,降水增加明显提高了氨基酸类和羧酸类碳源的利用,降水减少则明显提高了其他4种碳源的利用率;0—5cm表层土中,除胺类外,对其余5类碳源的利用率在对照样地最高;5—10cm表层土中,微生物对6大类碳源的利用没有表现出对降水响应的一致的规律。6类碳源中,只有酚酸类碳源的利用率对空间位置变化的响应达到显著水平。
2.4 不同降水量条件下土壤微生物的主成分分析
对各样品培养168h后的平均颜色变化率做主成分分析,以探究不同降水量条件下土壤微生物碳源利用的差异(图4)。第1主成分和第2主成分的贡献率分别为54.165%和45.835%。其中降水减少30%样地两个层次表层土均有较低的第1主成分和较高的第2主成分,与其他样品区分开来,说明降水减少30%确实引起了表层土壤微生物对碳源利用的明显变化。降水增加30%样地中,0—5cm表层土与根际土均有较高的第1主成分,对照样地中0—5cm表层土与根际土均有较高的第1主成分和较低的第2主成分,说明降水增加30%和对照样地中,0—5cm表层土与根际土对碳源的利用情况都是相近的。
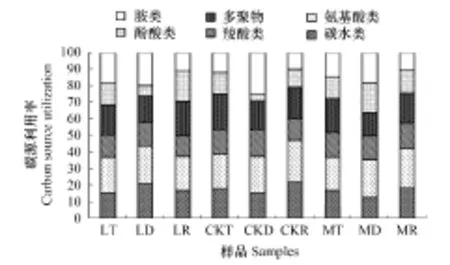
图3 不同降水条件下土壤微生物对6大类碳源的利用强度 Fig.3 Carbon source utilization of soil microorganisms under different precipitation
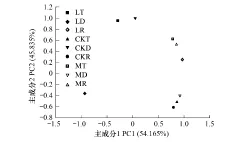
图4 不同降水条件下土壤微生物的主成分分析 Fig.4 Principle component analysis of soil microbial community microorganism under different precipitation
对31种碳源主成分分析中的因子载荷可反映碳源利用的差异,绝对值越大,表明该基质的影响越大,在众多碳源中起主要分异作用[20]。本研究中PC1载荷值绝对值>0.5的有21种,0.8以上的有7种,其中氨基酸类4种,多聚类、羧酸类和碳水类各1种(表3)。PC2的载荷在0.5以上的碳源有7种,其中碳水类4种,羧酸类1种,胺类2种。综合分析,碳水类和氨基酸类碳源为不同降水条件下微生物功能多样性表现出空间异质性的敏感碳源。此外,碳水类中的N-乙酰-D-葡萄糖胺、D-纤维二糖、α-D-乳糖,在PC1和PC2载荷均达到0.5以上,三者为碳水类碳源中的最敏感类型。

表3 31种碳源的因子载荷值
3 结论与讨论
3.1 不同降水量条件下AWCD值和微生物多样性
AWCD值能反应出土壤微生物活性及微生物利用单一碳源的反应速率[21]。研究中发现,AWCD值在培养初期和培养末期对降水量变化的响应不一致,培养初期,降水量增、减样地的AWCD值高于对照,即降水量的变化对微生物的代谢活性产生了一定的促进作用;在培养末期,AWCD值趋于稳定后,这种促进作用消失,导致AWCD值产生明显差异的因素主要是土样的空间位置(图2)。在整个培养过程中,降水量增减30%的控制幅度对微生物代谢活性的影响并不大。但是,我们前期的研究结果已经证实,降水变化能够明显驱动土壤微生物群落的组成结构发生较大变化,如不同降水条件下,真菌群落中的优势种群具有较大差异[22],同时降水变化也显著影响了细菌群落中优势种群的丰度[23]。可见,在相同控制降水条件下,微生物群落的结构和功能所表现出的响应程度并不一致。其原因可用“功能冗余”来解释,即同一群落中的某些物种在生态功能上有一定程度的重叠[24]。降水变化虽然导致土壤微生物群落中优势种群的变化,但由于功能的冗余性,其变化程度反应到功能上就会被稀释。因而,微生物群落的结构对外界条件变化的反应比功能更为敏感,这一结论也与Berga等的研究相一致[25]。
整个培养过程中,各降水条件下根际土土壤微生物的AWCD值均高于表层土,与国内外众多的研究结果一致,普遍认为根际分泌物对其周围微生物群落生长和代谢的促进作用是导致这一结果的主要原因[26-29]。不同降水量条件下,Shannon指数Simpson指数和McIntosh 指数均差异不显著,和上述AWCD的值一样,说明降水增减30%的变化幅度并没有对微生物多样性产生显著影响。3个指数在根际土、0—5cm和5—10cm表层土间没有表现出一致的显著差异,这与AWCD值在土壤空间位置上表现出了明显的异质性(根际土高于表层土)不同,说明根际对周围微生物的影响主要体现在代谢活性上,并没有影响微生物的均匀度和优势度。
3.2 不同降水量条件下微生物对碳源利用的差异

综上所述,降水量增减30%的情况下,未对原始红松阔叶林表征土和红松根际土的微生物功能多样性产生显著影响,但3种降水条件下,土壤微生物功能多样性在土层之间及表征土与根际土之间差异较为明显。
[1] Easterling D R, Evans J L, Groisman P Y, Karl T R, Kunkel K E, Ambenje P. Observedvariability and trends in extreme climate events: a brief review. Bulletin of the American Meteorological Society, 2000, 81 (3): 417-425.
[2] Wang Y Q, Zhou L. Observed trends in extreme precipitation events in China during 1961- 2001 and the associated changes in large-scale circulation. Geophysical Research Letters, 2005, 32(9): L09707, doi: 10.1029/2005GL022574.
[3] 孙凤华, 吴志坚, 杨素英. 东北地区近50年来极端降水和干燥事件时空演变特征. 生态学杂志,2006, 25(7): 779- 784.
[4] Copley J. Ecology goes underground. Nature, 2000, 406(6795): 452-454.
[5] Harris J A. Measurements of the soil microbial community for estimating the success of restoration.European Journal of Soil Science, 2003, 54(4):801- 808.
[6] 曹鹏, 贺纪正. 微生物生态学理论框架. 生态学报, 2015, 35 (22):7263- 7273.
[7] Rogers B F,Tate III R L. Temporal analysis of the soil microbial community along a toposequence in Pineland soils. Soil Biology and Biochemistry,2001,33(10): 1389- 1401.
[8] 章家恩, 蔡燕飞, 高爱霞, 朱丽霞. 土壤微生物多样性实验研究方法概述. 土壤, 2004, 36(4): 346- 350.
[9] 蔡燕飞, 廖宗文. 土壤微生物生态学研究方法进展. 土壤与环境, 2002, 11(2): 167- 171.
[10] 陈晓倩, 殷浩文. 微生物群落多样性分析方法的进展. 上海环境科学, 2003, 22(3): 213- 217.
[11] Engebretson J J,Moyer C L. Fidelity of select restriction endonucleases in determining microbial diversity by terminal restriction fragment length polymorphism. Applied and Environmental Microbiology, 2003, 69(8): 4823 - 4829
[12] Denaro R, D′Auria G, Di Marco G D, Genovese M, Troussellier M, Yakimov M M, Giuliano L.Assessing terminal restriction fragment length polymorphism suitability for the description of bacterial community structure and dynamics in hydrocarbon-polluted marine environments.Environmental Microbiology, 2005, 7(1): 78- 87.
[13] 郑华, 欧阳志云, 方治国,赵同谦. BIOLOG在土壤微生物群落功能多样性研究中的应用. 土壤学报 2004, 41(3): 456- 461.
[14] Marschner P, Neumann G, Kania A, Weiskopf L, Lieberei R. Spatial and temporal dynamics of the microbial community structure in the rhizosphere of cluster roots of white lupin (LupinusalbusL). Plant and Soil, 2002, 246(2): 167- 174.
[15] Classen A T, Boyle S I, Haskins K E,Overby S T, Hart S C. Community- level physiological profiles of bacteria and fungi: plate type and incubation temperature influences on contrasting soils FEMS Microbiology Ecology, 2003, 44(3): 319- 328.
[16] Choi K H, Dobbs F C. Comparison of two kinds of Biolog micro-plates (GN and ECO) in their ability to distinguish among aquatic microbial communities. Journal of Micro biology Methods, 1999, 36(3): 203- 213.
[17] 中国科学院南京土壤研究所微生物室土壤微生物研究法.北京:科学出版社,1985: 40- 47.
[18] 杜小刚, 唐明, 陈辉, 张海涵, 张永安. 黄土高原不同树龄刺槐丛植菌根与根际微生物的群落多样性. 林业科学,, 2008, 44 (4):78- 82.
[19] 郝晓晖, 胡荣桂, 吴金水, 汤水荣, 罗希茜. 长期施肥对稻田土壤有机氮、微生物生物量及功能多样性的影响. 应用生态学报, 2010, 21(6): 1477- 1484.
[20] Garland J L. Analysis and interpretation of community-level physiological profiles in microbial ecology. FEMS Microbiology Ecology, 1997, 24 (4): 289- 300.
[21] 林青, 曾军, 马晶, 王重, 张涛, 李珊, 娄恺. 新疆地震断裂带次生植物根际土壤微生物碳源利用. 应用生态学报, 2011, 22(9): 2297- 2302.
[22] 王楠楠,杨雪, 李世兰, 隋心, 韩士杰, 冯富娟. 降水变化驱动下红松阔叶林土壤真菌多样性的分布格局. 应用生态学报. 2013, 24(7): 1985- 1990.
[23] Nannan Wang, Yang X, Li SL, Sui X, Han S J, Feng F J.. Effects of variation in precipitation on the distribution of soil bacterial diversity in the primitive Korean pine and broadleaved forests. World Journal of Microbiology and Biotechnology, 2014,30(11): 2975- 2984.
[24] Wohl D L, Arora S, Gladstone JR. Functional redundancy supports biodiversity and ecosystem function in a closed and constant environment. Ecology, 2004, 85(6), 1534- 1540.
[25] Berga M, Székely AJ, Langenheder S. Effects of disturbance intensity and frequency on bacterial community composition and function. PLoS ONE, 2012, 7(5): e36959.
[26] 王轶,邹莉,王义. 凉水自然保护区原始阔叶红松林土壤微生物的主要生理类群及分布.东北林业大学学报. 2008, 36(3): 17- 17, 48- 48.
[27] 张学利, 杨树军, 张百习, 袁春良. 不同林龄樟子松根际与非根际土壤的对比. 福建林学院学报, 2005, 25(1): 80- 84.
[28] Iovieno P, Alfani A, Bååth E. Soil microbial community structure and biomass as affected byPinuspineaplantation in two Mediterranean areas. Applied Soil Ecology, 2010, 45(1): 56- 63.
[29] 李春格, 李晓鸣, 王敬国.大豆连作对土体和根际微生物群落功能的影响. 生态学报, 2006, 26(4): 1144- 1150..


[32] Knoepp J D, Turner D P, Tingey D T. Effects of ammonium and nitrate on nutrient uptake and activity of nitrogen assimilating enzymes in western hemlock. Forest Ecology and Management, 1993, 59(3/4): 179- 191.
[33] Vinolas L C, Vallejo V R, Jones D L. Control of amino acid mineralization and microbial metabolism by temperature. Soil Biology and Biochemistry, 2001, 33(7/8): 1137- 1140.
Effects of precipitation change on soil microbial functional diversity in the primitive Korean pine and broadleaved forests
WANG Nannan1, HAN Dongxue1, SUN Xue1, GUO Wei2, MA Hongyu2, FENG Fujuan1,*
1NortheastForestryUniversity,Harbin150040,China2ChangbaimountainAcademyofScience,Antu133613,China
Global climate change and sustainable development are the two most important challenges worldwide. Patterns of precipitation, includes quantity, intensity and distribution, are expected to change. Subsequently, soil moisture content is expected to followed the precipitation pattern changes, which would affect the aboveground biomass and soil microorganisms activity. The latter would consequently affect the structure and functioning of terrestrial ecosystem. Therefore, it is critical to understand how ecosystem structure and function will respond to the expected changes of precipitation pattern. Many large controlled field experiments modify the precipitation pattern change. Most of those studies have been focusing on species composition, productivity and soil respiration. Soil microorganisms are sensitive to micro-environmental changes, which drive the soil nutrient cycling, as well as ecosystem processes such as soil material conversion and energy flow. Therefore, they have been recognized as sensitive indicator of soil ecosystem. As a consequence, soil microorganisms have been a popular research topic in pedology, and have become an extremely important and relatively quick growing research field. Forest ecosystem can contribute greatly to adjust of global climate change. Broad-leavedKoreanpine mixed forest is zonal climax vegetation in northeastern China, and it plays a significant ecological role in this region. We selected Changbai Mountain to study the microbial feedbacks to the precipitation changes. Soil microbial functional diversity and its changes driven by precipitation change (30% increase and decrease) were measured in different layer soil (0—5cm, 5—10cm andKoreanpine rhizosphere soil), using the Biolog microplate. Our results showed that the average well color development (AWCD) value were highest in the increased precipitation plots, and lowest in the control plot at the beginning of the cultivation. however, it did not have an obvious pattern with precipitation regime at the end of cultivation. Throughout the whole incubation periods, the AWCD value in rhizosphere soil was higher than in surface soil. Shannon-Wiener, Simpson, and McIntosh diversity indices showed no significant difference between different layers and precipitation patterns. This suggest that precipitation increasing or decreasing with 30% had no significant effect on functional diversity of different layers or the rhizosphere soil in broad-leavedKoreanpine mixed forest. However, the utilization intensity of six categories carbon sources types were specified. Amino acids, carbohydrate and polymers were the main carbon sources with a high utilization rate, especially the amino acids. The microbial functional diversity under different precipitation conditions showed that the spatial heterogeneity was reflected the use of amino acids and carbohydrate by microrganisms. N-Acetyl-D-Glucosamine, D-cellobiose, and α-D-Lactose was the most specified carbon sources to microbes. This evaluation of microbial functional diversity in bulk soil and rhizosphere soil under different precipitation patterns can help other researchers to summarize the patterns and mechanism of microorganism responses to precipitation change. It is also provide a scientific reference for further study on climate change.
Carbon use; Biolog; soil microbiology; functional diversity; soil moisture
国家自然科学基金项目(41105104);中央高校基本科研业务费专项(2572015EA02);长白山科学研究院开放基金项目(201506)
2015- 09- 10;
日期:2016- 06- 13
10.5846/stxb201509101873
*通讯作者Corresponding author.E-mail: ffj9018@sina.com
王楠楠, 韩冬雪, 孙雪, 国微, 马宏宇, 冯富娟.降水变化对红松阔叶林土壤微生物功能多样性的影响.生态学报,2017,37(3):868- 876.
Wang N N, Han D X, Sun X, Guo W, Ma H Y, Feng F J.Effects of precipitation change on soil microbial functional diversity in the primitive Korean pine and broadleaved forests.Acta Ecologica Sinica,2017,37(3):868- 876.

