基于Au纳米颗粒/还原氧化石墨烯C-反应蛋白免疫传感器的研制
张 茜,夏介仁,李德蕾,张坤蕾,白茹燕,胡 蓉,杨云慧
(云南师范大学 化学化工学院,云南 昆明 650500)
基于Au纳米颗粒/还原氧化石墨烯C-反应蛋白免疫传感器的研制
张 茜,夏介仁,李德蕾,张坤蕾,白茹燕,胡 蓉*,杨云慧*
(云南师范大学 化学化工学院,云南 昆明 650500)
采用还原氧化石墨烯-金纳米颗粒(RGO-Au NPs)作为免疫传感器的固定基质,将C-反应蛋白(CRP)抗体固定在玻碳电极表面,用蒽醌二羧酸作为标记物,制成夹心型的CRP免疫传感器。在最优实验条件下,通过示差脉冲伏安法对CRP的含量进行检测。该传感器在0.25~100 ng/mL范围内具有良好的线性关系,检出限为0.08 ng/mL,线性系数为0.997。该传感器为C-反应蛋白的检测提供了一种新的手段。
夹心型免疫传感器;C-反应蛋白(CRP);还原氧化石墨烯;电化学
进入新世纪以来,心血管疾病严重危害人类的身体健康。我国心血管疾病的发病率和死亡率逐年增加。近10年来,研究表明C-反应蛋白(C-reactive protein)直接参与各种炎症和动脉粥样硬化等心血管疾病的发病机理。该蛋白已成为心血管疾病很重要的预示因子和危险因子[1],与心血管疾病具有很好的相关性[2]。
CRP是由肝细胞合成的一种急性蛋白,当受到炎症的刺激或细菌感染时,其值会在受刺激4~6 h后开始升高,每隔8 h升高1倍,一般36~50 h达到峰值。随着炎症的恢复,CRP值会不断降低[3]。人体中正常的CRP具有一定的生理作用,可增强机体的免疫能力[4]。以往,由于检测CRP的方法比较落后,易产生假阴性和假阳性结果,在很大程度上影响了它在临床上的应用价值,故导致其临床作用被弱化。近年来,随着研究的进展,快速、灵敏、简便、可靠的检测CRP的方法已被建立,使得CRP在临床上的应用价值得以提升,其应用领域也大大增加。
一般来说,人体内CRP的正常值小于2.0 mg/L,但当患有急性炎症时其值会增大至1 000倍以上[5]。CRP水平值的高低可直接用来估测心血管疾病的严重程度。美国心脏协会和疾病控制预防中心提出3个级别的CRP浓度:小于1.0 mg/L为低危险;1.0~3.0 mg/L之间为一般危险;大于3.0 mg/L为极度危险[6]。目前,研究发现CRP在临床上具有很大的应用价值:①CRP在血清中的水平可预测发热性癌症病人是细菌感染还是过滤性感染[7]。②C-反应蛋白在血清中的水平可作为心肌梗塞、中风和动脉粥样硬化的重要预测指示因子[8-9]。③如果CRP在血清中的值升高,患癌症的风险会增大,C-反应蛋白与非小细胞肺癌具有很好的相关性[10]。
2011年,侯建国等[11]将多壁碳纳米管(MCNTs)-硫堇(Thi)-Nafion复合物固定于丝网印刷电极(SPCE)表面作为基底电极,再利用磁性Au@Fe3O4标记C-反应蛋白酶抗体(HRP-anti CRP),并将其吸附到基底电极表面,研发了可再生使用的信号放大的磁性纳米修饰CRP电流型免疫传感器,该传感器的线性范围为0.1~110 ng/mL,具有灵敏度高、结果稳定性好、可再生使用等特点。2013年,Bryan等[6]利用金电极制备了一种无标记型电化学生物传感器用于检测血液中的CRP,其线性范围为0.5~50 nmol/L。杨云慧等[12]利用Pd/共价有机骨架材料(COF-LZUll)多孔复合材料将CRP抗体(anti-CRP)固定在玻碳电极表面,构建了一种非标记型C-反应蛋白免疫传感器。
碳纳米材料是一种地球上较普遍而特殊的材料,具有独特的物理化学性质[13]。1991年,Iijima发现了碳纳米管,其直径在0.7~60 nm之间[14]。随后,各种碳材料相继被发现并被应用于不同的领域。石墨烯作为一种碳二维材料,其碳原子的杂化方式为sp2[15],在力学、热学和电学方面均具有优良的性能,被称为一种理想的增强体[16]。目前,其制备方法主要有Boride法、Staudemnaier法和Hummer法等[17-18]。2004年,Geim和Novoselov成功地从石墨中分离出石墨烯,证明它可以单独存在[19]。近年来,石墨烯被广泛应用于电化学方面的研究[20-22],Ramesh等[23]将石墨烯的氧化物悬浮液负载到玻碳电极(GCE)和金电极的表面,分别形成氧化石墨烯修饰的电极,并用于研究一些典型的氧化还原电对的特性。李焘等[24]将纳米石墨烯修饰到电极上,并采用电化学发光法测定了盐酸氯丙嗪。
本文将氧化石墨烯通过电沉积的方法沉积到玻碳电极上变成还原氧化石墨烯,并负载Au纳米颗粒,用蒽醌二羧酸作为标记物,制成夹心型的免疫传感器,从而实现了CRP的定量检测。利用还原氧化石墨烯修饰电极,增加了电极的表面积,进一步增加了导电性。本文构建的基于还原氧化石墨烯(RGO)的传感器具有准确度高、特异性强、灵敏度高、检测速度快等优点。
1 实验部分
1.1 试剂与仪器
氯金酸(HAuCl4·4H2O,昆明铂锐材料有限公司);碳酸钠、硝酸钠(天津市大茂化学试剂厂);浓硫酸(云南杨林工业开发区汕滇药业有限公司);高锰酸钾、N-羟基琥珀酰亚胺(NHS)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)(麦克林试剂网);尿素(Amresco公司);石墨粉、无水乙醇(天津市风船化学试剂科技有限公司);C-反应蛋白抗体(anti-CRP)、C-反应蛋白(CRP)(上海领潮生物科技有限公司);30%过氧化氢(西陇化工股份有限公司);牛血清蛋白(BSA)、磷酸缓冲溶液(PBS,pH 7.40)(美国Sigma公司);蒽醌二羧酸(QC,梯希爱(上海)化成工业发展有限公司);冰醋酸(成都化学试剂厂);实验所用试剂均为分析纯,所用水为二次蒸馏水。
示差脉冲伏安法(DPV)、电化学交流阻抗(EIS)均用CHI 660D电化学工作站(上海辰华仪器公司)测量;以饱和甘汞电极(SCE)为参比电极,玻碳电极(GCE)为工作电极,铂电极为辅助电极;JEM2100透射电镜(日本电子株式会社);TGL16离心机(长沙湘智离心机仪器有限公司);CS501超级恒温器(重庆实验设备厂);ST2200HP超声波清洗器(上海科导超声仪器有限公司);DZF-6020型真空干燥箱(上海博迅实业有限公司)。
1.2 实验方法
1.2.1 氧化石墨烯的制备 在圆底烧瓶中分别加入1.5 g NaNO3和30 mL浓硫酸,在磁力搅拌器上搅拌直至完全溶解,随后加入2 g石墨粉并搅拌均匀,在冰水浴搅拌的条件下缓慢加入9 g KMnO4,在该条件下搅拌2 h后,在室温下搅拌5 d,然后缓慢加入200 mL 5%的H2SO4,在室温下搅拌2 h,缓慢加入100 mL 3% 的H2O2,溶液变成亮黄色后在室温下搅拌2 h,反应完成后将溶液离心并弃去上清液,再用3%的H2SO4和0.5%的H2O2混合溶液洗涤离心3次,最后用水反复洗涤直至溶液呈中性,方可合成氧化石墨烯。
1.2.2 蒽醌二羧酸标记的CRP抗体的制备 将2.0 mg NHS和1.3 mg EDC分散于1 mL H2O中混匀,之后加入1 mL 1 mg/mL QC充分混匀,在振荡仪上搅拌一夜,离心,分散在PBS中,随后逐滴加入10 μL 1 mg/mL的CRP抗体,振荡20 h,在10 000 r/min的条件下离心5 min,弃去上清液后分散于1 mL PBS中,之后加入25 μL 10%的BSA,振荡30 min,封闭非特异性位点,离心,最后分散于1 mL PBS中备用。
1.3 免疫传感器的制备

图1 免疫传感器的制备流程Fig.1 Stepwise of fabricating immunosensor

图2 氧化石墨烯的透射电镜图Fig.2 TEM image of GO

图3 扫描速度对传感器响应电流的影响Fig.3 Effect of scan rates on response current of immunosensor scan rate(a-g):20,40,60,80,100,120,140 mV/s; inset:the plot of peak current vs.v1/2
用金相砂纸将玻碳电极(Φ=3 mm)打磨干净,将电极表面在不同粒径大小的Al2O3粉末上抛光,再将电极分别用硝酸水溶液(1∶1)、无水乙醇、水各超声洗涤5 min,自然风干后,将电极放在氧化石墨烯溶液中通过电沉积的方法沉积,在-1.4~1.2 V范围内采用循环伏安法沉积,电极上得到RGO;取出电极用PBS缓冲液清洗干净,放入HAuCl4溶液中用同样的方法,在-0.8~2.0 V范围内采用循环伏安法沉积上Au纳米颗粒。电沉积完成后用PBS溶液冲洗干净,自然风干,在电极表面滴加CRP抗体10.0 μL,置于冰箱中在4 ℃条件下过夜。将已修饰好CRP抗体的玻碳电极用PBS缓冲液冲洗3次,自然晾干,在电极上滴加10 μL 1%的BSA溶液,将电极放在恒温箱中(温度为37 ℃)封闭1 h。封闭好的电极用PBS溶液冲洗3次,自然晾干后,用于CRP的测定。CRP 免疫传感器的制备流程如图1所示。
1.4 检测方法
在该免疫传感器上滴加不同浓度的CRP抗原,将电极放在恒温箱中(温度为37 ℃)培育,培育完之后取出并用PBS冲洗干净,自然晾干。然后滴加10.0 μL蒽醌二羧酸标记的CRP抗体,置于上述恒温箱中培育。之后取出并用PBS冲洗干净,自然晾干。该传感器作为工作电极,与铂电极、甘汞电极组成三电极系统,置于pH值为6.5的醋酸缓冲溶液中,通过示差脉冲伏安法(DPV)进行测定,得到DPV曲线,根据传感器响应电流值与CRP浓度成正比的关系,实现对CRP的定量测定。每次测定完后用4 mol/L尿素洗脱30 min,用PBS缓冲液洗干净,重复上述实验过程。
2 结果与讨论
2.1 氧化石墨烯的微观形貌
对合成的氧化石墨烯材料进行透射电镜(TEM)表征,如图2所示,可以看出该材料是一种层状结构,片层中存在褶皱,说明氧化石墨烯的层数很少。表面非常光滑,呈透明的薄片状。
2.2 氧化还原峰电流与扫描速度的关系
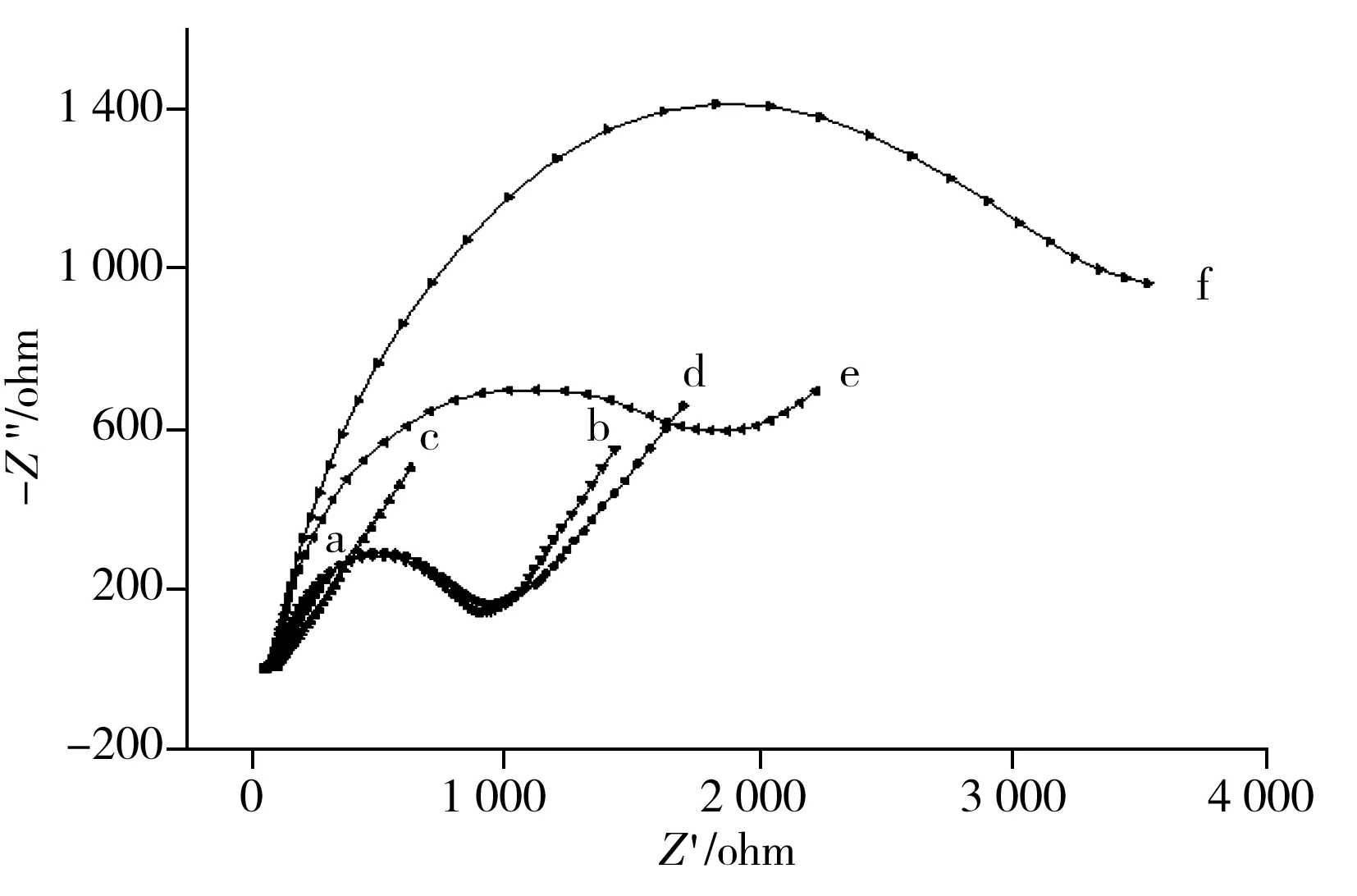
图4 不同修饰电极界面的交流阻抗行为Fig.4 EIS curves of different modified electrodea:bare GCE;b:RGO/GCE;c:Au/RGO/GCE;d:anti-CRP/BSA/anti-CRP /Au/RGO /GCE;e:CRP/anti-CRP/BSA/anti-CRP/Au/RGO/GCE;f:labeled anti-CRP/CRP/BSA/anti-CRP/Au/RGO/GCE

图5 pH值对免疫传感器响应电流的影响Fig.5 Effect of pH value on response of CRP immunosensor
为考察QC-labeled anti-CRP/CRP/anti-CRP/RGO/GCE免疫传感器的电化学行为,实验考察了扫描速度对氧化还原峰电流的影响,当扫描速度在20~140 mV/s 范围内变化时,传感器在HAc-NaAc缓冲溶液(pH 5.5)中的循环伏安曲线如图3所示。可以看出,氧化峰和还原峰电流随着扫描速度的增大而增大,且氧化还原峰电流与扫描速度的平方根成正比,说明电流受扩散控制。
2.3 不同修饰电极界面的交流阻抗行为
图4为不同修饰电极界面在5 mmol/L[Fe(CN)6]3-/4-溶液中的交流阻抗行为。图中曲线a为裸玻碳电极(GCE)的阻抗曲线,可以看出该电极对电子传递几乎无阻碍作用,只受扩散控制;曲线b为修饰了RGO电极的交流阻抗图,其电阻值增大,说明RGO成功修饰在电极上;曲线c为Au/RGO修饰电极的交流阻抗图,电阻值减小,说明金纳米颗粒的导电性良好;曲线d为anti-CRP/Au/RGO修饰电极的交流阻抗图,与曲线c相比其电阻值明显增大(Rct=1 100 Ω),说明抗体已固定在电极表面,从而阻碍了[Fe(CN)6]3-/4-电子的传递作用;曲线e为anti-CRP/Au/RGO修饰的电极在培育了20 ng/mL 的CRP抗原后的交流阻抗曲线,其阻抗明显增大(Rct=1 800 Ω),说明抗原和抗体间发生了特异性结合,导致阻抗增大,进一步阻碍了[Fe(CN)6]3-/4-电子的传递;曲线f为QC labeled anti-CRP/CRP/anti-CRP/RGO/GCE免疫传感器的阻抗曲线,加了标记的抗体后,标记抗体与抗原进一步特异性结合,使得阻抗值进一步增大(Rct=3 500 Ω),说明电极修饰膜对电子传递的阻碍作用增强。
2.4 实验条件的优化
2.4.1 缓冲溶液pH值对传感器响应电流的影响 缓冲溶液的pH值会影响蒽醌二羧酸的氧化还原峰电流,从而进一步影响免疫传感器的灵敏度,本实验考察了不同pH值的HAc-NaAc缓冲溶液对标记抗体材料中QC的氧化峰电流响应的影响。如图5所示,当pH值从4.5增至5.5时,氧化峰电流随之增加,继续增加pH值时,QC的氧化峰电流反而减小,当pH值为5.5时,免疫传感器的电流响应值最大。因此实验选择pH值为5.5的HAc-NaAc缓冲溶液作为最佳测试底液。
2.4.2 固定抗体浓度对传感器响应电流的影响 为了考察固定抗体浓度对该免疫传感器响应电流的影响,本实验在电极表面固定不同浓度的抗体(5,10,20,30,40,50 μg/mL )制备传感器并测其电流响应值,结果显示,响应电流随着固定抗体浓度的增加而增大,并在固定抗体浓度为20 μg/mL时达到最大值,之后响应电流随着固定抗体浓度的增加反而减小。因此,本实验选择最佳固定抗体浓度20 μg/mL。
2.4.3 抗原培育时间对传感器响应电流的影响 固定20 μg/mL抗体和20 μg/mL 抗原,改变抗原培育时间,通过测定响应电流值的大小,考察了抗原培育时间对传感器响应电流的影响。结果显示,随着培育时间的延长,响应电流逐渐增大,45 min时达到最大值,之后电流值随培育时间的增长反而下降。因此选择最佳的抗原培育时间为45 min。

图6 免疫传感器对不同浓度CRP的响应曲线Fig.6 DPV response curves of immunosensor incubated with different concentration of CRP CRP concentration(a-h):0.25,0.5,2.5,5.0,10.0,25.0,50.0,100 ng/mL;inset:calibration curve for the CRP immunosensor

图7 CRP电化学免疫传感器的选择性Fig.7 Selectivity of the CRP electrochemical immunosensor
2.4.4 标记抗体的培育时间对传感器响应电流的影响 固定20 μg/mL抗体和20 μg/mL抗原,同时保持抗体抗原结合时间不变,改变标记抗体培育时间,测定响应电流值,考察了标记抗体的培育时间对免疫传感器响应信号的影响。结果显示,随着标记抗体培育时间的延长,响应电流先增大后略有减小,在45 min时电流出现峰值。所以实验选择45 min为标记抗体的最佳培育时间。
2.5 传感器的校正曲线
为了获得该传感器对不同浓度CRP的响应工作曲线,在最佳实验条件下,分别培育不同浓度CRP的传感器,并对其响应电流值进行测定,结果如图6所示。该传感器在0.25~100 ng/mL范围内具有良好的线性响应,其线性方程为I(μA)=15.37lgc+38.69,相关系数为0.997;灵敏度较高,根据3σ规则,其检出限为0.083 ng/mL。
2.6 免疫传感器的选择性
为考察该免疫传感器的选择性,本实验选择200 ng/mL的甘氨酸(Gly)、1%牛血清蛋白(BSA)和200 ng/mL丙氨酸(Ala)作为干扰物质测定其响应电流值,通过与20 ng/mL CRP的响应电流值作对比来考察传感器的抗干扰能力。从图7可看出,相同的实验条件下甘氨酸、丙氨酸和BSA的响应电流均远小于CRP的响应电流。说明甘氨酸、丙氨酸和BSA对CRP检测的干扰较小,进一步说明该传感器对CRP具有较高的选择性。
2.7 回收率的测定
为了考察该传感器可否用于真实样品中CRP的检测,采用标准加入法将3种不同浓度的CRP抗原分别加至稀释的血清样品中,测定其回收率。由表1可看出,3种加标浓度的回收率在(100±10)%以内,平均回收率为101.5%,且3次测定值的相对标准偏差(RSD)在5%以内,说明该传感器用于真实样品中CRP的测定具有一定的可行性。

表1 真实血样中CRP回收率的测定Table 1 Recoveries of CRP in real human serum
2.8 稳定性的检测
在相隔12 d后,用该传感器在相同实验条件下对CRP进行检测,响应电流值下降了6.4%;相隔25 d后在相同的实验条件下检测CRP,响应电流值下降了7.7%。说明该传感器的稳定性较好,在真实样品中CRP含量的检测方面具有较好的应用价值。
2.9 与其他CRP检测方法的对比
将本方法与其它检测CRP的方法进行对比(如表2),本文所制的传感器具有较高的灵敏度和较低的检出限。

表2 几种检测CRP方法的对比Table 2 The comparison of several detection methods of CRP
3 结 论
本文以AuNPs/RGO作为C-反应蛋白抗体的固定基质,采用蒽醌二羧酸标记C-反应蛋白抗体,制成夹心型的免疫传感器,实现了对CRP的定量检测。利用还原氧化石墨烯修饰电极,增加了电极的表面积,进一步增强了导电性。该传感器具有选择性好、灵敏度高、线性范围宽、检出限低等优点,在测定血清样品中的CRP方面具有较好的应用价值。
[1] Bai S L,Li J J.Chin.J.Caroiol.(白书玲,李建军.中华心血管病杂志),2004,32(8):765-768.
[2] Yoshida Y,Iwasa H,Kumagai S,Yoshida H,Suzuki T.Arch.Gerontol.Geriatr.,2010,51(2):164-168.
[3] Arinzon Z,Peisakh A,Schrire S,Berner Y.Arch.Gerontol.Geriatr.,2011,53(3):364-369.
[4] Xie L L,Wang X.Prog.Physiol.Sci.(谢良麒,王宪.生理科学进展),2004,35(2):113-118.
[5] Huang C J,Lin H I,Shiesh S C,Lee G B.Biosens.Bioelectron.,2010,25(7):1761-1766.
[6] Bryan T,Luo X,Bueno P R,Davis J J.Biosens.Bioelectron.,2013,39(1):94-98.
[7] Sklavou R,Karavanaki K,Critselis E,Kossiva L,Giannaki M,Tsolia M,Papadakisa V,Papargyria S,Vlachoua A,Karantonisa F,Polychronopouloua S,Gourgiotis D.Clin.Biochem.,2012,45(15):1178-1182.
[8] Zhao Y P,Wang H R,Liu S J,Zhao X H,Chen Y C,Yang Y C,Wang W,Wu Y M,Chen A Q,Tang J M,Yao Y S,Li Y,Chen J F,Shen C,Yang S.Gene,2013,512(1):41-46.
[9] Gupta R K,Periyakaruppan A,Meyyappan M,Koehne J E.Biosens.Bioelectron.,2014,59:112-119.
[10] Aref H,Refaat S.Egypt.J.ChestDiseasesTuberculosis,2014,63(3):717-722.
[11] Hou J G,Cao Y T,Zhou H K,Meng L H,Hu F T,Gan N.Chin.J.Sens.Actuators(侯建国,曹玉廷,周汉坤,孟令花,胡富陶,干宁.传感技术学报),2011,24(10):1371-1378.
[12] Liu T Z,Xia J R,Li Y,Chen W K,Zhang S,Liu Y,Zheng L,Yang Y H.Chem.J.Chin.Univ.(刘婷知,夏介仁,李瑶,陈文凯,张帅,刘仪,郑丽,杨云慧.高等学校化学学报),2015,36(10):1880-1887.
[13] Li W Z,Liang C H,Xin Q.Chin.J.Catal.(李文震,梁长海,辛勤.催化学报),2004,25(10):839-843.
[14] Liu Z,Chen X H,Song H H.NewCarbonMater.(刘治,陈晓红,宋怀河.新型炭材料),2002,17(2):73-76.[15] Lü Q,Yan H X,Liu C.Eng.PlasticsAppl.(吕青,颜红侠,刘超.工程塑料应用),2016,44(2):140-144.
[16] Hu K,Kulkarni D D,Cho I,Tsukruk V V.Prog.Polym.Sci.,2014,39(11):1934-1972.
[17] Wei H M,Tian Z H.J.Yangtze.Univ.:Nat.Sci.Ed.(魏红敏,田志宏.长江大学学报:自然科学版),2015,12(5):58-62.
[18] Xiao S J,Yu S W,Tan X Y.Chem.World(肖淑娟,于守武,谭小耀.化学世界),2015,56(6):378-382.
[19] Zhou C,Chen S H,Lou J Z.Mater.Rev.(周超,陈思浩,楼建中.材料导报),2014,28(1):15-20.
[20] Zhuang Q F,Wang Y,Ni Y N.ChemJ.Chin.Univ.(庄欠粉,王勇,倪永年.高等学校化学学报),2015,36(9):1674-1680.
[21] Feng Y J,Wei Y P,Zhao X H,Fu X W,Huang L L,Yang H,Yang Y H.Chem.Res.Appl.(冯亚娟,魏玉萍,赵晓慧,符雪文,黄亮亮,杨华,杨云慧.化学研究与应用),2011,23(4):444-450.
[22] Li H M,Zhang H Y,Lai X W,Liang L,Liu K P,Gou X J.J.Instrum.Anal.(李惠茗,张惠怡,赖祥文,梁立,刘坤平,苟小军.分析测试学报),2016,35(3):292-298.
[23] Ramesh P,Bhagyalakshmi S,Sampath S.J.ColloidInterfaceSci.,2004,274(1):95-102.
[24] Li T,Tan X C,Hu Q,Wu J W,Fang X X,Liu S G,Yu H C,Huang Z Y.J.Instrum.Anal.(李焘,谭学才,胡琪,吴佳雯,方晓雪,刘绍刚,余会成,黄在银.分析测试学报),2014,33(2):212-216.
[25] Huttunen R J,Näreoja T,Mariani L,Härmä H.Biosens.Bioelectron.,2016,83:54-59.
[26] Lee W B,Chen Y H,Lin H I,Shiesh S C,Lee G B.Sens.ActuatorsB,2011,157(2):710-721.
[27] Justino C I,Freitas A C,Amaral J P,Rocha-Santos T A,Cardoso S,Duarte A C.Talanta,2013,108:165-170.
Development of a C-Reactive Protein Immunosensor Based on Au Nanoparticles/Reduced Graphene Oxide
ZHANG Xi,XIA Jie-ren,LI De-lei,ZHANG Kun-lei,BAI Ru-yan,HU Rong*,YANG Yun-hui*
(College of Chemistry and Chemical Engineering,Yunnan Normal University,Kunming 650500,China)
In this paper,Au nanoparticles(Au NPs)/reduced graphene oxide(RGO) was used as the matrix of immunosensor to immobilize c-reactive protein(CRP) antibody on the surface of glassy carbon electrode.A sandwich immunosensor was constructed using quinone dicarboxylic acid as tag.Under the optimal experiment conditions,the concentration of CRP was detected by differential pulse voltammetry.The linear range is 0.25-100 ng/mL with a detection limit of 0.08 ng/mL and a correlation coefficient of 0.997.This immunosensor provides a new simple means for the determination of c-reactive protein.
sandwich immunosensor;c-reactive protein(CRP);reduced graphene oxide;electrochemistry
10.3969/j.issn.1004-4957.2017.03.009
2016-09-12;
2016-11-10
国家自然科学基金项目(21465026,21165023)
O657.1;O629.73
A
1004-4957(2017)03-0349-06
*通讯作者:杨云慧,博士,教授,研究方向:电分析化学与生物传感器,Tel:0871-65941086,E-mail:yyhui2002@aliyun.com 胡 蓉,博士,讲师,研究方向:生物传感器,Tel:0871-65941086,E-mail:hudierong_168@163.com

