分子印迹固相萃取/高效液相色谱法分离和富集枳实中4种黄烷酮
贺美艳,叶玉凤,刘 炎,李珍柱,焦必宁,曾绍梅,苏学素*
(1.西南大学 化学化工学院,重庆 400715;2.中国农业科学院 柑桔研究所,重庆 400712)
分子印迹固相萃取/高效液相色谱法分离和富集枳实中4种黄烷酮
贺美艳1,2,叶玉凤2,刘 炎2,李珍柱1,焦必宁2,曾绍梅1,苏学素1*
(1.西南大学 化学化工学院,重庆 400715;2.中国农业科学院 柑桔研究所,重庆 400712)
采用沉淀聚合法以橙皮素为模板分子,2-乙烯基吡啶为功能单体,二甲基丙烯酸乙二醇酯为交联剂,合成了橙皮素分子印迹聚合物。利用紫外光谱法确定了最佳功能单体与配比,优化了合成条件。采用傅立叶变换红外光谱、扫描电子显微镜、静态吸附对聚合物进行表征。实验结果表明,分子印迹聚合物的吸附性能明显优于空白印迹聚合物,且此聚合物对柚皮苷、橙皮苷、柚皮素和橙皮素的相对选择系数分别为1.40,1.39,1.59和2.89,表明该分子印迹聚合物对4种黄烷酮有较好的选择性。将印迹聚合物作为固相萃取填料,对枳实提取液进行分离和富集,结果表明上述4种黄烷酮的提取率分别为72.6%,61.1%,95.4%和93.5%,分离富集效果良好,大大提高了枳实中4种黄烷酮的提取效率。
分子印迹聚合物(MIP);高效液相色谱;黄烷酮;橙皮素;枳实
枳实为常用中药,应用历史悠久,始载于《神农本草经》,为芸香科植物酸橙 Citrus aurantium L.及其栽培变种或甜橙C.sinensis Osbeck的干燥幼果[1]。枳实性味苦、辛,微寒,归脾胃大肠经,具有破气消积、化痰除痞的功效[2]。枳实的主要成分为生物碱、黄烷酮及挥发油等,其中的黄烷酮是一种黄酮类化合物,主要包括柚皮苷、橙皮苷、柚皮素和橙皮素等物质。目前,提取和分离黄烷酮的方法有超临界流体萃取[3]、高效逆流色谱[4-5]、超声提取[6]、生物酶解[7]、微波辅助、液液萃取(LLE)以及固相萃取等方法,但由于枳实中化学成分较多,基质复杂,对黄烷酮的选择性提取有较大影响,因此,开发一种能够同时分离和富集多种黄烷酮的技术具有重要意义。
分子印迹技术是指为获得在空间和结合位点上与某一分子(模板分子、印迹分子)完全匹配的聚合物的实验制备技术。1972年德国的Wulff 和Sarhan[8]成功制备出分子印迹聚合物来拆分手性外消旋酒石酸盐。与传统的分离或分析介质相比,分子印迹聚合物具有高特异性、高选择性和高强度等特点,而且制备简单、成本低、可重复利用、耐受高温、高压、酸碱和有机溶剂等[9],非常适合作为固相萃取柱的填充材料,近年来广泛应用于色谱分离、固相萃取[10]、仿生传感、模拟酶催化、临床药物分析等领域,有望在生物工程、临床医学、环境监测、食品工业[11-12]等行业形成产业化应用。
枳实中黄烷酮化合物的结构相似,其活性和药理相近,通常具有杀菌、抗炎、抗肿瘤、抗HIV 病毒、抗诱变、抗氧化等活性[13],具有很大的药用价值。利用橙皮素分子印迹聚合物来提取黄烷酮类化合物有少量报道[14-15],但大多数研究是针对单一成分作为提取目标物合成分子印迹聚合物,橙皮素分子印迹固相萃取-高效液相色谱法用于枳实中柚皮苷、橙皮柑、柚皮素、橙皮素4种黄烷酮的分析研究尚未见报道。因此,本文合成了橙皮素分子印迹聚合物,研究了印迹聚合物对4种黄烷酮的选择性差异,并制备了分子印迹固相萃取柱,建立了基于分子印迹固相萃取技术的高效液相色谱同时分离枳实中4种黄烷酮的方法。该方法前处理过程简便、高效、环保,且有机溶剂用量低,降低了对人体的伤害和对空气的污染,可用于枳实中4种黄烷酮类物质的纯化、分离与富集。
1 实验部分
1.1 仪器与试剂
TU-1810紫外分光光度计(北京普析通用仪器有限责任公司),Waters高效液相色谱仪(美国Waters 公司),JSM-7800F热场发射扫描电子显微镜(日本电子株式会社),CZX-GFC.101-2-BS电热恒温鼓风干燥箱(上海博泰实验设备有限公司),KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司),Milli-Q纯水机(法国 Millipore 公司),梅特勒AB304-S/FACT电子天平(上海志荣电子科技有限公司),DF101S集热式恒温加热磁力搅拌器(郑州科泰实验设备有限公司),Bruker tensor 27傅立叶红外光谱仪(德国Bruker公司)。
橙皮素(Hesperetin)、橙皮苷(Hesperidin)、柚皮素(Naringenin)、柚皮苷(Naringin)标准品(Sigma-Aldrich公司);枳实(重庆市北碚区歇马镇和平药店);2-乙烯基吡啶(2-VP)、二甲基丙烯酸乙二醇酯(EGDMA,Aliaddin Industrial Corporation)、偶氮二异丁腈(AIBN)、丙烯酰胺(AM)、α-甲基丙烯酸(MAA)、2-(三氟甲基)丙烯酸(TFMAA)均为分析纯,成都市科龙化工试剂厂,乙腈、甲醇(色谱纯,Sigma-Aldrich公司)、冰醋酸(分析纯,川东化工集团有限公司)。
1.2 高效液相色谱条件
色谱柱:X-Bridge®C18(5 μm,4 mm×250 mm),流速:1 mL/min,柱温:25 ℃,进样量:10 μL,检测波长:283 nm,压力:1 366 psi。流动相:A为0.2%乙酸溶液,B为乙腈;梯度洗脱程序:0~10 min,85%~75% A;10~20 min,75%~60% A;20~30 min,60%~50% A;30~35 min,50%~0% A;35~40 min,0% A;40~45 min,0%~85% A;45~50 min,85% A。
1.3 分子印迹聚合物的制备
准确称取模板分子橙皮素于100 mL圆底烧瓶中,加50 mL致孔剂乙腈溶解,待其完全溶解后加入功能单体2-VP,超声30 min,加入交联剂EGDMA和引发剂AIBN,超声脱气10 min,通N2除氧10 min,密封,放入60 ℃水浴中反应24 h,待反应完成后,真空干燥,然后用乙酸-甲醇(体积比3∶7)索氏提取洗脱模板分子直至HPLC检测不到模板分子为止,用甲醇索氏提取法洗去聚合物中残留的乙酸,70 ℃真空干燥8 h,得到分子印迹聚合物(MIP),备用。空白印迹聚合物(NIP)的制备除不加橙皮素外,其他条件与MIP相同。
1.4 聚合物的结构表征
用傅立叶红外光谱仪测定橙皮素、MIP(未洗脱)和NIP(未洗脱)的红外光谱图,分析其特征吸收峰的变化。将制备的MIP和NIP进行扫描电镜观察,分析其表面形态特征。
1.5 静态吸附性能测定和Scatchard分析
分别称取9份10 mg MIP和NIP于10 mL离心管中,加入2 mL浓度为2~120 mg/L的橙皮素标准溶液,摇床振荡2 h,4 000 r/min离心分离20 min,过0.22 μm滤膜,HPLC检测MIP和NIP吸附前后橙皮素的浓度,根据吸附前后浓度的变化,由式(1)计算MIP和NIP对橙皮素的吸附量,得吸附量(Q)对起始浓度(C0)的等温吸附曲线。
Q=[103(C0-Ce)·V]/(M·W)
(1)
采用Scatchard模型评价聚合物的结合特性。式(2)中,当以Q/Ce对Q作图时,根据线性关系的斜率和截距可求得结合平衡常数Kd和最大表观结合量Qmax。
Q/Ce=(Qmax-Q)/Kd
(2)
式中,C0为橙皮素的初始浓度(mg/L),Ce为吸附平衡浓度(mg/L),V为橙皮素溶液的体积(mL),M为橙皮素的摩尔质量,W为聚合物的质量(g),Q为聚合物的平衡吸附量(μmol/g),Qmax为最大表观结合量(μmol/g);Kd为结合位点的平衡离解常数。
1.6 选择性能评价实验
为研究聚合物对4种黄烷酮的选择性,称取5 mg MIP和NIP加入一定浓度的4种黄烷酮混合标准溶液,恒温摇床振荡2 h,离心10 min(4 000 r/min),分离上清液,过0.22 μm滤膜,HPLC测定各物质的平衡浓度,按公式(3)[16],计算各物质的分配系数,得到MIP和NIP对底物的选择性系数(Ie)。其中,Kd(mL/g)为某物质的分配系数;KMIP和KNIP分别为MIP和NIP对目标物吸附达平衡的分配系数。
Kd=C0/Ce;Ie=KMIP/KNIP
(3)
1.7 枳实中4种黄烷酮的分子印迹固相萃取
精确称取2g枳实细粉末于100mL圆底烧瓶中,加入20mL甲醇后称重,水浴回流1.5h[17],冷却至室温,再次称重,用甲醇补足损耗,过滤,取上清液过0.22μm滤膜,待MISPE净化。
称取100mgMIP和NIP分别溶于丙酮后湿法装入3mL固相萃取空柱,上样前依次用甲醇、乙腈和水各2mL进行活化,用1mL10mg/L的4种黄烷酮混合标准溶液上样,淋洗,洗脱,收集洗脱液,N2吹干后,用甲醇复溶,HPLC测定。
2 结果与讨论
2.1 高效液相色谱方法的建立
配制浓度为2~120mg/L的4种黄烷酮标准溶液,经HPLC测定,绘制峰面积(y)对其质量浓度(x,mg/L)的曲线图,得到柚皮苷、橙皮柑、柚皮素、橙皮素4种黄烷酮的标准曲线、保留时间和检出限。结果显示,4种黄烷酮在2~120 mg/L范围内呈良好的线性关系,其相关系数分别为0.999 8,0.999 1,0.999 9,0.999 8;检出限分别为0.5,0.5,0.2,0.2 mg/L。
2.2 聚合物制备条件的优化
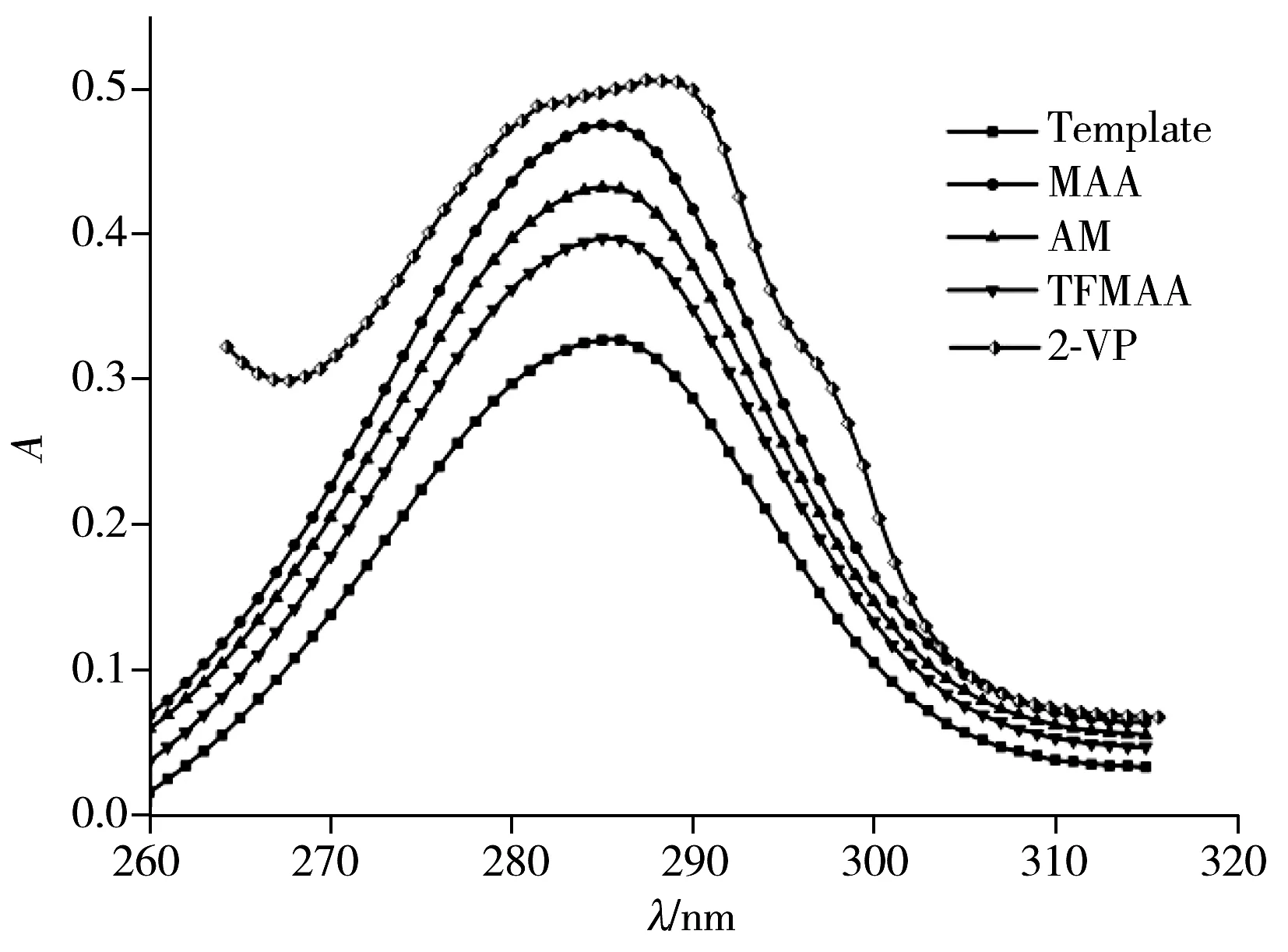
图1 不同功能单体与橙皮素预聚合后的紫外吸收波长Fig.1 UV-spectra of hesperetin with different monomers after prepolymerization
2.2.1 功能单体及其用量的选择 功能单体能否与模板分子形成氢键是制备MIP的关键。利用紫外分光光度计测定橙皮素与不同的功能单体(MAA,2-VP,AM,TFMAA)预聚合后最大吸收峰的变化情况。实验结果如图1,当功能单体为2-VP时,橙皮素的紫外最大吸收峰发生了较明显的红移,这可能是由于弱酸性的橙皮素在预聚合过程中与碱性的功能单体2-VP能较好地形成氢键。故实验选择2-VP作为功能单体。
模板分子与功能单体的比例也会影响聚合物的吸附性能及其选择性,利用紫外分光光度计考察了橙皮素与2-VP在不同摩尔比下(1∶0,1∶2,1∶4,1∶6,1∶8)聚合后最大吸收峰的变化,实验结果表明,当橙皮素与2-VP的比例为1∶6时,紫外最大吸收峰发生了较大的红移,所以模板分子与2-VP的最佳比例为1∶6。
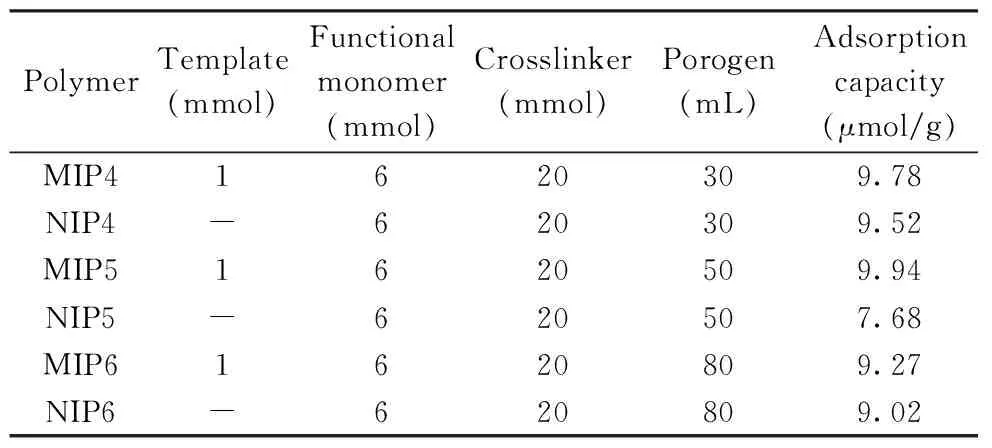
表1 致孔剂用量对聚合物的影响Table 1 The effect of the amount of porogen on polymers
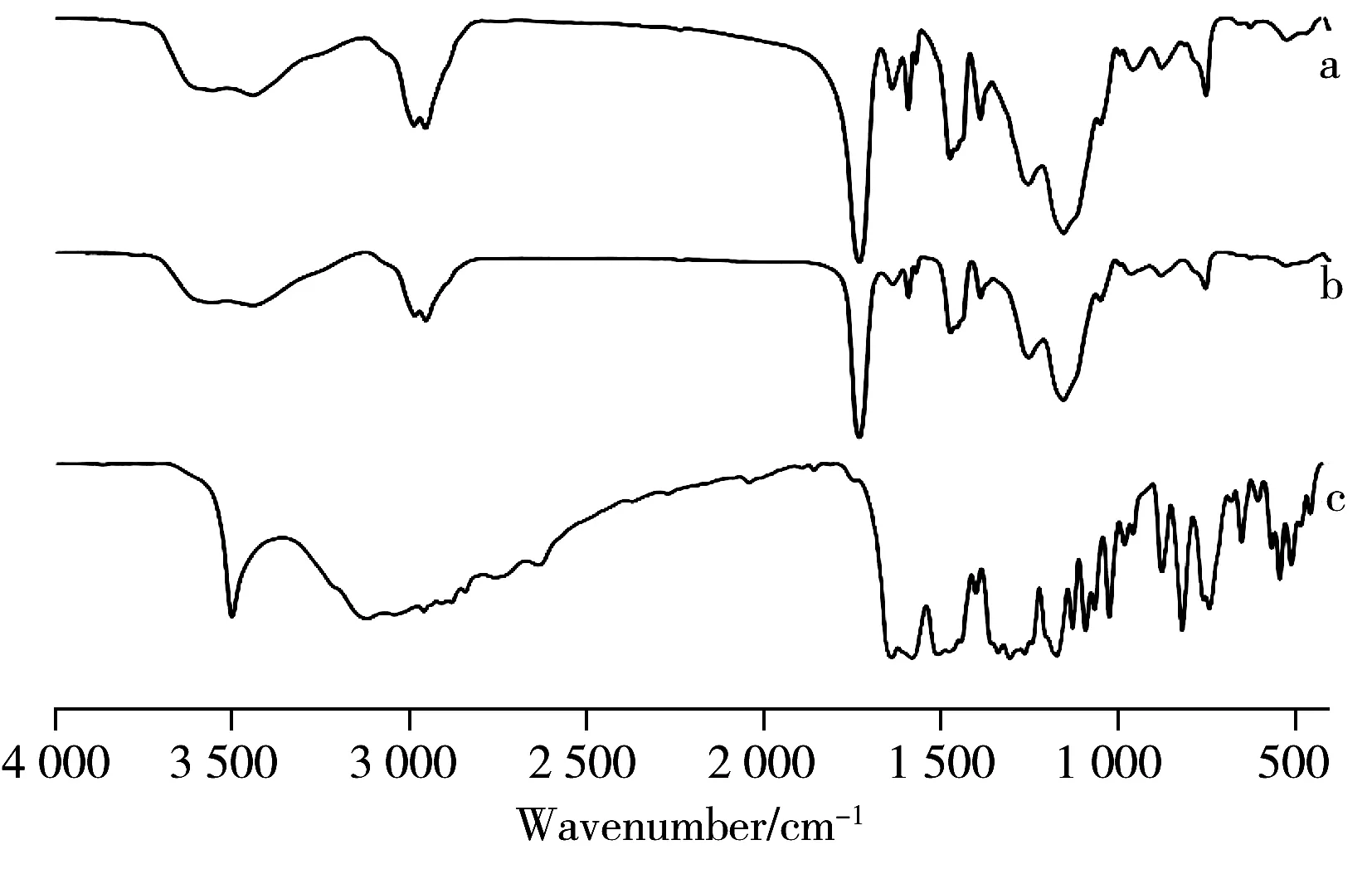
图2 MIP未洗脱(a),NIP未洗脱(b)和橙皮素(c)的红外光谱Fig.2 Infrared spectra of MIP(before eluting)(a),and NIP(b)(before eluting) and hesperetin(c)
2.2.2 交联剂用量的确定 交联剂(EGDMA)的作用是固定模板分子和功能单体之间形成的复合体,使之在聚合物中具有固定的结合位点,从而实现聚合物对模板分子的专一选择性,所以EGDMA的用量至关重要。实验测定了橙皮素与EGDMA的摩尔比为1∶10(MIP1),1∶20(MIP2),1∶40(MIP3)时的吸附量,结果表明当橙皮素与EGDMA的比例为1∶20 时,MIP2的吸附量最大,且与NIP2的吸附差异性较大,故选择两者的最佳比例为1∶20。
2.2.3 致孔剂用量的确定 溶剂在聚合过程中通常作为分散介质和致孔剂,为聚合物的形成提供了合成环境[18],实验选择极性较小的乙腈为致孔剂,考察了致孔剂用量对聚合物的影响(表1)。结果显示,当致孔剂的用量为50 mL时,分子印迹聚合物的吸附量较大且MIP5与NIP5的静态吸附差异性较大,突出了MIP的优势。
综上所述,筛选得到分子印迹聚合物的最优制备条件为橙皮素∶2-VP∶EGDMA=1∶6∶20,致孔剂为50 mL乙腈。
2.3 聚合物的结构表征


图3 MIP(A)和NIP(B)的扫描电镜图Fig.3 Scanning electron micrograms of MIP(A) and NIP(B)

2.4 静态吸附性能和Scatchard分析
为研究聚合物的结合特性,测定了MIP和NIP吸附达平衡时的结合量Q,并对初始浓度(C0)作图,结果表明,MIP和NIP对橙皮素的结合量随浓度先增加后减少,在100 mg/L 时结合量达到最大,且在整个吸附过程中MIP对橙皮素的吸附量明显高于NIP,说明MIP 的吸附能力主要来自于特异性结合位点,而 NIP 的吸附为非特异性结合。
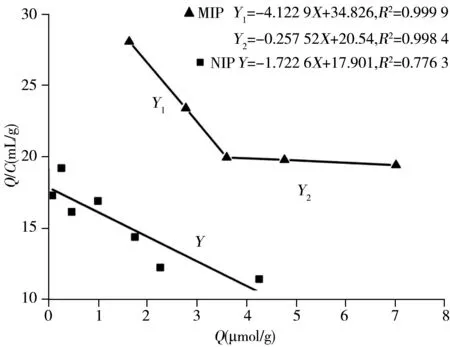
图4 MIP和NIP的Scatchard方程Fig.4 Scatchard equations of MIP and NIP
由Scatchard分析曲线(图4)可知,对MIP而言,Q/C对Q呈非线性关系,而图的两端呈线性,表明结合位点是非均一的,MIP有两种不同类型的结合位点,即特异性结合位点和非特异性结合位点[21],可计算出MIP所对应的Kd1=0.243 μmol/mL,Qmax1=143.61 μmol/g;Kd2=3.88 μmol/mL,Qmax2=5.29 μmol/g。而NIP线性关系较好,说明NIP只有一种吸附即非特异性吸附,其所对应的Kd=0.58 μmol/mL,Qmax=30.86 μmol/g。
2.5 选择性能评价实验
根据平衡时的分配系数公式和吸附选择系数公式,可计算出MIP和NIP对柚皮苷、橙皮苷、柚皮素和橙皮素的选择性系数分别为1.40,1.39,1.59和2.89。由于该值越大,表明MIP及NIP对底物的选择吸附性越强,可知MIP对橙皮素的选择性大于其他3种物质,且MIP对4种结构类似物的分配系数均高于NIP。以上结果表明,MIP对4种黄烷酮类结构类似物具有一定的类特异选择性。
2.6 分子印迹固相萃取
2.6.1 分子印迹固相萃取条件的优化 考察了4种黄烷酮标准溶液经过上样、淋洗和洗脱程序后在MISPE柱上的保留特性、柱去杂效果和目标物洗脱,从而筛选出最优固相萃取条件。选择甲醇为上样溶剂,固相萃取柱的吸附性较好;淋洗液选用甲醇-水(1∶20),洗脱液选择极性较强的乙酸-甲醇混合液(3∶7)。实验结果显示,MIP对柚皮苷、橙皮苷、柚皮素和橙皮素的回收率分别为85.4%,65.1%,94.3%和94.5%,回收率均高于NIP,说明MIP对4种黄烷酮的吸附能力比NIP强,即MIP具有类特异性吸附,而且MIP对结构差异较大的橙皮苷和柚皮苷的吸附能力比橙皮素,以及结构与橙皮素相似的柚皮素小,表明MIP具有一定的吸附差异性。
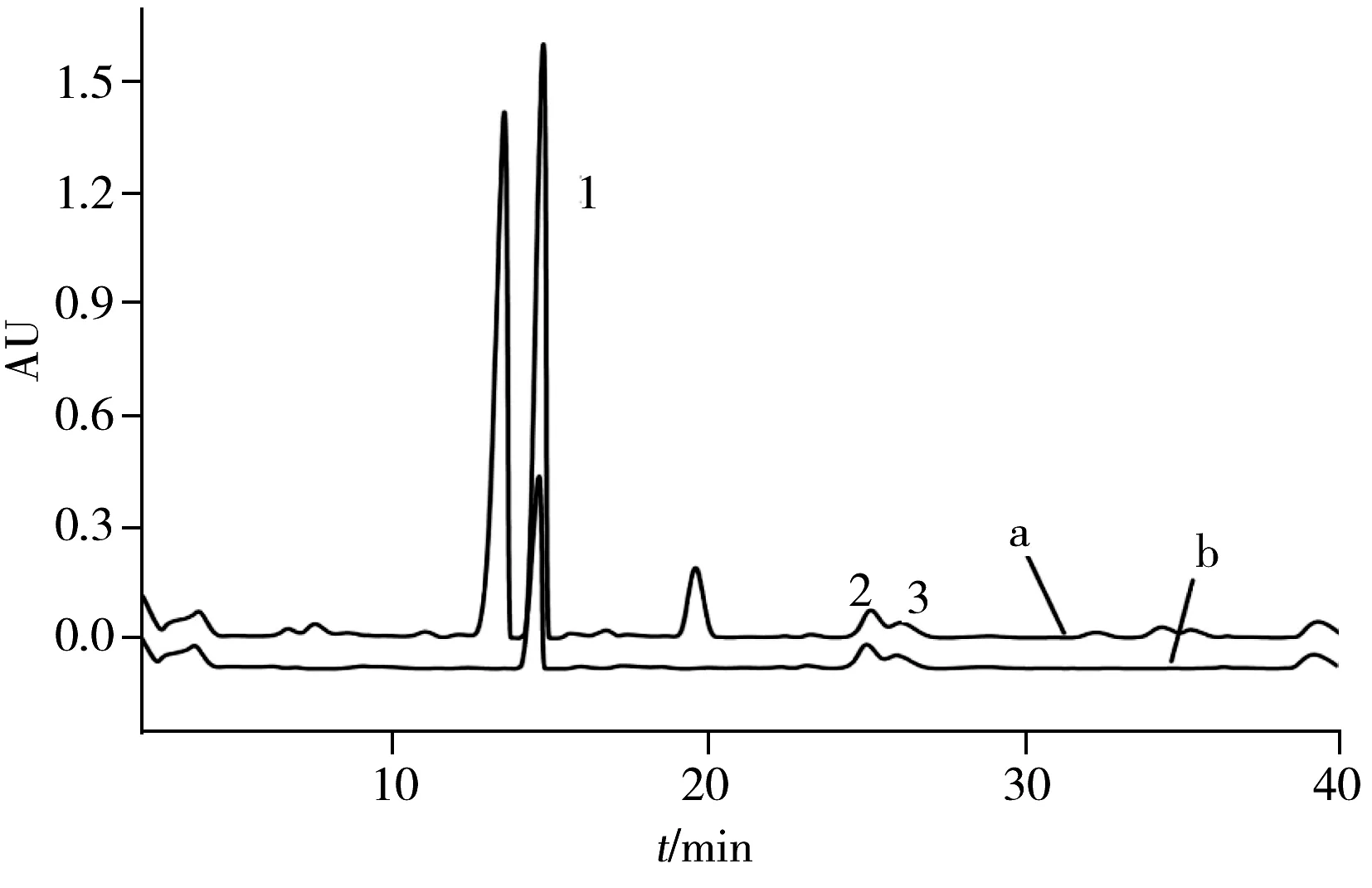
图5 枳实提取液(a)与MISPE净化后枳实洗脱液(b)的色谱图Fig.5 Chromatograms of crude extraction of citrus aurantium (a) and eluting solutions from MIPSPE column(b) 1:hesperidin;2:naringenin;3:hesperetin
2.6.2 实际样品的分析 在最优固相萃取条件下分离、富集枳实中4种黄烷酮,图5a为枳实提取液的色谱图(枳实中柚皮苷的含量很少,在HPLC色谱图中未观察到,故图5中未标出),图5b为经MISPE柱净化后得到洗脱液的色谱峰。发现经MISPE柱净化后枳实提取液中的杂峰被有效去除,达到了分离目的。实验结果表明,MIP对枳实中4种黄烷酮的提取率(61.1%~95.4%)明显优于NIP(40.0%~68.8%),且4种黄烷酮的提取率大小顺序为柚皮素>橙皮素>柚皮苷>橙皮苷,枳实中4种黄烷酮的提取量分别为0.075 mg/g(柚皮苷),7.55 mg/g(橙皮苷),0.49 mg/g(柚皮素),0.29 mg/g(橙皮素),说明MIP对4种黄烷酮具有较好的识别能力和类特异性吸附性能,可以很好地应用于枳实中4种黄烷酮的分离与富集。
3 结 论
本文以橙皮素为模板分子,2-乙烯基吡啶为功能单体,二甲基丙烯酸乙二醇为交联剂,乙腈为致孔剂,在模板分子∶功能单体∶交联剂的比例为1∶6∶20条件下采用沉淀聚合法合成了橙皮素分子印迹聚合物,聚合物对4种黄烷酮具有较好的识别能力和类特异性吸附性能。筛选和优化了分子印迹聚合物的合成条件,建立了基于MISPE技术快速分离和富集枳实中4种黄烷酮的高效液相色谱方法,从而为研究天然植物的分离富集以及中药制品中黄烷酮的质量控制提供了技术支撑。
[1] Zhang X X,Li Z Y,Ma Y L,Ma S C.Chin.J.Chin.Meter.Med.(张霄潇,李正勇,马玉玲,马双成.中国中药杂志),2015,40(2):185-190.
[2] Ma X Q,Li C,Yuan L H,Wang S J,Liu X Q.J.Chin.Pharm.Univ.(马雪琴,李辰,袁林华,王世俊,柳晓泉.中国药科大学学报),2013,44(2):161-166.
[5] Zheng G D,Zhou F,Jiang L,Yang D P,Yang X,Lin Y W.Chin.Tradit.HerbalDrugs(郑国栋,周芳,蒋林,杨得坡,杨雪,林乐维.中草药),2010,41(1):52-55.
[6] Jiang Z G.J.SouthChin.Univ.TropicalAgric.(蒋志国.华南热带农业大学学报),2006,12(3):32-35.
[7] González-Barrio R,Trindade L M,Manzanares P,DEGraaff L H,Tomás-Barberán F A,Espín J C.J.Agric.FoodChem.,2004,52(20):6136-6142.
[8] Wulff G,Sarhan A.Angew.Chem.Int.Ed.,1972,11(4):341.
[9] Liu H J.SynthesisandRecognitionPropertyStudyofSulfa-drugsMloecularlyImprintedPolymer.Changsha:Hunan University(刘慧君.磺胺类药分子印迹聚合物的合成及其识别性能的研究.长沙:湖南大学),2005.
[10] Pardeshi S,Singh S K.RSCAdv.,2016,6:23525-23536.
[11] Wang X H,Xie L F,Dong Q ,Liu H L,Huang Y P,Liu Z S.J.Chromatogr.B,2015,1007:127-131.
[12] Wang P L,Sun X H,Su X O,Wang T.Analyst,2016,141:3540-3553.
[13] Li Y H.PreparationSeparationandAdsorptionPropertiesofMolecularlyImprintedPolymers.Xinxiang:Henan Normal University(李亚辉.分子印迹聚合物的制备及其吸附性能研究.新乡:河南师范大学),2012.
[14] Shao H K,Zhao L G,Chen J,Zhou H T,Huang S T,Li K.J.Pharm.Biomed.Anal.,2015,111:241-247.
[15] Deng X S,Su L Q.Chem.Ind.Times(邓茜珊,苏立强.化工时刊),2009,23(4):28-30.
[16] Wang N,Xiao S J,Su C W.ColloidPolym.Sci.,2016,294:1305-1314.
[17] Huang A H,Cao C,Zeng Y E,Chen H F.J.Pharm.Anal.(黄爱华,曹骋,曾元儿,陈海丰.药物分析杂志),2009,(9):1448-1450.
[18] Song X L,Li J H,Wang J T,Chen L X.Talanta,2009,80(2):694-702.
[19] Li C,Shi B,Zhang M K,Jiu Z W,Cheng Y Q.Sci.Technol.FoodInd.(李超,石波,张梦柯,韭泽悟,程永强.食品工业科技),2012,33(19):53-57.
[20] Zeng S M,Jiao B N,Liu G Y,Wang S S,Zhao F N,Zhang C,Wang J,Jin J M,Jin F,Shao H,Zheng L F,Ma X B,Wu J C M,Su X S,She Y X.J.Instrum.Anal.(曾绍梅,焦必宁,刘广洋,王珊珊,赵风年,张超,王静,金茂俊,金芬,邵华,郑鹭飞,马兴斌,吴金措姆,苏学素,佘永新.分析测试学报),2016,35(4):373-379.
[21] Zeng S M,She Y X,Jiao B N,Liu G Y,Wang J,Su X S,Ma X B,Jin M J,Jin F,Wang S S.RSCAdv.,2015,5(115):94997-95006.
Molecularly Imprinted Solid-phase Extraction Combined with High Performance Liquid Chromatography for Separation and Enrichment of Four Flavanones in Citrus Aurantium
HE Mei-yan1,2,YE Yu-feng2,LIU Yan2,LI Zhen-zhu1,JIAO Bi-ning2,ZENG Shao-mei1,SU Xue-su1*
(1.School of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China;2.Citrus Research Institute,Chinese Academy of Agricultural Sciences,Chongqing 400712,China)
A molecularly imprinted polymer to recognize four flavanones(hesperetin,hesperidin,naringenin,naringin) was prepared via precipitation polymerization using hesperetin as template molecule,2-vinylpyridine(2-VP) as functional monomer,and ethylene glycol dimethacrylate(EGDMA) as cross-linking agent.The optimal functional monomer and ratio were selected by UV spectrum method,and the optimized synthesis conditions were obtained.The molecularly imprinted polymer(MIP) and non-molecularly imprinted polymer(NIP) were characterized by scanning electron microscopy(SEM),Fourier transform infrared spectroscopy(FTIR) and static adsorption experiments.The MIP and NIP were used as selective sorbents for the comparative determination of naringin,hesperidin,naringenin,hesperetin.The results showed that the MIP had higher selective adsorption capacity to four flavanones than the NIP,and the relative selectivity coefficients(Ie) were 1.40,1.39,1.59 and 2.89,respectively.A molecularly imprinted solid phase extraction(MISPE)column filled with the polymer material was prepared to enrich and separate four flavanones in Citrus aurantium.In the optimum conditions,four flavanones of the Citrus aurantium was extracted by solid phase extraction.The results showed that the extraction efficiencies for four flavanones were 72.6%(naringin),61.1%(hesperidin),95.4%(naringenin) and 93.5%(hesperetin),respectively.The MISPE with neglectable matrix interference exhitited a good separation effect and greatly improved the extraction efficiencies for four flavanones in Citrus aurantium.
molecularly imprinted polymer(MIP);high performance liquid chromatography(HPLC);flavanones;hesperetin;citrus aurantium
10.3969/j.issn.1004-4957.2017.03.005
2016-09-19;
2016-10-19
国家现代农业(柑橘)产业技术体系建设专项(CARS-27);柑橘及热带果品未知危害因子识别与已知危害因子安全性评估(GJFP2016004)
O657.72;TQ460.72
A
1004-4957(2017)03-0325-06
*通讯作者:苏学素,副教授,研究方向:生物有机药物合成,Tel:023-68349603,E-mail:suxuesu@163.com

