基于UPLC-Q-TOF-MS法分析凉山虫草化学成分
秦伟瀚,刘 翔,阳 勇,张小梅,郭延垒,刘 飞
(重庆市中药研究院,重庆 400065)
基于UPLC-Q-TOF-MS法分析凉山虫草化学成分
秦伟瀚,刘 翔,阳 勇,张小梅,郭延垒,刘 飞*
(重庆市中药研究院,重庆 400065)
应用超高效液相色谱-四极杆串联飞行时间质谱法(UPLC-Q-TOF-MS)对凉山虫草提取物的主要化学成分进行定性分析。采用Agilent SB-C18(50 mm×4.6 mm,1.8 μm)色谱柱,以0.1%甲酸水-乙腈溶液为流动相,梯度洗脱,流速0.25 mL/min,柱温30 ℃;质谱分析采用信息关联模式(IDA)正、负离子分别采集。应用PeakView软件的Formula Finder等功能、各色谱峰的质谱数据与数据库匹配结合各色谱峰的二级碎片裂解规律,共鉴定出27个化合物,其中8个为虫草中未曾报道物质;主要化学成分包括生物碱、糖苷、核苷、氨基酸等成分。该方法精确、可靠、高效,适用于凉山虫草成分的快速鉴定,为凉山虫草的开发利用以及阐明其药效物质基础提供了参考。
凉山虫草;UPLC-Q-TOF-MS;裂解规律;化学成分
虫草属(Cordyceps(Fr.)Link)为真菌寄生于昆虫,并从其头部或体表长出子实体的虫菌复合体[1-3]。在我国该属共有139个名称,分布于29个省区[4]。凉山虫草(Cordycepsliangshanensis)始载于《四川通志》,为麦角菌科真菌寄生在鳞翅目昆虫幼虫的子座和幼虫尸体的干燥物,产于四川、云南等省区,生长海拔较低。其性甘、味平,归肾、肺经,具有补肺益肾之功效,主治虚喘劳嗽等症。基于功效上的相似性在四川部分地区已作为冬虫夏草的替代品种使用,并于1987年载入《四川省中药材标准》[5-10]。近年来对凉山虫草的研究逐渐成为热点,有不少关于其药理、毒理及化学成分方面的研究报道[11-20]。本研究首次采用超高效液相色谱-四极杆串联飞行时间质谱法(UPLC-Q-TOF-MS)分析凉山虫草的主要化学成分,以电喷雾离子源正、负离子模式分别对色谱流出物进行检测,并通过高分辨质谱分析结合数据库及相关文献共鉴定出27个化合物,其中有8个为虫草中未曾报道物质,鉴定成分中主要包括生物碱、糖苷、核苷、氨基酸类等。该研究为凉山虫草的药效学物质基础和质量评价提供了科学依据。
1 实验部分
1.1 仪器与试药
LC-30A型超高效液相色谱仪(日本岛津公司):二元高压泵、自动进样器、柱温箱;TripleTOFTM 4600型四极杆串联飞行时间高分辨质谱仪(美国AB公司):Analyst 1.6工作站、PeakView 1.2.0.3 数据处理软件;JY92-ⅡD型超声波细胞粉碎机(宁波新艺超声设备有限公司);超低温冷冻储存箱(中科美菱公司);CPA225D型十万分之一分析天平(德国赛多利斯公司)。
乙腈、水(色谱级,德国Merck公司);甲酸(色谱级,美国ACS公司);甲醇(分析纯,重庆川东化工公司)。
虫草样品经重庆市中药研究院生药研究所研究员鉴定为麦角菌科虫草菌属真菌子座与幼虫尸体复合体凉山虫草(Cordycepsliangshanensis)。
1.2 实验方法
1.2.1 色谱条件 采用Agilent SB-C18(50 mm×4.6 mm,1.8 μm)色谱柱,柱温:30 ℃,流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱程序:0~12 min,10%~95% B;12~16 min,95% B;16~16.5 min,95%~10% B,16.5~20 min,10% B;进样量2 μL,流速0.25 mL/min。
1.2.2 质谱条件 采用电喷雾离子源(ESI),正/负离子模式,喷雾电压(IS)分别为+5 500 V,-4 500 V;雾化气压力(GS1)为45 psi;气帘气压力(CUR)为25 psi;辅助气压力(GS2)为50 psi;离子源温度(TEMP)为500 ℃;簇裂解电压(DP)为64 V;碰撞能量(CE)为47 V;碰撞能量滚动区间(CES)为15 V;检测模式为信息关联采集模式(IDA),多重质量亏损(MMDF)和动态背景扣除(DBS)为触发二级扫描的条件,满足该条件优先进行二级扫描。
1.2.3 样品制备 将虫草样品切段后置于-80 ℃冰箱冷冻1 h,迅速取出于研钵中研成细末,精密称定虫草样品粉末0.1 g,置于5 mL试管中,加入75%甲醇2 mL,精密称定,于超声波细胞破碎仪中超声处理(功率:600 W) 30 min,取出,放冷,再次称定重量,用75%甲醇补足减失的重量,摇匀,过0.22 μm微孔滤膜,即得。
2 结果与讨论
2.1 实验条件的优化
2.1.1 提取方法的优化 考察了不同提取溶剂(甲醇、乙醇、乙酸乙酯、水);不同提取方法(冷浸、超声、回流、细胞破碎);不同溶剂比例(65%,70%,75%,80%,85%)及不同提取时间(10,20,30,40 min),最终确定以75%的甲醇细胞破碎30 min为最佳的提取方案。
2.1.2 色谱-质谱条件的优化 考察了不同流动相(甲醇-水、乙腈-水、甲醇-0.1%甲酸水溶液、乙腈-0.1%甲酸水溶液、乙腈-5 mmol/L乙酸铵水溶液)以及不同色谱柱(Agilent SB-C18,Waters BEH-C18,Phenomenex NUNA-C18柱),根据主要化合物的TIC响应值及分离效果,最终确定乙腈-0.1%甲酸水溶液为样品分析的流动相,Agilent SB-C18为样品分析色谱柱。在TOF MS模式下,以样品TIC响应值大小为参考,逐个微调Gas1,Gas2,CUR,IS,TEM及喷雾针位置等离子源参数(如“1.2.2”所述),以使总离子流响应达到最佳。
2.2 化学成分的分析鉴定
采用上述色谱质谱条件,对凉山虫草样品进行正、负离子模式采集,全扫描总离子流图见图1,所得结果导入Peak View软件,将满足质量误差小于5 ppm、同位素分布正确且含有二级碎片的化合物确认为目标物质,结合Peak View软件Formula Finder功能、数据库及二级碎片裂解规律,从凉山虫草醇提样品中找到5类共27个化合物(表1),通过对照文献,发现其中有8个成分未曾报道,课题组对成分做了进一步研究,研究显示其主要化学成分包括以下5种类型:
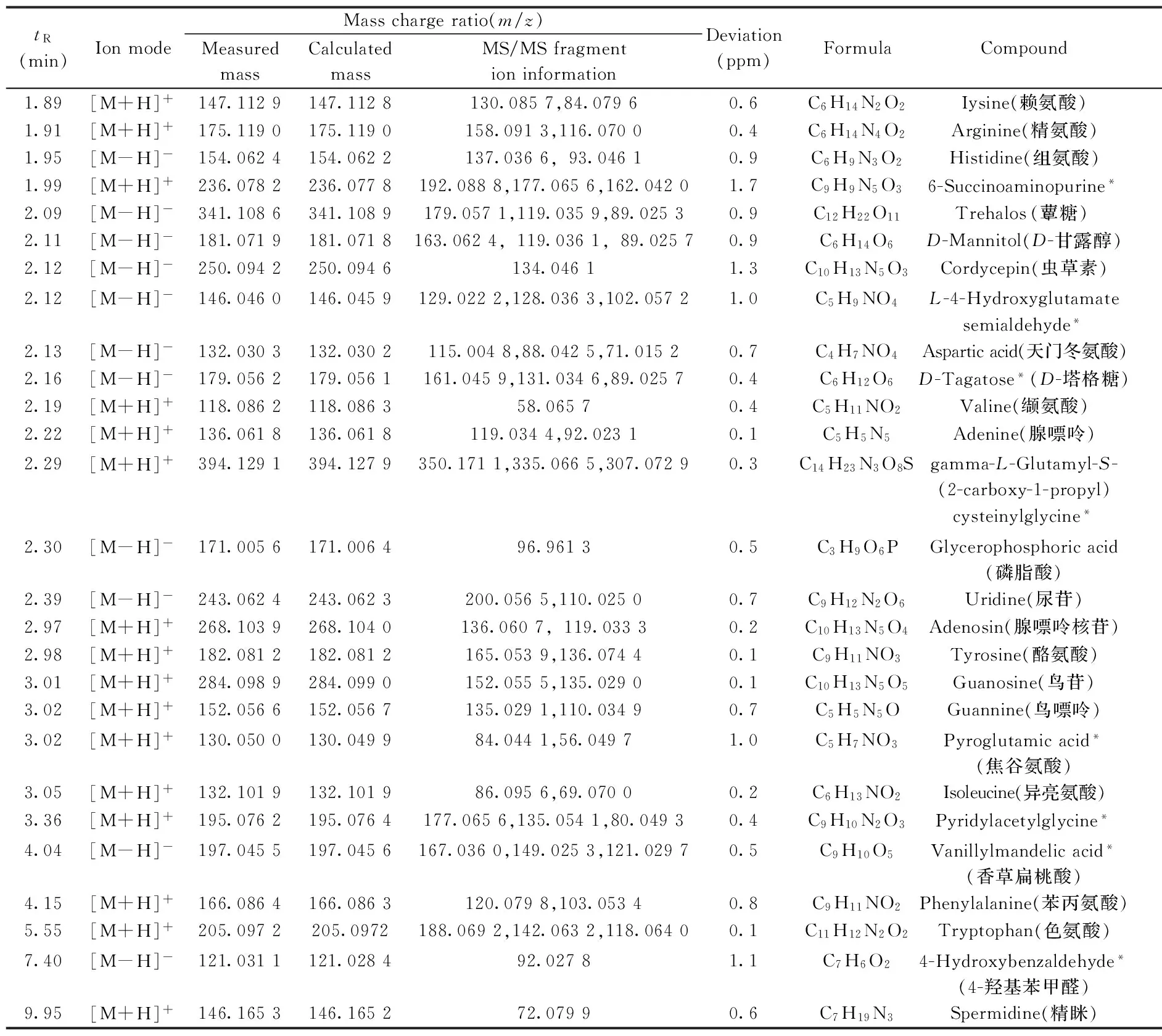
表1 凉山虫草的UPLC-Q/TOF分析结果Table 1 Analysis results for Cordyceps liangshanensis by UPLC-Q/TOF
*compounds not reported in the literature of Cordyceps sinensis(虫草中未报道成分)
2.2.1 生物碱类 生物碱是虫草类药材的有效成分之一,但已知种类较少。在正离子模式下,保留时间为3.36 min获得m/z195.076 2[M+H]+的质谱信号,二级质谱出现m/z177.065 6,135.054 1,80.049 3质谱峰,根据数据库匹配出分子式为C9H10N2O3,推测该化合物为Pyridylacetylglycine,二级碎片离子为[M+H-OH]+,[M+H-C2H4O2]+,[M+H-C4H4NO3]+,其MS/MS图谱见图2;保留时间为9.95 min获得m/z146.165 3[M+H]+的质谱信号,二级质谱出现m/z72.079 9质谱峰,根据数据库匹配出分子式为C7H19N3,推测该化合物为精眯,二级碎片离子为[M+H-C3H9N2]+,据文献报道冬虫夏草中含有此物质[21]。
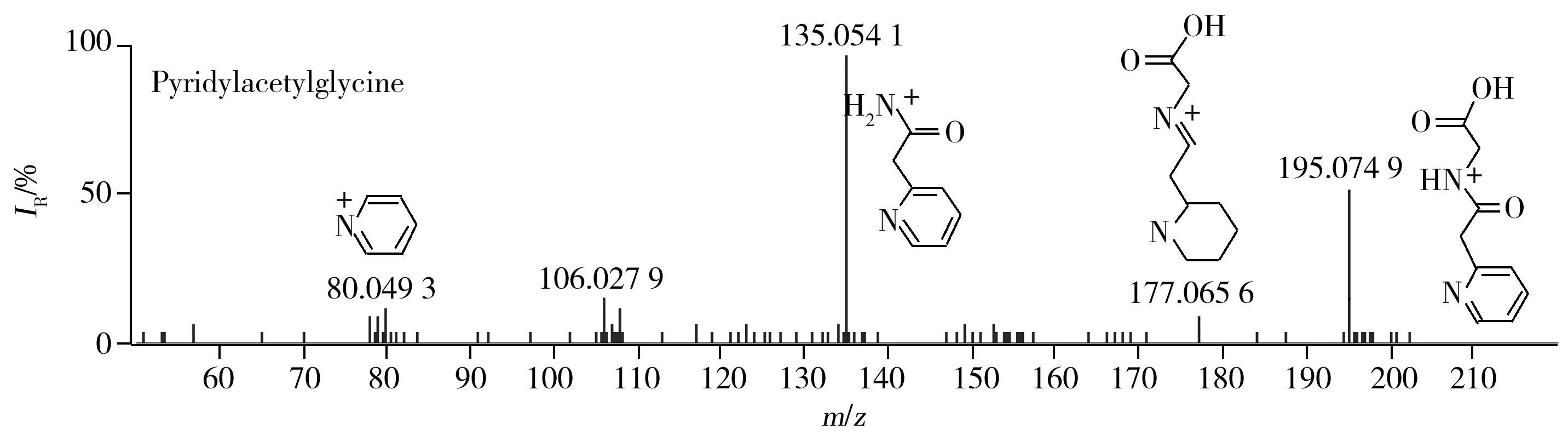
图2 正离子模式下Pyridylacetylglycine 的MS/MS图谱Fig.2 MS/MS spectrum of pyridylacetylglycine in negative ion mode
2.2.2 糖苷类 虫草中含有多种糖苷类成分,且主要含于子座。在负离子模式下共找到3种糖苷类物质,保留时间为2.09 min获得m/z341.108 62[M-H]-的质谱信号,二级质谱出现179.057 1,119.035 9,89.025 3质谱峰,根据数据库匹配出分子式为C12H22O11,推测该化合物为蕈糖,二级碎片离子为[M-H-C6H11O5]-,[M-H-C8H15O7]-,[M-H-C9H17O8]-,蕈糖的MS/MS图谱见图3;保留时间为2.11 min获得m/z181.071 9[M-H]-的质谱信号,二级质谱出现163.062 4,119.036 1,89.025 7质谱峰,根据数据库匹配出分子式为C6H14O6,推测该化合物为D-甘露醇,二级碎片离子为[M-H-H2O]-,[M-H-C2H6O2]-,[M-H-C3H8O3]-;保留时间为2.16 min获得m/z179.056 2[M-H]-的质谱信号,二级质谱出现161.045 9,131.034 6,89.025 7质谱峰,根据数据库匹配出分子式为C6H12O6,推测该化合物为D-塔格糖,二级碎片离子为[M-H-H2O]-,[M-H-H2O-CH2O]-,[M-H-C3H6O3]-。据查证虫草相关文献,除D-塔格糖外上述糖苷类物质均有报道[22-25]。
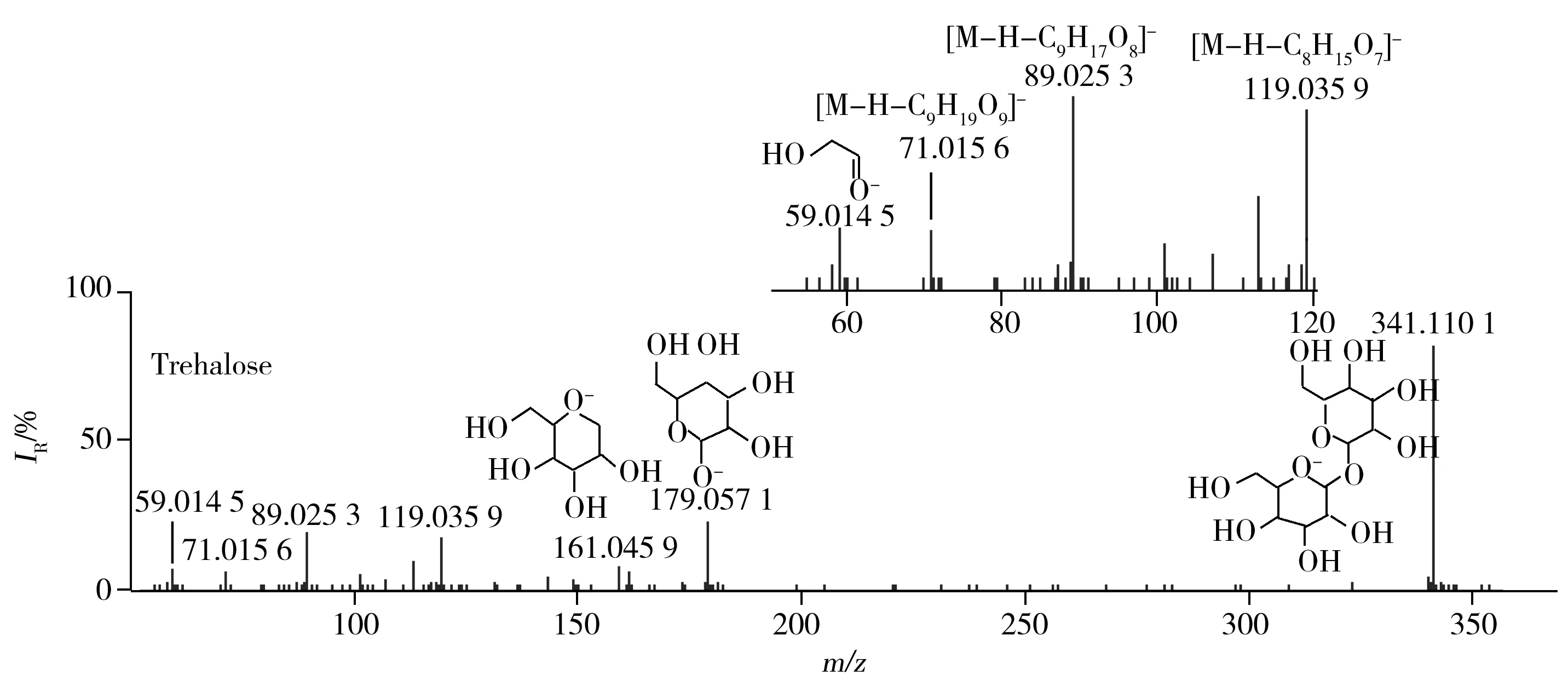
图3 正离子模式下蕈糖的MS/MS图谱Fig.3 MS/MS spectra of trehalose in negative ion mode
2.2.3 氨基酸类 虫草中氨基酸种类丰富,本实验在正离子模式下共找到8种,分别是赖氨酸、精氨酸、缬氨酸、酪氨酸、Pyroglutamic acid、异亮氨酸、苯丙氨酸、色氨酸,其保留时间分别为1.89,2.21,2.19,2.98,3.02,3.05,4.15,5.55 min,[M+H]+精确分子质量分别为147.112 9,175.119 0,118.086 2,182.081 2,130.050 0,132.101 9,166.086 4,205.097 2,二级质谱中均出现[M+H-COOH]+或[M+H-NH3]+的碎片离子。
在负离子模式下找到3种氨基酸,分别是组氨酸、L-4-Hydroxyglutamate semialdehyde、天门冬氨酸,保留时间分别为1.95,2.12,2.13 min;获得m/z为154.062 4,146.046 0,132.030 3[M-H]-的质谱信号,二级质谱中均出现[M-H-NH3]-及[M-H-COO]-的碎片离子。
2.2.4 核苷类 核苷类是虫草属药材的重要有效成分,腺苷、虫草素等常作为定量分析的检测指标。在正离子模式下共找到4种核苷类物质,保留时间为2.22 min获得m/z136.061 8[M+H]+的质谱信号,二级质谱出现119.034 4,92.023 1质谱峰,根据数据库匹配出分子式为C5H5N5,推测该化合物为腺嘌呤,二级碎片离子为[M+H-NH3]+和[M+H-NH3-CNH]+;保留时间为2.97 min获得m/z268.103 9[M+H]+的质谱信号,二级质谱出现136.060 7,119.033 3质谱峰,根据数据库匹配出分子式为C10H13N5O4,推测该化合物为腺嘌呤核苷,二级碎片离子为[M+H-C5H8O4]+和[M+H-C5H8O4-NH3]+;保留时间为3.01 min获得m/z284.098 9[M+H]+的质谱信号,二级质谱出现152.055 5,135.029 0质谱峰,根据数据库匹配出分子式为C10H13N5O5,推测该化合物为鸟苷,二级碎片离子为[M+H-C5H9O4]+和[M+H-C5H9O4-NH3]+;保留时间为3.02 min获得m/z152.056 6[M+H]+的质谱信号,二级质谱出现135.029 1,110.034 9质谱峰,根据数据库匹配出分子式为C5H5N5O,推测该化合物为鸟嘌呤,二级碎片离子为[M+H-NH3]+和[M+H-CH2N2]+。
在负离子模式下共找到3种核苷类物质,保留时间为2.12 min获得m/z250.094 2[M-H]-的质谱信号,二级质谱出现134.046 1质谱峰,根据数据库匹配出分子式为C10H13N5O3,推测该化合物为虫草素,二级碎片离子为[M-H-C5H8O3];保留时间为2.39 min获得m/z243.062 4[M-H]-的质谱信号,二级质谱出现200.056 5,110.025 0质谱峰,根据数据库匹配出分子式为C9H12N2O6,推测该化合物为尿苷,二级碎片离子为[M-H-CHNO]-和[M-H-C5H9O4]-。根据上述分析可知,该类物质多有脱去五元呋喃糖基的二级碎片离子,符合核苷类化合物的裂解规律。
2.2.5 其 它 结合数据库、相关文献及二级碎片,本实验从凉山虫草醇提物中还鉴定出香草扁桃酸、磷脂酸、4-羟基苯甲醛、6-Succinoaminopurine及gamma-L-Glutamyl-S-(2-carboxy-1-propyl)cysteinylglycine。
2.3 裂解规律分析
2.3.1D-塔格糖裂解规律 保留时间为2.16 min化合物[M-H]-的实际测量值为179.056 2,理论值为179.056 1,偏差为0.4 ppm。由二级质谱图可知m/z为179.056 9[M-H]-的母离子脱去18.011 3 Da生成161.046 0的离子碎片,通过PeakView软件的Mass Calculators功能计算出H2O的精确质量数为18.010 02 Da,差值小于0.01 Da,表明该化合物可能会先脱去一分子水。谱库检索得到的分子式均为C6H12O6,但仅有D-塔格糖最符合上述二级碎片裂解规律且各碎片的理论值与实测值之差均小于0.01 Da。该化合物的提取离子流图及MS/MS图谱见图4。

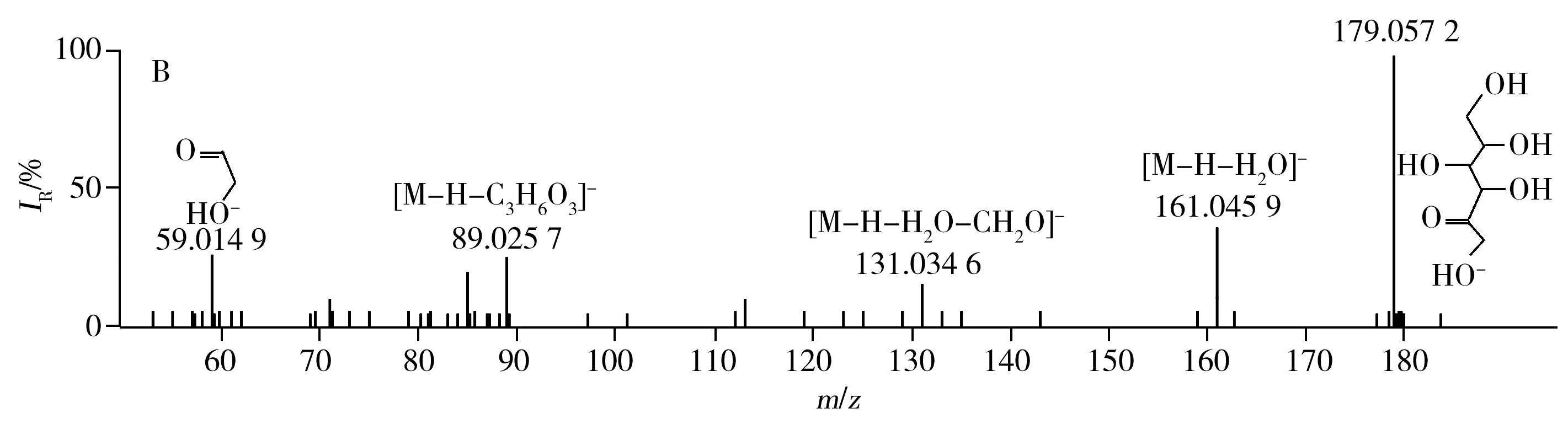
图4 负离子模式下D-塔格糖的提取离子流图(A)及MS/MS图谱(B)Fig.4 XIC(A) and MS/MS(B) spectra of D-tagatose in negative ion mode
2.3.2 腺嘌呤裂解规律 保留时间为2.22 min化合物[M+H]+的实际测量值为136.061 8,理论值为136.061 8,偏差为0.1 ppm。由二级质谱图可知m/z为136.061 8[M+H]+的母离子脱去17.026 4 Da生成119.034 4的离子碎片,通过PeakView软件的Mass Calculators功能计算NH3的精确质量为17.026 00 Da,差值小于0.01 Da,表明该化合物可能先脱去NH3碎片;119.034 4离子再脱去27.011 3 Da生成92.023 1,通过软件计算出HCN的精确质量数为27.010 35 Da,相差亦小于0.01 Da,表明该化合物可能又脱掉1个HCN碎片。分析谱库中检索得到分子结构与上述二级碎片相印证,仅腺嘌呤最为符合。该化合物的提取离子流图及MS/MS图谱见图5。
2.3.3 香草扁桃酸解规律 保留时间为4.04 min化合物[M-H]-的实际测量值为197.045 5,理论值为197.045 6,偏差为0.5 ppm。由二级质谱图可知m/z为197.047 0[M-H]-的母离子脱去30.011 Da生成167.036 0的离子碎片,通过PeakView软件的Mass Calculators功能计算出CH2O的精确质量数为30.010 02 Da,差值小于0.01 Da,表明该化合物可能先脱去CH2O碎片;167.036 0离子再脱去18.010 7 Da生成149.025 3,通过软件计算H2O的精确质量数为18.010 02,差值同样小于0.01 Da,表明该化合物可能又脱掉一分子水。167.036 0离子也可脱去46.006 3 Da生成121.029 7,通过软件计算出HCOOH的精确质量数为46.004 93 Da,差值为0.001 37 Da,表明该化合物可能含有羧基。将谱库中检索得到分子结构与上述二级碎片相互印证,仅香草扁桃酸最为符合。该化合物的提取离子流图及MS/MS图谱见图6。
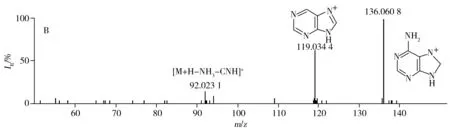
图5 负离子模式下腺嘌呤的提取离子流图(A)及MS/MS图谱(B)Fig.5 XIC(A) and MS/MS(B) spectra of adenine in negative ion mode
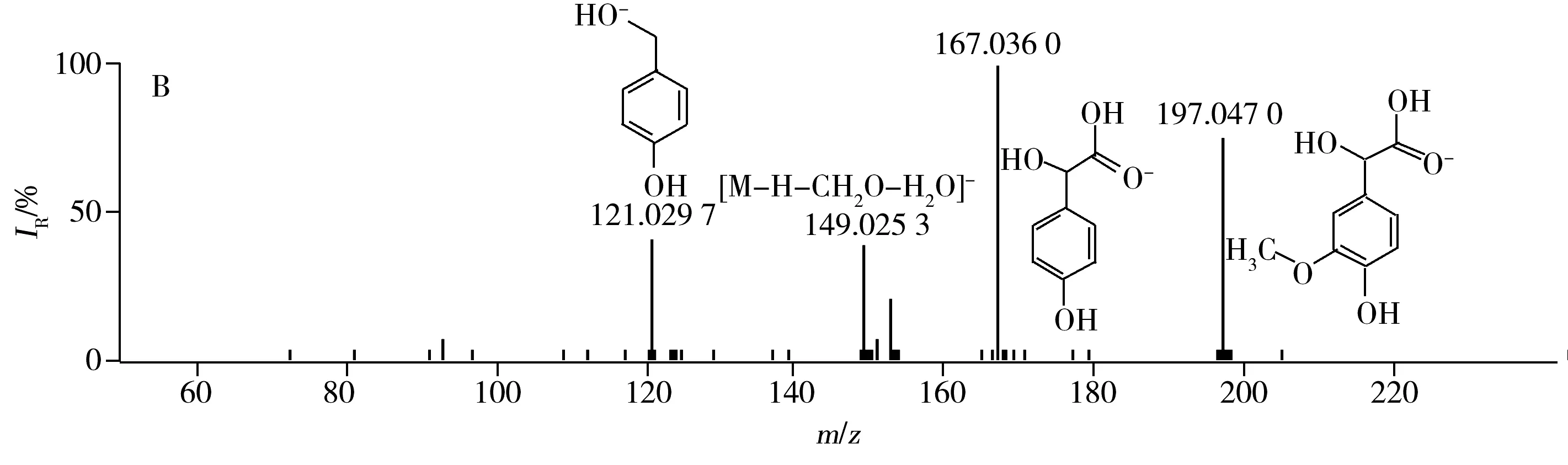
图6 负离子模式下香草扁桃酸的提取离子流图(A)及MS/MS图谱(B)Fig.6 XIC(A) and MS/MS(B) spectra of vanillylmandelic acid in negative ion mode
3 结 论
本文采用信息关联(IDA)正、负离子模式分别进行数据采集。研究显示,正离子模式下的质谱响应及峰数明显高于负离子,正、负离子分开采集在最大程度上提高了检测物质的灵敏度,有助于获得更多化合物信息。文中首次采用超高效液相色谱-四极杆串联飞行时间质谱法(UPLC-Q-TOF-MS)分析凉山虫草的主要化学成分,并通过PeakView软件的Formula Finder,Mass Calculators,Fragment Matching等功能结合数据库及二级碎片裂解规律共鉴定出27个化合物,其中有8个为虫草中未曾报道物质,鉴定成分中主要包括生物碱、糖苷、氨基酸、核苷类等。该研究结果为凉山虫草药效学、毒理学研究,以及后续质量标准制定提供了科学依据。
[1] Fu L,Chen Z H.LifeSci.Res.(傅岚,陈作红.生命科学研究),2004,8(1):1-7.
[2] Zhou Z F,Liang Y Z,Hu Y,Guo F Q.J.Instrum.Anal.(周枝凤,梁逸曾,胡芸,郭方遒.分析测试学报),2004,23(2):35-37.
[3] Wang Y L,Dai L L,Ma K,Zhao Y N,Li T T,Sun L J.J.Instrum.Anal.(王雅玲,代玲玲,马堃,赵轶男,李婷婷,孙力军.分析测试学报),2010,29(10):1091-1094.
[4] Song B,Lin Q Y,Li T H,Shen Y H,Li J J,Luo D X.J.FungalRes.(宋斌,林群英,李泰辉,沈亚恒,黎静静,罗棣辛.菌物研究),2006,4(4):10-26.
[5] Sung G H,Hywel-Jones N L,Sung J M,Jennifer Luangsa-ard J,Shrestha B,Spatafora J W.Stud.Mycol.,2007,57(1):5-59.
[6] Chen S Y,Cao S P,Yuan H,Guo L N,Zheng J,Lin Y,Chen D,Lin R C.WorldSci.Technol.Chin.Med.Mater.Med.(陈抒云,曹树萍,袁航,过立农,郑健,林羽,陈丹,林瑞超.世界科学技术-中医药现代化),2014,(6):1336-1346.[7] Chen S Y.APharmacognosticalStudyandAnalysisandIdentificationBasedontheDNABarcodeontheHerbofYiNationalityMetacordycepsLiangshanensis.Fuzhou:Journal of Fujian College of Traditional Chinese Medicine(陈抒云.彝药凉山虫草的生药与基于DNA条形码的分析鉴定研究.福州:福建中医药大学),2014.
[8] Yu D,Chen L,Guo J L.LishizhenMed.Mater.Med.Res.(喻东,陈璐,国锦琳.时珍国医国药),2010,21(8):2024-2025.
[9] Zhou Y X,Cha Y S.Chin.J.Ethnomed.Ethnopharm.(周亚兴,查云盛.中国民族民间医药),2012,21(15):43-44.[10] Ma Q X.Bull.Med.Res.(马庆翔.医学研究通讯),1984,(10):24.
[11] Chen L,Wan D G,Chen B R,Zhao N,Guo J L.J.ChengduMed.Coll.(陈璐,万德光,陈斌儒,赵那,国锦琳.成都医学院学报),2012,7(2):248-249.
[12] Guo J L,Chen L,Fan H L,Wan D G.WestChinaJ.Pharm.Sci.(国锦琳,陈璐,范华玲,万德光.华西药学杂志),2010,25(1):59-60.
[13] Chen L,Wan D G,Ren Y,Xie T,Lei Y,Guo J L,Liu X F.Pharm.Clin.Chin.Mater.Med.(陈璐,万德光,任艳,谢婷,雷艳,国锦琳,刘显福.中药与临床),2010,1(2):25-26.
[14] Chen L,Wan D G,Zhao N,Chen B R,Guo J L.J.Mil.Surg.SouthwestChin.(陈璐,万德光,赵那,陈斌儒,国锦琳.西南军医),2013,(2):145-146.
[15] Li J Z,Huang L Y,Zhang B J,Lei Y L,Hu R Y,Liu D Q.J.Chin.Med.Mater.(李吉珍,黄良月,张白嘉,雷玉兰,胡若英,刘道庆.中药材),1990,(3):34-36.
[16] Tan Z Y,Gao R,Gao Y,Xie C Z.BullChin.Mater.Med.(谈增毅,高蓉,高杨,谢昌卓.中药通报),1984,(1):31.
[17] Wu T J,Cao G M,Yin G H,Shen L D.BullChin.Mater.Med.(吴廷俊,曹共民,尹光华,沈联德.中药通报),1988,(10):40-41.
[18] Siu K M,Mak D H F,Chiu P Y,Poon M K T,Du Y,Ko K M.LifeSci.,2004,76(4):385.
[19] Li S P,Zhang G H,Zeng Q,Huang Z G,Wang Y T,Dong T T X,Tsim K W K.Phytomedicine,2006,13(6):428.
[20] Zhang G Q,Huang Y D,Bian Y,Wong J H,Ng T B,Wang H X.Appl.Microbiol.Biot.,2006,72(6):1152.
[21] Yan D,Liang J C.HeilongjiangSci.Technol.Inf.(严冬,梁举春.黑龙江科技信息),2013,(5):96.
[22] Hu M,Pi H M,Zheng Y M.LishizhenMed.Mater.Med.Res.(胡敏,皮惠敏,郑元梅.时珍国医国药),2008,19(11):2804-2806.
[23] Zhang W M,Li J.Strait.Pharm.J.(章伟明,李进.海峡药学),2008,20(4):67-69.
[24] Suo F Y,Su J,Jiang Y C,Xue H R T,Chen S Z.XinjiangAgric.Sci.(索菲娅,苏俊,姜彦成,雪合热提,陈世忠.新疆农业科学),2008,45(3):517-521.
[25] Tu Y Q,Zhu H L,Zeng W,Chen S J.J.Biol.(涂永勤,朱华李,曾纬,陈仕江.生物学杂志),2012,29(3):45-47.
Analysis of Chemical Constituents inCordycepsliangshanensisby UPLC-Q-TOF-MS
QIN Wei-han,LIU Xiang,YANG Yong,ZHANG Xiao-mei,GUO Yan-lei,LIU Fei*
(Chongqing Academy of Chinese Materia Medica,Chongqing 400065,China)
A UPLC-Q-TOF-MS method was developed for the analysis and identification of main chemical constituents in the extract ofCordycepsliangshanensis,by an Agilent SB-C18(50 mm×4.6 mm,1.8 μm) column with gradient elution using of 0.1% formic acid in water and acetonitrile as mobile phase at a flow rate of 0.25 mL/min.The column temperature was set at 30 ℃.MS analysis was based on information associated mode(IDA) with positive and negative ions collection.By using feature of PeakView such as Formula Finder,matching the mass spectrometry data of each chromatographic peak in the database and the cleavage law of each peak′s level two fragment,total of 27 compounds inCordycepsliangshanensiswere identified,in which 8 compounds in Cordyceps substance had never been reported before.The main chemical constituents include alkaloids,glycosides,nucleosides,amino acids,etc.The method is accurate,reliable and efficient,and is suitable for the rapid identification of ingredients inCordycepsliangshanensis.It provides a reference for the development and utilization ofCordycepsliangshanensisand clarification of its efficacy and material basis.
Cordycepsliangshanensis;UPLC-Q-TOF-MS;cleavage law;chemical constituents
10.3969/j.issn.1004-4957.2017.03.003
2016-09-09;
2016-10-20
国家自然科学基金资助项目(30901964,81072997);国家重大新药创制重大新药专项项目(2013ZX0101108)
O657.63;TQ460.72
A
1004-4957(2017)03-0312-07
*通讯作者:刘 飞,研究员,研究方向:冬虫夏草人工培植,Tel:023-89029026,E-mail:lfei1976@126.com

