R2*值在姿势异常步态障碍亚型帕金森病异质性中的研究价值*
王波,陈渝晖,任丽香,马莎,李洪亮,陈婧,吴昆华
(云南省第一人民医院,云南 昆明 650032)
R2*值在姿势异常步态障碍亚型帕金森病异质性中的研究价值*
王波,陈渝晖,任丽香,马莎,李洪亮,陈婧,吴昆华
(云南省第一人民医院,云南 昆明 650032)
目的 采用3.0T ESWAN定量测量不同运动障碍亚型帕金森病(PD)与正常对照组额叶白质区和灰质核团的R2*值,研究R2*值在姿势异常步态障碍(PIGD)亚型PD异质性中的诊断价值。方法 对122例PD及122例年龄、性别相匹配的正常对照组进行常规序列和ESWAN扫描。对122例PD进行运动障碍评分和临床分型,根据主要运动症状分为PIGD亚型PD(59例)和震颤亚型PD(63例)两型。经后处理在R2*图像上分别测量左右侧额叶白质区、红核、黑质网状带、黑质致密带、尾状核头、壳核、苍白球和丘脑的R2*值,并将所获得数据进行统计分析。结果 正常对照组在苍白球的R2*值最高,其次为黑质网状带、红核,额叶白质区的R2*值最低。PIGD亚型PD与正常对照组在黑质致密带的R2*值比较,差异有统计学意义(P<0.05);余感兴趣区的R2*值比较,差异无统计学意义。结论 PIGD亚型PD在黑质致密带的脑铁异常沉积较正常对照组明显,R2*值有助于PIGD亚型的诊断。
帕金森病;运动障碍亚型;异质性;脑铁沉积
帕金森病(parkinson's disease,PD)是中、老年人较为常见的慢性神经系统退行性疾病,依据运动障碍分为姿势异常、步态障碍(postural instability and gait disorder,PIGD)亚型PD和震颤亚型PD,PIGD亚型PD相对于震颤亚型PD患者往往伴随较严重的认知缺陷[1-2],且两型的首发症状、病情进展程度、异动症及智能障碍的发生率与早晚等比较差异有统计学意义,前者运动功能恶化速度较快,且需要高剂量左旋多巴维持治疗,生活质量受到的影响较大[3];但目前对该临床异质性的病理、生化等基础变化尚不明了[4-5]。本课题应用增强梯度回波T2加权血管成像(enhanced gradient echo T2star-weighted angiogra phy,ESWAN)的R2*值测量来探讨PIGD亚型PD脑铁沉积的部位,以及脑内铁沉积与PD发病和进展之间的关系。
1 资料与方法
1.1 临床资料及分组
1.1.1 PD组 选取2011年1月-2015年12月本院122例PD患者。男性67例,女性55例;其中PIGD亚型PD 59例(男性36例,女性23例),震颤亚型PD 63例(男性31例,女性32例)。平均年龄60.49岁(30~83岁),平均病程3.02年(0.5~20.0年)。按照2006年中华医学会神经病学分会运动障碍及帕金森病学组在《中华神经科杂志》刊发的中国帕金森病诊断标准进行诊断[6]。并且排除帕金森综合征和帕金森叠加综合征的患者。所有患者为右利手,对多巴胺药物有效。
1.1.2 正常对照组 选取与PD组年龄、性别相匹配的健康志愿者122例作为研究对象。所有入选者为右利手,无神经系统、精神疾病病史,无代谢性疾病及可能影响神经系统的系统性疾患。实验前受试者均被告知相关事宜并取得同意。
1.2 分组标准
在停药12 h后对PD组进行帕金森病综合评分量表评分和Hoehn-Yahr分级,依据震颤亚型相关8项平均分与姿势异常、步态障碍亚型相关5项平均分的比值进行运动分型[7]。震颤亚型PD:比值≥1.5或姿势异常、步态障碍平均分为0;PIGD亚型PD:比值≤1.0及或震颤亚型平均分为0。
1.3 扫描方法
1.3.1 MRI的扫描 采用GE Signa HDXt 3.0T超导型磁共振仪(美国通用电气公司)和8通道颅脑线圈(美国通用电气公司)。扫描参数有:横轴位SE T2WI(TR/TE:2 820/111 ms);FLAIR SE T1WI(TR/TE:1 777~1 823/26.8 ms,TI:860 ms);FLAIR SE T2WI (TR/TE:8 002/146~153 ms,TI:2 000~2 250 ms)。ESWAN横轴位:Oblic 3D Mode,FSPGR,TR/TE:68.2 ms/6.06、13.44、20.81、28.18、35.55、42.92、50.30 和57.67 ms,层厚/层间距:2/0 mm,翻转角20°,NSA:1,FOV:24 mm,Bandwith 31.25,距阵416×356。
1.3.2 R2*图像后处理及R2*值的测量 扫描完成后在aw 4.4工作站的Functool软件对ESWAN强度和相位的信息进行图像后处理,得到相位图、幅值图及R2*图像。在相位图、幅值图上剔除基底节区并发钙化的患者,全部数据由2位MRI医师使用多边形测量工具,分别测量得出双侧额叶白质区、红核、黑质网状带、黑质致密带、尾状核头、壳核、苍白球和丘脑的R2*值,并取其均值以尽可能减少人为误差,不同意见共同协商达成一致意见。见图1~3。

图1 R2*图像上双侧额叶白质区的测量示意图
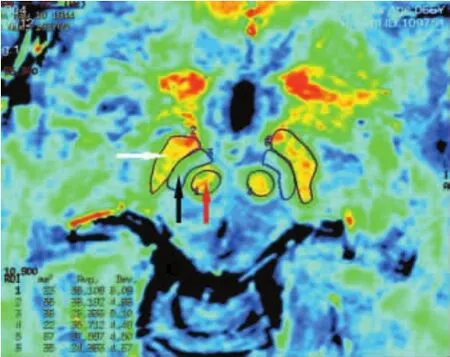
图2 R2*图像上双侧黑质网状带、黑质致密带、红核的测量示意图
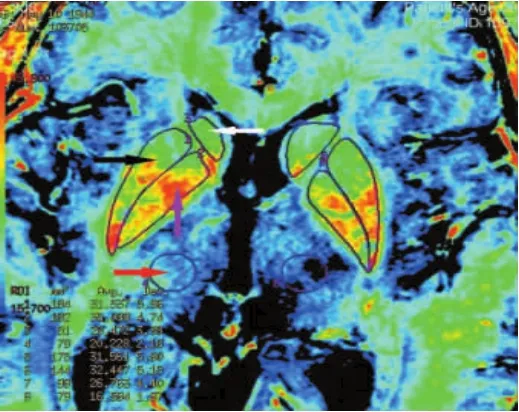
图3 R2*图像上双侧尾状核头、壳核、苍白球及丘脑的测量示意图
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PIGD亚型PD、震颤亚型PD分别与正常对照组各感兴趣区的脑铁含量比较
正常对照组在苍白球的R2*值最高,其次为黑质网状带、红核,额叶白质区的R2*值最低,说明正常对照组苍白球脑铁含量最高,其次为黑质网状带、红核,额叶白质区的脑铁含量最少。除PIGD亚型PD与正常对照组在黑质致密带的R2*值比较差异有统计学意义(P<0.05)外,余感兴趣区的R2*值比较,差异无统计学意义(P>0.05),说明PIGD亚型PD较正常对照组在黑质致密带有异常脑铁沉积见表1、2。
表1 PIGD亚型PD与正常对照组各感兴趣区的R2*值比较 (±s)

表1 PIGD亚型PD与正常对照组各感兴趣区的R2*值比较 (±s)
?
表2 震颤亚型PD与正常对照组各感兴趣区的R2*值比较 (±s)
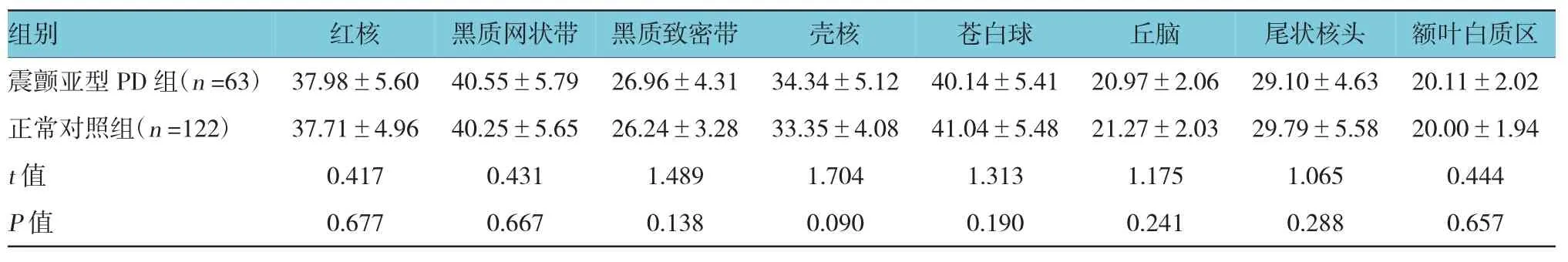
表2 震颤亚型PD与正常对照组各感兴趣区的R2*值比较 (±s)
?
2.2 PIGD亚型PD与震颤亚型PD各感兴趣区的脑铁含量比较
表3 PIGD亚型PD与震颤亚型PD各感兴趣区的R2*值比较 (±s)

表3 PIGD亚型PD与震颤亚型PD各感兴趣区的R2*值比较 (±s)
?
3 讨论
3.1 ESWAN的R2*值检测脑铁含量的可靠性及可行性
在正常的生理条件下,铁只有很少的一部分以游离铁的形式存在于体内,而绝大部分是与铁蛋白、转铁蛋白相结合存在的。由于铁蛋白具有较大的磁化率,增加局部磁场不均匀性,导致弥散相位不能很快重聚,使得R2*增加,并随铁含量升高而呈线性增加[8-9]。ESWAN序列是在常规磁敏感加权成像(sus ceptibility weighted imaging,SWI)序列的基础上开发
PIGD亚型PD与震颤亚型PD在各感兴趣区的R2*值比较,差异无统计学意义(见表3)。而成,采用多回波采集技术,所得图像是多个TE时间的回波加权平均图像,得到的相位图、T2*图及R2*图,有更高的信噪比(signal to noise ratio,SNR)及对比噪声比[10]。与常规SWI方法对比,ESWAN提高磁敏感性、空间分辨率、SNR,降低化学位移伪影[11];且ESWAN检查方便、易行,扫描时间不长[12],脑水含量、脑组织结构及周围组织磁敏感性对R2*值影响较小[13]。因此笔者通过测量脑内结构的R2*值,便可反映脑铁沉积的分布规律,为了解脑内铁沉积分布、测量和观察其变化,提供一种无创的活体检测方法。
局部磁场的不均匀是ESWAN用来显示脑铁分布的基本原理[14-15]。ESWAN采用的是薄层三维容积扫描,较常规磁共振检查能更清晰地显示脑内深部核团的细微形态和解剖结构[16],为本课题的测量提供较好的图像质量,得到的数据就更为准确。
3.2 脑铁的分布及含量
铁是脑组织新陈代谢所必需的微量元素之一,参与体内氧气运输、细胞的有氧代谢活动等多项重要的生理功能。铁为许多重要酶能够发挥正常功能提供基础,并且参与髓鞘中脂质和胆固醇的合成[17]。不同的脑细胞摄取铁的能力不一致,并且在不同脑区铁的密度亦不同,因而脑铁的分布具有不均衡性[18],说明不同脑区对铁的需求量不同形成不同的功能区,尤其是苍白球与黑质网状部的铁含量最多,反应铁在锥体外系具有重要意义。SPATZ[19]于1922年采用Perls染色法首先进行脑铁含量的系统研究,发现人体脑铁分布不一致,深部核团最高,皮质次之,白质最低。随后HALLGREN等[20]对81例死者脑标本的组织化学分析亦得出类似结果,锥体外系脑铁浓度最高,其次是灰质,白质最低。本课题的研究亦发现,在苍白球脑铁含量最高,其次为黑质网状带、红核,额叶白质区的铁含量最少,与文献报道一致[19-21]。
3.3 脑铁代谢紊乱与中枢神经系统退行性疾病
据文献报道,许多中枢神经系统退行性疾病与脑铁代谢异常密切相关[8]。部分研究者在对PD和阿尔茨海默病(alzheimer’s disease,AD)患者进行尸体解剖及脑组织铁沉积定量检测时发现,神经元死亡与脑铁沉积呈正相关[22]。郑兴友等[23]对30例AD与30例正常对照组进行扫描,后得出AD患者脑内多部位的R2*值出现改变,左侧海马的R2*值与MMSE评分存在相关性,可以用来评估AD患者病程变化。
3.4 PIGD亚型PD的诊断与脑铁沉积的异常增加、病理性沉积的部位
PD的诊断主要依据临床症状、体征及对多巴胺制剂的治疗敏感性确诊,误诊难以避免。据SNYDER等[24]对近期两组临床-病理系列研究结果发现,经神经专科医师根据临床症状、体征及对左旋多巴治疗敏感确诊的PD患者,尸解的诊断正确率最终仅有85%。现在国内外要对PD的亚型做出准确的诊断、治疗更是难以达到,尚需寻找更敏感的特异性指标。
目前大量尸检、动物实验和病理生理研究证实,脑铁在深部灰质核团的异常沉积、增加与PD具有密切的相关性,尤以黑质致密带的脑铁含量更为明显。可能与黑质铁增加诱导自由基产生、介导氧化应激损伤,导致黑质多巴胺能神经元凋亡有关[25]。据文献报道,PIGD亚型PD患者的多巴胺神经元的凋亡和病情进展等较震颤亚型PD严重[26]。因此ROSENB ER-KATZ等[26]提出2种亚型可能存在不同的发病机制,震颤亚型PD与丘脑部位的损伤关系更为密切,而PIGD亚型PD黑质-纹状体通路多巴胺神经元损伤更为严重。其中PIGD亚型PD中脑黑质神经元的丢失比震颤亚型PD患者明显,而丘脑、下丘脑、脑桥及前运动皮质代谢在震颤亚型PD明显,黑质致密带神经元丢失的数量与痴呆发生率、程度相关性密切。另外迷走神经背核、Meynert核、蓝斑、下丘脑后外侧及边缘叶等黑质外结构损伤,多巴胺、肾上腺及胆碱能等系统的神经递质受累,导致PD临床的异质性特点[27-28]。本实验结果显示,PIGD亚型PD与正常对照组在黑质致密带存在脑铁异常沉积,而在其他感兴趣区脑铁沉积比较,差异无统计学意义,病理、生化改变可能类似。推测PIGD亚型PD存在不同的病理、生化改变,为其个体化的治疗奠定一定的基础,尤其为外科手术靶点选择提供依据。
目前采用ESWAN的R2*值检测PD脑铁含量的有关报道较少,而且未对PIGD亚型PD进一步研究。本研究未对PIGD亚型PD的左右两侧、病情轻重及病程长短进一步细化分析,因此尚需扩大样本量进行进一步细化研究。
[1] VERLEDEN S,VINGERHOETS G,SANTENS P.Heterogeneity of cognitive dysfunction in Parkinson's disease:a cohort study[J]. Eur Neurol,2007,58(1):34-40.
[2]潘晓波,卓文燕,杜中立,等.帕金森病异质性的质子磁共振波谱研究[J].中国实用神经疾病杂志,2015,18(12):1-3.
[3] 黄静,张玉虎,王丽娟,等.帕金森病睡眠障碍与认知功能损害关系的研究进展[J].中华老年心脑血管病杂志,2013,5(5):554-556.
[4] BROWN M T,HENNY P,BOLAM J P,et al.Activity of neurochemically heterogeneous dopaminergic neurons in the substantia nigra during spontaneous and driven changes in brain state[J].J Neurosci,2009,29(9):2915-2925.
[5] 刘中霖,王丽敏,陶恩祥.帕金森病患者运动障碍的临床异质性[J].南方医科大学学报,2008,28(3):447-448.
[6] 蒋雨平,王坚,丁正同,等.原发性帕金森病的诊断标准(2005年)[J].中国临床神经科学,2006,14(1):40.
[7] JANKOVIC J,MCDERMOTT M,CARTER J,et al.Variable expression of parkinson's disease:a base-line analysis of the datatop cohort-the parkinson study group[J].Neurology,1990,40(10): 1529-1534.
[8] RAMOS P,SANTOS A,PINTO N R,et al.Iron levels in the human brain:a post-mortem study of anatomical region difference and age-related changes[J].J Trace Elem Med Biol,2014,28(1): 13-17.
[9] YAN S Q,SUN J Z,YAN Y Q,et al.Evaluation of brain iron content based on magnetic resonance imaging (MRI):comparison among phase value,R2*and magnitude signal intensity[J].PLoS One,2012,7(2):DOI:10.1371/journal.pone.0031748.
[10] DENK C,RAUSCHER A.Susceptibility weighted imaging with multiple echoes[J].Journal of Magnetic Resonance Imaging,2010, 31(1):185-191.
[11] CHEN X,ZENG C,LUO T,et al.Iron deposition of the deep grey matter in patients with multiple sclerosis and neuromyelitis optica:a control quantitative study by 3D-enhanced susceptibility-weighted angiography(ESWAN)[J].European Journal of Radiology,2012,81(4):633-639.
[12] PFEFFERBAUM A,ADALSTEINSSON E,ROHLFING T.MRI estimates of brain iron concentration in normal aging:comparison of field-dependent (FDRI)and phase (SWI)methods[J]. NeuroImage,2009,47(2):493-500.
[13] WALSH A J,WILMAN A H.Susceptibility phase imaging with comparison to R2 mapping of iron-rich deep grey matter[J]. Neuroimage,2011,57(2):452-461.
[14] HAACKE E M,CHENG N Y,CHENG Y C,et al.Susceptibility weighted imaging(SWI)[J].Magn Reson Med,2004,52(3):612-618.
[15] SEHGAL V,DELPROPOSTO Z,HAACKE E M,et al.Clinical applications of neuroimaging with susceptibility-weighted imaging[J]. Magn Reson Imaging,2005,22(4):439-450.
[16] 陈燕生,方元,史文宗,等.黑质致密部FA值和T2值对诊断早期帕金森病的比较研究[J].放射学实践,2014,29(2):155-158.
[17] 张静,张云亭,何宁,等.磁敏感加权成像对帕金森病患者丘脑底核的显示价值初探[J].磁共振成像,2011,2(5):353-357.
[18] MOOS T,NIELSEN T R,SKJORRINGE T,et al.Iron trafficking inside the brain[J].J Neurochem,2007,103(5):1730-1740.
[19] SPATZ H.Über den eisennachweis im gehirn,besonders in zentren des extrapyramidal-motorischen systems I. Teil[J]. Zeitschrift für die gesamte Neurologie and Psychiatrie,1922,77(1): 261-290.
[20] HALLGREN B,SOURANDER P.The effect of age on the non-haemin iron in the human brain[J].J Neurochem,1958,3(1): 41-51.
[21] 夏爽,柴超,沈文,等.MR定量磁敏感图评估正常人脑铁含量的初步研究[J].中华放射学杂志,2014,48(9):730-735.
[22] QIAN Z M,WANG Q.Expression of iron transport proteins and excessive iron accumulation in the brain in neurodegenerative disorders[J].Brain Research Reviews,1998,27(3):257-267.
[23] 郑兴友,邓利猛,廖伟华,等.R2*值在阿尔茨海默病中的初步研究[J].临床心身疾病杂志,2016,5(22):115-116.
[24] SNYDER L R,CRUZ-AGUADO R,SADILEK M,etal. Parkinson-dementia complex and development of a new stable isotope dilution assay for BMAA detection in tissue[J].Toxicol Appl Pharmacol,2009,240(2):180-188.
[25] MICHAELI S,OZ G,SORCE D J,et al.Assessment of brain iron and neuronal integrity in patients with Parkinson's disease using novel MRI contrasts[J].Mov Disord,2007,22(3):334-340.
[26] ROSENBER-KATZ K,HERMAN T,GILADI N,et al.Gray matter atrophy distinguishes between Parkinson disease motor subtypes[J].Neurology,2013,80(16):1476-1484.
[27] BODNER C R,MALTSEV A S,DOBSON C M,et al.Differential phospholipid binding of alpha-synuclein variants implicated in Parkinson's disease revealed by solution NMR spectroscopy[J]. Biochemstry,2010,49(5):862-871.
[28] LEMKAU L R,COMELLAS G,LEE S W,et al.Site-specific perturbations of alpha-synuclein fibril structure by the Parkinson's disease associated mutations A53T and E46K[J].PLoS one,2013,8(3):DOI:10.1371/journal.pone.0049750.
R2*value quantitative study on postural instability and gait disorder-dominant Parkinson's disease*
Bo Wang,Yu-hui Chen,Li-xiang Ren,Sha Ma,Hong-liang Li,Jing Chen,Kun-hua Wu
(The First People's Hospital of Yunnan Province,Kunming,Yunnan 650032,China)
Objective To quantitatively analyze the iron deposition in deep brain gray nucleus and frontal white matter between different movement disorder subtypes of Parkinson's disease (PD)and control subjects, and to evaluate its correlation with age using ESWAN(enhanced gradient echo T2 star-weighted angiography) with 3.0 Tesla scanner,and investigate the diagnostic value of the R2*value on the clinical heterogeneity of PIGD-dominant PD.Methods 122 patients with PD and 122 control subjects were analyzed with routine sequences and ESWAN sequences by 3.0T MR.122 cases (male 67,female 55)who have PD were divided into PIGD-dominant PD (n=59)and tremor-dominant PD (n=63)group.The R2*value was measured in both sides of frontal white matter (FWM),red nucleus (RN),substantia nigra pars reticulate(SNr),substantia nigra pars compacta(SNc),putamen(PUT),globus pallidus(GP),head of caudate nucleus(CN)and thalamus (THA),and was statistically analyzed.Results The R2*value of GP was the highest,followed by the SNr and RN.The lowest R2*value was seen in the FWM.The R2*value was significant reduced in SNc of PIGD-dominant PD compared with the control subjects group (P<0.05).There were no statistical differences in others regions (P>0.05).Conclusions The abnormal brain iron deposition is significant reduced in SNc of PIGD-dominant PD compared with the control subjects group.The R2*value can help to diagnose PIGD-dominant PD.
parkinson's disease;movement disorder subtypes;heterogeneity;brain iron deposition
R742.5
A
10.3969/j.issn.1005-8982.2017.05.014
1005-8982(2017)05-0068-05
2016-07-24
云南省教育厅重点项目(No:2015Z052);云南省临床重点专科课题;云南省第一人民医院“昆华·奥新”科技计划(No:2014DS008)
吴昆华,E-mail:wukunhua@hotmail.com;Tel:13608817635

