鲍曼不动杆菌碳青霉烯酶耐药基因分析及同源性研究
饶丽华++++涂建斌++++王艳琴

[摘要]目的 分析鲍曼不动杆菌碳青霉烯酶耐药基因型和医院感染鲍曼不动杆菌同源性。方法 回顾性分析2013年1月~2014年8月非重复分离的68株耐碳青烯酶鲍曼不动杆菌(CRAB),多重PCR的方法检测6种常见的β-内酰胺酶基因IMP、VIM、OXA-23、OXA-24、OXA-58和OXA-51,并对其中确定为医院感染的8株用脉冲场凝胶电泳(PFGE)进行基因同源性分析。结果 68株多重耐药鲍曼不动杆菌全部检出OXA-23、OXA-51基因,其余基因均未检出;8株经PFGE同源性分析提示为同一来源克隆株,且同源性较高。结论 我院临床分离的耐碳青霉烯酶鲍曼不动杆菌主要携带OXA-23、OXA-51基因型,且存在克隆传播。
[关键词]鲍曼不动杆菌;碳青霉烯酶;耐药基因;同源性
[中图分类号] R446.1 [文献标识码] A [文章编号] 1674-4721(2017)02(c)-0115-04
Analysis for genotype and homology of carbapenemase resistance in Acinetobacter baumannii
RAO Li-hua TU Jian-bin WANG Yan-qin
Department of Clinical Laboratory,Nanchang Hospital of Integrated Traditional and Western Medicine in Jiangxi Province,Nanchang 330002,China
[Abstract]Objective To analyze the genotype and homology of drug resistance gene in carbapenemase resistant Acinetobacter baumannii(CRAB).Methods 68 strains of CRAB isolated from January 2013 to August 2014 were included in our retrospective analysis.Multiplex Polymerase Chain Reaction(Multiplex-PCR) was conducted to analyze six types of β-lactamase resistant gene IMP,VIM,OXA-23,OXA-24,OXA-58,OXA-51 in these strains of CRAB,and the gene homology of 8 CRAB isolateswere analyzed by pulsed field gel electrophoresis(PFGE).Results All of the 68 isolates of CRAB were found to carry OXA-23,OXA-51,but not IMP,VIM,OXA-24,OXA-58.The result of PFGE suggested that the 8 CRAB isolates might derived from the same clone.And the gene homology analysis showed high homology among them.Conclusion All the 68 CRAB strains isolated from our hospital belong to the same clone and carry OXA-23,OXA-51 genes mainly,indicating that there is clone spread among CRAB isolates.
[Key words]Acinetobacter baumannii;Carbapenemase;Drug resistance gene;Homology鮑曼不动杆菌为不发酵糖革兰阴性杆菌,广泛存在于自然界,属于条件致病菌,是医院感染的重要病原菌之一,可引起呼吸道、泌尿道、血液、伤口等感染[1]。碳青霉烯类抗生素(亚胺培南、美罗培南等)是有效治疗革兰阴性杆菌,特别是产超广谱β-内酰胺酶(ESBLs)和持续高产C类头孢菌素酶(AmpC酶)感染的重要抗生素。近年来,广谱抗菌药物的大量运用使鲍曼不动杆菌耐药形势严峻,耐碳青霉烯类鲍曼不动杆菌(carbapenemase resistant Acinetobacter baumannii,CRAB)的比例逐年增高[2]。多重耐药鲍曼不动杆菌已成为引起院内感染的重要病原菌,给临床治疗带来极大困难[3]。本研究分析我院临床分离的多重耐药鲍曼不动杆菌碳青霉烯酶耐药基因型和医院感染鲍曼不动杆菌同源性,探究CRAB对多种抗菌药物的耐药机制,为防治CRAB感染提供依据,现报道如下。
1材料与方法
1.1材料
1.1.1菌株来源 68株CRAB均分离自2013年1月~2014年8月于我院住院患者临床标本,68株菌株均为非重复分离菌株。其中痰65株、脓液2株、创面分泌物1株。68例菌株中有26例来自我院呼吸科,其余均来自我院ICU。
1.1.2仪器与试剂 VITEK2-Compact型全自动微生物鉴定与药敏分析系统(法国生物-梅里埃)、AMP Genligt2400扩增仪、3730xl DNA Analyzer、测序仪和Beckman Coulter Optimal-80XP、Premix Tag酶体系由安普利生物技术公司提供。质控菌株大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853购自国家卫生计生委临床检验中心。
1.2方法
1.2.1菌株鉴定及药敏试验 所有分离菌株的培养鉴定严格按照《全国临床检验操作规程》[4]进行,采用梅里埃VITEK-2 Compact全自动微生物分析仪对所有收集的菌株进行种属鉴定。采用K-B纸片扩散法测定菌株对常用18种抗菌药物的敏感性。药敏试验结果判定标准按照美国临床和实验室标准协会(Clinical and Lab?鄄oratory Standards Institute,CLSI)2010的标准判定[5]。
1.2.2 OXA酶基因检测PCR扩增 此过程由厦门安普利生物技术公司协作完成。①样本的处理:挑取平板上的单菌落,加入25 μl的TE缓冲液水溶解,振荡均匀后加入25 μl的标本处理液混匀,100℃加热10 min,13 000 r/min离心10 min,取上清备用;②50 μl的扩增体系如下:上游引物0.2 μl,下游引物0.2 μl,dNTPS 0.6 μl,Taq酶0.5 μl,模板DNA 2 μl,DNA通用液46.5 μl;③PCR扩增过程:95℃预变性2 min;95℃变性20 s,55℃退火20 s,72℃延伸20 s,35个循环;72℃延伸10 min。产物经1.5%琼脂糖电泳,染色后在凝胶成像系统上分析结果,电泳结果大小与预期产物片段大小一致的产物进行测序。在NCBI上下载VIM、IMP、OXA-23、OXA-24、OXA-51和OXA58的相关基因序列,用DNAman比对软件进行比对,选择其保守序列设计引物,利用Primer 3.0在线设计引物(厦门安普利生物技术公司设计)(表1)。
1.2.3脉冲场凝胶电泳(PFGE) 由厦门安普利生物技术公司协作完成:首先配制pH值为8.0的细胞悬浮液,乙二胺四乙酸∶Tris(100 mmol/L)=1∶1;将平板上的细菌制成均匀细菌悬液,细菌浓度为4 MCF。取细菌悬液200 μl和蛋白酶K 10 μg混合,取1% Seaken Gold 200 μl琼脂糖凝胶制成胶块,胶块固定后置于细胞裂解液与蛋白酶K的混合液中3 h,洗胶后置于5 ml的TE缓冲液中低温保存,胶块切割成小块后置于酶切缓冲液中3 h,配制Seaken Gold琼脂糖凝胶160 ml,54℃水浴,倒入模具,凝固后将胶块置于电泳槽,条件设置为:电压6 V/cm,时间16 h,温度14℃,脉冲0.2~18.0 s,重复间隔120°,分子量标志物为λLadderDNA。电泳结束后行Gelred染色20 min,用荧光成像仪进行胶体成分分析,用统计软件分析同源性。
2结果
2.1 68株CRAB杆菌耐药率
68株CRAB对头孢哌酮/舒巴坦最为敏感,耐药率为36%,其次是米诺环素,耐药率为45%;而对另外16种抗菌药物的耐药率均在60%以上,其中对氨苄西林、头孢他啶、头孢曲松、头孢吡肟、哌拉西林等耐药率高达100%(表2)。
2.2多重PCR扩增结果
2.2.1 OXA酶基因检测结果 68株CRAB的基因检测均携带有OXA-23、OXA-51基因;未检测出IMP、VIM、OXA-24、OXA-58基因。
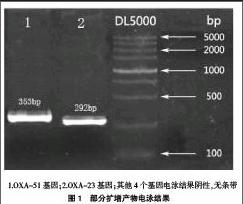
2.2.2部分扩增产物电泳结果 结果表明若基因电泳为阴性,则无条带显示(图1)。
1.OXA-51基因;2.OXA-23基因;其他4个基因电泳结果阴性,无条带
3讨论
近几年,世界各地均出现了多重耐药鲍曼不动杆菌的医院感染和暴发流行。随着广谱抗菌药物的大量使用特别是碳青霉烯类抗生素的广泛使用,CRAB呈逐年增加的趋势,对其临床治疗造成较大的困难[6]。有报道鲍曼不动杆菌对多种抗菌药物具有天然耐药性,其主要耐药机制是外膜微孔蛋白形成的通道小,从而导致外膜通透性低,抗菌药物不易进入[7]。
本研究收集的菌株均来自使用广谱抗生素且免疫力低下的ICU病区和呼吸科患者,与王金良[8]报道的近几年鲍曼不动杆菌感染率在不断上升,已成为重症监护病房感染的主要病原菌相符。
本研究药敏结果表明除对头孢哌酮/舒巴坦和米诺环素比较敏感,对其他16种抗菌药物的耐药率均在60%以上,其中对氨苄西林、头孢他啶、头孢曲松、头孢吡肟、哌拉西林等耐药率高达100%,耐药形势严峻。据目前研究,多重耐药鲍曼不动杆菌的耐药机制主要是产生水解药物的碳青霉烯酶,碳青霉烯水解酶的产生是介导鲍曼不动杆菌对碳青霉烯类抗生素耐药的主要原因[9],而产OXA类碳青霉烯酶是引起世界范围内鲍曼不动杆菌对碳青霉烯类抗生素耐药的最重要机制。
本研究68株多重耐药鲍曼不动杆菌全部检出OXA-23、OXA-51基因,其余基因均未检出,高于魏星等[10]报道的比例,表明我院临床分离的CRAB碳青霉烯酶的耐药基因主要是OXA-23型,这与国内外的相关报道基本相同[11-12]。我院鲍曼不动杆菌多重耐药与OXA-23、OXA-51基因密切相关,据报道国内大约有80%的鲍曼不动杆菌是由于产生OXA-23型碳氢烯酶,OXA-23可能是鲍曼不动杆菌耐药的主要原因[13]。这与有些学者认为鲍曼不动杆菌中最常见的为产生碳氢酶烯酶,即OXA酶,OXA酶的四个基因型中OXA-23和OXA-51是我國流行最广的碳氢酶烯酶基因型观点一致[14]。
鲍曼不动杆菌作为医院内感染的重要病原菌已引起世界范围内的广泛重视,随着β-内酰胺类抗生素和第三代头孢菌素等广谱抗生素的广泛应用,诱导了大量耐药株的产生,由单一抗生素耐药发展到多重耐药,甚至出现了泛耐菌株,给抗感染治疗带来巨大困难[15-16]。鲍曼不动杆菌感染也一直是我院ICU、呼吸科等临床科室抗感染治疗最棘手的问题,本研究中鲍曼不动杆菌菌株表型全部为多重耐药,目前,临床面临药物选择的巨大压力,所以临床实验室应积极建立碳青霉烯水解酶的检测方法,加强对产酶菌株的检测与监控,指导临床在选择联合用药方案时,一方面要考虑到药物的最小抑制浓度,另一方面应尽可能了解菌株的主要耐药表型,便于针对不同的耐药机制,合理联合用药。
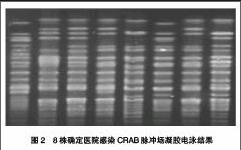
本研究对确定为医院感染的8株CRAB经PFGE同源性分析提示为同一来源克隆株,且同源性较高,进一步提示CRAB在我院潜在暴发流行趋势。由于CRAB对包括碳青霉烯类的大多数抗生素耐药,CRAB在同一病区及不同病区间传播是很容易导致暴发流行的,因此预防该类感染的发生较治疗更重要,为避免耐药菌在医院环境中广泛定植传播,应采取有效的感染控制方法,严格遵守无菌操作和感染控制规范,重视医护人员手卫生,加强消毒隔离措施,切断耐药克隆株的传播途径,合理使用抗菌药物防止耐药菌株的产生与流行。
[参考文献]
[1]Peleg AY,Seifert H,Paterson DL.Acinetobacter baumannii:emergence of a successful pathogen[J].Clin Microbiol Rev,2008,21(3):538-582.
[2]钟敏,黄文芳.耐碳青霉烯类鲍曼不动杆菌产OXA酶的研究进展[J].中国微生态学杂志,2013,25(1):122-124.
[3]陈佰义,何礼贤,胡必杰,等.中国鲍曼不动杆菌感染诊疗与防控专家共识[J].中华医学杂志,2012,92(2):76-78.
[4]叶应妩.全国临床检验操作规程[M].南京:东南大学出版社,1997.
[5]Rauta PR,Kumar K,Sahoo PK.Emerging new multi-drug resistant bacterial pathogen,Acinetobacter baumannii associated with snakehead Channa striatus eye infection[J].Curr Sci,2011,101(4):548-553.
[6]朱德妹,汪复,胡付品,等.2010年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2011,11(5):321-329.
[7]何祖光.鲍曼不动杆菌临床分布特征及耐药分析[J].实验与检验医学,2011,29(3):330-331.
[8]王金良.密切注视鲍曼不动杆菌的耐药发展趋势[J].中华检验医学杂志,2005,28(4):355-356.
[9]Peleg AY,Seifert H,Paterson DL.Acinetobacter baumannii:emergence of a successful pathogen[J].Clin Microbiol Rev,2008,21(3):538-582.
[10]魏星,沈定霞,闰中强,等.耐碳青霉烯鲍曼不动杆菌的传播和分子特征[J].中华流行病学杂志,2008,29(3):277-281.
[11]王辉,孙宏莉,廖康,等.北京和广州地区四家医院不动杆菌碳青霉烯酶基因型研究[J].中华检验医学杂志,2005, 28(6):636-641.
[12]Walther-Rasmussen J,H?覬iby N.OXA-type carbapenemases[J].J Antimicrob Chemother,2006,57(3):373-383.
[13]李蓉,李文林,石小玉,等.产ESBLS鲍曼不动杆菌的耐药特性、质粒谱及耐药基因型[J].中国抗生素杂志,2006, 31(4):202.
[14]汤凤珍,张伟红,陈惠玲.碳青霉烯类抗生素耐药鲍曼不动杆菌碳青霉烯酶基因型研究[J].中國感染与化疗杂志,2010,10(5):354-356.
[15]史俊艳,张小江,徐英春.2007年中国CHINET鲍曼不动杆菌耐药性监测[J].中国感染与化疗杂志,2009,9(3):196-200.
[16]胡莹,刘晓莉,马润,等.昆明地区烧伤病房鲍曼不动杆菌的耐药性和分子流行病学调查[J].实验与检验医学,2014,32(5):508-510.
(收稿日期:2016-11-21 本文编辑:任 念)

