过表达S100A13基因的甲状腺癌TT细胞侵袭能力变化
刘畅,谢翠松,陶松桔,宋卫红
(郴州市第一人民医院,湖南郴州 423000)
过表达S100A13基因的甲状腺癌TT细胞侵袭能力变化
刘畅,谢翠松,陶松桔,宋卫红
(郴州市第一人民医院,湖南郴州 423000)
目的 观察过表达S100A13基因的甲状腺癌TT细胞侵袭能力变化情况。方法 分别用pcDNA3.1/NT-GFP-S100A13表达质粒和pcDNA3.1/NT-GFP空质粒转染TT细胞,构建空载体pCDNA3.1/NT-GFP-TT细胞系(空载体组)和S100A13稳定过表达甲状腺癌TT细胞系(S100A13过表达组),采用Transwell侵袭实验观察两组细胞的侵袭能力,蛋白印迹法检测两组细胞酸性成纤维细胞生长因子1(FGF-1)、细胞周期蛋白E(Cyclin E)、CD31蛋白表达。结果 S100A13过表达组、空载体组穿出基质膜的细胞数分别为(83.7±5.0)与(40.0±1.7)个,两组比较P<0.01。S100A13过表达组、空载体组细胞FGF-1蛋白相对表达量分别为1.224±0.124、0.837±0.152,Cyclin E蛋白相对表达量分别为1.034±0.131、0.459±0.032,CD31蛋白相对表达量分别为1.147±0.144、0.312±0.071,两组比较,P<0.05或<0.01。结论 过表达S100A13基因的甲状腺癌TT细胞侵袭能力增强,这可能与S100A13促进FGF-1、Cyclin E、CD31蛋白表达有关。
甲状腺癌;S100A13基因;细胞侵袭;酸性成纤维细胞生长因子1;细胞周期蛋白E
S100蛋白家族是一个有21个成员的钙结合蛋白家族,在多种肿瘤中表达异常,并参与肿瘤的发生发展,在体内发挥多种生物学功能。S100A13是S100蛋白家族中的重要成员之一,在肿瘤及炎症等疾病的病理过程中发挥重要作用[1]。酸性成纤维细胞生长因子1(FGF-1)是成纤维细胞生长因子家族的重要成员之一,其能够刺激血管内皮及平滑肌细胞的增殖与迁移,促进胶原的水解与沉积,最终促进肿瘤细胞的转移[2]。细胞周期蛋白E(Cyclin E)是G1期重要的周期蛋白,与细胞周期蛋白质依赖激酶结合促进pRB的磷酸化,参与肿瘤的发生发展。CD31即血小板-内皮细胞黏附分子1,是一种相对分子质量为130 kD的跨膜糖蛋白,广泛分布在血管的各种细胞上,尤其在培养的血管内皮细胞的连接处存在高表达,可作为机体血管生成的标志,可直接反映移植瘤的微血管生成情况。本课题组前期建立了S100A13稳定过表达人甲状腺髓样癌细胞株(TT),并证实S100A13基因对TT细胞的增殖有促进作用[3]。本研究观察了过表达S100A13基因的甲状腺癌TT细胞侵袭能力变化,并探讨其机制。现将结果报告如下。
1 材料与方法
1.1 细胞、试剂及仪器 TT细胞购买于中国科学院细胞库,用含10%胎牛血清(FBS)的F12K培养基于培养箱(37 ℃、5% CO2)中静置培养。兔抗人FGF-1单克隆抗体、抗人CD31单克隆抗体和Cyclin E单克隆抗体均购于士德生物工程有限公司。
1.2 细胞转染及分组 分别用pcDNA3.1/NT-GFP-S100A13表达质粒和pcDNA3.1/NT-GFP空质粒转染TT细胞。转染24 h后采用荧光显微镜观察转染效率,转染效率达30%,并换用含有500 μg/mL G418的完全培养基筛选阳性克隆,连续筛选4周后形成阳性细胞克隆,构建空载体pCDNA3.1/NT-GFP-TT细胞系和S100A13稳定过表达TT细胞系。将空载体pCDNA3.1/NT-GFP-TT细胞系(空载体组)和S100A13稳定过表达TT细胞系(S100A13过表达组)培养于10%FBS+1%双抗+RPMI1640完全培养基中,37 ℃、5% CO2饱和湿度培养箱内培养。0.25%胰酶消化,2~3 d传代1次。
1.3 细胞侵袭能力观察 采用Transwell侵袭实验。将预冷的无血清RPMI1640培养液按1∶6稀释基质胶,于每个直径8 μm的Transwell小室中铺加50 μL基质胶稀释液,再放置于37 ℃培养箱中过夜成膜。次日将已成膜的小室取出,于小室上腔中加入无血清RPMI1640培养液100 μL,放置20 min,使基质胶水化。分别取上述两组细胞(100 μL)接种在小室的上腔,于下腔中加入500 μL含10%胎牛血清的RPMI1640培养液。将小室板置于37 ℃、5% CO2的细胞培养箱中培养30~36 h后取出,用棉签轻轻擦弃小室上层细胞,再用PBS液洗涤3遍。将小室置于4%多聚甲醛液中固定10 min,倒置晾干,0.1%结晶祡溶液染色20 min,PBS液清洗,倒置晾干,中性树胶封片。将小室放置在光学显微镜下观察并拍照,于高倍视镜下随机选取4个视野对细胞进行计数,再取平均值,实验重复3次。
1.4 细胞FGF-1、Cyclin E、CD31蛋白检测 采用蛋白印迹法。提取上述两组细胞的总蛋白,BCA法测定总蛋白浓度,取50 μg总蛋白进行SDS-PAGE凝胶电泳分离、转膜、含5%脱脂奶粉的TBST封闭2 h后,FGF-1抗体、CD31抗体和Cyclin E抗体(1∶1 000)4 ℃孵育过夜。去除一抗,TBST洗膜3次,二抗(1∶1 000)、37 ℃孵育45 min,TBST洗膜3次,暗室中用蛋白荧光检测试剂盒(Hyclone.Pierce)显示结果于X线片。扫描蛋白条带灰度值,进行定量,以β-actin为对照。以目的蛋白条带灰度值与β-actin条带灰度值的比值作为FGF-1、CD31蛋白的相对表达量。
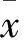
2 结果
2.1 两组细胞侵袭能力比较 S100A13过表达组、空载体组穿膜侵袭细胞数分别为(83.7±5.0)、(40.0±1.7)个,两组比较,P<0.01。
2.2 两组细胞FGF-1、Cyclin E、CD31蛋白相对表达量比较 S100A13过表达组、空载体组细胞FGF-1蛋白相对表达量分别为1.224±0.124、0.837±0.152,Cyclin E蛋白相对表达量分别为1.034±0.131、0.459±0.032,CD31蛋白相对表达量分别为1.147±0.144、0.312±0.071,两组比较,P<0.05或<0.01。
3 讨论
S100A13在心肌、骨骼肌、脑组织、胰腺、肾脏、子宫、小肠、甲状腺等器官和组织中均有表达,特别在甲状腺滤泡细胞中高表达。研究[4]发现,S100A13在乳头状甲状腺癌中的表达明显高于癌旁正常组织。在黑色素瘤细胞中,S100A13通过调控细胞因子和NF-κB信号通路参与细胞周期进展和分化[5],且S100A13的表达状态亦与黑色素瘤患者的复发风险相关[6]。此外,S100A13高表达肺癌细胞侵袭性增强[7]。在转移性癌症患者血清中亦发现S100A13水平升高[8]。上述结果均表明,S100A13增高可能是肿瘤转移的一个重要预报器。侵袭为肿瘤细胞转移的第一步,为了探讨体外S100A13基因过表达在甲状腺癌中的侵袭作用,我们建立了稳定高表达S100A13基因的TT细胞系,研究S100A13基因过表达在体外对TT细胞侵袭能力的影响。本研究结果发现,S100A13稳定过表达甲状腺癌TT细胞较空载体pCDNA3.1/NT-GFP-TT细胞穿过基质膜的细胞数明显增多,表明S100A13过表达能增强甲状腺癌TT细胞的侵袭能力。
FGF-1是一种广谱有丝分裂原与促血管生成因子,其通过激活纤维母细胞生长因子受体发挥生物学效应[9,10]。FGF-1不仅在正常发育与创伤愈合中扮演着重要角色,也在肿瘤的发生和发展中发挥重要作用,表现出癌基因样作用[11]。据文献报道,FGF-1在食管腺癌、胰腺癌、前列腺癌等多种恶性肿瘤中高表达[12~14],其与血管生成和肿瘤发生等过程密切相关,并在其中起重要作用[15]。FGF-1可促进血管内皮增生,促进血管生成。研究[16]发现,甲状腺癌中S100A13蛋白表达明显高于甲状腺腺瘤和正常组织,其阳性表达与淋巴结转移相关,与FGF-1表达具有很好的一致性。本研究表明,与空载体组相比,S100A13过表达组FGF-1蛋白高表达。据此我们推测,S100A13基因过表达能显著促进TT细胞侵袭可能与FGF-1有关。Cyclin E基因在宫颈鳞癌、卵巢癌、消化道肿瘤、子宫内膜癌中的表达增加[4,6,7]。其高表达可缩短G1期进程,使细胞提前进入S期,从而干扰DNA和中心体复制及分裂,导致细胞转化和肿瘤生成。研究证实,S100A13过表达组中Cyclin E蛋白高表达,S100A13增强甲状腺癌TT细胞的侵袭能力可能与Cyclin E蛋白高表达促进肿瘤细胞增殖有关。CD31为机体血管生成的标志,可直接反映移植瘤的微血管生成情况[14~18],肿瘤诱导所产生的肿瘤血管网直接影响肿瘤细胞淋巴结转移。研究中我们发现,S100A13过表达组CD31蛋白的表达明显高于空载体组。因此,S100A13增强甲状腺癌TT细胞的侵袭能力可能与CD31高表达促进肿瘤血管生成有关。
综上可见,过表达S100A13基因的甲状腺癌TT细胞侵袭能力增强,这可能与S100A13促进FGF-1、Cyclin E、CD31蛋白表达有关。
[1] Prudovsky I, Mandinova A, Soldi R, et al. The non-classical export routes: FGF-1 and IL-1 alpha point the way [J]. J Cell Sci, 2003,116(24):4871-4881.
[2] Billottet C, Janji B, Thiery JP, et al. Rapid tumor development and potent vascularization are independent events in carcinoma producing FGF-1 or FGF-2[J]. Oncogene, 2002,21(53):8128-8139.
[3] 曹仁贤,田利娜,文芳,等.过表达S100A13基因对甲状腺癌TT细胞生长特性的影响[J].癌症,2008,27(8):822-824.
[4] Martinez-Aguilar J, Clifton-Bligh R, Molloy MP. A multiplexed, targeted mass spectrometry assay of the S100 protein family uncovers the isoform-specific expression in thyroid tumours[J]. BMC Cancer, 2015,15:199.
[5] Massi D, Landriscina M, Piscazzi A, et al. S100A13 is a new angiogenic marker in human melanoma[J]. Mod Pathol, 2010,23(6):804-813.
[6] Azimi A, Pernemalm M, Frostvik Stolt M, et al. Proteomics analysis of melanoma metastases: association between S100A13 expression and chemotherapy resistance[J]. Br J Cancer, 2014,110(10):2489-2495.
[7] Pierce A, Barron N, Linehan R, et al. Identification of a novel, functional role for S100A13 in invasive lung cancer cell lines[J]. Eur J Cancer, 2008,44(1):151-159.
[8] Smirnov DA, Zweitzig DR, Foulk BW, et al. Global gene expression profiling of circulating tumor cells[J]. Cancer Res, 2005,65(12):4993-4997.
[9] Grose R, Dickson C. Fibroblast growth factor signaling in tumorigenesis[J]. Cytokine Growth Factor Rev, 2005,16(2):179-186.
[10] Presta M, Dell′Era P, Mitola S, et al. Fibroblast growth factor/fibroblast growth factors receptor system in angiogenesis[J]. Cytokine Growth Factor Rev, 2005, 16(2):159-178.
[11] Prudovsky I, Mandinova A, Soldi R, et al. The non-classical export routes: FGF1 and IL-1alpha point the way[J]. J Cell Sci, 2003,116(Pt 24):4871-4881.
[12] Soslow RA, Nabeya Y, Ying L, et al. Acidic fibroblast growth factor is progressively increased in the development of oesophageal glandular dysplasia and adenocarcinoma[J]. Histopathology, 1999,35(1):31-37.
[13] Grose R, Dickson C. Fibroblast growth factor signaling in tumorigenesis[J]. Cytokine Growth Factor Rev, 2005,16(2):179-186.
[14] 田利娜,曹仁贤,刘星,等.shRNA干扰S100A13基因对人甲状腺癌细胞释放成纤维细胞生长因子1的影响[J].中华内分泌代谢杂志,2010,26(10):847-849.
[15] 赵仲生,茹国庆,马杰.细胞周期素E和P53蛋白在胃癌组织中表达及预后意义[J].中国癌症杂志,2003,13(3):211-214.
[16] 刘畅,曹仁贤,钟警,等.甲状腺癌组织中S100A13、FGF-1表达及意义[J].实用癌症杂志,2009,24(1):19-20.
[17] 傅玉峰,丁炯.VEGF表达与胃癌生物学特性的实验研究[J].南京医科大学学报(自然科学版),2006,29(9):749-752.
[18] Shirakawa K, Kobayashi H, Sobajima J, et al. Inflammatory breast cancer: vasculogenic mimicry and it s hemodynamics of an inflammatory breast cancer xenograft model[J]. Breast Cancer Res, 2003,5(3):136-139.
湖南省医药卫生科研计划课题项目(B2014-176)。
10.3969/j.issn.1002-266X.2017.02.012
R736.1
A
1002-266X(2017)02-0040-03

