拥挤胁迫对已接种疫苗的大菱鲆部分免疫和应激指标的影响
殷述亭, 刘宝良, 黄 滨, 霍欢欢, 王蔚周 顺
(1 青岛农业大学海洋科学与工程学院,山东 青岛266109;2 中国水产科学研究院黄海水产研究所,山东 青岛266071)
拥挤胁迫对已接种疫苗的大菱鲆部分免疫和应激指标的影响

(1 青岛农业大学海洋科学与工程学院,山东 青岛266109;2 中国水产科学研究院黄海水产研究所,山东 青岛266071)
通过对3个养殖初始密度(低、中、高密度组分别为5、10、20 kg/m2)的大菱鲆(Scophthalmusmaximus)接种减毒迟缓爱德华氏菌疫苗,观察其血液、脾脏、头肾、鳃和皮肤中部分免疫和应激指标的变化规律,研究经接种疫苗操作后大菱鲆应对拥挤胁迫的应激响应。结果显示,低密度养殖的白细胞介素(1L-1β)、补体(C3)、免疫球蛋白M(IgM)、溶菌酶(LZM)和肿瘤坏死因子(TNF -α)等免疫指标显著高于中、高密度组(P<0.05),高密度组血液中皮质醇的含量高于中、低密度组(P<0.05);通过基因表达分析发现,高密度组的热休克蛋白(HSP70)表达量显著高于中、低密度组;低密度组的免疫球蛋白M(IGM)表达量高于中、高密度组。研究表明,为提高大菱鲆的免疫效果、减少应激反应,可以采用低密度(5 kg/m2)养殖。
大菱鲆;迟缓爱德华氏菌疫苗;拥挤胁迫;血清指标;基因表达
大菱鲆(Scophthalmusmaximus)属于硬骨鱼纲,鲽形目鲆科,原产于欧洲大西洋海域,是世界市场公认的优质比目鱼类之一[1],自1992年被引入我国后,迅速成为我国北方沿海省份主要养殖经济鱼类之一。近年来,伴随养殖规模的不断扩大,病害问题时有发生,影响了产业的健康发展。目前,我国对于水产动物的病害防治仍然以化学防治为主,因此,抗生素类药物被大量使用,导致环境污染,所引发的食品安全问题受到社会各界的关注。
迟缓爱德华氏菌属于肠杆菌科的爱德华菌属(Edwardsiella),是继鳗弧菌后又一种给我国水产养殖业带来巨大经济损失的病原菌[2-4]。鱼用疫苗是一种能够激发鱼体产生自动免疫的生物制剂,可以利用疫苗技术有效预防迟缓爱德华氏菌病。但是,疫苗的使用效果受免疫策略的影响。有研究表明,不同水温对已接种草鱼轮状病毒疫苗的草鱼免疫力影响显著[5];不同佐剂的疫苗对大鲵的免疫力能产生不同的影响[6];注射、口服免疫菌蜕疫苗对罗非鱼均能产生免疫效果[7]。目前,关于拥挤胁迫对接种疫苗免疫力的影响相关报道还很少,因此有必要明确两者之间的关系。
拥挤胁迫作为一种常见胁迫因子,可导致免疫相关蛋白和基因变化。据报道[8],拥挤胁迫降低塞内加尔鳎机体免疫功能。相似的研究结果在金头鲷、虹鳟和罗非鱼的研究中也有报道[9-11]。此外,拥挤胁迫也会引起免疫球蛋白M基因和热休克蛋白(HSP70)基因表达的变化。本研究是在工厂化循环水养殖中对大菱鲆接种已减毒迟缓爱德华氏菌疫苗,比较不同养殖密度对大菱鲆同一时间点的部分免疫指标及应激指标的变化情况,确定对大菱鲆免疫力的影响。
1 材料与方法
1.1 材料
所用大菱鲆饲养于烟台市山东东方海洋科技股份有限公司开发区分公司的循环水养殖系统中。该系统有3个水池,每个水池体积3 m3,均采用(150±10)g、健康以及体表无损伤的大菱鲆,实验采用的疫苗来自华东理工大学张元兴教授实验室[12]。
1.2 实验设计与日常管理
实验设置低、中、高3个密度组,分别为5、10和20 kg/m2,每个密度组设置1个空白对照组。每个密度组设置 3 个重复。每天8:00和16:00进行投喂,日投喂量为体质量的1.2%左右,根据摄食情况和大菱鲆的体重变化随时调整。水循环速率为24次/天,日换水量为100%。实验鱼在系统中暂养半个月后开始注射疫苗,注射时将鱼捞出后用MS-222进行麻醉,对实验组进行腹腔注射减毒疫苗,对照组则注射等量的生理盐水。
1.3 样品采集
共进行9次取样,第1次取样是注射疫苗前的第1天,第2次取样为注射疫苗后的第1周,以后每周取样1次。取样前将大菱鲆置于200 mg/L的MS-222中做深度麻醉,避免对鱼的刺激。每次取样5尾鱼,用注射器取尾静脉血3 mL,放入5 mL离心管中保存,每个注射器内加入0.5 mL的肝素钠作为抗凝剂,4℃冰箱过夜,用转速12 000 r/min离心30 min,取上清液放到冻存管中,-80℃冰箱保存备用。取抽完血的鱼的肝脏、脾脏、头肾、肠、鳃和皮肤,用遇冷的生理盐水漂洗去血液,减去组织表面的结缔组织,用剪刀将其剪成1 mm大小放入冻存管中,将冻存管放入液氮中暂时保存,后转入-80℃冰箱长期保存,以便日后用于RNA提取。
1.4 水质与血液免疫指标测定
1.5 基因表达
利用RNA快速提取试剂盒(宝生物工程〈大连〉有限公司)提取脾脏、头肾、鳃和皮肤组织的总RNA,提取方法按试剂盒说明书操作。使用反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser (Takara Dalian,China)将提取的总RNA反转录为cDNA,放置于20μL的RNAse free dH2O中,在-80℃冰箱中保存待用。
本实验所用的引物通过Genbank相关基因设计。所有引物由上海生物工程有限公司合成,按照使用说明进行实时荧光定量PCR(qRT-PCR)反应。采用SYBR Green Ⅰ嵌合荧光法进行实时定量PCR扩增反应。每个反应取2μL cDNA、10μL的SYBR Prime Ex Taq ,反应条件为:95℃3 min,然后40个循环(95℃15S,57℃60S,读板记录荧光量),最后72℃3 min。以β-actin为内参,对得到的各样品Ct值进行均一化处理,以低密度组的值为基准,应用2-ΔΔCt法[16]分析实验组中的基因相对表达量。
1.6 数据处理
2 结果
2.1 水质参数的变化
整个实验过程中DO、T、pH和盐度相对稳定,分别维持在(8±0.5)mg/L、 (18±1)℃、(7.5±0.3)和(28±1)。实验组和对照组之间没有显著性差异。氨氮、亚硝酸盐和可溶性磷酸盐的浓度和COD有略微上升的趋势,但实验组和对照组之间没有明显差异,不同密度组之间也没有明显差异(图1)。
2.2 接种疫苗后不同密度组大菱鲆血清免疫和应激指标的变化
2.2.1 对白细胞介素1β(1L-1β)的影响
在接种疫苗前,实验组和对照组中不同密度组大菱鲆的1L-1β水平差异不显著,接种操作后,实验组中的高密度组大菱鲆的1L-1β浓度迅速升高,达到峰值后开始下降并趋于平稳,而低密度组的1L-1β的浓度在第2周达到峰值后开始下降直至趋于平稳;对照组中的中、高密度组呈现相对平稳的趋势,低密度组呈现先相对平稳后上升的趋势(图2A)。结果显示,在实验组中,自第2周起低密度组中的1L-1β浓度显著高于其它组;在对照组中,自第8周起低密度组的1L-1β的浓度明显高于其它密度组(P<0.05)。
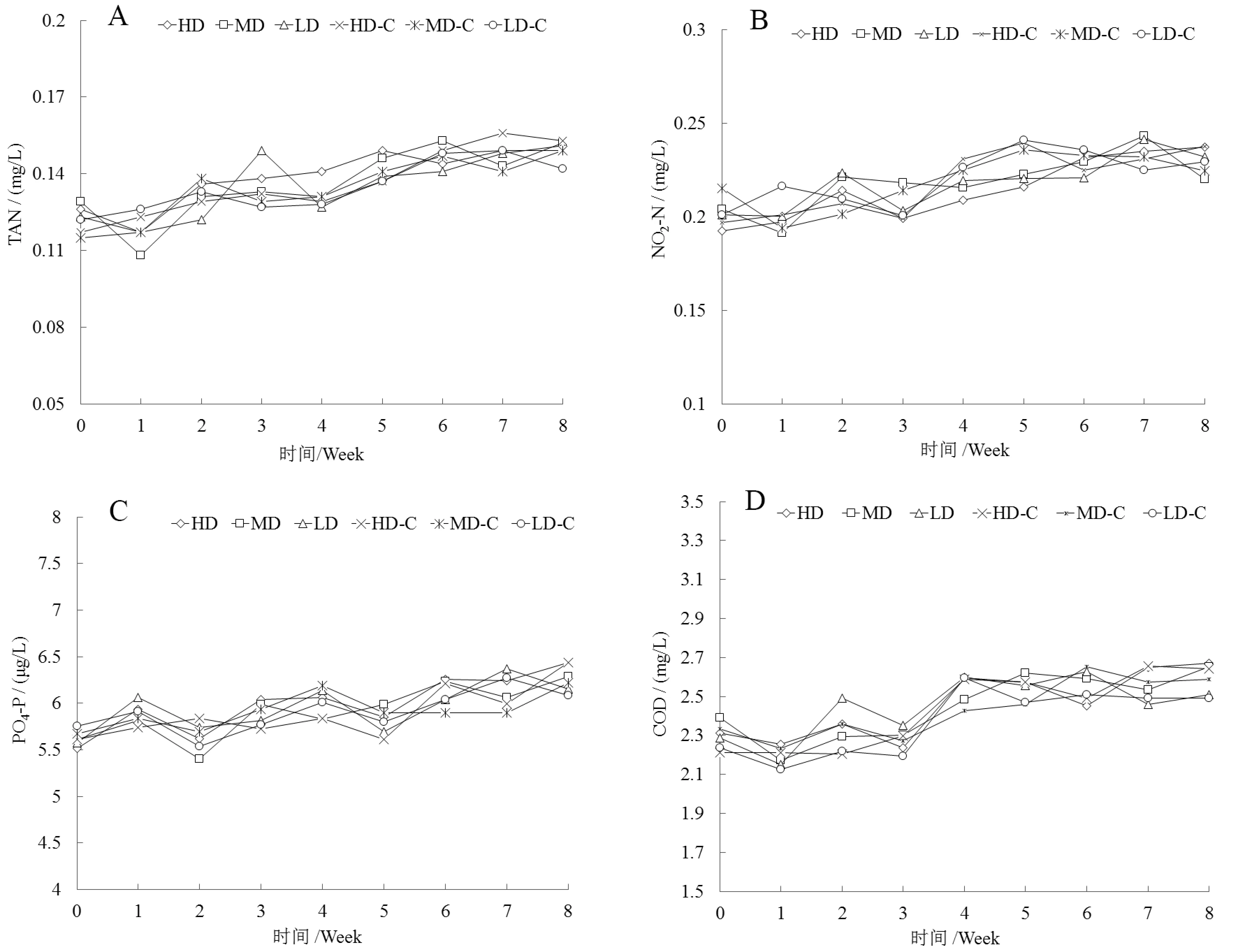
图1 养殖密度对大菱鲆水质指标的影响

图2 拥挤胁迫对血液免疫指标的影响
2.2.2 对已免疫大菱鲆补体C3的影响
接种疫苗之前,实验组和对照组中的不同密度组大菱鲆补体C3浓度无显著差异,接种操作后,实验组各密度组中C3浓度均显著升高,在第3周达到峰值并缓慢下降,趋于平稳;对照组中的C3浓度呈现相对平稳的趋势(图2B)。结果显示,自第2周起,实验组中的低密度组大菱鲆C3浓度显著高于其它组(P<0.05);对照组未出现明显差异。
2.2.3 对已免疫大菱鲆总免疫球蛋白M(IgM)的影响
接种疫苗之前,实验组和对照组中不同密度组大菱鲆总IgM的浓度差异不显著,接种操作后,实验组中各密度组的IgM浓度均显著升高,在第2周达到峰值后并缓慢下降,趋于平稳,对照组中、高密度组的IgM呈现一个相对平稳的趋势,低密度组先呈现相对平稳,后上升的趋势(图2C)。结果显示,在实验组中,自第2周起低密度组中大菱鲆的总IgM浓度显著高于其它组(P<0.05);对照组未出现明显差异。
2.2.4 对已免疫大菱鲆溶菌酶(LZM)的影响
接种疫苗之前,实验组和对照组的不同密度组中大菱鲆LZM浓度差异不显著,接种操作后,实验组中各密度组的LZM浓度均显著升高,中、高密度组在第2周达到峰值后开始缓慢下降,最后趋于平稳,而低密度组在第3周达到峰值后缓慢下降,后趋于平稳;对照组呈现相对平稳趋势(图2D)。结果显示,自第3周起,低密度组中大菱鲆的LZM浓度显著高于其它组(P<0.05);对照组中未出现明显差异。
2.2.5 对已免疫大菱鲆肿瘤坏死因子α(TNF-α)的影响
接种疫苗之前,实验组和对照组不同密度组中的大菱鲆TNF-α的浓度差异不显著,接种操作后,实验组中各密度组的TNF-α浓度均显著升高,在第3周达到峰值后开始缓慢下降,最后趋于平稳;对照组则呈现相对平稳的趋势(图2E)。结果显示,自第3周起,实验组中低密度组大菱鲆的TNF-α浓度显著高于实验组中的其它组(P<0.05),对照组中未出现明显差异。
2.2.6 对已免疫大菱鲆皮质醇(Cortisol)的影响
接种疫苗之前,实验组和对照组中的不同密度组中大菱鲆皮质醇浓度的差异不显著,接种操作后,实验组中各密度组的皮质醇浓度均呈现先上升后下降,最后都趋向平稳,低密度组在第2周达到峰值后缓慢下降,中、高密度组在第4周达到峰值后开始下降;对照组中低密度组呈现相对平稳的趋势,中、高密度组呈现先保持相对平稳后上升的趋势(图2F)。结果显示,在实验组中,自第3周起,中、高密度的皮质醇浓度显著高于低密度组;在对照组中,自第7周起低密度组皮质醇浓度显著低于中、高密度组(P<0.05)。
2.3 已免疫大菱鲆的部分免疫基因和应激基因表达量的变化
2.3.1 热休克蛋白基因(HSP70)的变化
接种疫苗前,实验组和对照组的各组织间的IgM表达量差异不显著;接种操作后,实验组各密度组的组织表达量均呈现先升高后降低最后趋于平稳的趋势(图3A,C,D)。
在第2周以后,脾脏、鳃和皮肤中IgM基因表达量达到最大值后开始下降(图3A,C,D),在第3周后,头肾的IgM表达量达到最大值后开始下降(图3B)。对照组中除低密度组中的头肾组织表达量自第7 周起IgM的表达量出现一个上升外,其它各密度组的各个组织均呈现一个相对平稳的趋势(图3A,B,C,D)。统计分析结果显示,自第2周起,实验组中低密度组的显著高于同期中密度组,而中密度组的又显著高于同期的高密度组;对照组中、低密度组的头肾组织,自第七周起显著高于头肾组织中、高密度组的IgM表达量外,其它组织均为出现显著的差异 (图3A,B,C,D,P<0.05)。
2.3.2 免疫球蛋白M基因(IgM)的变化
接种疫苗前,实验组和对照组不同组织HSP70的表达量差异不显著,接种操作后,实验组中的各个密度组各个组织的HSP70表达量均呈现先上升后下降,最后稳定的趋势,对照组的各密度组呈现相对平稳的趋势(图4A,B,C,D)。统计结果显示,实验组中各密度组在头肾、脾脏和鳃的表达量在第2周后,高密度组显著高于同期中、低密度组的HSP70表达量(图4A,B,C,P<0.05),而在皮肤中的表达量在第3周后,高密度组显著高于同期中、低密度组的HSP70的表达量(图4D,P<0.05);对照组间未出现显著差异(图4A,B,C,D,P<0.05)。
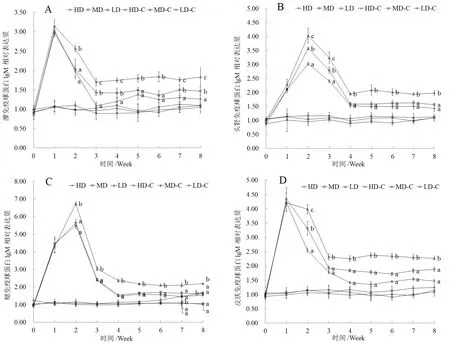
图3 拥挤胁迫对IgM相对表达量的影响

图4 拥挤胁迫对HSP70相对表达量的影响
3 讨论
3.1 水质变化对大菱鲆免疫指标的影响

3.2 拥挤胁迫对接种疫苗后大菱鲆血清免疫和应激指标的影响
有研究表明,拥挤胁迫会对鱼类的免疫机能产生影响[21-22]。血液中含有多种免疫物质,如1L-1β、LZM、IgM、补体C3和TNF-α等,在抵御物理、化学和生物等因素胁迫中具有非常重要的作用[23]。
补体在鱼类抵抗微生物感染过程中扮演这重要角色,启动后能够参与机体靶细胞溶解和调理反应,其中补体C3是补体系统最主要的成分之一,激活后具有溶血、溶菌、调理、免疫吸附等生物学功能[24]。拥挤胁迫对黄姑鱼补体C3的影响差异不显著[25];而在施氏鲟稚鱼中,随养殖密度的逐渐增大,补体C3呈现减少的趋势[26]。这同本实验的结论一致。不同密度组大菱鲆经免疫刺激2周后,补体C3随密度的逐渐增大而减少。同时,本实验中大菱鲆血清补体C3浓度在免疫达到峰值的时间与聂芬[26]研究黄颡鱼补体C3浓度达到峰值的时间相同。因此,可以推测拥挤胁迫能够通过降低大菱鲆补体C3的浓度,进而影响降低大菱鲆的免疫力。
IgM是鱼类最主要的免疫球蛋白,是当机体受到抗原刺激后最先产生的抗体,具有很强的细胞毒活性和细胞溶解活性。IgM广泛应用于评估鱼类的免疫水平,是由相关的免疫球蛋白基因产生的。本实验发现,第1周IgM在血清中及部分组织表达量达到峰值,这与李桂欢[28]研究罗非鱼以及王玉娟[17]研究大菱鲆的结果相类似,而Vargas-Chacoff等[29]对智利亚南极鱼研究发现,在高密度(60 kg/m3)养殖条件下,IgM浓度和低密度(3.1 kg/ m3)条件下并没有差异。但在本研究中,当大菱鲆养殖密度达到20 kg/m2时,免疫球蛋白的浓度显著降低。因此,拥挤胁迫能通过影响IgM的表达量来影响IgM的浓度,使高密度组大菱鲆的免疫力降低。
LZM广泛存在于生物体液、血清和巨噬细胞中,在抵御外来病原菌方面发挥着重要作用,其活性在一定程度上能说明鱼非特异性免疫的体液免疫状态,也能水解革兰氏阳性菌的细胞壁,使内容物逸出进而起到杀菌的作用[30]。Demers等[31]对虹鳟的研究发现,随着养殖密度的升高,LZM水平显著升高。而本研究结果则显示低密度组的LZM水平显著高于中、高密度组,这同俄罗斯鲟幼鱼应对不同密度胁迫时LZM应答规律[32]相同。但在本研究中,接种疫苗后LZM出现急剧上升,同样,与孙金辉等[33]研究虹鳟时发现LZM在第三周达到最大值的时间相类似。因此,拥挤胁迫能够通过降低大菱鲆的LZM浓度,进而降低高密度组大菱鲆的免疫力。
1L-1β和TNF-α是两种主要的促炎细胞因子。1L-1β能够通过诱导炎症反应效应细胞、相关组织细胞、淋巴细胞和血管内皮细胞生长发育而在炎症中发挥着作用,并且具有调节代谢、造血和免疫学活性等功能[34];TNF-α是当病原入侵时,由巨噬细胞或者是单核细胞产生的炎症细胞因子,能够直接杀死肿瘤细胞,还在细胞间的信号传导中发挥作用[35],在抵御寄生虫和病原微生物中充当介质,同时在机体内发挥着治疗作用[36-38]。有研究表明,急性拥挤胁迫以显著诱导1L-1β和TNF-α基因表达上调,这可能和皮质醇浓度上调有关[39-40],但长期的密度胁迫可导致1L-1β和TNF-α基因表达下调[10],这与本研究结果相似。本实验中,大菱鲆接种疫苗后,1L-1β和TNF-α的浓度快速升高并达到最大值,这与幼龄大马哈鱼接受杀鲑气单胞菌疫苗进行腹腔免疫时,鱼体肾脏和脾脏中1L-1β和TNF-α基因的表达规律相类似[41]。因此,拥挤胁迫能够通过抑制1L-1β和TNF-α的基因表达,影响这两种促炎细胞因子浓度,进而导致高密度组免疫力降低。
3.3 拥挤胁迫对接种疫苗后大菱鲆血清皮质醇浓度的影响
皮质醇是一种重要的应激激素,其由丘脑下部—垂体—肾间组织轴所分泌[42],其上升是被看成鱼类应激的灵敏信号[43]。因此,血清皮质醇水平可作为评价鱼类应激反应的一个重要指标。国内外很多学者对血清皮质醇浓度进行了大量研究。如:拥挤胁迫对缘石脂鲤的血浆皮质醇浓度并没有产生影响[44];拥挤胁迫使鲫鱼血液皮质醇浓度在几天内显著升高,随后虽有下降但高密度组一直保持较高浓度[45];高密度养殖虹鳟的皮质醇浓度会明显高于低密度组的皮质醇浓度[46];牙鲆研究中也发现相同的规律[47]。本实验中发现接种疫苗初期大菱鲆皮质醇浓度上升,这与张意敏等[48]研究罗非鱼的实验结果相同。因此推测,这主要是因为皮质醇是一种快速响应的应激激素,接种操作对大菱鲆的应激刺激效应随着时间推移已经不显著,而养殖密度造成的慢性拥挤胁迫逐渐体现出来,导致高密度组皮质醇浓度高于其它组,这类似于虹鳟中的研究发现[46]。因此,拥挤胁迫能够使鱼长期处于应激状态,导致鱼体免疫力下降。
3.4 拥挤胁迫对接种疫苗后大菱鲆部分免疫基因和应激基因表达量的影响
HSPs主要作为分子伴侣参与蛋白质折叠、组装、降解以及细胞内定位,在鱼类中HSP70是研究最广泛的热休克蛋白之一,其在正常情况下就可以进行表达,在温度、盐度、低氧、渗透压以及微生物感染等环境因子的胁迫下,其表达量就会显著增加[49]。本研究结果显示,大菱鲆接种疫苗后,HSP70表达量在第一天就出现了急剧上升,这同先前于大菱鲆中研究结论[50]相同;养殖到第2周时低密度与中高密度出现了明显差异,这与在海鲈和施氏鲟的研究结果[51-52]相类似。拥挤胁迫能够通过降低HSP70的基因表达量,进而影响大菱鲆的免疫力。
4 结论
各个养殖密度组在注射疫苗后,经过2个月的养殖,高密度组能够引起各血液免疫指标发生不利的变化,低密度组的IgM、LZM、1L-1β、TNF -α和C3浓度高于中、高密度组,而皮质醇的浓度高密度组则显著高于低密度组。通过基因表达分析显示,高密度(20 kg/m2)引起脾脏、头肾、鳃和皮肤组织中的免疫相关基因表达,高密度组HSP70免疫基因表达量明显高于中、低密度组;低密度组(5 kg/m2)的IgM表达量明显高于中(10 kg/m2)、高密度组(20 kg/m2)。研究表明,拥挤胁迫降低了大菱鲆的免疫能力,在低密度下养殖,大菱鲆的免疫能力较好。
□
[1] 雷霁霖.海水养殖新品种介绍—大菱鲆[J].中国水产,2000,293(4):38-39.
[2] CLAVIJO A M,CONROY G,CONROY D A,et al.First report of Edwardsiella tarda from tilapias in Venezuela[J].Bulletin- European Association of Fish Pathologists,2002,22(4):280-282.
[3] 张晓君,战文斌,陈翠珍,等.牙鲆迟钝爱德华氏菌感染症及其病原的研究[J].水生生物学报,2005,29(1) :31-37.
[4] PARK S B,AOKI T,JUNG T S.Pathogenesis of and strategies for preventing Edwardsiella tarda infection in fish[J].Veterinary Research,2012,43(1):67.
[5] 杨先乐,左文功.水温与草鱼免疫应答关系的研究[J].Current Zoology,1997(1):42-48.
[6] 杨星,张美彦,周勇,等.不同佐剂对大鲵嗜水气单胞菌灭活疫苗的免疫效果[J].水生态学杂志,2015(5):69-73.
[7] 付天增,郝金婷,李宁求,等.迟缓爱德华菌菌蜕疫苗对罗非鱼注射和口服免疫的效果分析[J].水生生物学报,2016,40(6):1158-1165.
[8] COSTAS B,ARAG O C,DIAS J,et al.Interactive effects of a high-quality protein diet and high stocking density on the stress response and some innate immune parameters of Senegalese sole Solea senegalensis[J].Fish Physiology and Biochemistry,2013,39(5):1141-1151.
[9] MONTERO D,IZQUIERDO M S,TORT L,et al.High stocking density produces crowding stress altering some physiological and biochemical parameters in gilthead seabream,Sparus aurata,juveniles[J].Fish Physiology &Biochemistry,1999,20(1):53-60.
[10]YARAHMADI P,MIANDARE H K,HOSEINIFAR S H,et al.The effects of stocking density on hemato-immunological and serum biochemical parameters of rainbow trout (Oncorhynchus mykiss)[J].Aquaculture Research,2015,23(1):55-63.
[11]TELLI G S,RANZANI-PAIVA M J,DIAS D C,et al.Dietary administration of Bacillus subtilis,on hematology and non-specific immunity of Nile tilapia Oreochromis niloticus,raised at different stocking densities[J].Fish & Shellfish Immunology,2014,39(2):305-11.
[12]XIAO J,CHEN T,LIU B,et al.Edwardsiella tarda mutant disrupted in type III secretion system and chorismic acid synthesis and cured of a plasmid as a live attenuated vaccine in turbot[J].Fish & Shellfish Immunology,2013,35(3):632-41.
[13]王秀华,周凌云,王玉娟,等.多效价载体疫苗免疫大菱鲆效果评价[J].中国水产科学,2011,18(4):918-923.
[14]何杰,强俊,徐跑,等.低温驯化下4种不同品系罗非鱼血清皮质醇与免疫相关指标的变化[J].中国水产科学,2014,21(2):266-274.
[15]隗黎丽,刘毅.爱德华氏菌灭活疫苗对黄颡鱼免疫相关基因表达及过氧化氢酶、超氧化歧化酶和补体C3活性的影响[J].水产科学,2015,34(3):150-154.
[16]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and 2-ΔCt method[J].Methods,2001,25(4):402-408.
[17]王玉娟.两种佐剂对大菱鲆鳗弧菌浸泡疫苗免疫效果的影响[D].上海海洋大学,2012.
[18]THOMAS S L,PIEDRAHITA R H.Apparent ammonia-nitrogen production rates of white sturgeon (Acipensertransmontanus) in commercial aquaculture systems [J].Aquacultural Engineering,1998,17(1):45-55.
[19]张晓雁,李罗新,危起伟,等.养殖密度对中华鲟行为、免疫力和养殖环境水质的影响[J].长江流域资源与环境,2011,20(11):1348-1354.
[20]刘永士,臧维玲,侯文杰,等.室内罗氏沼虾幼虾养殖密度对水质与生长的影响[J].上海海洋大学学报,2010,19(2):184-189.
[21]HEGAZI M M,ATTIA Z I,ASHOUR O A.Oxidative stress and antioxidant enzymes in liver and white muscle of Nile tilapia juveniles in chronic ammonia exposure [J].Aquatic Toxicology,2010,99(2):118—125.
[22]刘松岩.环境胁迫对中华鲟体内自由基水平和抗氧化酶活力的影响[D].武汉:华中农业大学,2006.
[23]CORBEL M J.The immune response in fish:a review[J].Journal of Fish Biology,1975,7(4):539-563.
[24]王志平,张士璀,王光锋.鱼类补体系统成分及补体特异性和功能的研究进展[J].水生生物学报,2008 ,32(5):760-769.
[25]薛宝贵,楼宝,徐冬冬,等.密度胁迫对黄姑鱼幼鱼生长、代谢及非特异性免疫的影响[J].渔业科学进展,2014,31(2):45-51.
[26]聂芬,石小涛,李大鹏,等.拥挤胁迫对史氏鲟稚鱼血浆溶菌酶活性和补体水平的影响[J].水生生物学报,2007,31(4):581-584.
[27]隗黎丽,刘毅鲴.爱德华氏菌灭活疫苗对黄颡鱼免疫相关基因表达及过氧化氢酶、超氧化歧化酶和补体C3活性的影响[J].水产科学,2015,34(3):150-154.
[28]李桂欢.罗非鱼源无乳链球菌嵌合型亚单位疫苗与DNA疫苗的研制及免疫效果评价[D].广东:广东海洋大学,2014.
[29]VARGASCHACOFF L,MARTíNEZ D,OYARZúN R et al.Combined effects of high stocking density and Piscirickettsia salmonis treatment on the immune system,metabolism and osmoregulatory responses of the Sub-Antarctic Notothenioid fish Eleginops maclovinus[J].Fish & shellfish immunology,2014,40(2):830-831.
[30]Grinde B,Jollès J,Jollès P.Purification and characterization of two lysozymes from rainbow trout (Salmogairdneri)[J].European Journal of Biochemistry,1988,173(173):269-273.
[31]DEMERS N E,BAYNE C J.The immediate effect of stress on hormones and plasma lysozyme in rainbow trout [J].Develop-mental and Comparative Immunology,1997,21(4):363-373。
[32]曹阳,李二超,陈立侨,等.养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响[J].水生生物学报,2014(5):968-974.
[33]孙金辉,王庆奎,陈成勋,等.嗜水气单胞菌灭活疫苗对虹鳟免疫力和抗病力的影响[J].淡水渔业,2013,43(1):44-49.
[34]何江帅,卢强,李伟,等.鲤鱼白细胞介素-1β全长cDNA的克隆·鉴定及其差异表达分析[J].安徽农业科学,2011,39(12):7301-7304.
[35]GARCíA-CASTILLO J,PELEGRíN P,MULERO V,et al.Molecular cloning and expression analysis of tumor necrosis factor alpha from a marine fish reveal its constitutive expression and ubiquitous nature[J].Immunogenetics,2002,54(3):200-207.
[36]CZARNIECKI C W.The role of tumor necrosis factor in viral disease[J].Antiviral Research,1993,22(4):223-258.
[37]GOLDFELD A E,TSAI E Y.TNF-alpha and genetic susceptibility to parasitic disease[J].Experimental Parasitology,1996,84(2):300-303.
[38]STEINSHAMN S,BEMELMANS M H,VAN TITS L J,et al.TNF receptors in murine Candida albicans infection:evidence for an important role of TNF receptor p55 in antifungal defense[J].Journal of Immunology,1996,157(5):2155-2159.
[39]KANG S Y,KO Y H,MOON Y S,et al.Effects of the Combined Stress Induced by Stocking Density and Feed Restriction on Hematological and Cytokine Parameters as Stress Indicators in Laying Hens[J].Asian Australasian Journal of Animal Sciences,2011,24(3):414-420.
[40]CHRISTOPHERMARLOWEA C,MONICAF B,INGVILD B,et al.Changes in selected stress and immune-related genes in Atlantic cod,Gadus morhua following overcrowding [J].Aquaculture Research,2008,39(14):1533-1540.
[41]FAST M D,JOHNSON S C,JONES S R M.Differential expression of the pro-inflammatory cytokines IL-1β-1,TNFα-1 and IL-8 in vaccinated pink (Oncorhynchusgorbuscha) and chum (Oncorhynchusketa) salmon juveniles[J].Fish & Shellfish Immunology,2007,22(4):403-407.
[42]BERNIER N J,FLIK G,KLAREN P H M.Chapter 6 Regulation And Contribution Of The Corticotropic,Melanotropic And Thyrotropic Axes To The Stress Response In Fishes[J].Fish Physiology,2009,28(09):235-311.
[43]STRANGE R J,SCHRECK C B.Anesthetic and Handling Stress on Survival and Cortisol Concentration [J].Journal of the Fisheries Research Board of Canada,2011,35(3):345-349.
[44]TOLUSSI C E,HILSDORF A W S,CANEPPELE D,et al.The effects of stocking density in physiological parameters and growth of the endangered teleost species piabanha,Brycon insignis (Steindachner,1877) [J]culture,2010,310(1/2):221-228.
[45]王文博.环境胁迫、中草药及基因转植对鱼体非特异性免疫功能的影响[D].武汉:中国科学院研究生院,2005.
[46]NORTH B P,TURNBULL J F,ELLIS T,et al.The impact of stocking density on the welfare of rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,2006,255(1/4):466-479.
[47]SERGIONESTOR B.Stress response of juvenile flounder (Paralichthys orbignyanus,Valenciennes 1839),to acute and chronic stressors[J].Aquaculture,2011,313(1/4):140-143.
[48]张意敏,朱华平,卢迈新,等.两种环境胁迫下果寡糖对罗非鱼血液中皮质醇及血糖的影响[J].广东农业科学,2013,40(10):121-124.
[49] S RENSEN J G,KRISTENSEN T N,LOESCHCKE V.The evolutionary and ecological role of heat shock proteins[J].Ecology Letters,2003,6(11):1025-1037.
[50]NI M,WEN H,LI J,et al.The physiological performance and immune responses of juvenile Amur sturgeon (Acipenserschrenckii) to stocking density and hypoxia stress[J].Fish & Shellfish Immunology,2014,36(2):325-335.
[51]GORNATI R,PAPIS E,RIMOLDI S,et al.Rearing density influences the expression of stress-related genes in sea bass (Dicentrarchuslabrax,L.)[J].Gene,2004,341(50):111-118.
[52]NI M,WEN H,LI J,et al.The physiological performance and immune responses of juvenile Amur sturgeon (Acipenserschrenckii) to stocking density and hypoxia stress[J].Fish & Shellfish Immunology,2014,36(2):325-335.
Effects of crowding stress on immunity and stress index of turbot injected with vaccine
YIN Shuting1,2,LIU Baoliang2,HUANG Bin2,HUO Huanhuan2,WANG Weifang2,LEI Jilin2,ZHOU Shun1
(1MarineScienceandEngineeringCollege,QingdaoAgriculturalUniversity,Qingdao266109China;2YellowSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Qingdao266071,China)
In this study,the responses of turbots to crowding stress were studied though obverting the changes of immune and stress index in blood,spleen,head kidney,gills and skin before and after being inoculated with attenuatedEdwardsiellatardavaccine,using turbots cultured in different initial stocking densities (low density:5 kg/m2,medium density:10 kg/m2,high density:20 kg/m2).The results showed that:the immune indexes such as serum interleukin (1L-1β),complement (C3),immunoglobulin M (IgM),lysozyme (LZM) and tumor necrosis factor (TNF-α) of turbots in the low density group were significantly higher than those of the medium and high density groups (P<0.05);the blood cortisol level of turbots in the low density group was significantly higher than that of the medium and low density groups (P<0.05);heat shock protein (HSP70) gene expression in the high density turbots was significantly higher than that of the medium and low density groups;and,immunoglobulin M (IgM) expression in low density turbots was higher than that of the medium and high density groups.Above all,in order to improve the immune effect and reduce stress response of turbot,it is suggested to adopt low density (5 kg/m2) breeding system.
Scophthalmusmaximus;Edwardsiellatardavaccine;crowding stress;serum immune index;gene expression
10.3969/j.issn.1007-9580.2017.01.006
2016-10-29
2017-01-18
国家自然基金项目(31402315);国家鲆鲽类产业技术体系高效养殖模式岗(CARS-50-G10);山东省现代农业产业技术体系创新渔业团队项目(SDAIT-12-06);青岛市市南区科技计划项目(2016-3-006-ZH)
殷述亭(1990—),男,硕士研究生,研究方向:工厂化健康养殖技术。E-mail:yst0325@163.com
周顺(1970—),男,教授,研究方向:病害免疫与防治。E-mail:zs1123@sina.com
S942.5
A
1007-9580(2017)01-026-09

