结核性脑膜炎患者脑脊液外泌体中let-7d表达的研究
尹慧敏 贾永林 李燕飞 段冉冉 景黎君 滕军放 贾延劼△
1)郑州大学第一附属医院神经内科 郑州 450052 2)河南开封市中心医院神经内科 开封 475000
结核性脑膜炎患者脑脊液外泌体中let-7d表达的研究
尹慧敏1)贾永林1,2﹚李燕飞1﹚段冉冉1﹚景黎君1﹚滕军放1﹚贾延劼1﹚△
1)郑州大学第一附属医院神经内科 郑州 450052 2)河南开封市中心医院神经内科 开封 475000
目的 探讨结核性脑膜炎(tuberculoulous meningitis,TBM)患者脑脊液外泌体的分离及外泌体中let-7d的表达水平及其意义。方法 收集我院15例结核性脑膜炎患者(结脑组,TBM组),20例病毒性脑膜炎患者(病脑组,VM组),10例化脓性脑膜炎患者(化脑组,PM组)及20例正常脑脊液患者(对照组)的脑脊液,采取ExoQuick Precipitation 提取法分离并纯化外泌体,通过透射电镜观察其形态,采用实时荧光定量PCR法检测其let-7d表达水平。结果 (1)脑脊液中的外泌体,电镜下呈圆形或茶托状外形,直径40~100 nm,实时定量PCR法检测发现其内含有不同程度表达水平的let-7d;(2)结核性脑膜炎患者脑脊液外泌体中let-7d的表达水平显著低于对照组,差异有统计学意义(P<0.05);(3)let-7d表达水平结脑组、化脑组与对照组相比均明显下调,差异有统计学意义(P<0.05);病脑组与对照组相比也下调,但差异无统计学意义(P>0.05);(4)let-7d表达水平在化脑组与结脑组相比明显下调,差异有统计学意义(P<0.05);(5)let-7d表达水平在结脑组与病脑组相比明显下调,差异有统计学意义(P<0.05)。结论 中枢神经系统感染性疾病的脑脊液中可分离出外泌体,通过比较3种脑炎外泌体中let-7d的表达水平,发现在TBM患者中let-7d的表达水平显著下调,为其诊断提供潜在的生物学标志物。
结核性脑膜炎;外泌体;分离;let-7d
结核性脑膜炎(TBM)是由结核分枝杆菌引起的中枢神经系统感染性疾病,约占神经系统结核病的70%。目前,诊断主要依靠脑脊液常规生化、细胞学检查,然而在TBM发生的早期,脑脊液常规生化、细胞学变化多不典型[1],因此,严重影响了TBM的早期诊治,故探讨TBM的潜在诊断标志物具有重大的临床意义。
外泌体(exosomes)是一种由细胞主动分泌的大小均一、直径40~100 nm的膜性囊泡小体,最早是由Pan等[2]从绵羊红细胞上清液中分离的一种小囊泡,具有脂质双分子层结构,广泛存在于血液、尿液、唾液、脑脊液等体液中[3]。其内含有多种蛋白质、mRNA、miRNA等,在不同细胞间进行信息传递,发生多种生物功能[4]。外泌体在中枢神经系统中参与正常的生理条件以及介导病理状态[5],在中枢神经系统的疾病的发生、发展及损伤修复中起重要作用。
微小RNA(miRNA)是一类内源性非编码的小分子单链RNA,长20~25个氨基酸。具有高度保守性、时序性和组织特异性,其主要功能是从转录后水平调节基因的表达,广泛参与多种生物的生命过程[6]。Let-7家族是miRNA重要的组成部分之一,包含13个成员,其中let-7d在大脑中的表达水平非常高,在多种神经系统疾病中起重要作用,可能成为某些疾病的潜在生物学标志物。本研究通过分离脑脊液中的外泌体,探讨let-7d在外泌体中的表达水平及其意义。
1 资料和方法
1.1 临床资料 选择2015-01-2016-10就诊于郑州大学第一附属医院的住院患者,其中15例结核性脑膜炎患者(结脑组),男8例,女7例,年龄(31±17.53)岁;20例病毒性脑膜炎患者(病脑组),男12例,女8例,年龄(35±4.85)岁;10例化脓性脑膜炎患者(化脑组),男4例,女6例,年龄(40±8.95)岁;20例正常脑脊液患者(对照组),男9例,女11例,年龄(38±10.51)岁。分别收集各组脑脊液标本。该试验由郑州大学第一附属医院伦理委员会批准,并获得所有受试者或其委托人知情同意。
1.2 入选标准 (1)结脑组:有急性或亚急性脑膜炎的临床表现,脑脊液检测到结核分枝杆菌或合并肺结核,伴脑脊液检测结果符合典型TBM的表现,Xpert MTB/RIF检测阳性,脑脊液其他细菌、病毒、寄生虫、肿瘤检查均阴性,所有患者经抗结核治疗有效。(2)病脑组:有急性脑膜炎的临床表现,血或脑脊液检测到特异性病毒抗体,或经PCR检测到病毒DNA,或发病前1周内有明确的病毒感染史,脑脊液其他细菌、寄生虫、肿瘤检查均阴性,所有病例经抗病毒治疗有效。(3)化脑组:有急性脑膜炎的临床表现,脑脊液培养中检测到阳性致病菌,或脑脊液检测结果符合典型PM的表现,脑脊液其他细菌、寄生虫、病毒、肿瘤检查均阴性,所有病例经抗生素治疗有效。(4)对照组:有头痛的临床表现,但神经系统无阳性体征,脑脊液检测结果正常。
1.3 方法
1.3.1 取材:用普通干燥管分别收取入组患者的脑脊液2 mL,于4 ℃,RCF(500)×g条件下离心10 min,以去除污染细胞,于-80 ℃冰箱保存备用。
1.3.2 外泌体分离:取保存的结脑组、病脑组、化脑组、对照组的脑脊液,按照ExoQuick Precipitation(美国SBI公司)说明书分离提取CSF中的外泌体。
1.3.3 外泌体的形态学观察:取分离纯化的外泌体10 μL,滴加在2 mm的载样铜网上,于室温静置1 min后用滤纸吸去多余液体,用2%(w/v)磷钨酸钠溶液10 μL滴加于载样铜网上室温复染5 min后用滤纸吸去多余液体,室温晾干,于透射电子显微镜观察并照相。
1.3.4 实时定量PCR(qRT-PCR):按照 miRCURYTMRNA分离试剂盒(Exiqon公司)说明提取各组脑脊液外泌体中的RNA,分光光度法测定RNA含量及浓度。按照miRCURY LNATMUniversal RT microRNA PCR system(Exiqon公司)说明书将miRNA逆转录为cDNA,其反应的总体积为20 μL。按照GoTaq®qPCR Master Mix荧光定量检测试剂盒说明书进行荧光定量检测,以U6为内参,每例样本重复检测3次。应用LightCycler 1.5定量PCR仪进行实时定量PCR检测,计算每个处理组中的每个miRNA 的△Ct值,2-△△Ct表示目的基因miRNA的相对表达量。
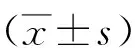
2 结果
2.1 外泌体的形态特征 通过透射电镜观察,各组均发现外泌体,其大小均一,直径40 ~ 100 nm,呈圆形或茶托形的小囊泡,外周可见完整的膜性结构,内含低电子密度物质(图1)。
2.2 let-7d表达水平 实时定量PCR检测在结脑组、病脑组、化脑组及对照组的let-7d的相对表达量(图2);结果显示,let-7d表达水平结脑组、化脑组与对照组相比均明显下调,差异有统计学意义(P<0.05);病脑组与对照组相比也下调,但差异无统计学意义(P>0.05);化脑组与结脑组相比明显下调,差异有统计学意义(P<0.05);结脑组组与病脑组相比明显下调,差异有统计学意义(P<0.05)。

图1 电镜下可见TBM组外泌体直径40~100 nm,呈圆形或茶托形的膜性小囊泡,其中心为低电子密度成分 图2 采用qRT-PCR法检测各组脑脊液外泌体中let-7d的表达水平
3 讨论
外泌体作为细胞分泌的囊泡,近年来因其在细胞间的通讯作用受到人们的广泛关注。这些囊泡通过转运分子(如miRNA)促进细胞间的通讯,因此可用作指示疾病状态的生物标志物[7]。外泌体来源的miRNA已被用于癌症的诊断与预后评估[8]。因此,通过从脑脊液中分离外泌体,并对其内容物进行检测,具有重要的临床意义。外泌体的提取方法包括超速离心、免疫磁珠、超滤、沉淀或试剂盒[9]。其中超速离心是最常用的分离方法,但其过程较费时,回收率不稳定,同时受限于仪器设备的配置;近年来,商品化的外泌体提取试剂盒受到广泛应用,操作简便,不需特殊的仪器设备,同时可获得高纯度和高回收率的外泌体。本研究采用ExoQuick试剂盒分离提取脑脊液中的外泌体,透射电镜下观察到其为大小40 ~100nm,圆形或茶托形具有膜性的小囊泡,与国外文献报道一致[10]。该方法同时极大缩短了外泌体的提取时间,简化了操作步骤,因此可广泛适用于外泌体的临床研究。
TBM是临床常见的中枢神经系统感染性疾病,具有病死率高、致残率高等特点,因此早期诊断及治疗能够显著改善患者的预后[11]。但传统的涂片抗酸染色镜检法敏感度低,结核分枝杆菌培养法所需时间较长,其当前诊断主要依靠脑脊液常规生化、细胞学检查,但早期脑脊液检查结果常难于病毒性脑膜炎、化脓性脑膜炎等感染性疾病相鉴别,极易误诊。随着科学技术的进展,Wiwanitkit等[12]提出miRNA可能是结核感染中一个有用的生物标志物,可能参与了其感染的发病机制。Yagi等[13]也认为,脑脊液外泌体中miRNA可反映大脑的病理生理过程。本研究发现,在3种脑炎及正常人的脑脊液外泌体中均表达不同水平的let-7d,但与正常人相比化脓性脑膜炎外泌体中let-7d明显下调,其下调幅度明显大于TBM及病毒性脑膜炎,而TBM外泌体中let-7d与病毒性脑膜炎相比也明显下调,因此,我们可通过检测脑脊液外泌体中的let-7d水平区分这3种脑炎,为临床诊断提供潜在的生物学标志物。
Let-7d作为let-7家族家族中的一员,存在于let-7a-1/let-7f-1/let-7d集群,位于人类基因组染色体9q22.3的B区[14];作用于许多靶基因,如MYC、IMP-1、PPARγ受体等[14-16]。MYC是一种多功能、核内磷酸化蛋白,其与Lin28相互作用,共同参与了细胞周期进程、凋亡等过程[14]。同时,let-7家族也是RAS家族的直接和强有力的调控者,let-7d通过抑制K-RAS mRNA的表达引起细胞增殖的减少[17]。近年来,let-7家族被认为在大脑的生长和形态形成中起重要的调节作用[18],let-7d的表达水平与多能细胞向神经细胞分化中明显相关[19]。研究认为,miRNA被运输到外泌体,并使受体基因沉默,推测let-7d可能通过此方式调节结核性脑膜炎相关基因。
本研究表明,在结核性脑膜炎患者脑脊液外泌体中let-7d表达明显下调,可能为该病的诊断与鉴别提供新的生物学标志物,但let-7d表达水平是否与结核性脑膜炎的发生发展有更深的相关性,仍需进一步深入研究。
[1] Cherian A,Thomas SV.Central nervous system tuberculosis[J].Afr Health Sci,2011,11(1):116-127.
[2] Pan BT,Johnstone RM.Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro:selective externalization of the receptor[J].Cell,1983, 33(3):967-978.
[3] Hirshman BR,Kras RT,Akers JC,et al.Extracellular Vesicles in Molecular Diagnostics:An Overview with a Focus on CNS Diseases[J].Adv Clin Chem,2016,76:37-53.
[4] Sun D,Zhuang X,Zhang S,et al.Exosomes are endogenous nanoparticles that can deliver biological information between cells[J].Adv Drug Deliv Rev,2013,65(3):342-347.
[5] Sampey GC,Meyering SS,Zadeh MA,et al.Exosomes and their role in CNS viral infections[J].J Neurovirol,2014,20(3):199-208.
[6] Tan JY,Marques AC.The miRNA-mediated cross-talk between transcripts provides a novel layer of posttranscriptional regulation[J].Adv Genet,2014,85:149-199.
[7] Tkach M,Thery C.Communication by Extracellular Ve-sicles:Where We Are and Where We Need to Go[J].Cell,2016,164(6):1 226-1 232.
[8] Sato-Kuwabara Y,Melo SA,Soares FA,et al.The fusion of two worlds:non-coding RNAs and extracellular vesicles-diagnostic and therapeutic implications(Review)[J].Int J Oncol,2015,46(1):17-27.
[9] 卢婉,杨人强,王伶.外泌体的研究进展[J].生命的化学,2013,33(4):438-442.
[10] Marqués-García F,Isidoro-García M.Protocols for Exosome Isolation and RNA Profiling[J].Methods Mol Biol.2016,1 434:153-167.
[11] 杨学谨.结核性脑膜炎的临床诊治[J].临床医学,2014,34(5):47-48.
[12] Wiwanitkit S,Wiwanitkit V.MicroRNA from tuberculosis RNA:A bioinformatics study[J].J Thorac Dis,2012,4(3):296-297.
[13] Yagi Y,Ohkubo T,Kawaji H,et al.Next-generation sequencing-based small RNA profiling of cerebrospinal fluid exosomes[J].Neurosci Lett,2016,(16):30 795-30 799.
[14] Wang Z,Lin S,Li JJ,et al.MYC protein inhibits transcription of the microRNA cluster MC-let-7a-1~let-7d via noncanonical E-box[J].J Biol Chem,2011,286(46): 39 703-39 714.
[15] Benjamin B,Park SM,Murmann AE,et al.Let-7 modulates acquired resistance of ovarian cancer to Taxanes via,IMP-1-mediated stabilization of multidrug resi-stance 1[J].Int J Cancer,2012,130(8):1 787-1 797.
[16] Rohm B,Holik AK,Kretschy N,et al.Nonivamide enhances miRNA let-7d expression and decreases adipogenesis PPARγ expression in 3T3-L1 cells[J].J Cell Biochem,2015,116(6):1 153-1 163.
[17] Yu ML,Wang JF,Wang GK,et al.Vascular smooth mu-scle cell proliferation is influenced by let-7d microRNA and its interaction with KRAS[J].Circ J,2011,75(3):703-709.
[18] Lehmann SM,Krüger C,Park B,et al.An unconven-tional role for miRNA:let-7 activates Toll-like receptor 7 and causes neurodegeneration[J].Nat Neurosci 2012,15(6):827-835.
[19] Huleihel L,Benyehudah A,Milosevic J,et al.Let-7d microRNA affects mesenchymal phenotypic properties of lung fibroblasts[J].Am J Physiol Lung Cell Mol Physiol,2014,306(6):534-542.
(收稿2016-11-12)
Study of the expression of let-7d from cerebrospinal fluid exosomes in patients with tuberculous meningitis
YinHuimin*,JiaYonglin,LiYanfei,DuanRanran,JingLijun,TengJunfang,JiaYanjie
*DepartmentofNeurology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China
Objective To investigate the exosomes isolation from cerebrospinal fluid(CSF) in patients with tuberculous meningitis(TBM) and the expression of let-7d in exosomes.Methods The cerebrospinal fluid from 15 cases with tuberculous meningitis(TBM group),20 cases with viral meningitis(VM group),10 cases with purulent meningitis patients(PM group) and 20 normal cases(control group) was collected.ExoQuick Precipitation was used to isolate and purify exosomes and transmission electron microscopy was applied to observe the morphology.Eventually,the expression of let-7d was detected by real-time fluorescence quantitative PCR.Results (1)The exosomes in cerebrospinal fluid were round or cup-shaped,and the diameter was about 40~100nm.Real-time quantitative PCR found varying expression levels of let-7d in exosomes.(2)The expression level of let-7d in TBM group was significantly lower than that in control group(P<0.05).(3)The TBM and PM groups showed higher down-regulation of the expression level of let-7d compared with the control group(P<0.05).(4)The expression level of let-7d in the PM group was significantly down-regulated relative to the TBM group(P<0.05).(5)Significant down-regulation of expression level of let-7d was found in TBM group compared with VM group(P<0.05).Conclusion Exosomes can be isolated from cerebrospinal fluid in infectious diseases of the central nervous system.By comparing the expression level of let-7d in three sorts of encephslitis,we find that the expression of let-7d in TBM patients is significantly down-regulated,providing a potential biomarker for diagnosis.
Tuberculous meningitis;Exosomes;Isolation;Let-7d
国家自然科学基金(编号:81371385)
R529.3
A
1673-5110(2017)06-0009-04
△通讯作者:贾延劼,E-mail:jiayanjie1971@aliyun.com

