转染miR-124模拟物的宫颈癌细胞株Siha放射敏感性变化及其机制探讨
王梦洁,孟碧,李皓,高飞,叶婷,刘阳晨
(1蚌埠医学院研究生院,安徽蚌埠233030;2泰兴市人民医院)
转染miR-124模拟物的宫颈癌细胞株Siha放射敏感性变化及其机制探讨
王梦洁1,2,孟碧1,2,李皓2,高飞2,叶婷2,刘阳晨2
(1蚌埠医学院研究生院,安徽蚌埠233030;2泰兴市人民医院)
目的观察过表达微小RNA124(miR-124)对宫颈癌Siha细胞放射敏感性的影响,并探讨其机制。方法将宫颈癌Siha细胞分为观察组和对照组,观察组转染miR-124 模拟物,对照组不转染。采用实时荧光定量PCR法检测两组细胞miR-124和信号转导和转录激活因子3(STAT3) mRNA表达量。采用克隆形成实验检测两组细胞放射敏感性。采用流式细胞术检测两组细胞周期分布和放射后细胞凋亡率。结果观察组、对照组D0分别为1.062、1.542 Gy,Dq分别为1.605、1.970 Gy,SF2分别为0.527、0.685。观察组相对于对照组的放射增敏比为1.451。转染后24h观察组、对照组miR-124相对表达量分别为89.3±13.6、1.0±0.1,STAT3 mRNA相对表达量分别为0.3±0.03、1.0±0.1,两组相比,P均<0.05。观察组G0/G1期细胞比例为82.49%±1.97%、S期细胞比例11.87%±1.38%、G2/M期细胞比例为5.64%±0.72%;对照组分别为74.58%±1.28%、19.88%±0.26%、5.54%±1.05%。观察组G0/G1期比例高于对照组组,S期比例低于对照组(P均<0.05),两组G2/M期细胞比例相比P>0.05。观察组、对照组细胞X线照射后细胞凋亡率分别为45.87%±3.16%、37.27%±0.87%,两组相比,P<0.05。结论过表达miR-124可能提高宫颈癌Siha细胞的放射敏感性。其机制可能是过表达miR-124会抑制宫颈癌Siha细胞STAT3表达,进而阻滞细胞周期于G0/G1期,促进细胞凋亡,从而提高宫颈癌Siha细胞的放射敏感性。
宫颈癌细胞;微小RNA124;信号转导和转录激活因子3;放射敏感性;细胞凋亡;细胞周期
Abstract:ObjectiveTo observe the effect of microRNA124 (miR-124) overexpression on the radiosensitivity of cervical cancer Siha cells and its mechanism.MethodsThe cervical cancer Siha cells were divided into the observation group and control group. The miR-124 mimics were transfected into the observation group. The expression levels of miR-124 and signal transducer and activator of transcription 3 (STAT3) in the two groups were detected by real-time fluorescent quantitative PCR. Colony formation assay was used to detect the radiosensitivity of the two groups cells. Clone formation assay was used to detect the cell radiosensitivity. Flow cytometry was used to detect the cell cycle distritution and apoptosis rate after radiation.ResultsThe observation group and the control group had the D0 parameters of 1.062 Gy and 1.542 Gy, the Dq parameters of 1.605Gy and 1.970Gy, the SF2 parameters of 0.527 and 0.685, respectively. Compared with the control group, the radiation sensitization enhancement ratio (SER) was 1.451. At 24 h after transfection, the relative expression levels of miR-124 in the observation group and the control group were 89.3±13.6 and 1.0±0.1, respectively, and the relative expression levels of STAT3 mRNA were 0.3±0.03 and 1.0±0.1, respectively; significant difference was found between these two groups (allP<0.05). In the observation group, the percentage of cells in G0/G1phase was 82.49%±1.97%, was 11.87%±1.38% in S phase, and 5.64%±0.72% in G2/M phase;meanwhile, they were 74.58%±1.28%, 19.88%±0.26%, 5.54%±1.05%, respectively, in the control group. Compared with the control group, the percentage of cells in G0/G1phase was higher, while the percentage of cells in S phase was lower, and significant difference was found between these two groups (allP<0.05). Compared with the control group, the percentage of cells in G2/M phase was not significantly different (P>0.05). The apoptosis rates after X-irradiation were 45.87%±3.16% in observation group, versus 37.27%±0.87% in the control group, and significant difference was found between these two groups (P<0.05).ConclusionsOverexpression of miR-124 may enhance radiosensitivity of cervical cancer Siha cells. The mechanism may be that overexpression of miR-124 can inhibit the expression of STAT3 in cervical cancer Siha cells, and then induce the cell cycle arrest in G0/G1phase, promote the apoptosis, and thereby enhance the radiosensitivity of cervical cancer Siha cells.
Keywords: cervical carcinoma cell; microRNA-124; signal transducer and activator of transcription 3; radiosensitivity; apoptosis; cell cycle
放疗抵抗是导致肿瘤放疗失败的主要原因[1,2]。放疗主要是通过损伤癌细胞的DNA,进而导致癌细胞发生凋亡和不可逆性细胞周期阻滞[3,4]。miRNA在这一过程中起重要作用[5,6]。miR-124是一种高度保守的miRNA,在多种实体肿瘤中低表达,如头颈部鳞状细胞癌、胶质细胞瘤、非小细胞肺癌、乳腺癌、肝癌等[7~11],miR-124在肿瘤的发生发展过程中起着类似于抑癌基因的作用。过表达miR-124可以提高上述肿瘤组织对放疗的敏感性。但是宫颈癌细胞中miR-124表达情况及过表达miR-124对宫颈癌Siha细胞放射敏感性的影响尚未见文献报道。本课题组前期研究中发现宫颈癌Siha细胞中miR-124表达下降。本研究观察了过表达miR-124对宫颈癌SiHa细胞放射敏感性的影响,并探讨其机制。现报告如下。
1 材料与方法
1.1 细胞株、材料及试剂 宫颈癌SiHa 细胞购自上海中科院细胞库,用RPMI-1640培养基(含10%胎牛血清),置于37°C、5% CO2细胞培养箱中培养,待细胞融合度达85%左右后经胰酶消化传代。RPMI-1640培养液、胎牛血清购自美国Gibco公司;PBS、0.1%结晶紫染色液购自美国Solarbio公司;细胞培养瓶、培养板购自美国Corning公司;miR-124模拟物(序列:5′-UAAGGCACGCGGUGAAUGCCCAUUCACCGCGUGCCUUAUU-3′)购自苏州吉玛基因股份有限公司;Lipofectamine2000、Trizol购自美国Invitrogen公司;RT-PCR 试剂盒购自日本TaKaRa公司;胰酶细胞消化液、青霉素-链霉素溶液、细胞周期与细胞凋亡检测试剂盒、Annexin V-FITC凋亡检测试剂盒购自上海碧云天生物技术有限公司。
1.2 Siha细胞分组、miR-124模拟物转染 对数期生长期的Siha细胞,消化重悬后以4×105/孔铺于6孔板。设观察组和对照组。观察组细胞贴壁后按照Lipofectamine2000转染试剂盒说明书操作,用30 nmol/L的miR-124 模拟物转染Siha细胞6 h,然后替换为完全培养基培养继续培养48 h;对照组不转染,一直用完全培养基培养。
1.3 两组细胞放射敏感性观察 两组细胞转染后用胰酶消化、重悬,在6孔板上分别以200、500、1 000、3 000、5 000/孔铺板,然后用0、2、4、6、8 Gy的X线照射,每个照射剂量和细胞数目的组合设3孔。照射方法:用6MV X射线直线加速器,大机头旋转180°从下往上垂直照射细胞,并在培养板下方加垫1 cm厚的凡士林胶,源皮距为100 cm。继续培养一至两周,待6孔板涌现肉眼可见的细胞集落时,PBS洗涤2次,乙醇固定15 min,再用PBS洗涤2次,0.1%的结晶紫染色20 min,在显微镜下计数细胞个数≥50的单克隆集落,根据公式:克隆形成率(PE)=克隆数/接种细胞数×100%;存活分数(SF)=克隆数/(接种细胞数×未照射的PE)×100%,计算各组的细胞存活分数SF,用GraphPad Prime 5.0软件构建Siha细胞剂量存活曲线,根据公式:y=1-(1-exp{-k×x} )^N拟合成多靶单击模型,得到K和N这两个参数,用公式[K=1/D0;lnN=Dq/D0;SER= D0(对照组)/D0(观察组)]计算平均致死量(D0)、准阈剂量(Dq)、照射剂量2 Gy下细胞存活分数(SF2)和放射增敏比(SER)、。
1.4 两组细胞miR-124、STAT3 mRNA检测 用RT-PCR法检测两组细胞miR-124、STAT3 mRNA,操作按试剂盒说明书进行。每组测3孔。以U6为miR-124的内参基因,GAPDH为STAT3的内参基因。miR-124正向引物5′-GCTAAGGCACGCGGTG-3′,反向引物5′-GTGCAGGGTCCGAGGT-3′;U6正向引物5′-CTCGCTTCGGCAGCACATATACT-3′,反向引物 5′-ACGCTTCACGAATTTGCGTGTC-3′;STAT3正向引物5′-GAAGGACATCAGCGGTAAGA-3′,反向引物5′-AGATAGACCAGTGGAGACAC-3′;GAPDH正向引物5′-GGAGTCCACTGGCGTCTT-3′,反向引物 5′-GAGTCCTTCCACGATACCAA-3′。用2-ΔΔCt表示miR-124、STAT3 mRNA相对表达量。
1.5 两组细胞周期分布观察 采用流式细胞术。取两组转染后细胞,胰酶消化、重悬、离心后用预冷的PBS洗涤,再置于预冷的75%乙醇中固定,4 ℃过夜。再用预冷的PBS洗涤,碘化丙啶染色液染色,后37 ℃下避光孵育30 min,用流式细胞仪检测细胞周期分布。
1.6 两组细胞细胞凋亡率测算 采用流式细胞术。取两组转染后细胞,用8 Gy 剂量X线照射,继续培养48 h,胰酶消化重悬后计数8万个左右细胞,离心后加入Annexin V-FITC结合液,充分重悬后再加Annexin V-FITC混匀,最后加碘化丙啶染色,混匀后室温下避光孵育20 min,用流式细胞仪检测细胞凋亡率。
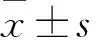
2 结果
2.1 两组细胞放射敏感性比较 观察组、对照组D0分别为1.062、1.542 Gy,Dq分别为1.605、1.970 Gy,SF2分别为0.527、0.685。观察组相对于对照组的SER为1.451。
2.2 两组细胞miR-124、STAT3 mRNA相对表达量比较 转染后24 h在荧光倒置显微镜下观察,转染效率接近100%。观察组、对照组miR-124相对表达量分别为89.3±13.6、1.0±0.1,STAT3 mRNA相对表达量分别为0.3±0.03、1.0±0.1,两组相比,P均<0.05。
2.3 两组细胞周期分布情况比较 观察组G0/G1期细胞比例为82.49%±1.97%、S期细胞比例为11.87%±1.38%、G2/M期细胞比例为5.64%±0.72%;对照组分别为74.58%±1.28%、19.88%±0.26%、5.54%±1.05%。观察组G0/G1期比例高于对照组组,S期比例低于对照组(P均<0.05),两组G2/M期细胞比例相比P>0.05。
2.4 两组细胞X线照射后细胞凋亡率比较 观察组、对照组细胞X线照射后细胞凋亡率分别为45.87%±3.16%、37.27%±0.87%,两组相比,P<0.05。
3 讨论
宫颈癌是我国女性生殖系统中最常见的恶性肿瘤,放疗是治疗宫颈癌的主要手段,放疗抵抗已成为影响宫颈癌患者治疗的关键问题。部分患者出现放疗抵抗,导致癌症复发、转移,甚至死亡。癌细胞对放射的敏感性是影响放疗疗效的关键因素,若癌细胞对放射的敏感性高,则较小的剂量就能达到较好的疗效。反之,若癌细胞对放射抵抗,则疗效将远低于预期目标。因此需要一种安全有效的放疗增敏剂,提高癌细胞对放射的敏感性,力求在减少放射相关不良反应的同时达到最好的疗效。倪猛等[12]发现miR-96可通过负调控HERG1表达增强胰腺癌PANC-1细胞的放射敏感性,这为提高胰腺癌临床放疗疗效提供了新思路。越来越多的研究显示,某些miRNA与肿瘤细胞的放射抵抗相关。本研究中我们通过克隆形成实验绘制Siha细胞的存活曲线,比较观察组和对照组细胞的放射敏感性,发现过表达miR-124可降低Siha细胞克隆形成能力。观察组和对照组D0分别为1.062、1.542 Gy,表明过表达miR-124可提高了Siha细胞对放射损伤敏感度;观察组和对照组Dq分别为1.605、1.970 Gy,表明过表达miR-124降低了Siha细胞对放射后的亚损伤修复能力。我们的结果表明miR-124可增强Siha细胞的放射敏感性,SER可达到1.451,这与Hao等[13]发现miR-124可增加非小细胞肺癌细胞放射敏感性的研究结果一致。
本研究结果显示,过表达miR-124的制Siha细胞G0/G1期细胞比例增高,而S期细胞比例降低,细胞发生G1期阻滞,这会导致DNA复制减少,细胞分裂速度减慢,进而抑制Siha细胞增殖能力。而且就放射敏感性而言,处于S期的细胞放射敏感性最差,这可能是观察组细胞放射敏感性较高的原因。目前为止绝大多数研究结果表明G1期阻滞的程度与细胞放射敏感性呈正相关,我们的实验结果也提示G1期阻滞能增加宫颈癌Siha细胞的放射敏感性[14]。除细胞周期阻滞外,凋亡也与宫颈癌放疗敏感性密切相关,细胞凋亡是放射诱导的宫颈癌细胞死亡的主要方式,也是评价宫颈癌放射敏感性的重要指标之一[15]。细胞对放射的敏感性与其凋亡的反应程度一致,放射诱导的凋亡越高, 则表示放射敏感性越高,反之亦然。在本研究中,两组细胞经8Gy X线照射后48 h,观察组细胞凋亡率明显高于对照组,因此我们推论miR-124可能通过阻滞细胞周期于G0/G1期和促进放射诱导的凋亡来提高Siha细胞的放射敏感性。
本研究发现转染miR-124模拟物可提高Siha细胞中miR-124的表达,同时STAT3的表达明显降低。在之前的研究中我们通过荧光素酶报告基因实验已证明STAT3为miR-124的直接靶基因。STAT3在多种癌组织中高表达,参与细胞生长、分化、凋亡等多种生理功能的调控 ,与肿瘤的增殖、分化、细胞凋亡及预后密切相关[16~18]。关于STAT3对放射抵抗的作用机制可能是激活STAT3可靶向调节与细胞恶性转化相关的基因表达[19]。一方面STAT3可通过激活下游抗凋亡的基因、调控细胞周期的基因或血管生成基因表达,影响细胞生长和凋亡,导致肿瘤产生放射抵抗[20,21]。另一方面STAT3也可激活乏氧诱导因子 1 (HIF-1)基因,诱发肿瘤细胞自噬,而达到提高放射敏感性的目的[22]。如STAT3可直接调节细胞周期蛋白D1(Cyclin D1)基因表达,使细胞周期发生S期阻滞,DNA复制速度加快,促使细胞增殖、癌变等。CyclinD1表达水平已被证明与癌细胞放疗敏感性有关[23,24]。抑制STAT3基因也可调节下游B淋巴细胞瘤-2(Bcl-2)抗凋亡的表达,促进放射处理后细胞的凋亡,逆转癌细胞的放射抵抗性[25]。这与我们的研究结果一致。我们推测miR-124可能是通过靶向调节STAT3表达,阻滞细胞周期于G0/G1期,并促进放射诱导的调亡,进而增加Siha细胞的放射敏感性。但这有待于我们进一步深入研究证实。
综上所述,过表达miR-124可增加宫颈癌Siha细胞的放射敏感性,抑制宫颈癌Siha细胞STAT3表达可能是其作用机制。miR-124、STAT3可能是宫颈癌放疗中潜在的放射增敏剂,这需要通过大量临床研究进一步确定miR-124和STAT3的临床意义。本研究为研究宫颈癌细胞辐射抵抗机制提供新的证据,可能发现了一个增加宫颈癌放射敏感性的潜在靶点。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016,66(2): 115-132.
[2] Vordermark D. Radiotherapy of Cervical Cancer [J]. Oncol Res Treat, 2016,39(9):516-520.
[3] Barker HE, Paget JT, Khan AA, et al. The tumour microenvironment after radiotherapy: mechanisms of resistance and recurrence [J]. Nat Rev Cancer, 2015,15(7):409-425.
[4] YH T. Identification of more feasible microRNA-mRNA interactions within multiple cancers using principal component analysis based unsupervised feature extraction[J]. Int J Mol Sci, 2016,17(5):E696.
[5] Gonzalez-Quintana V, Palma-Berre L, Campos-Parra AD, et al. MicroRNAs are involved in cervical cancer development, progression, clinical outcome and improvement treatment response[J]. Oncol Rep, 2016,35(1):3-12.
[6] 王强强,王梦洁,张玉虹,等. miR-449a对食管鳞癌细胞Eca-109增殖、迁移、侵袭的影响及机制 [J]. 山东医药, 2017,57(16): 24-27.
[7] Zhao Y, Ling Z, Hao Y, et al. MiR-124 acts as a tumor suppressor by inhibiting the expression of sphingosine kinase 1 and its downstream signaling in head and neck squamous cell carcinoma [J]. Oncotarget, 2017,8(15):25005-25020.
[8] He Y, Zhao C, Liu Y, et al. MiR-124 functions as a tumor suppressor via targeting hCLOCK1 in glioblastoma [J]. Mol Neurobiol, 2017,54(3):2375.
[9] Li W, Huang H, Su J, et al. miR-124 Acts as a tumor suppressor in glioblastoma via the inhibition of signal transducer and activator of transcription 3 [J]. Mol Neurobiol, 2017,54(4):2555-2561.
[10] Ma T, Zhao Y, Wei K, et al. MicroRNA-124 functions as a tumor suppressor by regulating CDH2 and epithelial-mesenchymal transition in non-small cell Lung cancer [J]. Cell Physiol Biochem, 2016,38(4):1563-1574.
[11] Wang Y, Chen L, Wu Z, et al. miR-124-3p functions as a tumor suppressor in breast cancer by targeting CBL [J]. BMC Cancer, 2016,16(1):826.
[12] 倪猛, 杨峥, 王红建, et al. miR-96通过靶向HERG1对胰腺癌细胞系PANC-1放疗敏感性的影响 [J]. 中华放射肿瘤学杂志, 2017,26(6): 693-395.
[13] Hao C, Xu X, Ma J, et al. MicroRNA-124 regulates the radiosensitivity of non-small cell lung cancer cells by targeting TXNRD1 [J]. Oncol Lett, 2017,13(4):2071-2078.
[14] Zheng R, Liu Y, Zhang X, et al. miRNA-200c enhances radiosensitivity of esophageal cancer by cell cycle arrest and targeting P21 [J]. Biomed Pharmacother, 2017,90(4):517-523.
[15] 张孟贤, 于世英, 陈元. 宫颈癌细胞周期阻滞和凋亡与放射敏感性的关系 [J]. 中华放射肿瘤学杂志, 2001,11(2): 116-117.
[16] Sun Y, Guo BF, Xu LB, et al. Stat3-siRNA inhibits the growth of gastric cancer in vitro and in vivo [J]. Cell Biochem Funct, 2015,33(7):495-502.
[17] Kunigal S, Lakka SS, Sodadasu PK, et al. Stat3-siRNA induces Fas-mediated apoptosis in vitro and in vivo in breast cancer [J]. Int J Oncol, 2009,34(5):1209-1220.
[18] Chen YJ, You ML, Chong QY, et al. Autocrine human growth hormone promotes invasive and cancer stem cell-like behavior of hepatocellular carcinoma cells by STAT3 dependent inhibition of CLAUDIN-1 expression [J]. Int J Mol Sci, 2017,18(6):1-21.
[19] Bu X, Zhao C, Wang W, et al. GRIM-19 inhibits the STAT3 signaling pathway and sensitizes gastric cancer cells to radiation [J]. Gene, 2013,512(2):198-205.
[20] Li X, Wang H, Lu X, et al. Silencing STAT3 with short hairpin RNA enhances radiosensitivity of human laryngeal squamous cell carcinoma xenografts in vivo [J]. Exp Ther Med, 2010,1(6):947-953.
[21] 王海茹,李晓明,李春林,等.RNA干扰沉默STAT3基因增强人喉癌细胞放射敏感性的实验 [J].中国耳鼻咽喉头颈外科,2009,16(11):623-627.
[22] Zhang C, Yang X, Zhang Q, et al. STAT3 inhibitor NSC74859 radiosensitizes esophageal cancer via the downregulation of HIF-1alpha [J]. Tumour Biol, 2014,35(10):9793-9799.
[23] Qin A, Yu Q, Gao Y, et al. Inhibition of STAT3/cyclinD1 pathway promotes chemotherapeutic sensitivity of colorectal caner [J]. Biochem Biophys Res Commun, 2015,457(4):681-687.
[24] Liu J, Shen W, Tang Y, et al. Proteasome inhibitor MG132 enhances the antigrowth and antimetastasis effects of radiation in human nonsmall cell lung cancer cells [J]. Tumour Biol, 2014,35(8):7531-7539.
[25] You S, Li R, Park D, et al. Disruption of STAT3 by niclosamide reverses radioresistance of human lung cancer [J]. Mol Cancer Ther, 2014,13(3):606-616.
Changes of radiosensitivity of cervical cancer cell line Siha transfected with miR-124 mimics
WANGMengjie1,MENGBi,LIHao,GAOFei,YETing,LIUYangchen
(1GraduateSchoolofBengbuMedicalCollege,Bengbu233003,China)
10.3969/j.issn.1002-266X.2017.35.003
R737.3
A
1002-266X(2017)35-0008-04
2017-03-22)
蚌埠医学院研究生科研创新计划(Byycx1624)。
王梦洁(1991-),女,在读研究生,主要研究方向为肿瘤放射治疗。E-mail: wangmengjiemj@163.com
刘阳晨(1969-),男,主任医师,硕士生导师,主要研究方向为肿瘤综合治疗。E-mail: liuyctx@163.com

