GPSM2过表达对人胰腺癌细胞迁移能力的影响
魏彪,张建新,崔磊,瞿建国,钱小宝,党胜春
(江苏大学附属医院 普通外科,江苏 镇江 212001)
近年来,胰腺癌的全球新发病例及死亡人数有明显上升趋势[1],由于其症状不明显而不易确诊等原因,患者确诊时多处于肿瘤晚期。据统计,胰腺癌患者5年生存率<5%,早期即会发生周围组织器官的侵犯或远处转移[2]。降低胰腺癌的转移能力是目前提高患者生存时间及生活质量的重要手段。G蛋白信号调节蛋白2(G-protein signaling modulator 2,GPSM2)最初被发现为调控细胞纺锤体的正确定位[3],维持细胞的对称性分裂[4-6],在参与细胞分裂的G2/M期发挥了重要的功能[7]。Fukukawa等[8]报道了GPSM2与乳腺癌发病密切相关。胰腺癌组织中GPSM2的过表达已被证实,且其表达水平与肿瘤分化程度、肿瘤临床分期及胰腺癌患者的预后息息相关[9-10]。笔者前期实验中发现,人胰腺癌MIA-PaCa-2细胞的GPSM2表达水平高于其他胰腺癌细胞株(PANC-1、AsPC-1),且该细胞株具有高侵袭转移能力[11-12]。本研究将通过构建GPSM2稳定高表达的胰腺癌细胞株,并在人胰腺癌MIA-PaCa-2细胞上鉴定其表达效率,观察过表达GPSM2的MIA-PaCa-2细胞迁移能力。
1 材料与方法
1.1 实验材料
MIA-PaCa-2细胞(中国科学院细胞库),真核表达载体pCMV-Tag 3B、嘌呤霉素质粒(中国碧云天公司),限制性核酸内切酶EcoR V和Xho I及T4DNA连接酶(NEB公司),Lipofectamine 2000(Invitrogen公司),聚凝胺(吉满生物有限公司),DNA凝胶回收试剂盒(天根生化科技有限公司),小量抽提试剂盒(杭州爱思进生物技术有限公司),Opti-MEM(北京索宝来科技有限公司),胎牛血清(Gibco公司),realtime PCR试剂盒、TRIzol、RNA溶解液(南京百斯凯科技有限公司),小鼠抗人GPSM2抗体、小鼠抗人β-catenin单克隆抗体、兔抗小鼠IgG抗体(江苏厚普生物技术科技有限公司),β-actin抗体(Sigma公司),DMEM基高糖础培养基(Hyclone公司),所有的引物合成均来源上海生工生物工程有限公司。
1.2 方法
1.2.1 GPSM2过表达真核载体的构建及鉴定 按照TRIzol法提取新鲜胰腺癌细胞的总RNA,采用反转录试剂盒扩增cDNA。PCR扩增GPSM2序列,并纯化回收。根据GenBank中GPSM2 cDNA序列设计并合成引物,设计的GPSM2引物上游序列:5'-TGA TAT CAT GGA GGA AAA TTT GA-3',下游序列:5'-CTC GAG CTA ATG GTC TGC CGAT-3'。在上游引物的5'端加入EcoR V限制性核酸内切酶位点,在下游引物5'端加入Xho I限制性核酸内切酶位点,下划线部分为酶切识别位点。EcoR V和Xho I分别双酶切GPSM2片段和pCMV-Tag 3B质粒后,T4DNA连接酶进行连接反应。将重组表达载体转染用氯化钙法制备的新鲜大肠杆菌感受态细胞,并挑选出阳性克隆进行PCR扩增,送公司测序验证。测序正确后将构建的重组表达质粒命名为pCMV-Tag 3B-GPSM2。
1.2.2 重组质粒转染胰腺癌MIA-PaCa-2细胞及获得稳定表达细胞株 MIA-PaCa-2胰腺癌细胞转染前24 h接种于10 cm培养皿中,转染前2 h再换用8 mL高糖DMEM新鲜培养基(不含抗生素,含10%FBS),转染时细胞融合度为60%~70%。pCMV-Tag 3B-GPSM2、空载pCMV-Tag 3B分别与嘌呤霉素质粒共转染,37 ℃、5%CO2孵育转染细胞4 h后,换完全培养基。每2天换用含3 μg/mL嘌呤霉素新鲜完全培养基持续培养转染MIAPaCa-2细胞株45 d。
1.2.3 运用RT-PCR检测GPSM2 mRNA的表达水平 采用TRIzol法分别提取pCMV-Tag 3B-GPSM2转染MIA-PaCa-2细胞(基因重组组)、pCMV-Tag 3B转染的MIA-PaCa-2细胞(阴性对照组)及未转染MIA-PaCa-2细胞(空白对照组)的总RNA,逆转录,变性获得单链cDNA模板。反应体系共25 μL,反应程序:95 ℃ 3 min,95 ℃ 30 s、55 ℃ 20 s、72 ℃ 20 s,40 个循环;然后 72 ℃延伸10 min。PCR引物序列为:GPSM2上游5'-GGC CAT TGA TTA TCA TCT GAA GC-3',下游5'-TCC TTA CCG TGT TTG AAA GGA A-3',扩增产物为99 bp;内参GAPDH上游5'-CCA CTA GGC GCT CAC TGT TC-3', 下 游5'-AGG CGC CCA ATA CGA CCA A-3',扩增产物为108 bp。
1.2.4 Western blot检测胰腺癌细胞中GPSM2、β-catenin蛋白表达水平 将胰腺癌细胞加入裂解液,置冰上进行超声裂解35~40 min,于4 ℃下12 000 r/min离心15 min,采用碧云天BCA蛋白浓度试剂盒测定总蛋白质浓度,并进行蛋白质定量。取100 μg细胞总蛋白与上样缓冲液混合后,经100 ℃ 5 min变性后至SDS-PAGE电泳,蛋白被转膜仪转至PVDF膜,5%脱脂奶粉+TBST封闭2 h,加入一抗过夜(4 ℃),充分洗涤,随后加入1:2 000稀释的二抗,室温下培育1 h;洗涤、DAB显色、暗室中胶片曝光、显影、定影后观察。
1.2.5 Transwell实验检测胰腺癌细胞的迁移能力将上述3组胰腺癌细胞分别采用常规消化传代方法,制成细胞悬液,计数,调整浓度为2×105/mL。在Chamber下室(即24孔板底部)中加入700 μL含10%血清的培养基,上室加入100 μL细胞悬液,继续在孵箱培养24 h;取出Chamber,吸干上室液体,移到预先加入800 mL 4%多聚甲醛的孔中,室温固定20 min;取出Chamber,PBS清洗两次。再将Chamber移至100%甲醇室温固定20 min。将Chamber移到预先加入Giemsa染液的孔中,室温染色15 min;PBS清洗Chamber,用湿棉棒小心擦去上室底部膜表面上的细胞;彻底晾干Chamber后,荧光倒置显微镜计数、拍照。
1.3 统计学处理
数据采用SPSS 17.0统计软件进行分析,实验数据以均数±标准差(±s)表示,组间差异采用配对t检验,GPSM2与β-catenin蛋白之间的相关性采用一元线性回归分析,P<0.05为差异有统计学意义。
2 结 果
2.1 重组载体的鉴定
挑取pCMV-Tag 3B-GPSM2载体转染的阳性菌落,接种到含50 μg/mL氨苄青霉素的LB培养基中,37 ℃培养16 h,用小量抽提试剂盒进行质粒抽提。所得质粒用双酶切鉴定。酶切结果表明,被切开的是阳性克隆。并将阳性克隆进行PCR扩增,送上海英骏测序显示重组质粒的GPSM2编码序列与设计的片段完全一致,表明pCMV-Tag 3B-GPSM2重组载体构建成功(图1)。
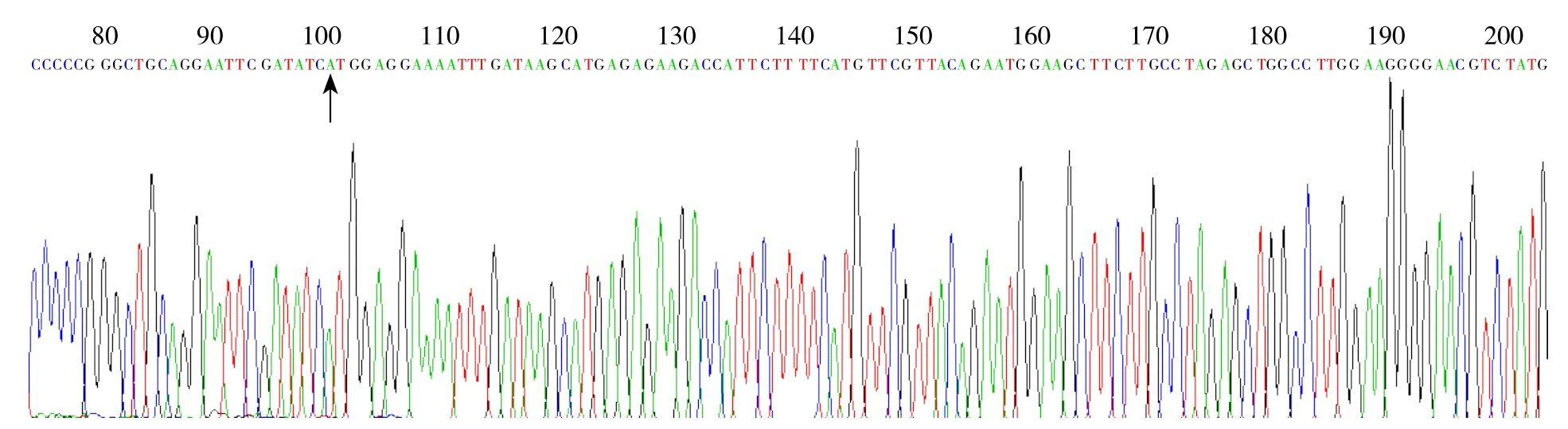
图1 测序法鉴定构建的重组质粒(箭头所标识的为GPSM2插入位置ATG)Figure 1 Sequencing identi fication of the recombinant plasmids (arrow showing GPSM2 insertion position of ATG codons
2.2 重组稳定细胞株的建立
pCMV-Tag 3B-GPSM2、空载pCMV-Tag 3B分别与嘌呤霉素质粒共转染的MIA-PaCa-2细胞,在含3 μg/mL嘌呤霉素新鲜完全培养基持续培养45 d后,存活的细胞株为重组稳定细胞株。
2.3 RT-PCR验证GPSM2 mRNA的高水平表达
RT-PCR检测结果显示,GPSM2转染组的GPSM2 mRNA表达水平较空白对照组和阴性对照组均明显上调(图2)(P<0.01),与空白对照组相比,GPSM2基因上调效率达到了73.3倍。阴性对照组与空白对照组间GPSM2 mRNA表达水平差异无统计学意义(P>0.05)。
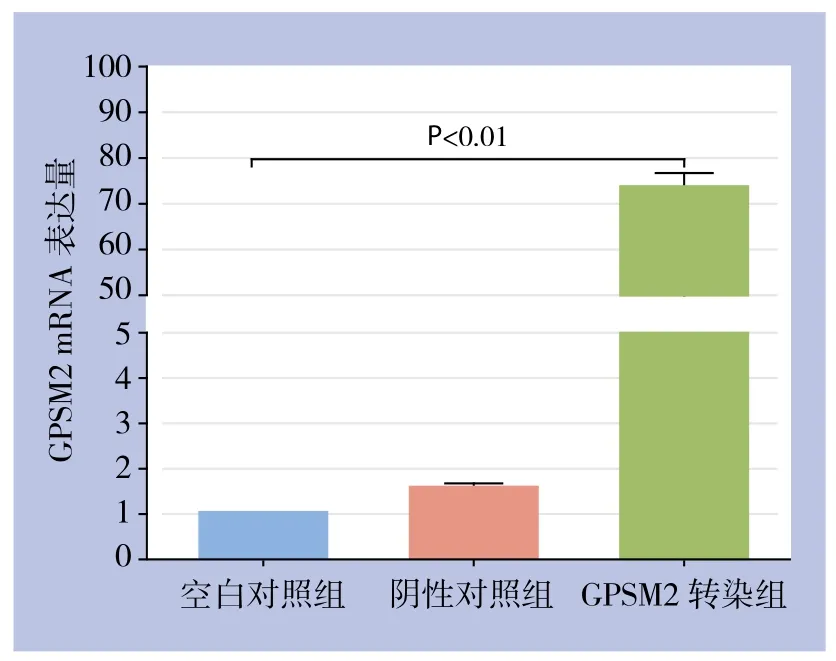
图2 各组胰腺癌细胞GPSM2 mRNA的表达情况Figure 2 The GPSM2 mRNA expressions in each group of pancreatic cancer cells
2.4 Western blot检测各组细胞GPSM2、β-catenin蛋白表达水平
Western blot检测结果显示,GPSM2转染组的GPSM2、β-catenin蛋白表达水平均较空白对照组和阴性对照组明显升高(均P<0.05),而阴性对照组与空白对照组间两种蛋白的表达差异均无统计学意义(均P>0.05)(图3)。经一元线性回归发现,各组胰腺癌细胞的GPSM2与β-catenin蛋白的表达量呈明显的正向线性关系(P<0.05)。

图3 Western blot检测各组细胞GPSM2与β-catenin蛋白表达Figure 3 Western blot analyses for GPSM2 and β-catenin protein expressions in each group of cells
2.5 Transwell迁移细胞计数
Transwell实验结果显示,GPSM2转染组的迁移细胞计数比空白对照组和阴性对照组明显增多(均P<0.01),而阴性对照组与空白对照组间差异无统计学意义(P>0.05)(图4)。
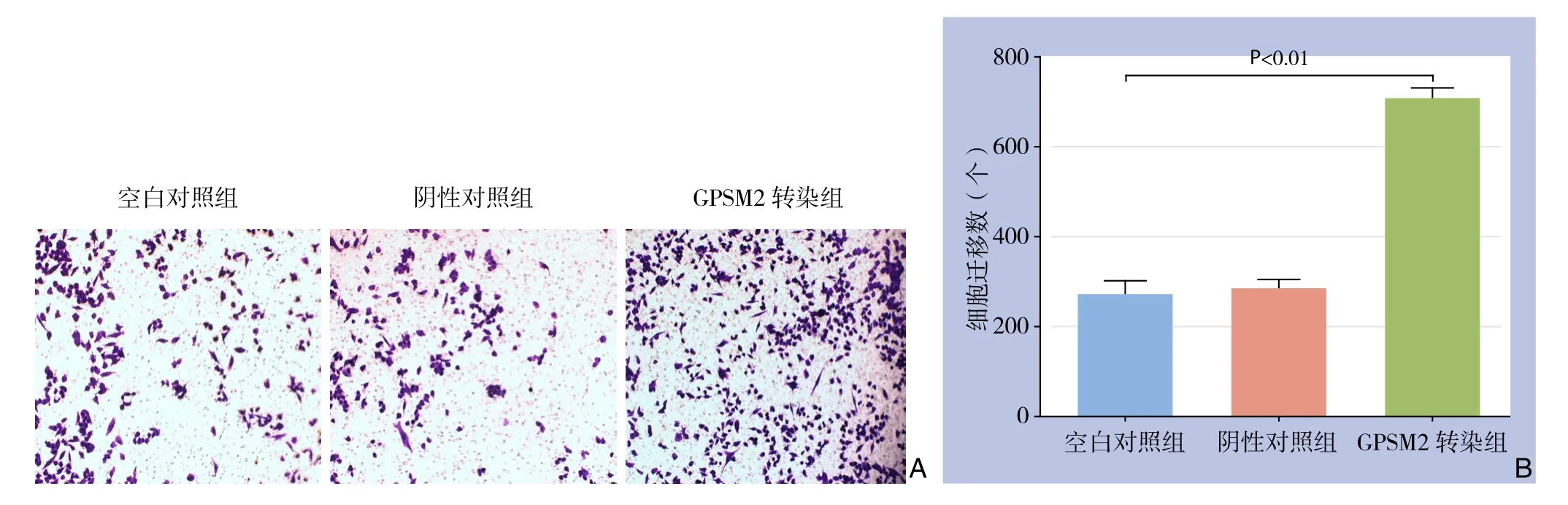
图4 Transwell实验检测各组细胞迁移能力 A:光镜下情况(×100);B:各组迁移细胞计数Figure 4 Migration ability in each group of cells by determined Transwell assay A:Views under microscope (×100); B:Numbers of migrated cells in each group
3 讨 论
G蛋白偶联受体属于膜蛋白受体,这类受体的立体结构中都有7个跨膜α螺旋,且其肽链的C端和连接第5和第6个跨膜螺旋的胞内环上都有G蛋白的结合位点[13]。据统计,与G蛋白偶联受体密切相关的疾病为数众多,大约有40%的现代药物是以G蛋白偶联受体作为靶点[14-15]。近年新发现的G蛋白偶联受体(蛋白酶激活受体)与消化道肿瘤的发生和发展密切相关[16]。GPSM2属于G蛋白信号调节蛋白家族,在人体各组织细胞中广泛表达,人染色体上的定位区域为1q31-1q32。McCudden等[17]发现GPSM2蛋白为G蛋白信号传导的负调节子。有报道[8,18]称,GPSM2的表达与多种恶性肿瘤的发病、增殖相关,如乳腺癌,前列腺癌,尤文肉瘤等。在胰腺癌细胞中GPSM2过表达,其表达水平与肿瘤的分化程度、临床分期相关,且肿瘤分化程度越低GPSM2的表达水平越高[10]。
β-catenin是由一条多肽链组成的胞质糖蛋白,其相对分子量92~95 kD,在人染色体的定位区域3p21.3-P22,全长为23.2 kb[19]。β-catenin蛋白是Wnt信号通路中的关键分子,当Wnt信号异常激活时,β-catenin在胞质积聚、细胞核移位,并激活下游的靶基因,从而诱发多种恶性肿瘤,如胰腺癌、肝癌、乳腺癌、白血病、黑色素瘤等[20]。据报道[21-22],在肝癌、结直肠癌等多种消化道恶性肿瘤细胞中普遍存在着β-catenin基因第三外显子突变,β-catenin蛋白在这些肿瘤细胞内异常聚积。肿瘤细胞的侵袭转移能力与其黏附性、细胞增殖能力、细胞外基质的降解以及肿瘤血管的形成等存在着明显的相关性。β-catenin作为黏附蛋白,与E-cadherin结合形成复合物后,定位于细胞膜,由此维持着细胞间的黏附性。β-catenin的异常高表达可明显降低肿瘤细胞间的黏附能力,从而导致肿瘤细胞从其原发灶中脱落并发生转移[23]。另有报道[24]称,β-catenin的异常高表达可使细胞膜完整性受损,并会引起血管内皮生长因子的生成增加,从而促进肿瘤细胞生长、侵袭和转移。
为了探究GPSM2对胰腺癌迁移能力的影响,本研究通过构建GPSM2过表达真核载体,并将其转染人胰腺癌细胞MIA-PaCa-2,RT-PCR和Western-blot分别验证了在mRNA和蛋白水平有效上调GPSM2基因。采用Transwell迁移实验显示,过表达GPSM2的MIA-PaCa-2稳定细胞株较空白对照组及阴性对照组的迁移能力明显上升。根据研究结果得出,GPSM2基因的上调能显著提升胰腺癌MIA-PaCa-2细胞的迁移的能力。Western blot检测显示过表达GPSM2的MIA-PaCa-2稳定细胞株的β-catenin蛋白表达水平较空白对照及阴性对照组显著上调。用一元线性回归分析发现,各组胰腺癌组织的GPSM2与β-catenin蛋白的表达量呈正向线性关系。
β-catenin的异常表达在胰腺癌侵袭转移的作用已经得到广泛认同[25-27],本研究结果发现,GPSM2与β-catenin蛋白在胰腺癌细胞中表达的关联性,同时还发现在胰腺癌MIA-PaCa-2细胞中过表达GPSM2后,胰腺癌细胞的迁移能力明显增强。由此推测,胰腺癌细胞中GPSM2的过表达能增强β-catenin蛋白的表达,可能由此促进胰腺癌细胞的迁移能力。
因此针对GPSM2设计治疗方案,降低胰腺癌细胞的迁移能力,提高胰腺癌患者生存时间及生活质量,可能成为抗胰腺癌药物研究中新的分子靶点。后续的研究中,本课题组将增加沉默GPSM2表达的胰腺癌细胞株,进一步验证GPSM2的过表达可促进胰腺癌细胞的迁移能力。
参考文献
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics 2016[J].CA Cancer J Clin,2016,66(1):7–30.doi:10.3322/caac.21332.
[2]Geismann C,Morscheck M,Koch D,et al.Up-regulation of L1CAM in pancreatic duct cells is transforming growth factor beta1- and slug-dependent:role in malignant transformation of pancreatic cancer[J].Cancer research,2009,69(10):4517–4526.doi:10.1158/0008–5472.CAN–08–3493.
[3]Williams SE,Beronja S,Pasolli HA,et al.Asymmetric cell divisions promote Notch-dependent epidermal differentiation[J].Nature,2011,470(7334):353–358.doi:10.1038/nature09793.
[4]Kaushik R,Yu F,Chia W,et al.Subcellular localization of LGN during mitosis:evidence for its cortical localization in mitotic cell culture systems and its requirement for normal cell cycle progression [J].Mol Biol Cell,2003,14(8):3144–3155.
[5]Du Q,Macara IG.Mammalian Pins is a conformational switch that links NuMA to heterotrimeric G proteins[J].Cell,2004,119(4):503–516.
[6]Ting SB,Deneault E,Hope K,et al.Asymmetric segregation and self-renewal of hematopoietic stem and progenitor cells with endocytic Ap2a2[J].Blood,2012,119(11):2510–2522.doi:10.1182/blood-2011–11–393272.
[7]Yasumi M,Sakisaka T,Hoshino T,et al.Direct binding of Lgl2 to LGN during mitosis and its requirement for normal cell division[J].J Biol Chem.,2005,280(8):6761–6765.
[8]Fukukawa C,Ueda K,Nishidate T,et al.Critical roles of LGN/GPSM2 phosphorylation by PBK/TOPK in cell division of breast cancer cells[J].Genes Chromosomes Cancer,2010,49(10):861–872.doi:10.1002/gcc.20795.
[9]彭云,崔磊,史坚强,等.G蛋白信号调节蛋白2在胰腺癌组织中的表达及临床意义[J].江苏大学学报:医学版,2016,26(3):231–234.doi:10.13312/j.issn.1671–7783.y160054.Peng Y,Cui L,Shi JQ,et al.Expression of G-protein signaling modulator 2 in pancreatic cancer tissues[J].Journal of Jiangsu University:Medicine Edition,2016,26(3):231–234.doi:10.13312/j.issn.1671–7783.y160054.
[10]顾敏,陈吉祥,史坚强,等.GPSM2在胰腺癌临床组织的表达及意义[J].医学信息,2015,(45):398–398.doi:10.3969/j.issn.1006–1959.2015.45.585.Gu M,Chen JX,Shi JQ,et al.GPSM2 expression in pancreatic tissues and its signi ficance[J].Medical Information,2015,(45):398–398.doi:10.3969/j.issn.1006–1959.2015.45.585.
[11]Zhang Y,Wei J,Wang H,et al.Epithelial mesenchymal transition correlates with CD24+CD44+ and CD133+ cells in pancreatic cancer[J].Oncol Rep,2012,27(5):1599–1605.doi:10.3892/or.2012.1681.
[12]何政,郑军.Grb2在胰腺癌中的表达及其意义[J].中国普通外科杂志,2014,23(3):338–342.doi:10.7659/j.issn.1005–6947.2014.03.015.He Z,Zheng J.Grb2 expression in pancreatic carcinoma and its significance[J].Chinese Journal of General Surgery,2014,23(3):338–342.doi:10.7659/j.issn.1005–6947.2014.03.015.
[13]Fribourg M,Moreno JL,Holloway T,et al.Decoding the signaling of a GPCR heteromeric complex reveals a unifying mechanism of action of antipsychotic drugs[J].Cell,2011,147(5):1011–1023.doi:10.1016/j.cell.2011.09.055.
[14]Sun J,Singh V,Kajino-Sakamoto R,et al.Neuronal GPCR controls innate immunity by regulating noncanonical unfolded protein response genes[J].Science,2011,332(6030):729–732.doi:10.1126/science.1203411.Epub 2011 Apr 7.
[15]Zhang R,Xie X.Tools for GPCR drug discovery[J].Acta pharmacologica Sinica,2012,33(3):372–384.doi:10.1038/aps.2011.173.
[16]李思熳,高振华,余果宇.PAR家族在消化道肿瘤中的作用[J].中国普通外科杂志,2013,22(2):218–222.doi:10.7659/j.issn.1005–6947.2013.02.018.Li SM,Gao ZH,Yu GY.The roles of PARs family in the digestive tract tumors[J].Chinese Journal of General Surgery,2013,22(2):218–222.doi:10.7659/j.issn.1005–6947.2013.02.018.
[17]McCudden CR,Willard FS,Kimple RJ,et al.G alpha selectivity and inhibitor function of the multiple GoLoco motif protein GPSM2/LGN[J].Biochim Biophys Acta,2005,1745(2):254–264.
[18]Pishas KI,Adwal A,Neuhaus SJ,et al.XI-006 induces potent p53-independent apoptosis in Ewing sarcoma [J].Sci Rep,2015,5:11465.doi:10.1038/srep11465.
[19]Valenta T,Hausmann G,Basler K.The many faces and functions of beta-catenin[J].EMBO J,2012,31(12):2714–2736.doi:10.1038/emboj.2012.150.
[20]Herr P,Hausmann G,Basler K.WNT secretion and signalling in human disease[J].Trends Mol Med,2012,18(8):483–493.doi:10.1016/j.molmed.2012.06.008.
[21]Khiari M,Arfaoui A,Kriaa L,et al.The prognostic value of the immunohistochemical expression and mutational pattern of the key mediator of Wnt signaling:beta-catenin in Tunisian patients with colorectal carcinoma [J].Appl Immunohistochem Mol Morphol,2012,20(1):62–70.doi:10.1097/PAI.0b013e31821a20c2.
[22]Tornesello ML,Buonaguro L,Tatangelo F,et al.Mutations in TP53,CTNNB1 and PIK3CA genes in hepatocellular carcinoma associated with hepatitis B and hepatitis C virus infections[J].Genomics,2013,102(2):74–83.doi:10.1016/j.ygeno.2013.04.001.
[23]Ferreri DM,Minnear FL,Yin T,et al.N-cadherin levels in endothelial cells are regulated by monolayer maturity and p120 availability[J].Cell Commun Adhes,2008,15(4):333–349.doi:10.1080/15419060802440377.
[24]Kim K,Lu Z,Hay ED.Direct evidence for a role of beta-catenin/LEF-1 signaling pathway in induction of EMT [J].Cell Biol Int,2002,26(5):463–476.
[25]秦毅,梁丁孔,施思,等.E-cadherin/β-catenin影响胰腺癌PANC-1细胞糖酵解效应的实验研究[J].中国癌症杂志,2015,25(2):81–86.Qin Y,Liang DK,Shi S,et al.The in fluence of E-cadherin/β-catenin on the glycolysis effect in PANC-1 cells[J].China Oncology,2015,25(2):81–86.
[26]朱建伟,熊力,马望,等.胰腺癌干细胞研究进展[J].中国普通外科杂志,2015,24(9):1304–1309.doi:10.3978/j.issn.1005– 6947.2015.09.019.Zhu JW,Xiong L,Ma W,et al.Research progress of pancreatic cancer stem cells[J].Chinese Journal of General Surgery,2015,24(9):1304–1309.doi:10.3978/j.issn.1005–6947.2015.09.019.
[27]Liu QQ,Chen K,Ye Q,et al.Oridonin inhibits pancreatic cancer cell migration and epithelial-mesenchymal transition by suppressing Wnt/β-catenin signaling pathway[J].Cancer Cell Int,2016,16:57.doi:10.1186/s12935–016–0336–z.

