环境因子对海州湾表层沉积物中氨氮吸附-解吸的影响
王功芹,张硕,李大鹏,张中发,李莉
1. 北京师范大学环境学院,北京 100875;2. 上海海洋大学海洋科学学院,上海 201306;3. 大洋渔业资源可持续开发省部共建教育部重点实验室,上海 201306;4. 国家远洋渔业工程技术研究中心,上海 201306
环境因子对海州湾表层沉积物中氨氮吸附-解吸的影响
王功芹1,张硕2,3,4*,李大鹏2,张中发2,李莉2
1. 北京师范大学环境学院,北京 100875;2. 上海海洋大学海洋科学学院,上海 201306;3. 大洋渔业资源可持续开发省部共建教育部重点实验室,上海 201306;4. 国家远洋渔业工程技术研究中心,上海 201306
沉积物中的有机质在微生物作用下矿化,产生大量氨氮,大部分氨氮会被沉积物颗粒吸附,影响氮在沉积物中的硝化、反硝化以及厌氧氨氧化等作用,因此,沉积物对氨氮的吸附-解吸作用是影响沉积物中氮循环的一个重要过程。海湾具有水动力作用强烈,扰动和盐度等物理化学条件复杂多变的特点,研究环境条件变化对沉积物中氨氮吸附-解吸的影响有助于揭示其对沉积物-水界面氮营养盐交换的影响机制。因此,以海州湾表层沉积物样品进行室内模拟实验,通过吸附-解吸动力学和热力学实验,研究扰动大小、粒度分布和盐度等环境因子对氨氮吸附-解吸的影响。结果表明,吸附和解吸是一个复合动力学过程,主要在30 min内完成,30 min以后逐渐达到动力学平衡状态;准二级吸附动力学方程和修正的Elovich模型对沉积物吸附氨氮的模拟效果较好,一级反应动力学方程可以较好地描述沉积物对氨氮的解吸动力学过程。热力学模型的拟合结果显示沉积物对氨氮的吸附符合Henry模型,描述解吸过程的最优模型是Langmuir模型。一定范围内振荡频率的增加、粒径的减小、盐度的降低都会提高沉积物对氨氮的吸附能力;一定范围内振荡频率的增加、粒度的增大、盐度的升高都会增强沉积物对氨氮的解吸量。该研究可为进一步认识和理解环境因子变化对氨氮吸附-解吸的影响及机制提供理论依据。
海州湾;表层沉积物;扰动;粒度分布;盐度;氨氮;吸附-解吸
海湾是海洋与陆地之间的过渡带,为区域生态系统提供了重要的生物资源、水质净化和气候调节等生态服务功能,是人类活动较频繁的区域(Halpern et al.,2008)。具有水动力作用强烈、泥沙输移、扰动和盐度等物理化学条件复杂多变等特点(陈振楼等,2000)。沉积物是有机质的重要蓄积库,也是营养盐等各类污染物再生的主要场所(马宁等,2010)。氮素在沉积物-水界面间的迁移和转化是一项非常复杂的生物化学过程,许多研究发现,扰动、粒度分布和盐度是影响海湾沉积物中氮循环的因素(Rysgaard et al.,1999;Gardner et al.,1991)。有关的研究(吴丰昌等,1996;杨龙元等,1998;俞志明等,1995)表明沉积物-水界面交换过程中氮主要以NH4+的形式存在。
海州湾位于苏鲁隆起和苏北南黄海过渡地带,属于季风气候,海域潮汐性质属正规半日潮,受黄河旋转潮波的控制,潮波整体上由北向南推进。近年来,国内外对氨氮的吸附解吸已有了一些研究,但就海州湾沉积物对氨氮的吸附解吸特征以及环境因素对该过程影响的报道并不多见。因此本文以海州湾表层沉积物为研究对象,研究了该区域表层沉积物对氨氮的吸附-解吸动力学和热力学特征,并选取沉积物粒径大小、扰动、盐度3种因素,研究其对氨氮吸附-解吸特性的影响,试图揭示海州湾表层沉积物-水界面氮元素交换的影响机制,以期为氨氮迁移转化机制提供科学依据。
1 采样与分析方法
1.1 样品采集
2014年10月利用抓斗采泥器采集海州湾沉积物表层0~2 cm样品为实验样品。采样点位于人工鱼礁区(34°53.50'N,119°34.02'E),将表层沉积物混合均匀后置于干净的聚乙烯袋中,在低温保温箱冷藏保存,带回实验室于阴凉通风处自然风干、研磨、过筛后置于干燥器备用。同时采集该点的上覆水样品测定3种形式氮含量。
1.2 实验培养
本研究根据温氏(Wentworth)沉积物粒度分级方法将所采集的沉积物样品划分为不同粒度的沉积物。将风干研磨后的沉积物样品依次过0.25、0.125、0.063、0.032 mm的不锈钢标准筛,得到0.25~0.125、0.125~0.063、0.063~0.032 mm和<0.032 mm粒度的沉积物样品,从而将沉积物分为4组(该沉积物分级只用于粒度分布对氨氮吸附-解吸过程影响的实验)。
根据海洋调查规范第4部分海水化学要素调查(国家质量技术监督局,2007),配制盐度为35‰的人工海水,然后把配制好的人工海水用无氨蒸馏水进行稀释,分别配成盐度为10‰、20‰、30‰的海水。
1.3 分析方法
1.3.1 理化性质测定
上覆水中硝酸盐氮、亚硝酸盐氮和氨氮的测定均按照GB17378.4—2007《海洋监测规范》中的相关测定方法:亚硝酸盐的测定采用重氮-偶氮法;硝酸盐的测定采用锌镉还原法;铵盐的测定采用次溴酸钠氧化法。
总氮(TN)的测定采用凯氏定氮法,称取过100目筛的沉积物样品1 g(准确到0.1 mg)于定氮管,在加速剂的催化下,经浓硫酸消煮后,用定氮仪测定。
粒度和总有机碳测定(TOC):利用激光粒度仪、liquidTOCⅡ总有机碳分析仪分别对表层沉积物样品的粒径大小和构成比例、总有机碳进行测定。
1.3.2 吸附实验过程
1.3.2.1 吸附动力学
称取若干份0.5 g过100目筛的沉积物样品,将样品置于100 mL离心管中,加入50 mL质量浓度(以NH4+-N计)为2.5 mg·L-1的NH4Cl标准溶液,置于恒温水浴振荡器上。在25 ℃、150 r·min-1的条件下振荡,分别于0.1、0.25、0.5、1、1.5、2、3、5、7、12、18、24 h后取出离心管,4000 r·min-1的条件下离心10 min,上清液过0.45 μm混纤-水系微孔滤膜,测定氨氮质量浓度。
1.3.2.2 吸附热力学
称取0.5 g沉积物样品于100 mL离心管中,加入50 mL不同质量浓度的NH4Cl标准溶液,初始质量浓度(以NH4+-N计)设定为0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mg·L-1,置于恒温水浴振荡器上。在150 r·min-1、25 ℃的条件下振荡吸附24 h后,取出离心管,静止平衡2 h,4000 r·min-1离心10 min,上清液过0.45 μm的混纤-水系微孔滤膜过滤,测定滤液中的氨氮质量浓度。
1.3.3 解吸实验过程
1.3.3.1 解吸动力学
将上述吸附动力学实验过程中达到吸附平衡的沉积物样品,加入蒸馏水,在25 ℃、150 r·min-1的条件下振荡,分别于0.1、0.25、0.5、 1、1.5、2、3、5、7、12、18、24 h后取出离心管,4000 r·min-1的条件下离心10 min,上清液过0.45 μm的混纤-水系微孔滤膜,测定氨氮质量浓度,此过程为解吸动力学。
1.3.3.2 解吸热力学
将上述吸附热力学实验过程中达到吸附平衡的沉积物样品用蒸馏水振荡解吸24 h,静止平衡2 h,上清液过0.45 μm的混纤-水系微孔滤膜过滤,测定滤液中氨氮质量浓度,此过程为解吸热力学。
上述吸附-解吸实验在相同条件下作3个平行样,使测定误差小于±5%,实验平衡时,滤液中氨氮含量测定的基本原理参见《海洋监测规范》(国家质量技术监督局,2007)中的海水分析部分,采用次溴酸钠氧化法氧化后测定。
1.3.4 吸附量和解吸量的计算
吸附量计算公式:

式中,Qt是吸附平衡时的吸附量(mg·kg-1);Ct是吸附平衡时溶液中氨氮的质量浓度(mg·L-1);C0是初始溶液中氨氮的质量浓度(mg·L-1);V为加入样品中溶液的体积,50 mL;m为沉积物质量,0.5 g。
解吸量计算公式:

式中,Qt为氨氮解吸平衡时的解吸量(mg·kg-1),Ct是解吸平衡时溶液中的氨氮质量浓度(mg·L-1),V为加入样品中溶液的体积,50 mL;m为沉积物质量,0.5 g。
1.3.5 动力学模型
1.3.5.1 吸附动力学模型
常用的吸附动力学模型有4种:一级反应动力学模型、准二级吸附动力学方程(杨洪美,2012)、抛物线扩散模型和修正的Elovich模型(Padmesha et al.,2005;Wang,2005)。
一级反应动力学模型:

准二级动力学方程:

抛物线扩散模型:

修正的Elovich模型:

式中,Q是表层沉积物对氨氮的吸附量(mg·kg-1);t为吸附时间(min);a、b、k均为吸附常数。
1.3.5.2 解吸动力学模型
常用的解吸动力学模型有4种:一级动力学方程(Suna,2004)、Elovich方程、扩散方程和双常数方程(夏勇锋,2014)。
一级反应动力学方程:

抛物线扩散模型:

Elovich方程:

双常数方程:

式中,Q为t时刻的解吸量(mg·kg);Qmax为沉积物对氨氮的最大解吸量(mg·kg-1);a、b、k为解吸速率常数;t是解吸时间。
1.3.6 热力学模型
为了描述表层沉积物对氨氮的吸附-解吸行为,根据以往的研究结果看,常用的模型有3种(姜桂华,2004;胡祖武等,2011):Henry模型、Freundlich模型和Langmuir模型。
Henry模型:

Freundlich模型:


Langmuir模型:Freundlich模型和Langmuir模型可以转换为一元线性方程:
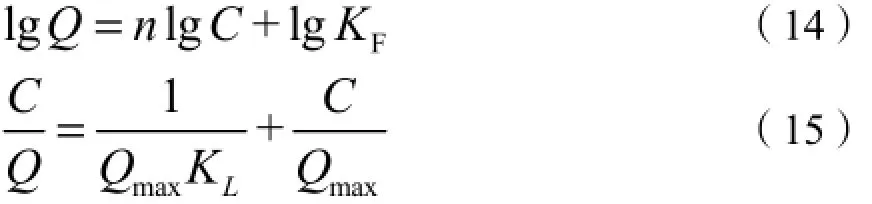
式中,Q是氨氮在表层沉积物上的吸附量(mg·kg-1),Qmax是表层沉积物对氨氮的最大吸附量(mg·kg-1),C是吸附平衡时氨氮的质量浓度(mg·L-1),n、KF、KL均为吸附平衡系数。
1.4 数据处理方法
采用Excle 2013、Origin 8.0等软件进行数据的统计分析。
2 结果与讨论
2.1 理化性质
该站点上覆水中硝酸盐质量浓度为0.530 mg·L-1,铵盐为0.182 mg·L-1,亚硝酸盐为0.174 mg·L-1。沉积物中TN质量分数为469 mg·kg-1,TOC为10.735 g·kg-1。沉积物的粒度分布是<0.004 mm占6.08%,0.004~0.063 mm占32.87%,0.063~0.25 mm占61.05%。
2.2 吸附-解吸平衡时间的确定
2.2.1 吸附平衡时间的确定
在初始质量浓度为2.5 mg·L-1,吸附时间为6 min~24 h的条件下,海州湾表层沉积物对氨氮的吸附动力学变化趋势见图1。由图可知,海州湾表层沉积物对氨氮的吸附是复合动力学过程,可以分为两个过程:快速吸附过程(0~30 min)和慢速吸附过程(30 min~24 h)。在0~30 min内,表层沉积物对氨氮的吸附量Q和吸附时间t几乎呈线性增加趋势,这段时间内,随时间的延长,吸附量增长速度较快,是快速吸附过程。30 min以后Q随t的延长增长得不多,吸附逐渐趋于稳定状态,12 h以后吸附动力学曲线为水平直线,吸附过程基本达到平衡。吸附过程的作用机制是吸附刚开始时,高质量浓度的铵盐离子集聚在沉积物吸附点位的周围,铵盐离子与吸附点位上的基团快速发生配位体交换作用,表现为较快的吸附阶段;随着时间的延长,沉积颗粒物上的吸附点位逐渐变少,并且由于沉积物颗粒上吸附NH4+而带正电荷,从而与溶液中的NH4+产生相互排斥的静电作用,导致吸附作用变慢,表现为慢反应阶段(Ruttenberg,1992;王雨春,2001)。
为了深入分析表层沉积物对氨氮的吸附动力学特性,对该吸附过程采用常用的吸附动力学模型进行拟合。

图1 沉积物对氨氮的吸附动力学曲线Fig. 1 Adsorption kinetic curve of ammonia nitrogen on the sediment
表1所示为海州湾表层沉积物对氨氮吸附动力学的拟合参数,从拟合的结果来看,海州湾表层沉积物对氨氮的吸附动力学不符合一级反应动力学模型、抛物线扩散模型,而准二级吸附动力学方程和修正的Elovich模型的模拟效果较好。准二级动力学方程的拟合达到了显著相关水平,相关系数r为0.999,所以海州湾表层沉积物对氨氮的吸附动力学进程可以用准二级动力学方程进行描述。这表明海州湾表层沉积物对氨氮的吸附是一个复杂的过程,可能会受到多种因素的综合影响。
2.2.2 解吸平衡时间的确定
解吸动力学是被吸附在沉积物上的氨氮重新进入水体的过程。根据实验所得解吸动力学数据绘制了海州湾表层沉积物中氨氮的解吸动力学曲线,如图2。
海州湾表层沉积物对氨氮的解吸动力学曲线与吸附动力学曲线基本一致,在0~30 min内,沉积物对氨氮的解吸量Q和解吸时间t几乎呈线性增加趋势,这段时间内,随时间的延长,解吸量增长速度较快。30 min以后随时间的延长,解吸量增长得不多,解吸逐渐趋于稳定状态,18 h以后基本达到解吸平衡。表层沉积物氨氮的吸附-解吸动力学曲线之间的区别为,(1)吸附过程完全平衡的时间为12 h,解吸过程达到平衡的时间为18 h,解吸平衡的时间长于吸附,意味着解吸过程相对于吸附过程存在滞后性。(2)最大解吸量为37.00 mg·kg-1,最大吸附量为228.09 mg·kg-1,平衡解吸量远远小于平衡吸附量,这就意味着吸附和解吸之间并非动态平衡的。根据该研究所得的吸附-解吸动力学过程,为了保证海州湾表层沉积物对氨氮的吸附-解吸平衡稳定,确定吸附-解吸热力学实验中所需要的最佳稳定平衡时间为24 h。
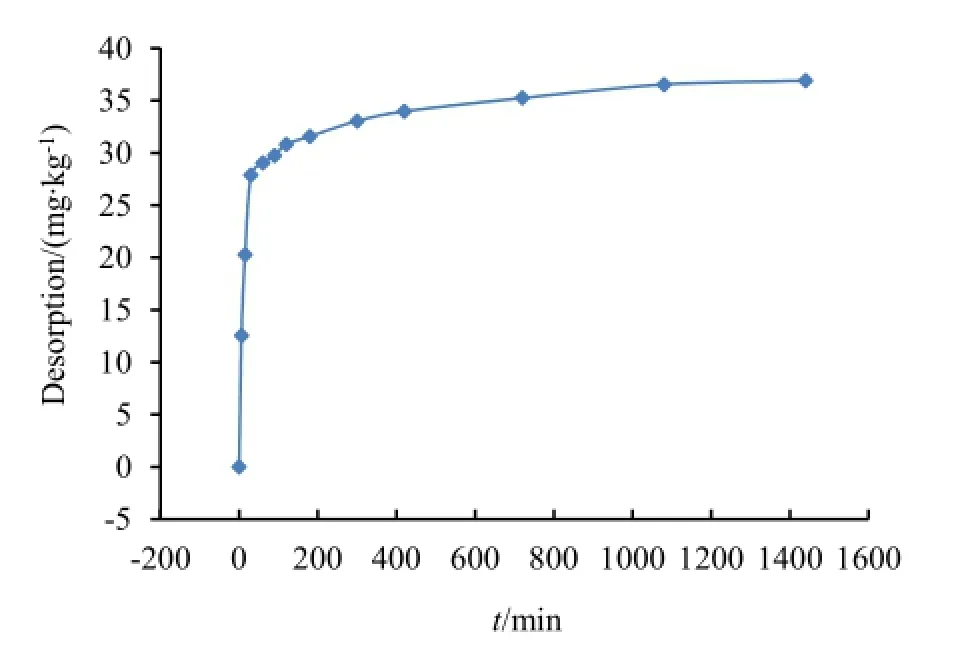
图2 沉积物对氨氮的解吸动力学曲线Fig. 2 Desorption kinetic curve of ammonia nitrogen on the sediment
为了更深入地分析表层沉积物对氨氮的解吸动力学特性,对该解吸过程采用常用的解吸动力学模型进行拟合。
表2所示为海州湾表层沉积物对氨氮的解吸动力学拟合参数,从表2可知,一级反应动力学方程的相关系数为0.957,抛物线扩散模型的相关系数为0.793,Elovich方程的相关系数为0.943,双常数方程的相关系数为0.886。由4种模拟方程对氨氮解吸过程拟合的相关系数可知,一级反应动力学方程可以较好地描述海州湾表层沉积物对氨氮的解吸动力学过程。
2.3 扰动对氨氮吸附-解吸过程的影响
水体扰动是由人类活动及自然环境的变化引起的,它能使表层沉积物中的颗粒氮再悬浮,进入上覆水体,也会加速沉积物间隙水中氮的扩散,从而加快氮的解吸速度(汪家权等,2002)。一方面扰动会增加水域中的溶解氧含量,不利于沉积物中氮的释放;另一方面扰动也增加了沉积物-水间的混合和交换,有利于沉积物中氮的释放。两者的作用强度决定了扰动对沉积物中氮的吸附-释放平衡。一般情况下,扰动会加速沉积物中氨氮的吸附与解吸,大量的研究(Sondergaard et al.,2002;Bootsmaa et al.,1999)也证明了此点。Sondergaard et al.(2002)研究了风力扰动下和未受扰动时湖泊沉积物的再悬浮状态,研究结果表明在受扰动的水体中沉积物释放磷的含量相当于未受扰动沉积物的20~30倍,其再悬浮是通过增加沉积物-水界面磷的通量来实现的。

表1 表层沉积物对氨氮的吸附动力学拟合参数Table 1 Parameters of adsorption kinetics of ammonia nitrogen on the sediment
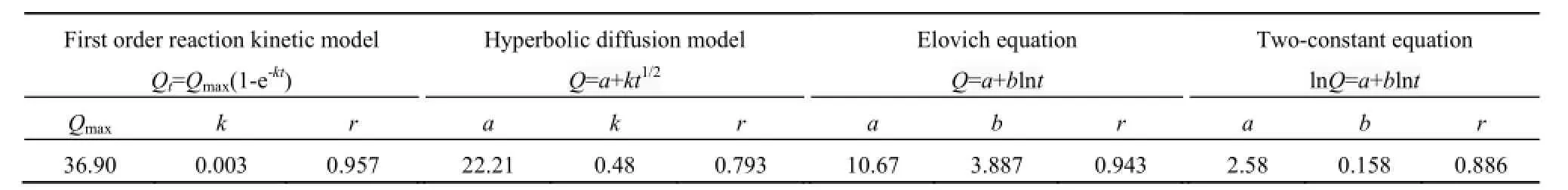
表2 表层沉积物对氨氮的解吸动力学拟合参数Table 2 Parameters of desorption kinetics of ammonia nitrogen on the sediment
2.3.1 扰动对吸附实验过程的影响
不同扰动强度下,海州湾表层沉积物对氨氮的等温吸附曲线见图3。由图3可知,在50~200 r·min-1的条件下,随着转速的增加,表层沉积物对氨氮的吸附量大体呈逐渐增加的趋势。
不同振荡频率下的表层沉积物样品均出现不同程度的解吸,在溶液氨氮质量浓度较低时出现的是氨氮的解吸现象,然后随着溶液中氨氮质量浓度的增加逐渐出现吸附过程,并且表层沉积物对氨氮的吸附量随溶液中氨氮质量浓度的增加而增加,海州湾表层沉积物对氨氮的吸附量和溶液中氨氮的平衡质量浓度呈线性关系。这与Mackin et al.(1984)和Rysgaa et al.(1999)的研究结果具有一致性,并且可以采用Henry模型进行拟合。吸附等温线与x轴的交点C0为表层沉积物与氨氮达到吸附-解吸平衡时溶液中氨氮的质量浓度。从表3的拟合结果来看,Henry模型对海州湾表层沉积物的拟合结果均达到显著性水平,其中,在200 r·min-1的扰动条件下,相关系数最大,为0.996。不同扰动强度下,表层沉积物对氨氮的吸附-解吸平衡质量浓度会发生变化,质量浓度变化范围为0.28~0.50 mg·L-1。扰动强度小,吸附-解吸平衡质量浓度大;扰动强度大,吸附-解吸平衡质量浓度小。这说明水体扰动强度大,有利于污染物从表层沉积物中扩散出来,并有助于上覆水体营养物质的扩散转移。
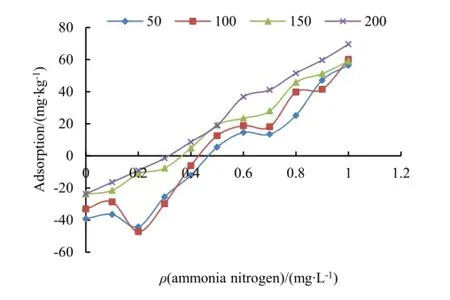
图3 不同振荡频率对氨氮等温吸附曲线的影响Fig. 3 Effect of frequency on ammonia nitrogen adsorption isotherms
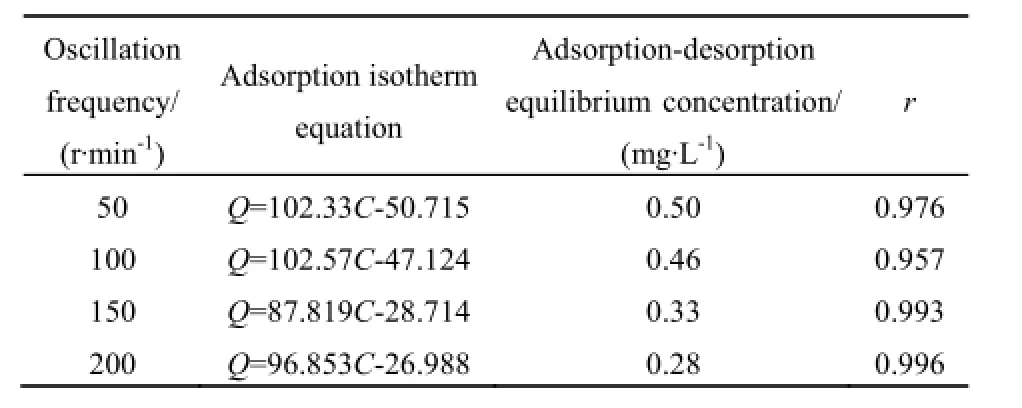
表3 不同振荡频率下表层沉积物对氨氮的吸附等温线方程Table 3 Ammonia nitrogen adsorption linear equations under different frequency
2.3.2 扰动对解吸实验过程的影响
不同扰动强度下,海州湾表层沉积物对氨氮的等温解吸曲线见图4。不同振荡频率下海州湾表层沉积物对氨氮的解吸模型拟合参数见表4。

图4 不同振荡频率对氨氮等温解吸曲线的影响Fig. 4 Effect of frequency on ammonia nitrogen desorption isotherms

表4 不同振荡频率下表层沉积物对氨氮的解吸模型拟合参数Table 4 Parameters of desorption model of ammonia nitrogen under different frequency
由图4和表4可知,在50 r·min-1的振荡频率下,表层沉积物对氨氮解吸量最小,为47.85 mg·kg-1;在150 r·min-1的条件下,解吸量最大,为66.67 mg·kg-1。50~150 r·min-1的扰动强度范围内,解吸量随着振荡频率的增加而增大。在振荡频率为200 r·min-1的条件下,解吸量反而有所减少。由表4可见,不同振荡频率下3种模型对氨氮解吸拟合效果不同。50 r·min-1时, Freundlich模型的拟合程度较高,相关系数为0.984;100~200 r·min-1范围内,Langmuir模型的拟合程度最高,相关系数为0.989~0.997。因此,描述氨氮解吸过程的最好模型应是Langmuir模型,Henry模型的拟合效果最差。
2.4 粒度分布对氨氮吸附-解吸过程的影响
粒度是海湾沉积物最基本的物理特征,沉积物的粒度特征包含了水动力环境、沉积物物源等许多环境信息(何起祥,2006)。沉积物粒径越小,沉积物颗粒所具有的比表面积就越大,吸附容量也随之增大(吕晓霞等,2004;戴纪翠等,2007)。采用制备好的4组沉积物样品(<0.032,0.032~0.063,0.063~0.125和0.125~0.25 mm)分别进行表层沉积物对氨氮吸附热力学室内模拟实验。分别测定沉积物对氨氮的吸附量和解吸量,从而得出粒径大小对海州湾氨氮吸附-解吸特性的影响。
2.4.1 粒度分布对吸附实验过程的影响
不同粒径范围内,海州湾表层沉积物对氨氮的等温吸附曲线见图5。由图5可知,随着粒径的减小,表层沉积物对氨氮的吸附量大体呈逐渐增加的趋势。相同氨氮质量浓度下的吸附量依次是粘土和中细粉砂(<0.032 mm)>粗粉砂(0.032~0.063 mm)>极细砂(0.063~0.125 mm)和细砂(0.125~0.25 mm)。
不同粒度范围内,当溶液氨氮质量浓度较低时,沉积物均出现不同程度的解吸现象,然后随着溶液中氨氮质量浓度的增加逐渐出现吸附过程,并且沉积物样品对氨氮的吸附量随着溶液中氨氮质量浓度的增大而增大。由图5可知,海州湾表层沉积物样品对氨氮的吸附量与溶液中氨氮的平衡质量浓度具有较好的线性关系,能采用Henry方程进行拟合,拟合结果见表5。由表5可知,Henry模型对海州湾表层沉积物的拟合结果均达到显著水平,其中0.032~0.063 mm粒径范围内的粗粉砂相关系数最大,为0.971。不同粒度组成的表层沉积物对氨氮的吸附-解吸平衡质量浓度存在差异,质量浓度变化范围为0.134~0.529 mg·L-1,极细砂和细砂的吸附-解吸平衡质量浓度较高,粘土和中细粉砂的吸附-解吸平衡质量浓度较低。由此可知,粘土和中细粉砂含量高的沉积物有利于污染物从沉积物中扩散出来,并有助于上覆水体营养物质的扩散转移。
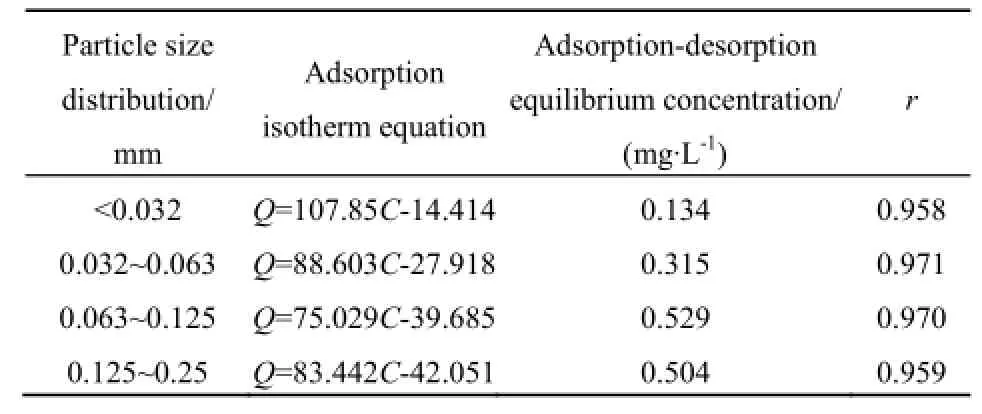
表5 不同粒度表层沉积物对氨氮的吸附等温线方程Table 5 Ammonia nitrogen adsorption linear equations under different particle size
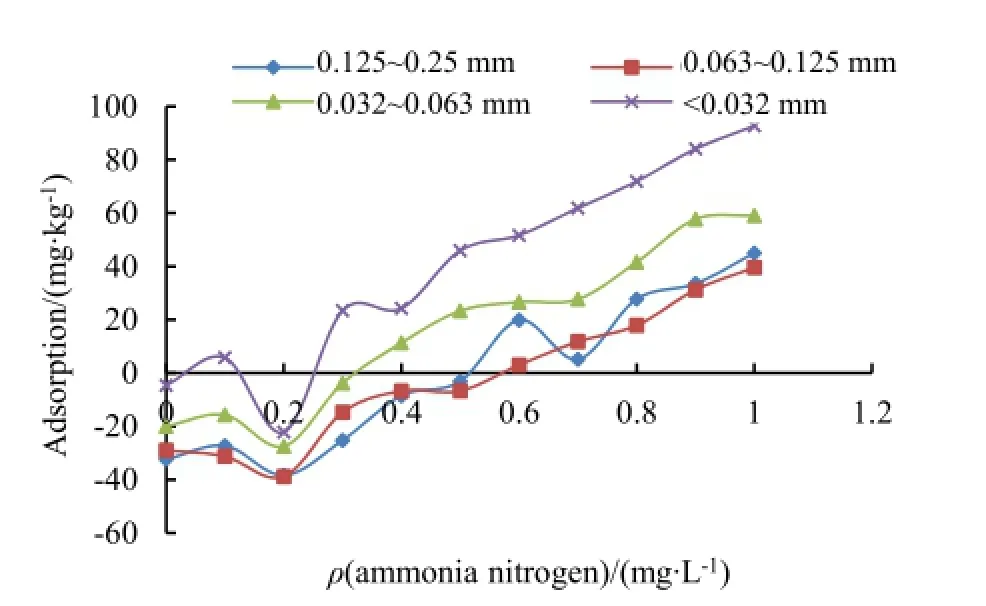
图5 不同粒度沉积物对氨氮等温吸附曲线的影响Fig. 5 Effect of different particle size on ammonia nitrogen adsorption isotherms

图6 不同粒度表层沉积物对氨氮等温解吸曲线的影响Fig. 6 Effect of different particle size on ammonia nitrogen desorption isotherms
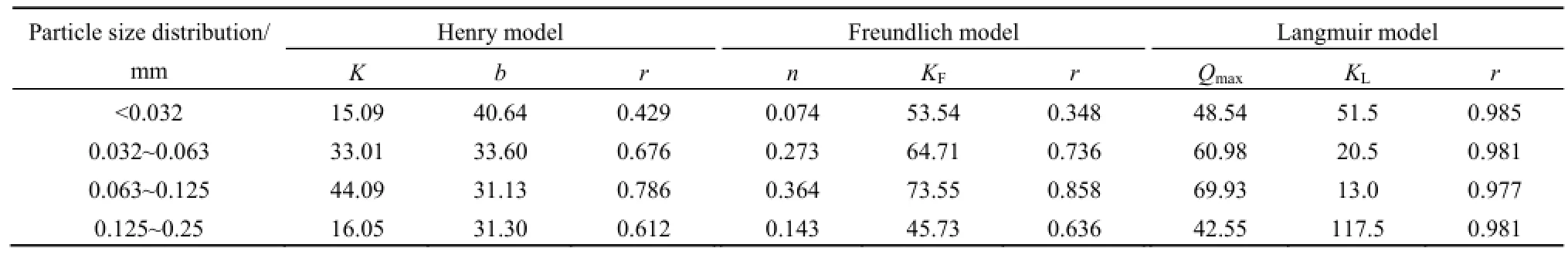
表6 不同粒度表层沉积物对氨氮的解吸模型拟合参数Table 6 Parameters of desorption model of ammonia nitrogen under different particle size
2.4.2 粒度分布对解吸实验过程的影响
不同粒径组成范围内,海州湾表层沉积物对氨氮的等温解吸曲线和解吸模型拟合参数分别见图6、表6。由图6和表6可知,0.125~0.25 mm粒度范围内的细砂表层沉积物对氨氮解吸量最小,为42.55 mg·kg-1,0.063~0.125 mm粒径组成的极细砂表层沉积物,其解吸量最大,为69.93 mg·kg-1。小于0.125 mm的表层沉积物样品,其解吸量随着粒径范围的扩大而增大。粒径范围在0.125~0.25 mm之间的表层沉积物,解吸量反而有所下降。由表6可见,不同粒度组成范围内3种模型对氨氮的解吸拟合效果不同,Henry模型和Freundlich模型的拟合效果较差,Langmuir模型的拟合程度最高,均达到显著性水平,其相关系数在0.977~0.985之间。因此,描述不同粒度范围内表层沉积物解吸过程的最优模型应是Langmuir模型。
2.5 盐度对氨氮吸附-解吸过程的影响盐度的变化是控制沉积物对吸附能力的重要因素之一(Boatman et al.,1982)。据报道,河口沉积物对的吸附量要低于淡水潮汐河(Simon et al.,1987)。盐度可能会直接影响硝化细菌,而这些硝化细菌对总硝化速率具有显著影响。Helder et al.(1983)的研究表明氧化剂可以适应0‰~35‰盐度范围并且生长;Macfarlane et al.(1984)的结果显示在0‰~20‰盐度范围内,氧化是最优的,在30‰~40‰时,其氧化性将显著减弱。本文为了研究在不同盐度条件下海州湾表层沉积物对氨氮吸附-解吸过程的影响,分别在10‰、20‰和30‰盐度水平下进行室内模拟实验,分别测定沉积物对氨氮的吸附量与解吸量。
2.5.1 盐度对吸附实验过程的影响
不同盐度条件下,海州湾表层沉积物对氨氮的等温吸附曲线见图7。由图7可知,盐度为10‰、20‰时,表层沉积物对氨氮的吸附量均高于盐度为30‰的。与不同扰动强度和粒径组成范围吸附曲线相同,在不同的盐度条件下,沉积物先出现不同程度的解吸现象,然后出现吸附过程,并且沉积物样品对氨氮的吸附量随溶液中氨氮质量浓度的升高而下降,10‰、20‰的盐度下,吸附量差异不大,当盐度为30‰时,吸附量显著下降。这可能是因为在10‰、20‰的盐度时,沉积物中的蛋白质、氨基酸、酚类、糖类等有机颗粒与氨氮发生聚合,随着盐度继续增大,絮凝体表面的吸附电位达到饱和,故吸附量下降。类似的结果在研究盐度对表层沉积物吸附解吸氮、磷的影响研究中也有报道(安敏等,2009;胡智弢等,2004;Millero et al.,2001)。由图7可知,海州湾表层沉积物样品对氨氮的吸附量与溶液中氨氮的平衡质量浓度具有较好的线性关系,能用Henry方程进行拟合,拟合结果见表7。从表7的拟合结果来看,Henry模型对海州湾表层沉积物的拟合效果均达显著性水平,其中在10‰、20‰的盐度下,相关系数相等并且较大,为0.999。不同盐度条件下,表层沉积物对氨氮的吸附-解吸平衡质量浓度存在差异,质量浓度变化范围为0.092~0.441 mg·L-1,当盐度为30‰时,吸附-解吸平衡质量浓度较高,盐度为10‰时,吸附-解吸平衡质量浓度较低。
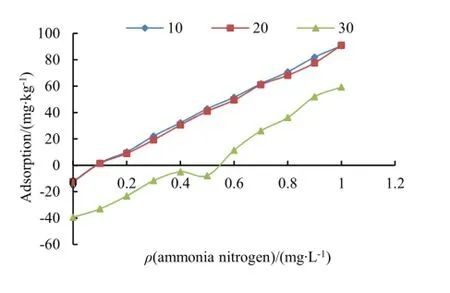
图7 不同盐度下表层沉积物对氨氮等温吸附曲线的影响Fig. 7 Effect of different salinity on ammonia nitrogen adsorption isotherms
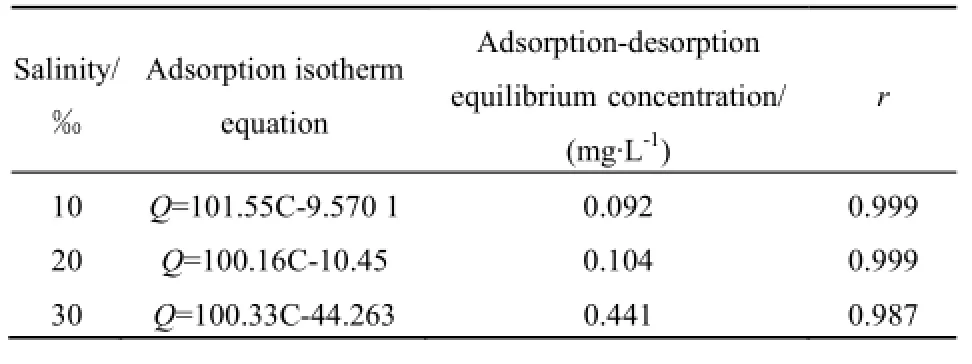
表7 不同盐度下表层沉积物对氨氮的吸附等温线方程Table 7 Ammonia nitrogen adsorption linear equations under different salinity
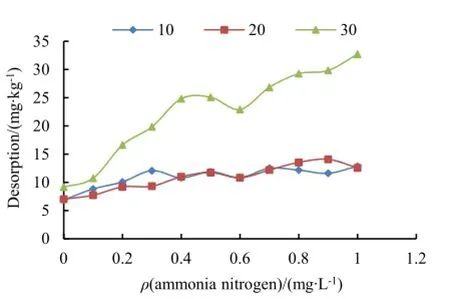
图8 不同盐度下表层沉积物对氨氮等温解吸曲线的影响Fig. 8 The effect of different salinity on ammonia nitrogen desorption isotherms

表8 不同盐度下表层沉积物对氨氮的解吸模型拟合参数Table 8 Parameters of desorption model of ammonia nitrogen under different salinity
2.5.2 盐度对解吸实验过程的影响
不同盐度条件下,海州湾表层沉积物对氨氮的等温解吸曲线和解吸模型拟合参数分别见图8、表8。由图8和表8可知,10‰盐度时沉积物对氨氮解吸量最小,为12.61 mg·kg-1,30‰时其解吸量最大,为34.97 mg·kg-1。其解吸量随着盐度的升高而增大,说明阳离子竞争是氨氮解吸的主要作用,即随着盐度增大,离子吸附于沉积物表面吸附点位的竞争能力大于氨氮。由表8可知,不同盐度条件下3种模型对氨氮的解吸拟合效果不同。盐度为10‰、20‰时,Langmuir模型的拟合程度最高,其相关系数分别为0.994和0.985;盐度为30‰时,Freundlich模型的拟合效果较好,相关系数为0.969。
3 结论
(1)沉积物对氨氮的吸附-解吸动力学实验表明吸附和解吸是一个复合动力学过程:0~30 min为快速吸附-解吸过程,30 min以后为慢速吸附-解吸过程。由吸附-解吸模型的拟合结果可知:准二级吸附动力学方程和修正的Elovich模型对沉积物吸附氨氮的模拟效果较好;一级反应动力学方程可以较好地描述沉积物对氨氮的解吸动力学过程。
(2)由吸附热力学实验可知,表层沉积物对氨氮的吸附符合Henry模型,在氨氮质量浓度较低时出现氨氮的解吸现象,随着氨氮质量浓度的升高逐渐出现吸附,表层沉积物对氨氮的吸附量随溶液中氨氮质量浓度的增加而增加。描述沉积物对氨氮解吸过程的最优模型是Langmuir模型,该模型拟合参数的最大解吸量为12.61~69.93 mg·kg-1,参数值KL可以较好地反应表层沉积物对氨氮的解吸能力。
(3)一定范围内扰动强度的增大、粒径的减小、盐度的降低都会提高表层沉积物对氨氮的吸附能力。振荡频率的增加会增强沉积物-海水界面间的混合作用和交换作用,加速悬浮颗粒表面的氮交换;粒径越小,沉积物颗粒所具有的比表面积越大,吸附容量越大;盐度的变化会促进或抑制离子吸附反应中配位键的形成,从而影响吸附容量的大小。
BOATMAN C D, MURRAY J W. 1982. Modeling exchangeable NH4+adsorption in marine sediments: Process and controls of adsorption [J]. Limnology and Oceanography, 27(1): 99-111.
BOOTSMAA M C, BARENDREGT A, VAN ALPHENB J C A. 1999. Effectiveness of reducing external nutrient load entering a eutrophicated shallow lake ecosystem in the Naardermeer nature reserve, The Netherlands [J]. Biological Conservation, 90(3): 193-201. GARDNER W S, SEITZINGER S P, MALCZYK J M. 1991. The effects of sea salts on the forms of nitrogen released from estuarine and freshwater sediments: Does ion pairing affect ammonium flux? [J]. Estuarine, 14(2): 157-166.
HALPERN B S, WALBRIDGE K A, et al. 2008. A global map of human impact on marine ecosystems [J]. Science, 319(5863): 948- 952.
HELDER W, DEVRIES R T P. 1983. Estuarine nitrite maxima and nitrifying bacteria (Ems-Dollard Estuary) [J]. Netherlands Journal of Sea Research, 17(1): 1-18.
MACFARLANE G T, HERBERT R A. 1984. Effect of oxygen tension, salinity, temperature and organic matter concentration on the growth and nitrifying activity of an estuarine strain of Nitrosomonas [J]. FEMS microbiology letters, 23(1): 107-111.
MACKIN J E, ALLER R C. 1984. Ammonium adsorption in marine sediment [J]. Limnology and Oceanography, 29(2): 250-257.
MILLERO F, HUANG F, ZHU X, et al. 2001. Adsorption and desorption of phosphate on calcite and aragonite in seawater [J]. Aquatic Geochemistry, 7(1): 33-56.
PADMESHA T V N, VIJAYARAGHAVANA K, SEKARANB G, et al. 2005. Batch and column studies on biosorption of acid dyes on fresh water macro alga Azolla filiculoides [J]. Journal of Hazardous Materials, 125(1-3): 121-129.
RUTTENBERG K C. 1992. Development of a sequential extraction method for different forms of phosphorus in marine-sediments [J]. Limnology and Oceanography, 37(7): 1460-1482.
RYSGAARD S, THASTUM P, DALSGGARD T, et al. 1999. Effects of salinity on NH4+adsorption capacity, nitrification, and denitrification in Danish estuarine sediment [J]. Estuaries, 22(1): 21-30.
SIMON N S, KENNEDY M M. 1987. The distribution of nitrogen species and adsorption of ammonium in sediments from the tidal Potomac River and estuary [J]. Estuarine, Coastal and Shelf Science, 25(1): 11-26.
SONDERGAARD M, KRISTENSEN P, JEPPESEN E. 2002. Phosphorus release from resuspended sediment in the shallow and wind-exposed Lake Arresø, Denmark [J]. Hydrobiologia, 228(5): 91-99.
SUNA BALCI. 2004. Nature of ammonium ion adsorption by sepiolite: analysis of equilibrium data with several isotherms [J]. Water Research, 38(5): 1129-1138.
WANG S R, JIN X C, PANG Y, et al. 2005. The study on the effect of pH on phosphate sorption by different trophic Lake Sediments [J]. Journal of Colloid and Interface Science, 285(2): 448-457.
安敏, 文威, 孙淑娟, 等. 2009. pH和盐度对海河干流表层沉积物吸附解吸磷 (P) 的影响[J]. 环境科学学报, 29(12): 2616-2622.
陈振楼, 许世远, 柳林, 等. 2000. 上海滨岸潮滩沉积物重金属元素的空间分布与累积[J]. 地理学报, 55(6): 641- 651.
戴纪翠, 宋金明, 郑国侠, 等. 2007. 胶州湾沉积物氮的环境生物地球化学意义[J]. 环境科学, 28(9): 1924-1928.
国家质量技术监督局. 2007. GB17378.4─2007海洋监测规范[S]. 北京:中国标准出版社.
何起祥. 2006. 中国海洋沉积地质学[M]. 北京: 北京海洋出版社.
胡智弢, 孙红文, 谭媛. 2004. 湖泊沉积物对 N和 P的吸附特性及影响因素的研究[J]. 农业环境科学学报, 23(6): 1212-1216.
胡祖武, 刘玲. 2011. 广东省典型城市湖泊沉积物氨氮吸附特性初步研究[J]. 安徽农学通报, 17(7): 36-38.
姜桂华. 2004. 铵态氮在土壤中的吸附性能探讨[J]. 长安大学学报, 21(2): 32-36.
吕晓霞, 宋金明, 袁华茂, 等. 2004. 南黄海表层沉积物中氮的潜在生态学功能[J]. 生态学报, 24(8): 1635-1643.
马宁, 王宇, 史春梅, 等. 2010. 氨氮在底泥中的吸附-解吸行为研究进展[J]. 现代农业科技, (24): 273-274.
汪家权, 孙亚敏, 钱家忠, 等. 2002. 巢湖底泥磷的释放模拟实验研究[J]. 环境科学学报, 22(6): 738-742.
王雨春. 2001. 贵州红枫湖、百花湖沉积物-水界面营养元素 (磷、氮、碳) 的生物地球化学作用[D]. 贵阳: 中国科学院地球化学研究所.
吴丰昌, 万国江, 蔡玉蓉. 1996. 沉积物-水界面的生物地球化学作用[J].地球科学展, 11(2): 191-197.
夏勇锋. 2014. 湘江 (衡阳段) 底泥吸附和解吸氨氮的特性研究:[D]. 湖南: 南华大学: 40-41.
杨洪美. 2012. 南四湖表层沉积物中氮形态及吸附释放研究:[D]. 济南:山东大学: 34-35.
杨龙元, 蔡启铭, 秦伯强, 等. 1998. 太湖梅梁湾沉积物- 水界面氮迁移特征初步研究[J]. 湖泊科学, 10(4): 41-47.
俞志明, 马锡年, 谢阳. 1995. 粘土矿物对海水中主要营养盐的吸附研究[J]. 海洋与湖沼, 26(2): 208-214.
Effects of Environmental Factors on Ammonia Nitrogen Adsorption and Desorption in the Surface Sediments of Haizhou Bay
WANG Gongqin1, ZHANG Shuo2,3,4*, LI Dapeng2, ZHANG Zhongfa2, LI Li2
1. School of Environment, Beijing Normal University, Beijing 100875, China; 2. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China; 3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China; 4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China
The mineralization of organism in the sediment could generate large amounts of ammonia nitrogen. Most of the ammonia nitrogen will be adsorbed by the sediments particles and will affect the nitrification, denitrification and anammox of nitrogen in the sediments, so the adsorption-desorption of ammonia nitrogen in sediments is an important process in nitrogen cycle. Bay has complicated and changing characteristics in physical and chemical conditions, such as hydrodynamic force function, disturbance and salinity. Studies on the effects of environmental factors on ammonia nitrogen adsorption and desorption could reveal the influencing mechanism of nitrogen exchange in sediment-water surface. Therefore, the regulatory effects of disturbance intensity, size distribution and salinity on ammonia nitrogen adsorption and desorption in surface sediments were investigated through modeling in laboratory along the Haizhou Bay, using adsorption and desorption dynamic and thermodynamics experiment. The results showed that the adsorption and desorption is a complex dynamic process. The dynamic process mainly finishes in 30 minutes and reach equilibrium state after 30 minutes. The quasi-dynamic equations and the modified Elovich model can have a good description of the adsorption process. The first-order kinetics equation could fit desorption dynamics process. The fitting results of thermodynamic model revealed that the adsorption of ammonia nitrogen in the sediments conform to the Henry model and the optimal model to describe desorption is Langmuir model. The study also showed that the adsorption capacity of surface sediment increased with disturbing condition in a specific range, particle diameter reducing and salinity decreasing in a specific range. The desorption capacity of surface sediment increased with disturbing frequency, particle diameter and salinity increasing. This research will provide the theory basis for further recognize and understand the effect and its mechanism of environmental factors changes on adsorption and desorption of ammonia nitrogen.
Haizhou Bay; surface sediments; disturbance; size distribution; salinity; ammonia nitrogen; adsorption and desorption
10.16258/j.cnki.1674-5906.2017.01.015
X834
A
1674-5906(2017)01-0095-09
王功芹, 张硕, 李大鹏, 张中发, 李莉. 2017. 环境因子对海州湾表层沉积物中氨氮吸附-解吸的影响[J]. 生态环境学报, 26(1): 95-103.
WANG Gongqin, ZHANG Shuo, LI Dapeng, ZHANG Zhongfa, LI Li. 2017. Effects of environmental factors on ammonia nitrogen adsorption and desorption in the surface sediments of Haizhou Bay [J]. Ecology and Environmental Sciences, 26(1): 95-103.
农业部转产转业项目-江苏省海州湾海洋牧场示范项目(D-8006-13-8023;D8006-12-8018);国家公益性行业(农业)科研专项(201003068)
王功芹(1988年生),女,博士研究生,主要从事环境中氮循环的研究。E-mail: gongqin_wang2015@163.com *通信作者:张硕(1976年生),男,副教授,博士,主要从事海洋牧场和人工鱼礁方面的基础理论与应用实践研究。E-mail: s-zhang@shou.edu.cn
2016-09-17

