药物涂层球囊治疗股腘动脉硬化闭塞症的临床研究
孙利坤,王兵,吴斐,刘俊超,牛晓阳,刘晓哲,许恒,卢维龙
(郑州大学第五附属医院 血管外科,河南 郑州 450052)
随着人口老龄化的加剧和人民生活水平的提高,下肢动脉硬化闭塞症的发病率逐年增加,未经正规、有效的治疗,最终进展为严重下肢缺血,甚至导致截肢。股腘动脉由于复杂的解剖和来自周围肌肉的生物力学作用,成为下肢动脉硬化闭塞症的高发区域,腔内治疗后再狭窄及支架内再狭窄发生率高达40%~60%[1]。药物涂层球囊(drug-coated balloon,DCB)通过定向输送抗增殖药物到达病变血管壁,抑制内膜增生,减少再狭窄,无永久性异物的植入,为股腘动脉硬化闭塞症的治疗提供了一种新的思路。国外相关研究表明,DCB在治疗股腘动脉病变时已取得一定程度的临床疗效,但目前针对我国患者的研究报道较少。本研究对我科2016年6月—2017年1月采用DCB(Orchid,先瑞达公司)治疗的34例股腘动脉硬化闭塞症患者进行随访观察,评估其有效性及安全性。
1 资料与方法
1.1 一般资料
研究纳入34例患者(42条患肢),其中原发狭窄性病变28条患肢,支架内再狭窄病变4条患肢,闭塞性病变10条患肢,基本情况及资料见表1。术前最小管腔直径(minimal lumen diameter,MLD)和踝肱指数(ankle brachial index,ABI)见表2。34例患者术前均行下肢动脉CT血管成像(CT angiography,CTA)或动脉造影检查证实存在股腘动脉硬化闭塞症。
1.2 治疗方法
患者取平卧位,采用局麻下顺行穿刺同侧或对侧股动脉,置入5 F动脉鞘常规造影了解病变累及范围、长度及远端流出道情况。全身肝素化后,5 F单弯导管及超滑导丝配合下通过股腘动脉病变段,再次造影确保导丝与导管远端在血管真腔内。先选用较小直径的普通球囊(直径比病变段血管小0.5~1 mm,长度与病变段相同或略长)进行预扩张,时间为1~2 min,若扩张效果不理想(仍有严重狭窄),应增加扩张时间。随后采用与参考血管直径相同的DCB扩张靶病变,时间为2~3 min(图1)。可用的DCB直径规格为3~6 mm,长度规格为20~300 mm,扩张压力为6~8个大气压(1个大气压=101.325 kPa),选取时长度应超过靶病变两端各10 mm,需要多个DCB连续扩张时,2个球囊之间应重叠10 mm,可避免治疗时靶病变区域的丢失。再次造影观察治疗效果,对于球囊扩张后仍有>50%的残余狭窄时植入金属裸支架。当顺行穿刺无法到达远端动脉时,采用经腘动脉或胫后动脉逆行穿刺。穿刺点处理:26例患者采用局部压迫止血,8例采用血管缝合器(perclose proglide,Abbott公司)。术后皮下注射低分子肝素钠针(5 000 IU,1次/12 h),口服阿司匹林(100 mg/d)、硫酸氢氯吡格雷(75 mg/d);3 d后停用抗凝治疗,继续双联抗血小板治疗;3个月后改为单阿司匹林治疗。
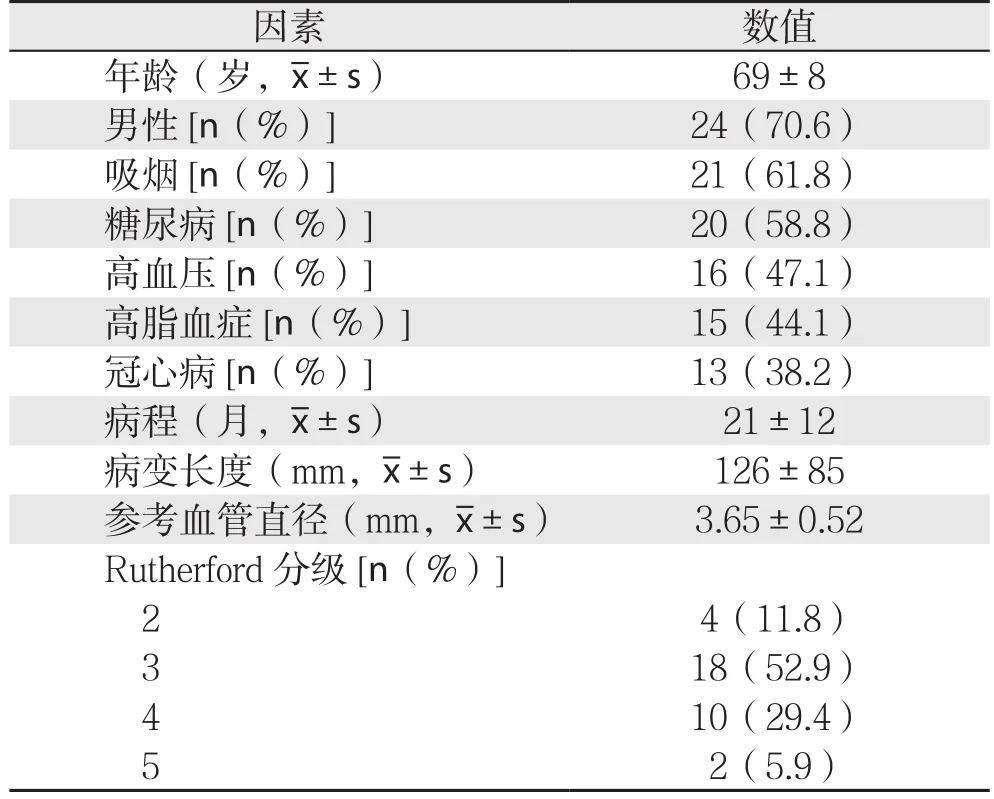
表1 34例患者一般资料
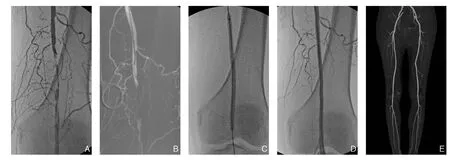
图1 DCB治疗股腘动脉病变 A:术前造影提示股浅动脉远端闭塞;B:导管配合导丝开通闭塞段;C:DCB治疗股浅动脉远端病变;D:术后造影提示股浅动脉管腔通畅;E:术后6个月复查CTA,股浅动脉通畅良好
1.3 疗效评估与随访
⑴ 随访时或需要再次血管重建时晚期管腔损失(late lumen loss,LLL)、MLD。⑵ 将靶病变再狭窄的发生定义为狭窄程度≥50%。⑶ 通过Rutherford分级变化、ABI、临床驱动靶血管血运重建率(target-lesion revascularization,TLR)评估临床疗效。⑷ 血管多普勒超声和CTA评价管腔通畅情况。⑸ 并发症包括:穿刺点血肿、血管破裂及夹层、急性血栓形成等。
1.4 统计学处理
应用SPSS 22.0统计学软件对数据进行分析,计量资料用均数±标准差(±s)表示,两组均数比较采用配对t检验,靶血管一期通畅率采用Kaplan-Meier分析,P<0.05为差异有统计学意义。
2 结 果
2.1 术后结果
本组34例患者(42条患肢)手术均获得成功,8例患者(10条患肢)顺行穿刺失败后,采用血管多普勒超声定位下逆行穿刺,其中8条患肢经腘动脉穿刺,2条患肢经胫后动脉穿刺,均获得成功。3例患者(4条患肢)术后残余狭窄>50%,植入金属裸支架。术中并发症:动脉夹层2例(2条患肢),分别发生在股浅动脉的近心端和远心端,使用直径稍大球囊长时间压迫,再次造影,夹层消失;血管破裂穿孔1例,造影可见对比剂外渗,植入Viabahn覆膜支架(Gore公司)。全组无围手术期病死病例。34例患者术后间歇性跛行、静息痛及缺血性溃疡症状较术前明显改善。
2.2 随访结果
34例患者均获得术后3~6个月随访,随访率100%,未发生死亡、截肢等临床不良事件。术后早期及术后3、6个月MLD、ABI均较术前明显改善(均P<0.05);术后6个月LLL为(0.08±0.94)mm(表2)。术后6个月靶病变再狭窄率为9.52%(4/42),靶血管一期通畅率曲线如图2所示,临床观察结果显示T L R为2.3 8%(1/4 2)。Rutherford分级均较术前得到改善:28例患者提高1级,6例患者提高2级。对2例动脉夹层和1例血管破裂患者进行造影随访,管腔通畅良好。1例患者术后6个月行CTA检查,发现股浅动脉远端局部呈瘤样扩张,未行特殊处理,继续随访观察。
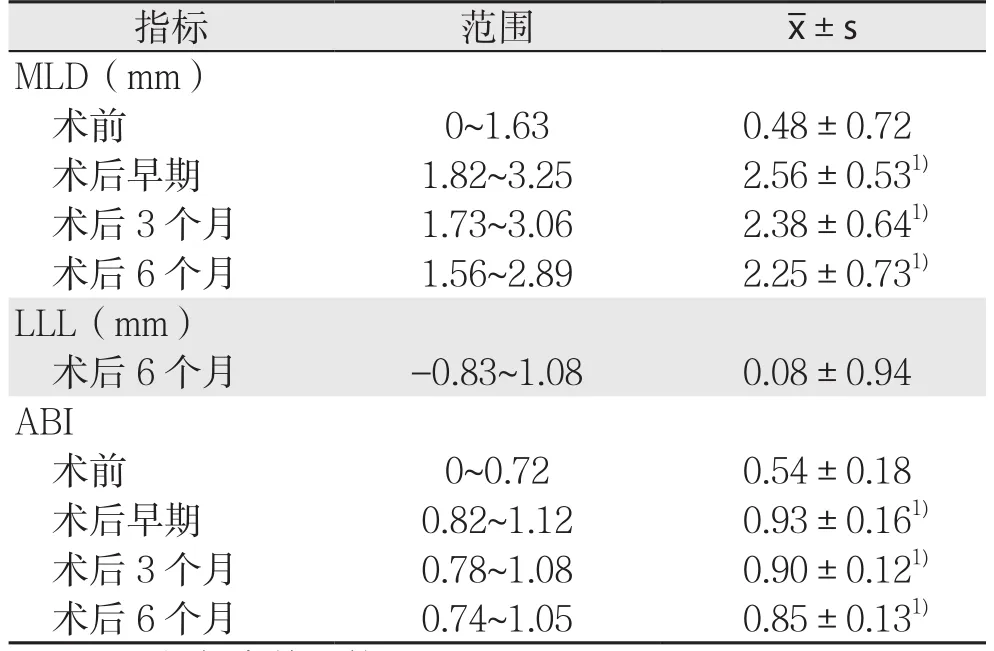
表2 靶病变治疗前后及随访结果
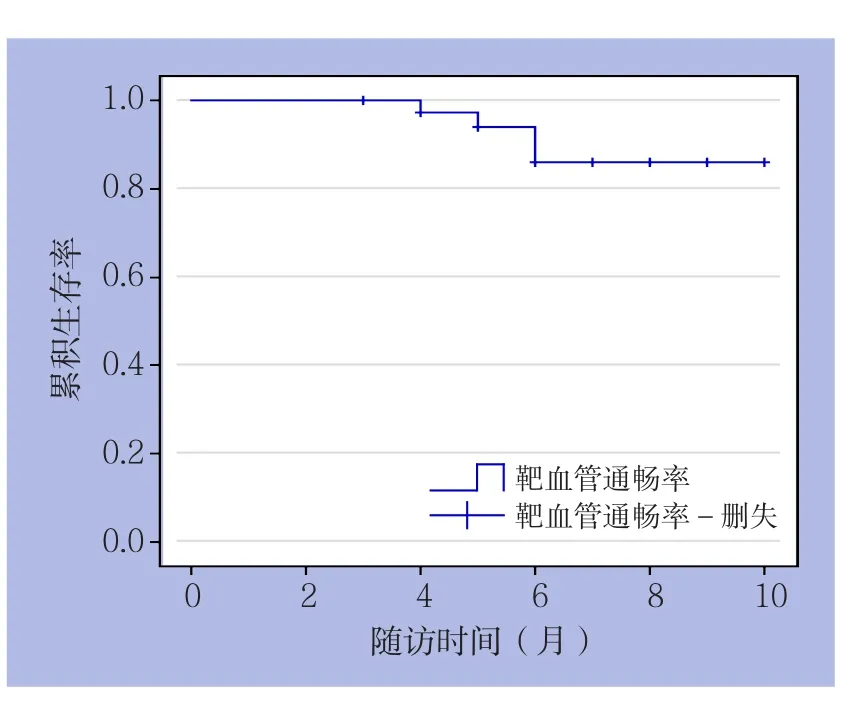
图2 34例患者术后靶血管一期通畅率曲线
3 讨 论
股腘动脉硬化闭塞症的治疗方式主要有动脉旁路移植和腔内介入治疗。旁路移植手术创伤大、风险高,尤其对于合并心、脑血管疾病的患者不能耐受。而腔内治疗以普通球囊血管成形术(plain old balloon angioplasty,POBA)和支架植入术为首选方式,创伤小、风险低,手术禁忌证相对较少,在临床上得到广泛应用,但术后再狭窄发生率较高,需要二次手术干预[2]。DCB作为一种新的腔内治疗方式,近年来在股腘动脉病变中得到一定的应用,其表面涂有抗增殖药物,通过球囊扩张使涂层药物快速释放到病变血管壁,抑制内膜增生,降低再狭窄率。目前使用的涂层药物主要为紫杉醇,具有以下特点:⑴ 高度亲脂性,能够迅速被血管壁组织吸收利用,避免血流冲刷造成药物损失。⑵ 药物吸收利用时间短,减少持续抗增殖药物作用导致的血管内皮化延迟,从而降低血栓事件的发生风险。⑶ 能够在动脉血管壁的平滑肌细胞层和成纤维细胞层保持较高的药物浓度,有效地抑制病变血管内膜增生[3-5]。相关动物细胞学试验结果表明紫杉醇可持续抑制血管平滑肌的增殖[6-7]。本研究所使用的是国内新上市的用于治疗外周血管病变的紫杉醇涂层球囊,药物浓度为3μg/mm2,与国外其他DCB药物涂层剂量相近,且有效性已在随机对照试验中证实[8-9]。
本研究34例患者术后6个月LLL为(0.08±0.94)mm,不劣于多数DCB治疗股腘动脉试验结果[1,10-11],且优于POBA组。在随访的造影结果中发现1例患者局部动脉呈瘤样扩张即管腔扩大,此区域为先前DCB治疗区,笔者认为产生此现象的原因可能与球囊直径过大以及紫杉醇对动脉血管壁的细胞毒性有关,远期效果尚需大样本试验的研究。国外Tepe等[1]最早对DCB治疗股腘动脉病变进行前瞻性、多中心、随机对照试验,共设置3组对照(DCB组、POBA组、溶有紫杉醇的造影剂组),平均病变长度74 mm,术后6个月DCB组的LLL、再狭窄率及TLR均优于两组对照组,初步证明DCB在股腘动脉病变的有效性。Jia等[10]使用与本研究相同的DCB进行国内首个多中心、随机对照试验,平均病变长度为150 mm,术后6个月的随访造影DCB组较POBA组效果显著,LLL、再狭窄率和TLR均降低,术后1年DCB组的Rutherford分级和ABI较术前得到明显改善。本研究未对DCB和POBA治疗股腘动脉病变进行对照试验,未来应选择具有相似基线水平的患者分别研究,观察其管腔通畅率以及临床症状改善情况。本组术后6个月再狭窄率为9.52%(4/42),优于使用与本研究相同DCB的试验结果[11],且与POBA、植入金属裸支架术后6个月的结果相比[12],优势更加明显。临床驱动TLR为2.38%(1/42)与Tepe等[13]试验结果相近,说明DCB可有效降低股腘动脉病变术后短、中期再狭窄率、临床驱动TLR,但远期效果有待进一步随访观察。
股腘动脉段植入支架后易反复摩擦血管壁,引起内膜过度增生形成支架内再狭窄(in-stent restenosis,ISR),多见于支架重叠、断裂及长段弥漫性病变区域[14-15]。Tosaka等[16]将股腘动脉ISR分为3型:I型为长度<50 mm的局灶性狭窄;II型为长度>50 mm的弥漫性狭窄;III型为支架内闭塞。目前,尚无明确的指南和共识规范ISR的治疗[17],而DCB以其特有的抗内膜增生药物涂层设计为股腘动脉ISR的治疗提供了一种新的选择[18]。本研究ISR病变共4条患肢,其中I型1条,II型2条,III型1条患肢,术后6个月随访造影管腔均通畅良好,短期内未发生再狭窄,远期通畅率有待观察。Stabile等[19-20]首次将DCB用于股腘动脉ISR的治疗,病变长度(82.9±78.9)mm,术后1、2年的通畅率分别为92.1%、70.3%,初步证明了DCB治疗股腘动脉ISR的有效性。该研究还发现II、III型病变再狭窄率比I型高,表明股腘动脉ISR病变的复杂程度与再狭窄率呈正性相关。Liistro等[21-22]对股腘动脉ISR患者进行DCB和POBA的对比试验,术后1年的TLR分别为13.6%和31.0%(P<0.05),术后3年的TLR分别为40%和43%(P=0.8),说明DCB中、短期治疗效果较POBA显著,但长期效果并不明显。笔者认为可能是由于通过DCB输送到血管壁的抗增殖药物远期浓度降低,药效减退,从而导致血管内膜组织延迟增生。Kinstner等[23]进行了关于DCB和POBA治疗股腘动脉ISR的前瞻性、多中心、随机对照研究,病变长度分别为(173±113)mm和(184±88)mm,术后12个月一期通畅率分别为40.7%和13.4%(P=0.02),免于临床驱动的TLR分别为49.0%和22.1%(P=0.11)。该研究发现病变长度与TLR具有相关性,说明DCB在病变类型简单、长度较短的ISR病变的短、中期效果更加显著。未来可针对不同长度、分型的ISR病变分别使用DCB和POBA治疗,观察其临床治疗效果以及中、远期通畅率影响因素。
研究[24]表明远端流出道条件不良是影响股腘动脉狭窄及支架内再狭窄腔内治疗效果的危险因素。Smolock等[25]认为在远端流出道不良的股浅动脉病变治疗中,及时开通膝关节以下的胫、腓动脉对于近、远期治疗效果具有重要意义,但对于临床症状的改善及保肢率影响不大。本研究中有4例患者(5条患肢)合并有膝下胫腓干动脉病变,同期使用直径较小的DCB治疗,术后6个月复查CTA,管腔均通畅良好。股腘动脉远端流出道不良是否对DCB治疗后的管腔通畅率产生影响,仍需大量临床试验的随访观察。
本研究中有2例动脉夹层和1例血管破裂,使用球囊扩张和植入支架后管腔均恢复通畅。对于股腘动脉闭塞性病变,本中心的经验是可使用导管配合导丝向前缓慢跟进,操作应细致轻柔,一般可顺利通过。DCB治疗病变时应注意:⑴ 使用DCB前应进行充分的预扩张,可使涂层药物更好的渗透入血管壁。⑵ 进行球囊扩张时,选择的球囊直径不宜过大,使用时应实行缓慢的梯度加压、减压,可防止形成夹层。⑶ 对于钙化严重的病变,应行充分预扩张撕裂钙化病灶内膜,使DCB涂层药物充分吸收,预扩张方法可采用高压球囊、切割球囊等。
总之,通过临床治疗观察,DCB能够降低股腘动脉硬化闭塞症术后6个月LLL、再狭窄率、临床驱动TLR,可作为一种安全、有效的治疗方式。此外,斑块切除术、激光及超声消融等与DCB的联合应用可能为未来下肢动脉病变的治疗提供更多的选择,如何进一步提高远期通畅率,降低术后再狭窄,仍需进一步临床研究。本试验的不足之处是病例数较少,随访时间短且未设置对照组,尚需要大样本、随机对照试验的进一步检验。
[1]Tepe G, Zeller T, Albrecht T, et al. Local delivery of paclitaxel to inhibit restenosis during angioplasty of the leg[J]. N Engl J Med,2008, 358(7):689–699. doi: 10.1056/NEJMoa0706356.
[2]刘俊超, 王兵, 王广华, 等. TASC C/D型主髂动脉硬化闭塞症的杂交手术治疗[J]. 中国普通外科杂志, 2016, 25(6):853–858. doi:10.3978/j.issn.1005–6947.2016.06.013.Liu JC, Wang B, Wang GH, et al. Hybrid therapy for TASC C/D aortoiliac arteriosclerosis obliterans[J]. Chinese Journal of General Surgery, 2016, 25(6):853–858. doi: 10.3978/j.issn.1005–6947.2016.06.013.
[3]Ng VG, Mena C, Pietras C, et al. Local delivery of paclitaxel in the treatment of peripheral arterial disease[J]. Eur J Clin Invest, 2015,45(3):333–345. doi: 10.1111/eci.12407.
[4]Colleran R, Harada Y, Cassese S, et al. Drug coated balloon angioplasty in the treatment of peripheral artery disease[J].Expert Rev Med Devices, 2016, 13(6):569–582. doi:10.1080/17434440.2016.1184969.
[5]Tepe G, Schnorr B, Albrecht T, et al. Angioplasty of femoralpopliteal arteries with drug-coated balloons: 5-year follow-up of the THUNDER trial[J]. JACC Cardiovasc Interv, 2015, 8(1 Pt A):102–108. doi: 10.1016/j.jcin.2014.07.023.
[6]Scheller B, Speck U, Abramjuk C, et al. Paclitaxel balloon coating,a novel method for prevention and therapy of restenosis[J].Circulation, 2004, 110(7):810–814.
[7]张文俐, 杜润, 朱政斌, 等. 药物洗脱球囊抑制下肢动脉狭窄性病变的实验研究[J]. 介入放射学杂志, 2014, 23(5):423–426.doi:10.3969/j.issn.1008–794X.2014.05.014.Zhang WL, Du R, Zhu ZB, et al. The inhibition effect of novel drug-eluting balloon on obstructive peripheral arterial disease of lower extremity: an experimental study in rabbit models[J]. Journal of Interventional Radiology, 2014, 23(5):423–426. doi:10.3969/j.issn.1008–794X.2014.05.014.
[8]Scheinert D, Schulte K L, Zeller T, et al. Paclitaxel-releasing balloon in femoropopliteal lesions using a BTHC excipient: twelvemonth results from the BIOLUX P-I randomized trial[J]. J Endovasc Ther, 2015, 22(1):14–21. doi: 10.1177/1526602814564383.
[9]张天华, 迟德财, 姜维良. 药物涂层球囊治疗下肢动脉硬化闭塞症的疗效[J]. 中国普通外科杂志, 2016, 25(12):1719–1724.doi:10.3978/j.issn.1005–6947.2016.12.009.Zhang TH, Chi DC, Jiang WL. Efficacy of drug-coated balloon in treatment of lower limb atherosclerosis obliterans[J]. Chinese Journal of General Surgery, 2016, 25(12):1719–1724. doi:10.3978/j.issn.1005–6947.2016.12.009.
[10]Jia X, Zhang J, Zhuang B, et al. Acotec Drug-Coated Balloon Catheter: Randomized, Multicenter, Controlled Clinical Study in Femoropopliteal Arteries: Evidence From the AcoArt I Trial[J].JACC Cardiovasc Interv, 2016, 9(18):1941–1949. doi: 10.1016/j.jcin.2016.06.055.
[11]许永乐, 贾鑫, 郭伟, 等. 紫杉醇药物涂层球囊治疗症状性下肢动脉硬化闭塞症的早中期结果[J]. 中华外科杂志, 2016, 54(8):617–619. doi:10.3760/cma.j.issn.0529–5815.2016.08.013.Xu YL, Jia X, Guo W, et al. Drug coated balloon with paclitaxel for the treatment of symptomatic peripheral artery disease:early and midterm results[J]. Chinese Journal of Surgery, 2016, 54(8):617–619. doi:10.3760/cma.j.issn.0529–5815.2016.08.013.
[12]Schillinger M, Sabeti S, Loewe C, et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery[J]. N Engl J Med, 2006, 354(18):1879–1888.
[13]Tepe G, Laird J, Schneider P, et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial[J]. Circulation, 2015, 131(5):495–502. doi: 10.1161/CIRCULATIONAHA.114.011004.
[14]Ansari F, Pack L K, Brooks SS, et al. Design considerations for studies of the biomechanical environment of the femoropopliteal arteries[J]. J Vasc Surg, 2013, 58(3):804–813. doi: 10.1016/j.jvs.2013.03.052.
[15]Al Shammeri O, Bitar F, Ghitelman J, et al. Viabahn for femoropopliteal in-stent restenosis[J]. Ann Saudi Med, 2012, 32(6):572–582. doi: doi: 10.5144/0256–4947.2012.575.
[16]Tosaka A, Soga Y, Iida O, et al. Classification and clinical impact of restenosis after femoropopliteal stenting[J]. J Am Coll Cardiol,2012, 59(1):16–23. doi: 10.1016/j.jacc.2011.09.036.
[17]符伟国, 岳嘉宁. 股腘动脉段病变支架内再狭窄的腔内治疗策略分析[J]. 中华外科杂志, 2016, 54(8):586–590. doi:10.3760/cma.j.issn.0529–5815.2016.08.006.Fu WG, Yue JN. Analysis of endovascular treatment strategies on in-stent restenosis of femoropopliteal artery lesions[J]. Chinese Journal of Surgery, 2016, 54(8):586–590. doi:10.3760/cma.j.issn.0529–5815.2016.08.006.
[18]刘俊超, 王兵. 药物涂层球囊治疗股腘动脉支架内再狭窄的研究进展[J]. 中国普通外科杂志, 2016, 25(12):1796–1800.doi:10.3978/j.issn.1005–6947.2016.12.021.Liu JC, Wang B. Drug-coated balloon for femoropopliteal instent restenosis:current research progress[J]. Chinese Journal of General Surgery, 2016, 25(12):1796–1800. doi:10.3978/j.issn.1005–6947.2016.12.021.
[19]Stabile E, Virga V, Salemme L, et al. Drug-eluting balloon for treatment of superficial femoral artery in-stent restenosis[J].J Am Coll Cardiol, 2012, 60(18):1739–1742. doi: 10.1016/j.jacc.2012.07.033.
[20]Virga V, Stabile E, Biamino G, et al. Drug-eluting balloons for the treatment of the superficial femoral artery in-stent restenosis: 2-year follow-up[J]. JACC Cardiovasc Interv, 2014, 7(4):411–415. doi:10.1016/j.jcin.2013.11.020.
[21]Liistro F, Angioli P, Porto I, et al. Paclitaxel-eluting balloon vs.standard angioplasty to reduce recurrent restenosis in diabetic patients with in-stent restenosis of the superficial femoral and proximal popliteal arteries: the DEBATE-ISR study[J]. J Endovasc Ther, 2014, 21(1):1–8. doi: 10.1583/13–4420R.1.
[22]Grotti S, Liistro F, Angioli P, et al. Paclitaxel-Eluting Balloon vs Standard Angioplasty to Reduce Restenosis in Diabetic Patients With In-Stent Restenosis of the Superficial Femoral and Proximal Popliteal Arteries: Three-Year Results of the DEBATE-ISR Study[J]. J Endovasc Ther, 2016, 23(1):52–57. doi:10.1177/1526602815614555.
[23]Kinstner CM, Lammer J, Willfort-Ehringer A, et al. Paclitaxel-Eluting Balloon Versus Standard Balloon Angioplasty in In-Stent Restenosis of the Superficial Femoral and Proximal Popliteal Artery: 1-Year Results of the PACUBA Trial[J]. JACC Cardiovasc Interv, 2016, 9(13):1386–1392. doi: 10.1016/j.jcin.2016.04.012.
[24]Davies MG, Saad WE, Peden EK, et al. Impact of runoff on superficial femoral artery endoluminal interventions for rest pain and tissue loss[J]. J Vasc Surg, 2008, 48(3):619–625. doi: 10.1016/j.jvs.2008.04.013.
[25]Smolock CJ, Anaya-Ayala JE, El-Sayed HF, et al. Clinical efficacy of concomitant tibial interventions associated with superficial femoral artery interventions in critical limb ischemia[J]. J Vasc Surg, 2013, 57(1):19–27. doi: 10.1016/j.jvs.2012.06.110.

