儿童进行性肌营养不良的临床及MRI表现特征
深圳市儿童医院放射科(广东 深圳 518026)
叶文宏 汪 苍 于根建 干芸根
儿童进行性肌营养不良的临床及MRI表现特征
深圳市儿童医院放射科(广东 深圳 518026)
叶文宏 汪 苍 于根建 干芸根
目的探讨进行性肌营养不良(PMD)患儿的临床及MRI表现特征,评价MRI对PMD的诊断价值。方法回顾性分析经临床和病理活检证实的33例PMD患儿的临床表现、发病年龄、家族史、激酶、肌电图、肌肉病理学特点及大腿肌肉的MRI资料。结果(1)男性多见,占91%,平均年龄3岁10个月,2-8岁占82%,2例有明确家族史(6%)。(2)所有患儿首次就诊均有双侧肢体对称性肌无力表现,以双下肢多见(76%)。(3)所有患儿CK值均明显升高。(4)33例均行肌电图检查,表现为肌源性损害。18例患儿行腓肠肌活检,病例结果均符合进行性肌营养不良。(5)MRI主要表现为2种信号改变:①T1WI和T2WI均呈对称性高信号,STIR呈等信号,提示为病变肌肉对称性脂肪替代,33例患儿股四头肌、臀大肌均受累,其次为大收肌(28例)、半膜肌(18例)、缝匠肌(16例),股薄肌(16例)、半腱肌(14例)、长收肌(10例)。②T1WI呈等低信号,T2WI呈高信号,STIR呈高信号,提示为炎性水肿,本组资料22例PMD患儿部分受累肌群出现此种信号改变,以股四头肌受累多见。33例中11例合并肌肉萎缩,5例合并肌间隙脂肪浸润;所有病例股骨及皮下脂肪信号未见异常。结论双下肢对称性肌无力是PMD的主要临床表现。CK是诊断PMD的主要生化指标。PMD肌电图表现为肌源性损害。肌肉病例活检是确诊PMD的主要方法。儿童PMD的MRI表现具有一定特征性,主要表现为受累肌群的脂肪替代和炎性水肿,以前者为主,MRI能够发现肌肉变性的程度和范围,可为临床提供肌肉活检的优选部位。
进行性肌营养不良;磁共振成像;临床表现;儿童
进行性肌营养不良(progressive muscular dystrophy,PMD)属遗传性骨骼肌变性疾病,临床特征主要为进行性加重的对称性肌无力和肌肉萎缩[1],儿童多见,有关其MRI表现的研究国内外报道较少[2]。本文对2010年至2014年我院收治的33例PMD患儿的临床表现、发病年龄、家族史、肌酶、肌电图、肌肉病理学特点及MRI资料进行回顾性分析,重点探讨MRI对PMD的诊断价值。
1 资料与方法
1.1 研究对象 搜集我院2010年1月至2014年9月间经临床和病理活检证实的进行性肌营养不良患儿33例,其中男性30例(91%),女性3例(9%)。33例均行肌电图检查,18例行腓肠肌活检。
1.2 研究方法
1.2.1 PMD诊断标准:参考实用儿科学[3],所有患者临床表现、实验室检查、肌电图及肌肉活检都符合诊断标准。
1.2.2 MR检查设备与方法:所有患者均行双侧大腿MRI检查,采用Siemens 3.0T超导磁共振成像仪,相控阵列线圈。扫描参数:层厚6mm,层距1mm。横断位:快速自旋回波序列(turbo spin echo,TSE)-T1WI(TR/TE=600ms/8ms)、快速自旋回波序列(t u r b o spin echo,TSE)-T2WI(TR/ TE=3800ms/70ms)、短时间反转恢复(short-time inversion recovery,STIR)T2WI脂肪抑制序列(TR/TE=3200ms/80ms,TI=150ms)。冠状位:STIR-T2WI脂肪抑制序列。不能配合的患儿检查前给予10%水合氯醛0.5ml/kg灌肠或口服镇静。
2 结 果
2.1 年龄特征 患儿年龄2~18岁,平均年龄3岁10个月;其中<4岁11例占33.3%,4~8岁15例占45.5%,8~18岁7例占21.2%,2~8岁占88.8%。
2.2 家族史 2例(7%)有PMD家族史,3例(9%)有轻度行动障碍亲属,1例(3%)有小儿麻痹症亲属。
2.3 临床表现 33例患儿首次就诊均有肌无力表现,最早受累肌肉为双下肢者25例(76%),双上肢者2例(6%),四肢同时受累者6例(18%)。所有患者均为左右肢体对称性受累。11例(33%)出现不同程度肌肉萎缩。
2.4 生化指标 所有患儿血、尿常规均正常。乳酸脱氢酶(LDH)、肌酸磷酸激酶(CK)、谷丙转氨酶(ALT)、谷草转氨酶(AST)均不同程度升高。其中,CK在所有患儿均显著升高。
2.5 肌电图及肌肉活检情况 33例均行肌电图检查,表现为肌源性损害,阳性率100%。MRI检查大腿肌肉异常阳性率100%。二者阳性率一致。18例行腓肠肌活检,病理结果均符合进行性肌营养不良,表现为部分肌纤维萎缩,并存肌肥大或粗细不等,见纤维组织及脂肪组织增生,肌纤维间可见脂肪细胞、少量淋巴细胞及中性粒细胞浸润。
2.6 大腿肌群MRI表现 主要表现为2种信号改变:(1)T1WI和T2WI均呈高信号,STIR呈等信号,提示脂肪替代。全部33例患儿股四头肌、臀大肌均受累,其次为大收肌(28例)、半膜肌(18例)、缝匠肌(16例)、股薄肌(16例)、半腱肌(14例)、长收肌(10例)。信号异常为双侧对称性,其形态表现多样,条索状13例(图1-3),网格状11例,大片状4例(图4-6、图7-9),完全被脂肪替代者5例(图10-12)。(2)T1WI呈等低信号,T2WI呈高信号,STIR呈高信号。本组资料中,有22例PMD患儿部分受累肌群出现此种信号改变,双侧不对称,以股四头肌多见,其形态呈线条状者17例(图12),斑片状3例(图6),片状2例(图3)。33例中,11例合并肌肉萎缩、肌间隙增宽(图7-9、图10-12);5例合并肌间隙大量脂肪浸润(图7-9、图10-12)。所有病例股骨及皮下脂肪信号未见异常。
3 讨 论
3.1 分型、发病机制及临床特点 进行性肌营养不良(PMD)是一组原发于肌肉的遗传性疾病,以进行性加重的肌无力和肌肉萎缩为临床特征。根据遗传方式不同,可分为三类:X连锁隐性PMD、常染色体显性遗传性PMD和先天性肌营养不良。其中假肥大型(Duchenne型肌营养不良,DMD)和良性型(Becker型肌营养不良,BMD)属于X连锁隐性PMD,基因位于Xp212-3,是由于抗肌萎缩蛋白基因突变及其蛋白产物缺失所致肌细胞膜损伤[4-5]。DMD是儿童时期最常见的PMD,一般男性发病,本研究中男性患儿占到91%。而实际上仅2/3PMD患儿的病变基因来自母亲,另1/3PMD患儿是自身Dys基因突变,并非所有患儿均有家族史[6],本组中仅2例有明确阳性家族史,这可能与既往对本病的认识不足及医疗条件落后有关。文献报道[7]患儿通常出生后早期就出现运动发育落后,3岁之前开始隐匿起病,5岁左右出现进行性加重的肌无力和肌萎缩,以双下肢肌无力为著。本组病例2~8岁患儿占88%,首诊以双下肢肌无力为表现者占76%。
3.2 MRI在PMD诊断中的价值PMD的MRI信号表现基本相似,主要有2种信号改变,即短T1长T2信号和长T1长T2信号,前者提示脂肪替代,在压脂T2WI上脂肪信号被抑制;后者提示炎症水肿,在压脂T2WI上呈更高信号,上述2种信号可在同一患者混合存在,本组有22例PMD患儿部分受累肌群出现上述两种信号改变。脂肪替代在大腿肌群表现为两侧对称受累,均以臀大肌和股四头肌为著。随着病情的进展,脂肪成分所占比例随之增多,本组33例中有5例大腿肌群大部分被脂肪组织所替代,肌肉明显萎缩,脂肪成分所占比例越大,其预后越差,是一种不可逆的改变[8]。而炎症水肿存在于疾病的不同时期,范围一般较小,多表现为线条状,少数表现为片状,本组22例出现炎症水肿表现,仅3例表现为斑片状,2例表现片状,其余均呈线条状,以股四头肌受累最常见。以上征象提示PMD患儿大腿肌群以脂肪替代主要特征,部分合并轻微炎症水肿改变,病变肌肉中脂肪比例的多少可以作为判断PMD预后的一项指标[9]。有文献[10]报道PMD患儿缝匠肌和股薄肌相对不易受累,他们认为可能与这些肌肉的解剖结构及功能特点有关,主要起协调作用受力较小,且多跨越两个关节。而本组资料33例中有16例患儿缝匠肌和股薄肌出现脂肪替代现象,呈线条状或网格状脂肪浸润。
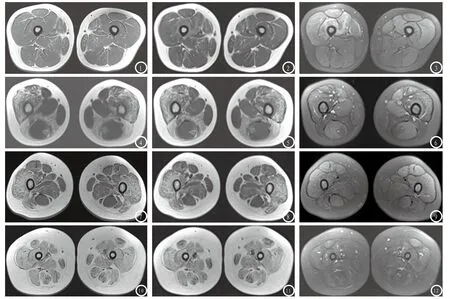
图1-3 男,4岁。图1为大腿中段横断面T1WI,图2为T2WI,图3为T2WI脂肪抑制,示股四头肌、缝匠肌、股薄肌、大收肌、半膜肌、半腱肌对称性线条状脂肪替代,其中右侧股四头肌内T2WI脂肪抑制可见片状高信号,提示合并炎症水肿。双侧大腿肌群未见萎缩。双侧股骨、皮下脂肪未见异常。图4-6 男,8岁。图4为大腿中段横断面T1WI,图5为T2WI,图6为T2WI脂肪抑制,示双侧股四头肌、大收肌、股二头肌对称性大片状脂肪替代,相应肌肉萎缩,双侧股外侧肌内T2WI脂肪抑制可见线状高信号,提示合并炎症水肿。缝匠肌、股薄肌、长收肌、半腱肌相对完好。双侧股薄肌、半腱肌增生肥大。双侧股骨、皮下脂肪未见异常。图7-9 女,10岁。图7为大腿中上段横断面T1WI,图8为T2WI,图9为T2WI脂肪抑制,示双侧臀大肌、股四头肌、缝匠肌、长收肌、大收肌对称性大片网格状脂肪替代,相应肌肉萎缩,T2WI脂肪抑制未见高信号。股薄肌、半腱肌、半膜肌相对完好。双侧股骨、皮下脂肪未见异常。图10-12 男,6岁。图10为大腿中段横断面T1WI,图11为T2WI,图12为T2WI脂肪抑制,示双侧大腿所有肌群对称性大片状脂肪替代,肌肉萎缩,肌间隙脂肪浸润,双侧股直肌内T2WI脂肪抑制可见斑片状高信号,提示炎症水肿。双侧股骨未见异常,皮下脂肪增厚。
本病确诊需做肌电图(EMG)、肌肉活检,本组患儿行EMG和(或)肌肉活检均证实为PMD,但二者均为创伤性检查,不易为患者接受。本组资料MRI阳性率100%,与EMG阳性率一致。文献报道[11]MRI对PMD肌肉异常的检出率高于临床,约50%临床评估正常的肌肉在MRI上显示有异常,包括一些明显的异常影像学改变,说明临床可能检测不出轻微的或严重但局限的肌肉病变。随着MRI在临床中的广泛应用,其应用于PMD诊断的优越性逐渐体现,能够判断肌肉病变的部位、范围和程度,能够区别肌肉的脂肪变性和炎症水肿,具有较高的特异性和敏感性,且不具创伤性,可重复检查,其对临床进行肌肉活检具有较强的指导意义,在病情、疗效和随访过程中,MRI能够提供客观准确的影像资料,具有重要的临床应用价值[12]。
3.3 鉴别诊断 本组33例PMD患儿中有10例发生误诊误治,容易被误诊的主要疾病有肝炎、心肌炎、脑病、慢性肌炎及多发性脂肪瘤等。造成PMD误诊的原因及相关鉴别疾病主要包括:(1)早期临床症状不典型,年龄越小,临床症状越不典型,3岁以前患儿正处于学步易摔阶段,容易掩盖肌无力的症状。部分患儿有出生时窒息缺氧史,需与脑部疾病鉴别,本组资料有1例患儿误诊为脑瘫。(2)片面根据检验结果作出诊断,因转氨酶增高而诊断为病毒性肝炎,或凭CK增高诊断为心肌炎,必须结合临床表现和患儿的具体情况仔细分析,遇到肌无力患儿需想到此病并进一步检查。(3)与慢性肌炎相鉴别,二者均为慢性病程,肌肉可水肿或萎缩,PMD水肿不累及皮肤,肌肉水肿程度较脂肪替代程度轻,而慢性肌炎水肿可累及皮肤,水肿程度常较重,脂肪替代较轻,而且临床上慢性肌炎患儿多以肌肉疼痛就诊[8]。(4)与多发性脂肪瘤相鉴别,本病也可表现为短T1长T2信号,压脂T2WI脂肪信号被抑制,但其占位效应明显,脂肪信号呈团块状改变,与PMD脂肪替代呈条状或片状改变不同,另外多发性脂肪瘤常有边界。
综上所述,双下肢对称性肌无力是PMD的主要临床表现。CK是诊断PMD的主要生化指标。PMD肌电图表现为肌源性损害。肌肉病例活检是确诊PMD的主要方法。儿童PMD的MRI表现具有一定特征性,主要表现为受累肌群脂肪变性和炎性水肿,以前者为主,MRI能够发现肌肉变性的程度和范围,可为临床提供肌肉活检的优选部位。MRI不失为PMD患者诊断和随访的重要辅助手段。
[1]Biggar WD.Ducbenne muscular d y s t r o p h y[J].P e d i a t r Rev,2006,27(3):83-88.
[2]刘茜玮,肖江喜,谢晟等.MRI对先天性肌营养不良的诊断价值[J].临床放射学杂志,2010,29(4):506-509.
[3]胡亚美,江载芳,诸福棠.实用儿科学(下册)[M].第7版,北京:人民卫生出版社,2011:2537-2361.
[4]S c h a r a U,M o r t i e r W. N e u r o m u s c u l a r d i s e a s e 2:muscular dystrophies(MD)[J]. Nervenarzt,2005,76(2)219-237.
[5]成胜权,强欢,曹红玉等.儿童进行性肌营养不良的临床及病理特征[J].中国当代儿科杂志,2013,15(8):649-652.
[6]Nakae Y,Stoward PJ,Kashiyama T,et al.Early onset of lipofuscin accumulation in dystrophin-deficitent skeletal muscles of DMD patients and mdx mice[J].J Mol Histol,2004,35(5):489-499.
[7]王丽旻,张鸿飞,朱世殊等.儿童进行性肌营养不良的临床与病理特征研究[J].中国优生与遗传杂志,2011,19(2):113-114.
[8]李青云,吕维富,刘影,等.皮肌炎/多发性肌炎腿部软组织的MRI表现特征[J].中国CT和MRI杂志,2011,9(5):59-60.
[9]叶茂斌,郭瑞敏,张临洪,等.进行性肌营养不良的MRI表现和鉴别诊断[J].放射学实践,2014,29(2):185-187.
[10]郑贤应,倪希和,慕容慎行.MRI在进行性肌营养不良症中的应用研究[J].中华放射学杂志,2001,35(10):761-765.
[1 1]S o o k h o o S,M a c k i n n o n I,Bushby K,et al.MRI for the demonstration of subclinical m u s c l e i n v o l v e m e n t i n muscular dystrophy[J].Clin Radiol,2007,62(2):160-165.
[12]刘莉,尹波,黎元.MRI在进行性肌营养不良症中的应用[J].国际医学放射学杂志,2010,33(6):529-531.
[13]张科蓓,华佳,邹爱华等.脂肪抑制技术在多肌炎、皮肌炎磁共振诊断中的价值[J].磁共振成像,2011,2(2):99-103.
[14]丁长青,王文生,丁爱兰,等.下肢肌肉损伤的低场MRI表现[J].中国CT和MRI杂志,2012,10(3):83-86.
(本文编辑: 刘龙平)
Clinical and MRI Features of Progressive Muscular Dystrophy in Children
YE Wen-hong, WANG Cang, YU Gen-jian,et al.,
Department of Radiology, Shenzhen Children's Hospital, Shenzhen 518026, Guangdong Province, China
ObjectiveTo study the clinical and MRI features of progressive muscular dystrophy(PMD) in children and to access the diagnostic value of MRI in PMD.MethodsRetrospective analysis was performed on the clinical data of 33 children with PMD, including clinical manifestations, age of onset,family history, creatase, electromyogram(EMG), pathological changes of muscles and the thigh muscle MRI findings.Results(1) 30(91%) cases were male.2 cases (6%) had a family history.(2) All cases presented symmetrical muscle weakness on the first consultation.25 cases(76%) appeared on bilateral lower extremities. (3) All cases had rised ceretine kinase(CK) levels. (4) EMG showed myogenic damage in all cases.Gastrocnemius muscle biopsy performed on 18 cases confirmed progressive muscular dystrophy.(5) Mainly two kinds of MRI signal features were found as follows: (1)The lesions carried hyperintense both on T1WI and T2WI, equisignal on STIR,showed symmetrical fat replacement for muscles in gluteus maximus and musculus quadriceps femoris of all cases,musculi adductor magnus of 28 cases, semitendinosus muscle of 18 cases, sartorius muscle and gracillis muscle of 16 cases, semitendinousus of 14 cases, musculi adductor magnus of 10 cases. (2)The lesions carried hypointense on T1WI and hyperintense on T2WI and STIR, showed muscle inflammation and edema in some involed muscles in 22 cases,with musculus quadriceps femoris as the most common.11 cases combined with muscular atrophy and 5 cases combined with spatium intermusculare fatty. No abnormality in bilateral femoral bone in all cases.ConclusionPMD showed a predominance of male. Symmetrical weakness of both lower extremities is the main manifestation of PMD. The MRI findings in PMD show characteristics in children, it displays two kinds of abnormal signals which represent fat replacement and inflammatory edema lesion. MRI can provide the degree and extent of the muscle degeneration, it can help to decide the accurate localizations for biopsy.
Progressive Muscular Dystrophy; Magnetic Resonance Imaging; Clinical Manifestation; Children
R722.11;R445.2
A
10.3969/j.issn.1672-5131.2017.03.046
2017-02-10
叶文宏

