水产品中孔雀石绿AlphaLISA检测方法的建立
龚倩, 郗存显, 聂福平, 曹淑瑞, 王国民, 陈冬东, 母昭德*
1(重庆医科大学 药学院,重庆,400016)2(重庆出入境检验检疫局 重庆市进出口食品安全工程技术研究中心,重庆,400020)3(重庆市生物化学与分子药理学重点实验室,重庆,400016)4(中国检验检疫科学研究院,北京,100123)
水产品中孔雀石绿AlphaLISA检测方法的建立
龚倩1,3, 郗存显2, 聂福平2, 曹淑瑞2, 王国民2, 陈冬东4, 母昭德1,3*
1(重庆医科大学 药学院,重庆,400016)2(重庆出入境检验检疫局 重庆市进出口食品安全工程技术研究中心,重庆,400020)3(重庆市生物化学与分子药理学重点实验室,重庆,400016)4(中国检验检疫科学研究院,北京,100123)
建立孔雀石绿(malachite green,MG)的光激化学发光纳米均相时间分辨荧光免疫法(AlphaLISA)分析方法。 将待测物,生物素化-MG-BSA,抗体加入到孔板中,再加入供体微珠和受体微珠。生物素化-MG-BSA和游离的待测物对抗体的竞争使得信号值减小,从而优化检测条件并进行方法学验证。结果表明:该方法特异性良好,与无色孔雀石绿,无色结晶紫无交叉反应,灵敏度为0.42 ng/mL,MG在2种鱼样品中的回收率在81.0%~105.0%和84.0%~90.8%之间,批内精密度RSD<9.5%,批间精密度 RSD<16.0%。MG-AlphaLISA方法可以简单、快速的对鱼类进行MG测定,具有特异性强、灵敏性高、稳定等特点。
AlphaLISA;孔雀石绿;水产品;检测方法
孔雀石绿(malachite green,MG)是人工合成的有毒的三苯甲烷类化学物,分子式为C23H25ClN2。因其价格低廉,常用作水产养殖业中的杀虫剂和杀菌剂和纺织工业中的丝绸、羊毛、皮革和纸张的染色剂[1],但很多研究表明MG特别是其代谢产物在水产动物体内有明显的高残留及高毒性,可产生致畸、致癌、致突变等副作用[2-4]。鉴于MG及其代谢产物的严重危害性,美国、日本和中国等国家都将MG列为水产品中不得检出药物。
目前,MG 的检测方法主要有固相萃取-高效液相色谱-荧光检测法[5]、高效液相色谱[6]、高效液相色谱法-质谱联用法[7]、分子印迹固相萃取-高效液相色谱法[8]、酶联免疫法[9-10]等。色谱法具有灵敏度高,测定精密、准确的特点,但其设备过于昂贵,操作步骤较为繁琐,操作人员需要专业培训,给使用带来一定困难。酶联免疫法方便快捷,灵敏度高,操作较为简单,却又存在假阳性问题。而AlphaLISA法在食品安全领域的应用较为少见。AlphaLISA法具有快速、 稳定、 高灵敏、免洗、无放射污染以及操作简单等特点,技术核心是当生物反应使供体微珠和受体微珠相互接近时,在680 nm激光照射下,供体微珠上的光敏剂将周围环境中的氧气转化为更为活跃的单体氧。单体氧扩散至受体微珠,发射波长为615 nm的光,即供体微珠和受体微珠的相互作用[11-13]。本研究建立的AlphaLISA法分析鱼肉中 MG 的测定方法,该方法操作简便、通用性强、免洗、检测时间短,方法的准确性和灵敏度均能满足分析测试的需要。
1 材料和方法
1.1 材料与试剂
孔雀石绿(MG)、无色孔雀石绿(leucomalachite green,LMG)、结晶紫(crystal violet ,CV)、无色结晶紫(leucomalachite crystal violet ,LCV),均来自德国Dr. Ehre-nstorfer GmbH公司。MG-BSA抗原、MG单克隆抗体,购自北京中检维康生物技术有限公司。生物素,购于Solulink公司。链霉素供体微珠、受体微珠、缓冲液Buffer、384孔板,购于美国PerkinElmer公司。乙腈(色谱纯),购于Tedia公司。其他的试剂(分析纯)购买于Sigma公司。
1.2 仪器与设备
多标记微孔板检测仪( AlphaLISA仪,EnSpire 2300),美国PerkinElmer公司;氮吹仪(N-EVAP 116),Organomation公司;振荡器(SR-2DS),日本TAITEC公司;离心机(3-30K),Sigma公司;烘箱,美墨尔特公司;分析天平(BS224S),Satorius公司。
1.3 实验方法
1.3.1 标准品的配制
准确称取MG 10 mg,溶解在10 mL的乙腈溶液中,配制成浓度为1 mg/mL的标准品母液,置于-20 ℃冰箱中储存。取母液用乙腈配置为浓度1 μg/mL溶液10 mL,保存在4 ℃冰箱中,作为日常使用。用Buffer缓冲液将MG母液倍比稀释,制成 0.5、1、2、5、10 μg/L MG 标准溶液。
1.3.2 受体微珠和供体微珠的配制
将10×Buffer按照说明书的方法配制成1×Buffer,用1×Buffer将受体微珠和供体微珠稀释为0.1 mg /mL溶液。
1.3.3 生物素-MG-BSA的制备
生物素-MG-BSA通过生物素化方法得到[14]。取MG-BSA抗原20 μL置于200 μL EP管中,再加入2 μL生物素,震荡混匀,室温放置90 min,放在4 ℃冰箱中备用。
1.3.4 样品预处理
准确称取样品5.0 g(精确到 0.01 g)于50 mL离心管中,加入11 mL乙腈,振荡20 min,7 000 r/min离心3 min,上清液转移至25 mL比色管中,重复提取一次后将上清液合并,并用乙腈定容至25 mL。将中性氧化铝小柱固定,用5 mL乙腈活化萃取小柱,取5 mL样品溶液加到已活化的中性氧化铝小柱中过柱,待样液全部流出后,再加入4 mL乙腈洗涤中性氧化铝柱。收集全部洗脱液,40 ℃氮气吹干,残留液用Buffer定容至1 mL,过0.22 μm滤膜,供检测用。
1.3.5 检测
在384孔板中加入5 μL生物素化抗原(2 mg/mL),5 μL的抗体(7.8 mg/mL)和5 μL待测样品或者标准品,振荡离心后,25 ℃避光孵育60 min。依次加入IgG受体微珠(100 μg/mL),链霉素供体微珠(100 μg/mL),振荡离心后,25 ℃避光孵育45 min。在AlphaLISA检测仪上测定待测孔的信号强度,根据标准曲线计算待测物中MG浓度。
2 结果与讨论
2.1 生物素化抗原和抗体的浓度优化
采用棋盘法优化实验条件。用Buffer将生物素化抗原分别稀释:1∶100、 1∶200、 1∶500、 1∶1 000、 1∶2 000、 1∶5 000、 1∶10 000。 抗体做一系列稀释:1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶9 600、 1∶12 800、1∶19 200、 1∶25 600。每种浓度加到孔板中,其中最后一个孔只加Buffer作空白对照。按照 1.3.5 的检测步骤进行检测,将待测样品替换成Buffer。各个浓度的信号强度值如表1所示。从表1中可以看出,生物素化抗原浓度在1∶2 000~1∶5 000倍稀释,抗体在1∶6 400~1∶12 800倍稀释时,信号强度值较高。在此浓度范围内,通过信号强度值和抗原抗体的成本,用量角度考虑,选择生物素化抗原浓度1∶2 000,抗体浓度1∶6 400作为实验的最适条件。

表1 生物素化-MG-BSA和MG抗体浓度优化
2.2 微珠浓度优化
供体微珠和受体微珠用Buffer分别稀释到:10、30 、50、100、120、200 μg/mL。按照 1.3.5 的检测步骤进行检测。结果见表2。由表2中结果可知,随着微珠浓度的增大,信号值也不断增大。当微珠浓度在100 μg/mL时,信号值出现较大增加。因为考虑到供体微珠和受体微珠价格昂贵,在实验过程中,不适宜的浓度不仅影响实验结果,还会造成浪费,所以一个合适的实验浓度就显得尤为重要,故选择微珠浓度为100 μg/mL。
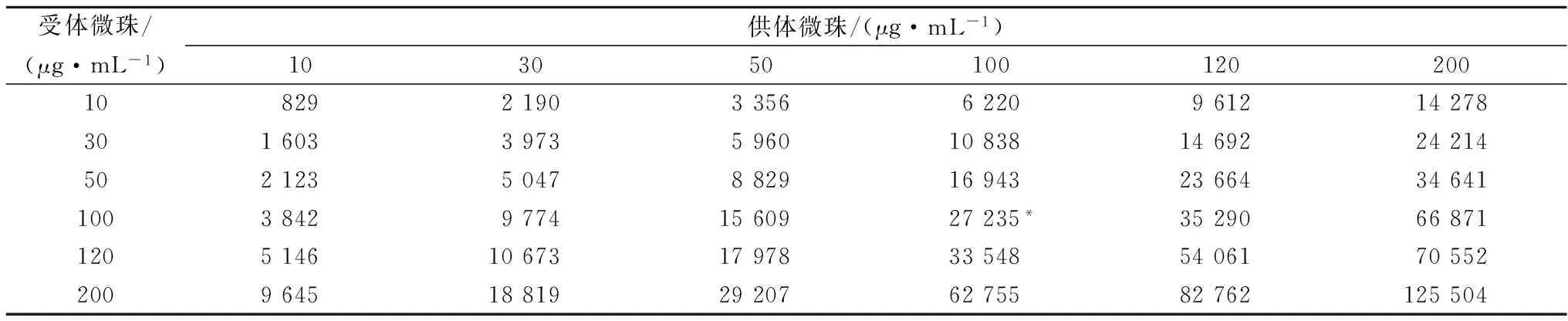
表2 供体微珠和受体微珠浓度优化
2.3 标准曲线及灵敏度
在最佳条件下,绘制MG标准曲线。标准溶液浓度为0.5 、1、2 、5 、10 ng/mL。结果以MG 溶液质量浓度对数值为横坐标(x)、抑制率(B/B0,即样品荧光值与阴性荧光值之比)为纵坐标(y),绘制标准曲线,标曲如图1所示。 MG-AlphaLISA的灵敏度则是计算 10 组标准曲线零浓度点的平均值(X)和标准差(SD),以X的数值减 2 倍 SD 所得的数值从标准曲线中找到对应浓度即为检测灵敏度[15]。建立的 AlphaLISA 方法检测灵敏性为0.42 ng/mL。
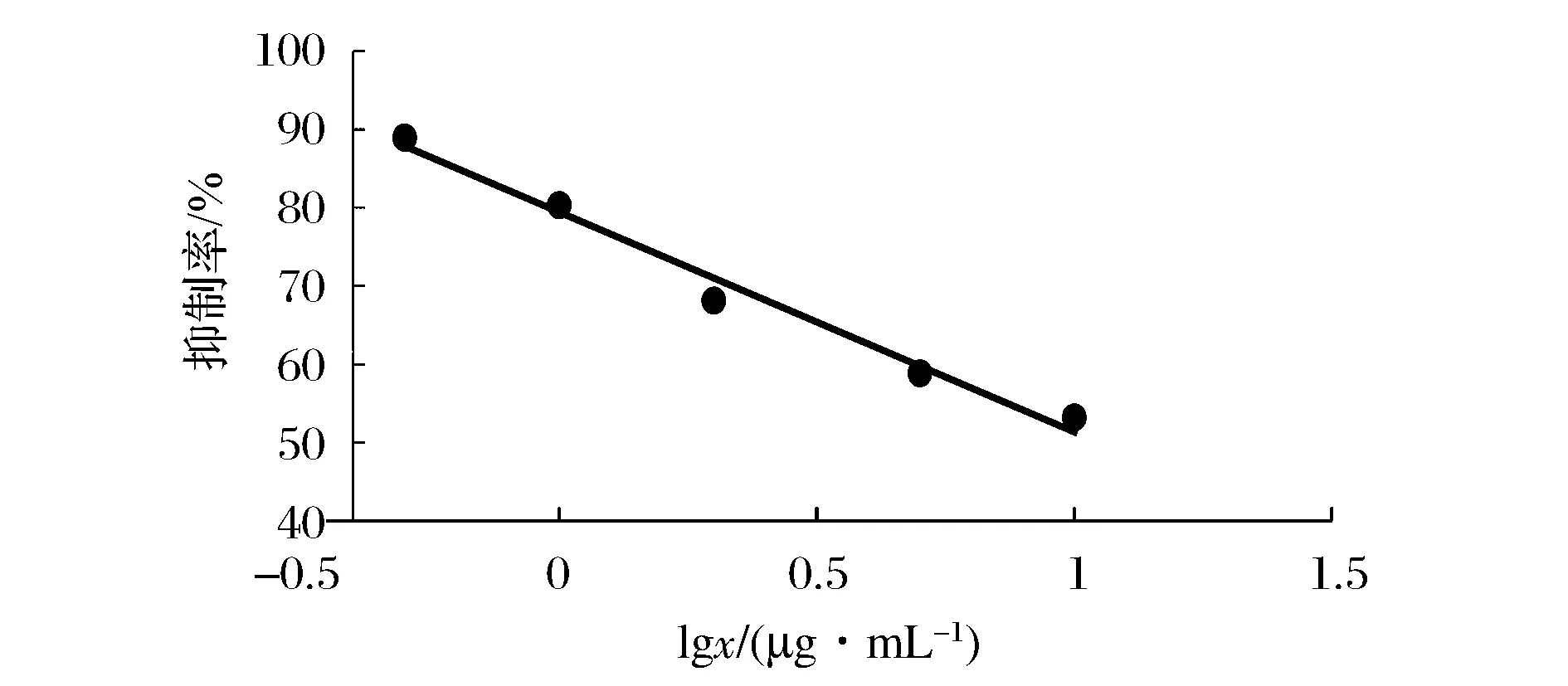
图1 孔雀石绿标准曲线Fig.1 Standard curve of MG
2.4 特异性
将MG与无色孔雀石绿、结晶紫、无色结晶紫这3种 MG 的结构类似物分别配制成0.5~10 ng/mL 的待测溶液, 用已建立的MG-AlphaLISA 方法进行检测,测定 IC50值。结果见表3。由表3中可知,MG与结晶紫的交叉率>100.00%,与无色孔雀石绿、无色结晶紫均无交叉反应。
2.5 样品测定
将已知浓度的MG标准品(1 、2 、5 μg/L)分别添加到2种鱼样品中,样品经预处理后采用已建立的 MG-AlphaLISA 方法进行检测,每个浓度重复检测 3 次。再根据标准曲线计算各个浓度添加的回收率。如表4所示。MG在2种鱼样中的回收率分别在81.0%~105.0% 和 84.0%~90.8%之间。方法精密度则是选择鲢鱼样品,分别添加不同浓度的MG标准品,每个浓度做3个平行样品。计算各浓度的平均测定值(X)、标准差(SD) 以及精密度(RSD)。结果见表5。该方法批内精密度在5.61%~9.22%,批间精密度在9.72% ~15.90%。采用常规的ELISA方法对2种鱼样进行测定,MG在2种鱼样中的回收率在74.6%~112.0%之间,精密度< 19.6%。对所采集的实际鱼样样品进行测定,结果表明,在市场购买的草鱼中均未检测出MG,在购买的促销鲢鱼中均检测出MG残留。将建立的 MG-AlphaLISA 方法与常规ELISA方法进行比较(表6),AlphaLISA 方法具有免洗,时间短,试剂、样品用量少等优点。

表3 孔雀石绿及其类似物交叉率
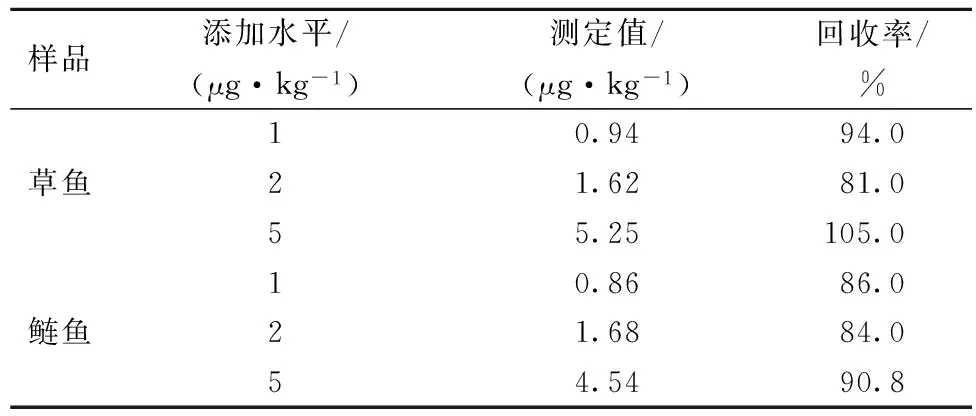
表4 加标回收率测定结果

表5 精密度测定结果

表6 MG-AlphaLISA 方法与常规ELISA方法的比较
3 结论
随着人们对动物源食品由需求型向质量型转变,动物源食品安全问题已逐渐成为全世界关注的一个焦点。尽管我国在2002年就将MG作为禁用兽药,但是一直禁而不止,很多养殖户仍在使用,导致了由MG引起的食品安全问题时有发生。在现有的检测孔雀石绿残留的方法中,常用的液质联用法检测周期长、仪器昂贵。ELISA方法无法满足越来越高的检测灵敏度,在实际应用中受到一定限制。
本实验中采用的AlphaLISA方法于2008年问世。该方法只需要极少量的实验试剂,与ELISA方法相比,用量大大减少,节约实验成本[16]。又因为不需要洗涤过程,进而得到较好的灵敏度和精密度。本方法批内精密度和批间精密度分别 <9.5%和 <16.0%。AlphaLISA检测的时间大大缩短,只需要2~3h。由此可见,AlphaLISA方法进行快速、高灵敏度的检测的能力极强,有望成为常规 ELISA 方法的替代方法。
[1] 李宁. 孔雀石绿对健康的影响[J]. 国外医学卫生学分册, 2005, 32 (5): 262-264.
[2] 龚朋飞, 王权, 陈永军. 孔雀石绿单克隆抗体的制备及其鉴定[J]. 中国兽医科学, 2007, 37(4) : 359-362.
[3] 徐向荣, 郝青, 彭加喜, 等. 水产品中残留孔雀石绿研究进展[J]. 热带海洋学报, 2013, 32 (4) : 97-106.
[4] 刘名扬, 肖珊珊, 于兵, 等. 水产品中孔雀石绿和结晶紫残留检测技术的研究进展[J]. 食品安全质量检测学报, 2015,6(1): 35-40.
[5] 邓建朝, 李来好, 杨贤庆, 等. 固相萃取—高效液相色谱—荧光检测法测定水体中的孔雀石绿[J]. 食品科学, 2012, 33(14): 150-153.
[6] 向仲朝, 岳蕴瑶, 张婷, 等. 水产品中孔雀石绿和结晶紫及其代谢产物的高效液相色谱测定法[J]. 中国卫生检验杂志, 2014 , 24(6) :788-790.
[7] 宗万里, 鲁刚. HPLC-MS/MS法快速测定鲜鱼肉中孔雀石绿及其代谢物含量[J]. 食品科学技术学报, 2014, 32(6): 72-76.
[8] 肖琴, 林一, 郑琳, 等. 分子印迹固相萃取—高效液相色谱法检测鱼肉中的孔雀石绿和结晶紫[J]. 粮油食品科技, 2011, 19(6):31-34.
[9] 邢玮玮, 王榕妹, 王俊卿, 等. 酶联免疫吸附分析法测定水产品及水中孔雀石绿和无色孔雀石绿[J]. 化学研究与应用, 2010, 22(1): 42-46.
[10] 谢焕龙, 王宇, 徐振林, 等. 基于混合抗体的酶联免疫分析方法同时检测孔雀石绿和隐孔雀石绿[J]. 现代食品科技, 2015, 31(12): 325-330.
[11] 洪小柳, 吕敬章, 张恒, 等. AlphaLISA 技术在食品安全检测中的研究进展[J]. 食品质量安全检测学报, 2014, 5(6) :198-202.
[12] 张存亮, 聂福平, 王昱, 等. 均相光激化学发光免疫分析技术的研究进展[J]. 中国动物检验, 2014, 31(3) :46-47.
[13] 张艺, 黄飚, 钮伟民, 等. 微囊藻毒素-LR超灵敏均相免疫分析方法的建立与优化[J].中国药理学与毒理学杂志, 2014, 28(3): 432-437.
[14] 赵芳, 岳振峰, 吕敬章, 等. 盐酸克伦特罗的 AlphaLISA 检测方法的建立[J]. 食品质量安全检测学报, 2014, 5(2) :497-502.
[15] 周彬, 高雷, 金坚, 等. 纳米均相时间分辨荧光免疫法检测脱氧雪腐镰刀菌稀醇方法的建立[J]. 食品工业科技, 2010, 31(8) : 338-342.
[16] 李晓丽, 陈雪岚, 刘春梅, 等. 孔雀石绿单克隆抗体的制备及直接竞争ELISA方法的建立[J]. 食品科学, 2009, 30(24) :283-286.
Quantitative determination of malachite green in aquatic products using amplified luminescent proximity homogeneous assay
GONG Qian1,3, XI Cun-xian2, NIE Fu-ping2, CAO Shu-rui2,WANG Guo-min2, CHEN Dong-dong4, MU Zhao-de1,3*
1(College of Pharmacy, Chongqing Medical University, Chongqing 400016, China)2(Chongqing Entry-Exit Inspection and Quarantine Bureau, Chongqing Engineering TechnologyResearch Center of Import and Export Food Safety, Chongqing 400020, China)3(Chongqing Key Laboratory of Biochemistry and Molecular Pharmacology, Chongqing 400016, China)4(Chinese Academy of Inspection and Quarantine, Beijing 100123, China)
A new method was established for analyzing malachite green (MG) by amplified luminescent proximity homogeneous assay (AlphaLISA). Samples, botinylated MG-BSA and MG antibody were added to a 384-well microplate, then donor beads and acceptor beads were added. Antibody competition between Biotinylated -MG-BSA and disassociate sample substances caused signal value decrease, thus optimized the test condition and analytical performance. The cross-reactivity of the MG-AlphaLISA with Leucomalachite green and Leucomalachite crystal violet were 11.74% and 7.24%, respectively; the sensitivity was 0.42 ng/mL; the recoveries of the determination for MG in two kinds of fish samples were 81.0%-105.0% and 84.0%-90.8%, respectively; the RSD of intra-day and inter-assay were <9.5% and <16.0%, respectively; the MG-AlphaLISA method is excellent in specificity, sensitivity, and stability. It can be widely used in rapid and simple screening for MG contamination in fish.
AlphaLISA; malachite green; aquatic product; detection method
10.13995/j.cnki.11-1802/ts.201702035
硕士研究生(母昭德教授为通讯作者,E-mail:mdz2008@tom.com)。
质检公益性行业科研专项项目(201210086);国家质量监督检验检疫总局科技计划项目(2015IK333)
2016-03-23,改回日期:2016-09-14

